Ging vin L Minh Chu Sinh vin Nhm



























- Slides: 33

Giảng viên: Lê Minh Châu Sinh viên : Nhóm 4 Lớp : K 39 - BQCB

Thành viên nhóm 1. Dương Thị Lan 2. Phạm Thị Liên 3. Trần Thị Loan 4. Hà Thị Hải Lương

Mục lục 1. Giới thiệu về vi khuẩn salmonela 2. Phương pháp xác định vi khuẩn salmonella ở thịt 2. 1. Nguyên tắc 2. 2. Môi trường nuôi cấy và thuốc thử 2. 3. Các bước tiến hành 3. Tài liệu tham khảo

1. Giới thiệu về vi khuẩn salmonela 1. 1. Phân loại khoa học : Salmonella được xếp vào: • Giới : Bacteria • Ngành: Proteobacteria • Lớp: Gramma Proteobacteria • Bộ: Enterobacteriales • Họ: Enterobacteriaceae • Giống: Salmonella lignieres 1900 • Loài: S. bongori & S. enterica


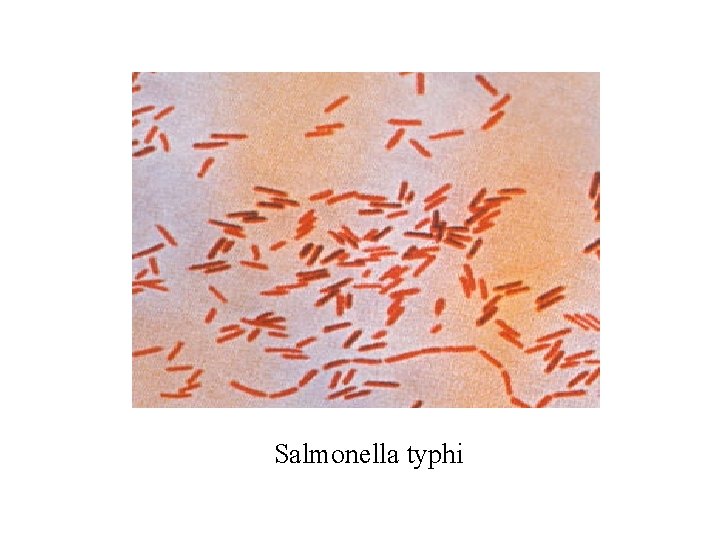
1. 2. Đặc đểm sinh học • Salmonella là trực khuẩn gram âm, di động, kích thước trung bình 3, 0 x 0, 5 µm, có nhiều lông ở xung quanh thân, trừ S. gallinarum và S. pullorum (gây bệnh ở gà vịt). • Là loại hiếu khí tuỳ tiện

• Chúng lên men sinh hơi glucoza, manit, sorbitol, sinh H 2 S, không sinh men lactoza, adonitol, không sinh indol, không có men ureaza, không khử phenylalanim, tryptophan, có men lyzindecaboxylaza, không tạo thành aceton, sử dụng xitrat ở môi trường tổng hợp.

Salmonella typhi

1. 3. Khả năng gây bệnh • Tùy theo từng loài, Salmonella có thể chỉ gây bệnh cho người, chỉ gây bệnh cho động vật, nhưng cũng có thể vừa gây bệnh cho người vừa gây bệnh cho động vật • S. typhi: loài này chỉ gây bệnh cho người, nó là vi khuẩn quan trọng nhất gây bệnh thương hàn. • S. paratyphi A: cũng chỉ gây bện cho người, là căn nguyên gây bệnh thương hàn, tỷ lệ phân lập đứng sau S. typhi.

• S. paratyphi B: chủ yếu gây bệnh cho người, nhưng có thể gây bệnh cho động vật. • S. paratyphi C: vừa có khả năng gây bệnh thương hàn, vừa có khả năng gây bệnh viêm dạ dày – ruột và nhiễm khuẩn huyết, thường gặp ở các nước Đông Nam Á.

• S. typhimurium và S. enteritidis: vừa có khả năng gây bệnh cho người vừa có khả năng gây bệnh cho động vật. Có thể gặp ở các nước khác nhau trên thế giới, chúng chủ yếu của bệnh nhiễm khuẩn nhiễm độc thức ăn do Salmonella. • S. choleraesuis: là nguyên nhân thường gặp trong các nhiễm khuẩn huyết do Salmonella ở nước ta

• Sự ngộ độc thực phẩm nhiễm salmonella liên quan đến nhiều yếu tố khác, phụ thuộc vào: ü Từng loại serotype ü Liều lượng ü Vi khuẩn. • Ngoài ra, phụ thuộc vào từng loại thức ăn và tình trạng sức khoẻ của mỗi cơ thể.

• Bởi sự nguy hiểm của salmonella với sức khoẻ con người nên các cơ quan kiểm tra vệ sinh thực phẩm thường coi salmonella là tiêu chuẩn đầu tiên đánh giá sự nhiễm khuẩn ở thực phẩm, cũng như quá trình sản xuất thực phẩm. • Không được có vi khuẩn salmonella trong thực phẩm và sự có mặt của vi khuẩn này không được bỏ qua khi chúng được phát hiện.


2. Phương pháp xác định vi khuẩn salmonella ở thịt 2. 1. Nguyên tắc Kỹ thuật phát hiện salmonella trong thực phẩm theo phương pháp của FAO (1979) và phương pháp của New Zealand (1991) đều gồm 6 bước :

1. Chuẩn bị mẫu và đồng nhất mẫu 2. Trước khi tăng sinh 3. Tăng sinh 4. Phân lập trên đĩa thạch chọn lọc 5. Kiểm tra các tính chất sinh hoá 6. Kiểm tra ngưng kết với kháng nguyên huyết thanh

2. 2. Môi trường nuôi cấy và thuốc thử • Nước đệm pepton BPW 2% ( Buffer Pepton Water 2%) • Môi trường Rappaort • Thạch SS ( Salmonella Shigella Agar) • Thạch xanh Birilliant ( Birlliant Green Agar) • Môi trường KIA (Kligler Irion Agar) • Môi trường Mannit di động

• Môi trường Ure Indol • Môi trường LDC ( Lyzin Decacboxylaza) • Môi trường ODC (Orthintn Doecaboxylaza) • Môi trường ADH (Arginin Dehydrolaza) • Môi trường ONPG (o-nitro-phenyl-B-d-Galactopysanosed) • Thuốc thử Kowacs

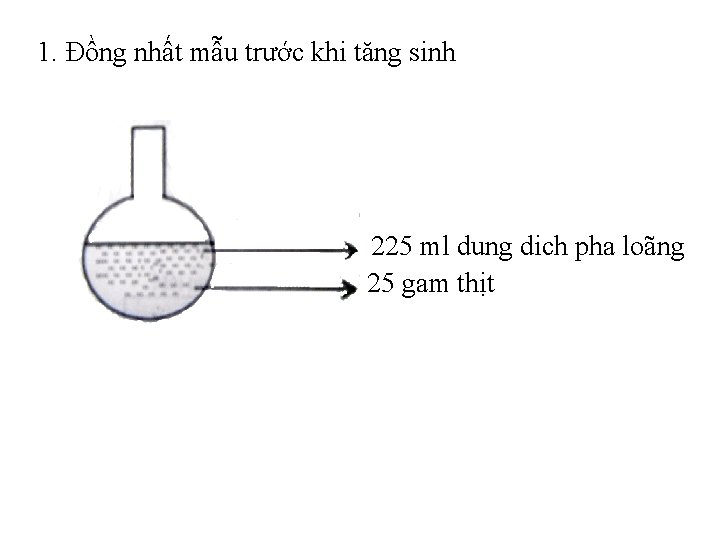
2. 3. Các bước tiến hành v Bước 1: chuẩn bị mẫu, đồng nhất mẫu. Cân 25 g mẫu đã được trộn vô trùng cho vào bình nón có chứa 225 ml nước đệm pepton BPW 2%, lắc đều trong 2 phút rồi để vào tủ ấm 370 C trong 16 – 20 h.

1. Đồng nhất mẫu trước khi tăng sinh 225 ml dung dich pha loãng 25 gam thịt

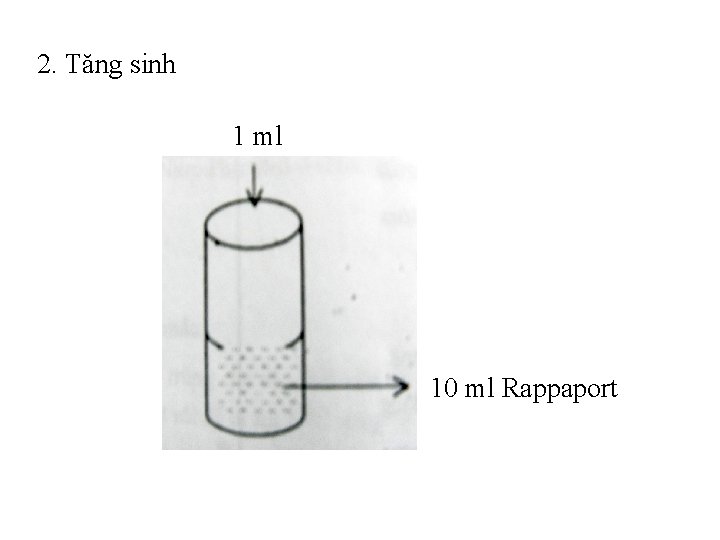
v Bước 2: Tăng sinh: • Dùng pipet vô trùng hút 1 ml dung dịch đã ủ ấm trên cho vào ống nghiệm có chứa 10 ml canh thang Rappaport, để ủ ấm trong 420 C/48 h. • Đối với salmmonella việc cấy chuyển qua môi trường tăng sinh là rất cần thiết vì môi trường này thuận lợi cho salmonella phát triển. • Nếu không có môi trường Rappaport thì dùng một trong các môi trường sau: Tetrathionat natri, Mueller Kauffmann, Selenit.

2. Tăng sinh 1 ml 10 ml Rappaport

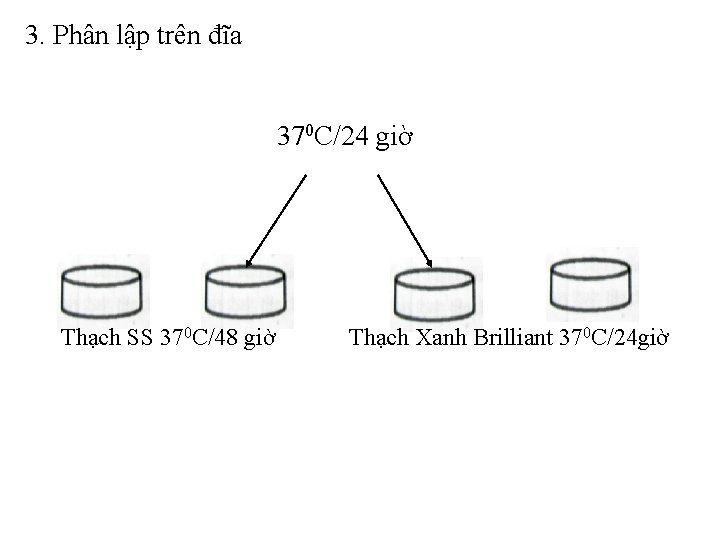
v Bước 3: Phân lập trên các đĩa thạch chọn lọc: • Dùng que cấy vô trùng cấy ria canh trùng từ ống tăng sinh lên 2 đĩa thạch SS và 2 đĩa thạch xanh Brilliant, rồi để tủ ấm 370 C/48 h đối với thạch SS, 24 h đối với thạch xanh Brilliant. • Cần cấy thưa để tạo các khuẩn lạc riêng rẽ

• Trên môi trường thạch SS, khuẩn lạc salmonella có chấm đen ở giữa. • Trên môi trường thạch xanh Brillinat, khuẩn lạc salmonella có màu hồng.

3. Phân lập trên đĩa 370 C/24 giờ Thạch SS 370 C/48 giờ Thạch Xanh Brilliant 370 C/24 giờ

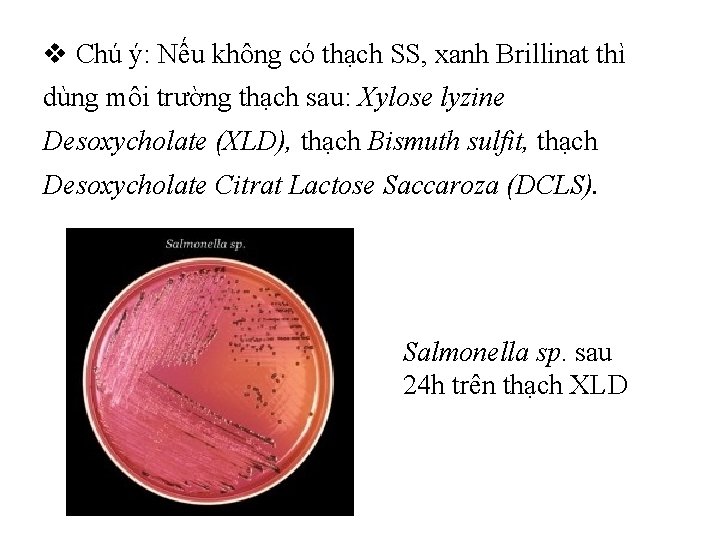
v Chú ý: Nếu không có thạch SS, xanh Brillinat thì dùng môi trường thạch sau: Xylose lyzine Desoxycholate (XLD), thạch Bismuth sulfit, thạch Desoxycholate Citrat Lactose Saccaroza (DCLS). Salmonella sp. sau 24 h trên thạch XLD

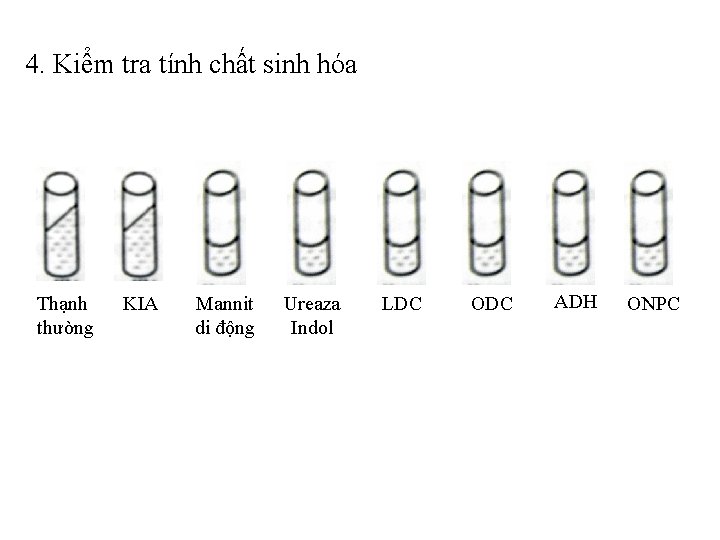
v Bước 4: kiểm tra các tính chất sinh hoá: • Từ những khuẩn lạc ghi ngờ salmonella thường cấy chuyển vào 7 môi trường chuẩn đoán và một ống thạch thường để xác định các tính chất sinh hoá

4. Kiểm tra tính chất sinh hóa Thạnh thường KIA Mannit di động Ureaza Indol LDC ODC ADH ONPC

KIA ODC Ure Indol ADH Mannit di động ONDG LDC Thạch thường

Để ủ ấm 370 C, có kết quả sau 24 h. Salmonella có tính chất sinh hoá theo bảng Tính chất Glucoza Lactoza H 2 S Hơi Mannit Di động Kết quả + + + Tính chất Ureaza Indol LDC ODC ADH ONDP Kết quả + + + -

v Bước 5: Kiểm tra ngưng kết với kháng nguyên huyết thanh tương ứng để xác định typ (nếu cần thiết và có điều kiện)

5. Kiểm tra ngưng kết với kháng nguyên huyết thanh. 370 C/24 giờ

Tài Liệu Tham Khảo 1. Giáo trình kiểm tra vệ sinh thú y. NXB Nông Nghiệp Hà Nội 2000. 2. Phương pháp phân tích vi sinh vật trong nước, thực phẩm, và mĩ phẩm. NXB Giáo dục
 Cây mọc lên từ hạt
Cây mọc lên từ hạt ếch đồng sinh 7
ếch đồng sinh 7 Axit abxixic
Axit abxixic Sơ đồ chu trình sinh sản của ếch
Sơ đồ chu trình sinh sản của ếch Arus pu chu chu
Arus pu chu chu Trò chơi chữ cái u ư chủ đề nghề nghiệp
Trò chơi chữ cái u ư chủ đề nghề nghiệp Muốn tính chu vi hình chữ nhật
Muốn tính chu vi hình chữ nhật Cách tính chu vi hình tam giác
Cách tính chu vi hình tam giác Vittago
Vittago Nhm vmware
Nhm vmware Dakshata nhm
Dakshata nhm Hris nhm jharkhand
Hris nhm jharkhand Nhm h
Nhm h National health mission tamil nadu
National health mission tamil nadu It is not opening
It is not opening Hrmis nhm
Hrmis nhm ếch đồng sinh 7
ếch đồng sinh 7 Tanh(x-y)
Tanh(x-y) Hình vẽ co và phản co nguyên sinh
Hình vẽ co và phản co nguyên sinh Một học sinh cận thị có các điểm cc cv
Một học sinh cận thị có các điểm cc cv Btvn
Btvn Diễn thế sinh thái là
Diễn thế sinh thái là Sinh inverse x formula
Sinh inverse x formula Biện pháp chống mỏi cơ
Biện pháp chống mỏi cơ Mùa đông năm ấy sao sáng soi cuối trời
Mùa đông năm ấy sao sáng soi cuối trời Khi nào hổ mẹ dạy hổ con săn mồi
Khi nào hổ mẹ dạy hổ con săn mồi San hô là sinh vật loại nào
San hô là sinh vật loại nào Vui ca phục sinh
Vui ca phục sinh 5 phẩm chất của học sinh
5 phẩm chất của học sinh Bản vẽ bể lọc sinh học nhỏ giọt
Bản vẽ bể lọc sinh học nhỏ giọt Sinh học 8 bài 24
Sinh học 8 bài 24 Additionstheoreme sinh cosh
Additionstheoreme sinh cosh Môi trường sống và các nhân tố sinh thái
Môi trường sống và các nhân tố sinh thái Tam giác scarpa
Tam giác scarpa