GESUNDHEITSMANAGEMENT II Teil 2 Prof Dr Steffen Flea

















- Slides: 22

GESUNDHEITSMANAGEMENT II Teil 2 Prof. Dr. Steffen Fleßa Lehrstuhl für Allgemeine Betriebswirtschaftslehre und Gesundheitsmanagement Universität Greifswald 1

Gliederung 1 Finanzierung 2 Produktionsfaktoren 2. 1 Menschliche Arbeit 2. 2 Betriebsmittel 2. 3 Werkstoffe 3 Produktion 2

2. 3 Werkstoffe • Arzneimittel • Medizinprodukte • Zahlreiche weitere Werkstoffe: – Nahrungsmittel, Reinigungsmittel, Heizstoffe, … 3

Arzneimittel • Synonym: Medikament, Pharmakon, Arzneistoff • Definition: Zu Diagnostik, Therapie und Prophylaxe verwendete natürliche oder synthetische Substanz oder Mischung von Substanzen • Typen: – feste Arzneimittel (z. B. Pulver, Puder, Granulat, Tablette, Dragees, Kapsel) – halbfeste Arzneimittel (z. B. Salbe, Gel, Zäpfchen) – flüssige Arzneimittel (z. B. Lösung, Sirup, Saft, Tropfen) – gasförmige Arzneimittel (z. B. Inhalat) – therapeutische Systeme (z. B. „Spirale“) 4

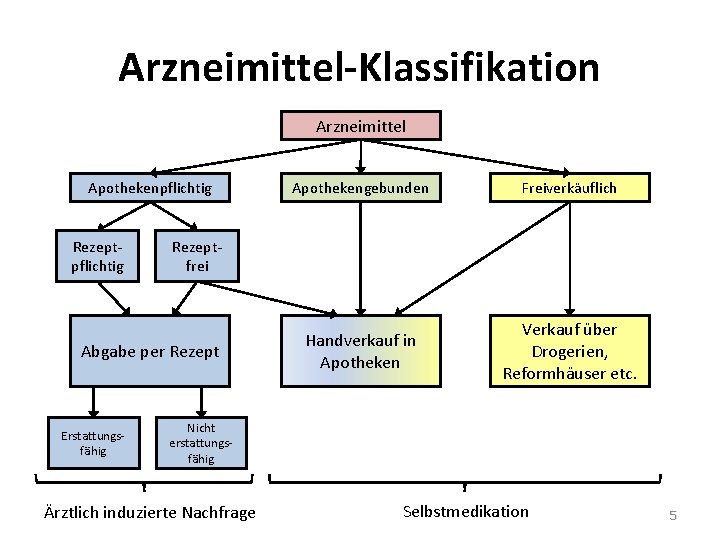
Arzneimittel-Klassifikation Arzneimittel Apothekenpflichtig Rezeptpflichtig Freiverkäuflich Handverkauf in Apotheken Verkauf über Drogerien, Reformhäuser etc. Rezeptfrei Abgabe per Rezept Erstattungsfähig Apothekengebunden Nicht erstattungsfähig Ärztlich induzierte Nachfrage Selbstmedikation 5

Arzneimittelmarkt • Bedeutender Teilmarkt (15 -20% der Gesundheitsausgaben) • Großer Zukunftsmarkt, Selbstmedikamentierung • Besonderheiten Deutschlands – Volle Mehrwertsteuer – Geringe staatliche Regulierung – 98% der Apotheken sind öffentlich, 2% Krankenhausapotheken 6

Arzneimittelentwicklung • Phasen: – Präklinische Studien: Untersuchung des Wirkstoffes, Tierversuche – Klinische Studien • Phase 1: Verträglichkeitsprüfung an gesunden Menschen • Phase 2: Studien an einer geringen Zahl von Erkrankten (30 -300) unter starker Beobachtung (z. B. Klinik) für kurze Zeit • Phase 3: Multicenterstudie (Kliniken und Arztpraxen) an großen Patientengruppen (300 -5000) über längere Zeit • Phase 4: Klinische Prüfung nach der Zulassung an großen Patientengruppen – Gesundheitsökonomische Evaluation: Gesundheitsreform 2006 sieht verpflichtende Überprüfung der ökonomischen Sinnhaftigkeit vor 7

Kosten der Arzneimittelentwicklung • Zeit: Von Vorklinischer Phase bis Zulassung: 8 -12 Jahre – Patentzeit für Substanzen: 20 Jahre. – Folge: u. U. nur 8 Jahre Ertrag vor Generika • Erfolg: etwa 10 % • Kosten: – Einzelkosten für die Entwicklung eines erfolgreichen Medikaments: 100 -400 Mio. € – Einzelkosten als Durchschnitt über alle: • 500 -1000 Mio. € • Grund: 90 % sind erfolglos, aber viele schon in der ersten Phase • Ziel: Möglichst viele schon während der ersten Phase aussieben 8

Zulassung • Inhalt: Feststellung von – Sicherheit – Wirksamkeit von Arzneimitteln Feststellung der Verkehrsfähigkeit • Verfahren – Antrag bei Arzneimittelbehörden – Unterlagen zur pharmazeutischen Qualität, therapeutischen Wirksamkeit und Unbedenklichkeit des Arzneimittels • Nach Zulassung: Pharmakovigilanz – laufende und systematische Überwachung der Sicherheit eines Arzneimittels – Unerwünschte Arzneimittelwirkungen 9

Zulassungsstellen • NB: EU-Zulassung über nationale Zulassungsstellen • Standard: Bundesinstitut für Arzneimittel und Medizinprodukte (Bf. Ar. M) • Ausnahmen: – Paul-Ehrlich-Institut (Blutprodukte und Impfstoffe) – Friedrich-Löffler-Institut (immunologische Tierarzneimitteln) – Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (Tierarzneimittel) 10

Sonderfälle • Orphan-Arzneimittel – Seltene Krankheiten: in der EU weniger als 5 von 10. 000 Personen – Einfachere Zulassung • Generika – Arzneimittel mit gleichem Wirkstoff wie nicht mehr patentgeschütztes Referenzarzneimittel. – vereinfachte Bedingungen zur Zulassung • Analogpräparat (Me-Too-Arzneimittel) – Arzneimittel mit Wirkstoff, der im Vergleich zu einem früher eingeführten Arzneistoff keine oder nur marginale therapeutische Unterschiede aufweist 11

Erstattung • AMNOG: Gesetz zur Neuordnung des Arzneimittelmarktes (1. 1. 2011) – Preisbildung für neu zugelassene Arzneimittel = Erstattungsfähigkeit durch (GKV) • § 35 a SGB V (Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen) – „Der Gemeinsame Bundesausschuss bewertet den Nutzen von erstattungsfähigen Arzneimitteln mit neuen Wirkstoffen. Hierzu gehört insbesondere die Bewertung des Zusatznutzens gegenüber der zweckmäßigen Vergleichstherapie, des Ausmaßes des Zusatznutzens und seiner therapeutischen Bedeutung. “ • § 35 b SGB V Kosten-Nutzen-Bewertung von Arzneimitteln – „Der Gemeinsame Bundesausschuss beauftragt […] das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen mit einer Kosten -Nutzen-Bewertung. In dem Auftrag ist insbesondere festzulegen, für welche zweckmäßige Vergleichstherapie und Patientengruppen die Bewertung erfolgen soll sowie welcher Zeitraum, welche Art von Nutzen und Kosten und welches Maß für den Gesamtnutzen bei der Bewertung zu berücksichtigen sind; “ 12

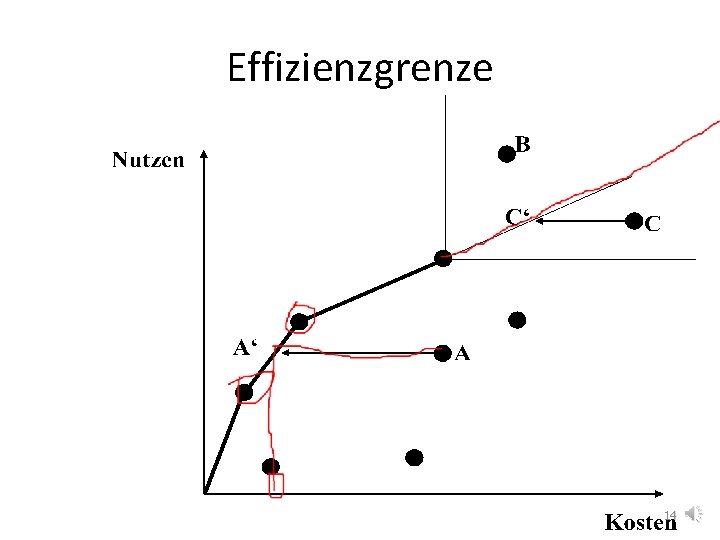
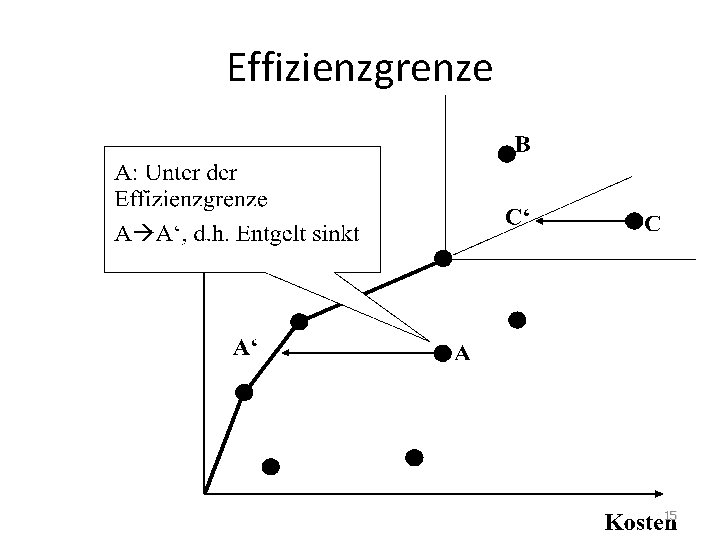
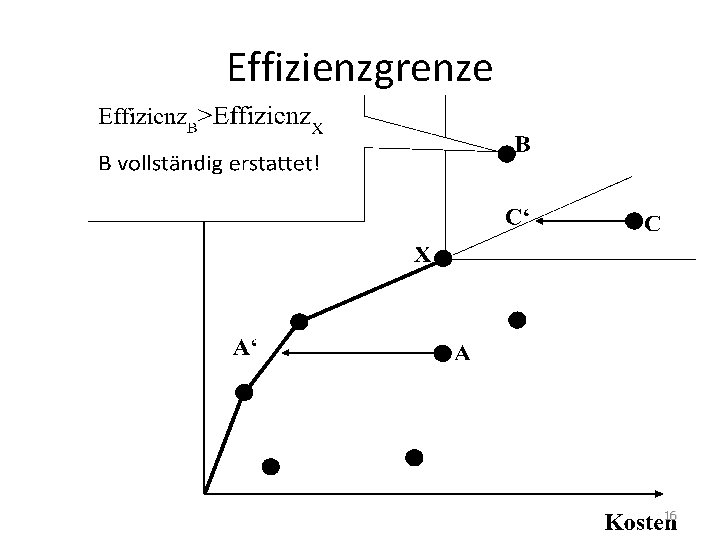
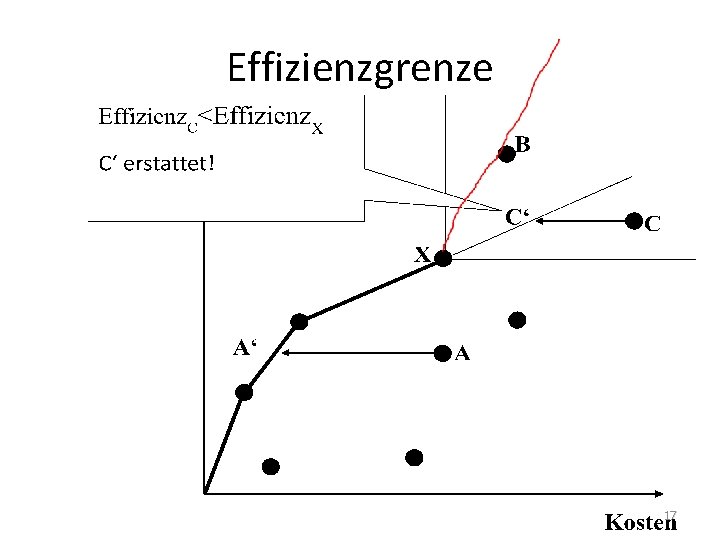
Erstattung • Schritt 1: Nutzenbewertung – Zusatznutzen gegenüber eingeführten Arzneimitteln (echte Innovation oder Me-Too? ) • Nein: 6 Monate nach Markteinführung in Festbetragssystem (Höchstpreise für bestimmte Arzneimittel-Wirkstoffgruppen) überführt • Schritt 2: Effizienzgrenze – Zusatznutzen und Nutzenkosten 13

Effizienzgrenze 14

Effizienzgrenze 15

Effizienzgrenze 16

Effizienzgrenze 17

NB! • Für Krankenhäuser ist der GKVErstattungspreis theoretisch irrelevant, da die Verkaufspreise von Medikamenten für Krankenhäuser frei verhandelbar sind. • In der Praxis ist die GKV-Erstattung jedoch ein Anhaltspunkt. 18

Compliance • Inhalt: Therapietreue, d. h. konsequentes Befolgen der ärztlichen Ratschläge • „Non-Compliance“ = von ärztlicher Verordnung abweichendes Verbrauchs- bzw. Einnahmeverhalten. • 30 % der verschriebenen und gekauften Arzneien wird weggeworfen, da – Packung zu groß ODER – Medikamente nicht eingenommen • Adhärenz: neuerer, umfassender Begriff, der die Verantwortung nicht allein beim Patienten sieht. 19

Medizinprodukte • Medizinproduktegesetz (MPG) • § 3: Medizinprodukte sind Produkte mit medizinischer Zweckbestimmung für die Anwendung beim Menschen – Anders als bei Arzneimitteln, die pharmakologisch, immunologisch oder metabolisch wirken, wird die bestimmungsgemäße Hauptwirkung bei Medizinprodukten primär auf z. B. physikalischem Weg erreicht. • Beispiele: Implantate, Produkte zur Injektion, Infusion, Transfusion und Dialyse, medizinische Software, Katheter, Dentalprodukte, Verbandstoffe, Sehhilfen, Röntgengeräte, Kondome, ärztliche Instrumente, Labordiagnostika, … • Problem: Medizinprodukte mit Arzneistoffen (z. B. beschichtete Implantate) 20

Risikoklassen https: //www. aokbv. de/imperia/md/aokbv/presse/bilderservice/gesundheitswesen/ams_grafik_p_1218_g. jpg 21

Gliederung 1 Finanzierung 2 Produktionsfaktoren 2. 1 Menschliche Arbeit 2. 2 Betriebsmittel 2. 3 Werkstoffe 3 Produktion 22