Genov terapie a farmakogenetika 1 6 2006 Genov











































- Slides: 50

Genová terapie a farmakogenetika 1. 6. 2006

Genová terapie: typy nemocí • • Infekční nemoci Rakoviny Vrozené nemoci Nemoci imunitního systému

Genová terapie Ø Zahrnuje jakoukoliv proceduru, určenou k léčení nemoci genetickou modifikací buněk pacienta. Ø Do buněk se transferují: geny, jejich části nebo oligonukleotidy. Ø Genová terapie in vivo: transfer přímo do buněk pacienta Ø Genová terapie in vitro: genové modifikace probíhají mimo organismus Ø Genová terapie ex vivo: modifikované buňky se vracejí do organismu

Genová terapie a jiné terapeutické molekulárně genetické přístupy Ø Rekombinantní proteiny a „genetically engineered“ vakcíny Ø Expresním klonováním produktů normálního genu (klonované geny jsou exprimovány v mikroorganismech nebo transgenních organismech), které slouží k tvorbě velkých množství medicínsky cenných produktů Ø Produkcí geneticky „engineering“ protilátek (geny protilátky jsou manipulovány k tvorbě nových částečně nebo plně humanizovaných protilátek) pro terapeutické použití Ø Produkcí „genetically engineered“ vakcín-především proti tumorům a infekčním agens.

Genová terapie Ø Klasická genetická terapie (dopravit geny do vhodných cílových buněk, aby bylo dosaženo optimální exprese vnesených genů) s cílem: Ø 1. zajistit produkci látky, která chybí Ø 2. aktivovat buňky imunitního systému ve snaze pomoci odstranit nemocné buňky

Neklasická genová terapie Ø Inhibice exprese genů asociovaných s patogenezou Ø Korekce genetického defektu a obnovení normální genové exprese Ø Současná genová terapie se omezuje na terapii somatických mutací. Ø Etické problémy s potenciální terapií zárodečných mutací.

Rekombinantní léky je možno produkovat expresním klonováním v mikroorganismech nebo v transgenních zvířatech V mikroorganismech: ü Výhody: dostatečná množství produkovaných látek ü Nevýhody: ü Pozměněné produkty v důsledku odlišných posttranslačních úprav bílkovin se stejnou primární strukturou (glykosylace) ü problémy s purifikací V transgenních zvířatech: ü možnost navodit podobné posttranslační systémy jako u člověka

„Genetically engineered“ protilátky a vakcíny Uměle produkované terapeutické protilátky jsou navrženy jako monospecifické (poznají jen jeden typ antigenního místa), které poznají specifické antigeny asociované s nemocí, což vede k zabití nemocných buněk Typy nemocí: • Lymfomy, leukemie, infekční nemoci, autoimunitní nemoci. Hybridomy = heterogenní směs hybridních buněk (vzniklých fúzí), které jsou schopny produkovat specifické protilátky (B lymfocyty imunizovaného zvířete) a přitom se v kultuře neomezeně dělit (nesmrtelný myší B-lymfocytární tumor).

Chimerické a humanizované protilátky Ø Rekombinantní protilátky humánní-hlodavčí Ø Humanizace hlodavčích m. Ab umožňuje získat velké množství protilátek a zároveň zabránit imunitní odpovědi lidského příjemce: Ø chimerické V/C protilátky) Ø CDR (complementarity determining regions) graft protilátky Ø Infekční patogeny a antigeny nádorových buněk



Plně lidské protilátky • Technologie fágového displaye: protilátky jsou tvořeny in vitro napodobováním selekční strategie imunitního systému • Transgenní myši: Transfer kvasinkových umělých chromozomů s velkými segmenty lidských těžkých a lehkých Ig řetězců do myších embryonálních buněk. Narozené myši obsahují velmi pozoruhodnou porci lidských V genetických segmentů a jsou schopny tvořit lidské protilátky

„Geneticky enginnered“ vakcíny Ø Pomocí rekombinantní technologie: Ø Vakcíny nukleových kyselin: Ø bakteriální plasmidy s geny pro patogeny nebo tumorové antigeny, podávané i. m. v solném roztoku. Obsahují silný virový promotor. Ø „gene gun“ - zlaté perly, do nichž byla precipitována DNA

„Geneticky enginnered“ vakcíny Ø Genetická modifikace antigenu – např. fúze cytokinu s antigenem ke zvýšení antigenicity Ø Genetická modifikace virů- virové vektory Ø Genetické modifikace mikroorganismů, které způsobí: Ø odstranění genů nutných pro patogenezu Ø expresi exogenního genu v bakteriích nebo parazitech po jeho inzerci do těchto organismů

Technologie klasické genetické terapie • Jedná se o zacílení buněk nemocné tkáně Ø Geny mohou inzertovány do buněk pacienta přímo a nepřímo Ø Inzertované geny se mohou ü Integrovat do chromozomů ü Zůstat extrachromozomálně (epizomy)

Genetický transfer Ø Ex vivo ü Transfer klonovaných genů do buněk v kultuře (transplantace autologních geneticky modifikovaných buněk) Ø In vivo ü Transfer se děje přímo do tkáně pacienta. Pomocí liposomů nebo virových vektorů.



Principy genetického transferu Ø c. DNA s kompletní DNA kódující sekvencí je modifikována k zajištění vysoké hladiny exprese, např. pomocí silného virového vektoru. Následná inzerce genu se děje Ø A) do chromozomu Ø gen se bude rozšiřovat do dalších buněk Ø zajištěna vysoká úroveň exprese (kmenové buňky) Ø náhodná inzerce-různá lokalizace –různá úroveň exprese-smrt jednotlivé buňky-rakovina (aaktivace onkogenu, deaktivace supresorového nebo apoptotického genu-výhoda transferu ex vivo. Ø B) extrachromozomálně – nevýhoda nejistého dlouhodobého účinku











Farmakogenetika

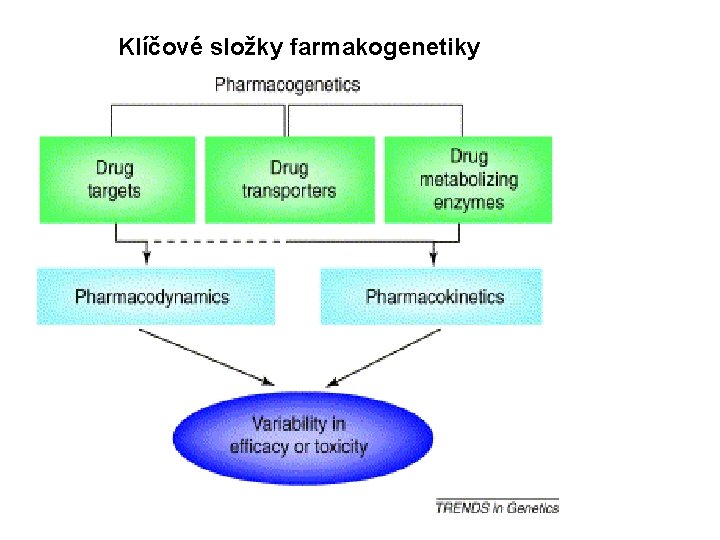
Cíl • Na základě interdisciplinárního integrace znalostí farmakologie a genetiky popsat vliv dědičnosti na odpověď organismu na různé léky. Ø Farmakogenomika ü Farmakodynamika: popisuje žádoucí či nežádoucí účinky léků na organismus (lék organismus) ü Farmakokinetika: se zabývá hladinami léků a jeho metabolitů v různých tkáních a vstřebáváním léků, jejich distribucí, metabolismem a eliminací (organismus lék)

Klíčové složky farmakogenetiky

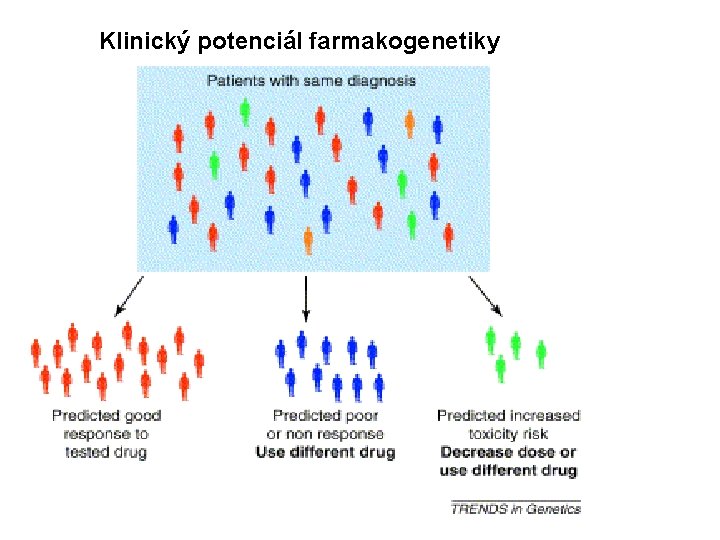
Klinický potenciál farmakogenetiky


Farmakogenetika a vývoj léků Ø Nutnost přesné diagnózy (k fenotypicky podobným stavům mohou vést různé patobiochemické mechanismy). Ø Individuální odpověď jedince na terapii může záležet na genech, vstupujících do interakce s metabolismem léku nebo jeho působením. Ø Polovina všech dosud používaných léků je metabolizována enzymy P 450.

P 450 • CYP 3 A 4 – 50% metabolizovaných léků • CYP 2 D 6 – 20% • CYP 2 C 9 + CYP 2 C 19 - 15 % • CYP 2 D 6, CYP 2 C 9, CYP 2 C 19 a CYP 2 A 6 byly prokázány jako funkčně polymorfní

Receptory signálních molekul účastnících se v patofyziologii nemoci Ø Ø Ø G-protein coupled receptors: -1 a -2 adrenergní receptory Receptor pro cholecystokinin 2 (CCK 2) Mu opioidní receptor U těchto receptorů byly prokázány polymorfismy, které ovlivňují afinitu ligandu. Je tedy možno navrhovat podle potřeb takové ligandy, které respektují (individuální terapie) nebo naopak nerespektují (univerzální použití léku) tuto variabilitu. Ø Je také možno navrhovat takové ligandy, které se vážou pouze na mutované varianty genů a inaktivují je (genová terapie)

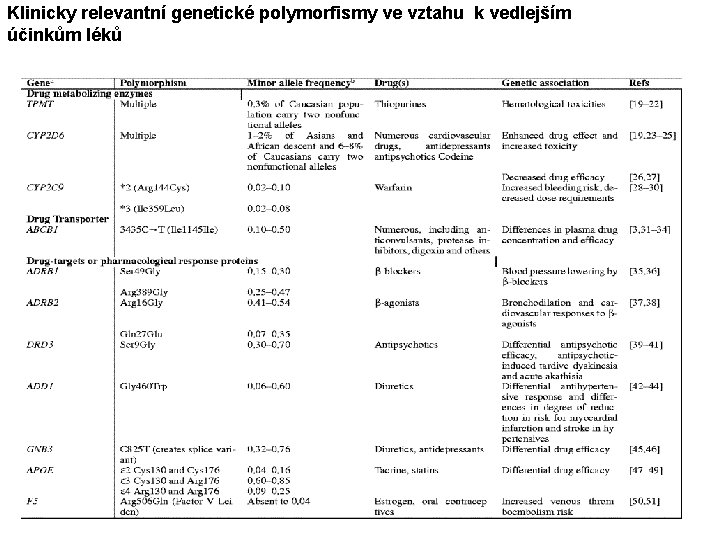
Klinicky relevantní genetické polymorfismy ve vztahu k účinnosti léků

Klinicky relevantní genetické polymorfismy ve vztahu k vedlejším účinkům léků

Hodnocení významu genetických faktorů u multigenních nemocí- 10 otázek ü Jak důležité jsou genetické vlivy i nejčastějších forem multigenních nemocí? ü Jaký je vliv prostředí na vznik nemoci? ü Které jsou nejslibnější přístupy k determinaci genetických faktorů pro nemoc? ü Které geny již byly vybrány jako vnímavé? ü Které cesty přispívají ke genetické vnímavosti pro danou nemoc? ü Jak mnoho genů se podílí na vnímavosti k nemoci účastní? ü Jsou nejčastější formy multigenní nemoci asociovány s častou nebo vzácnou genetickou variabilitou v populaci? (hypotéza častá variace/častá nemoc vs. genetický heterogenní model) ü Proč alely, které jsou asociovány s nemocí, nebyly z populace eliminovány? ü Jako důležité jsou pro danou nemoc interakce genyprostředí a geny-geny? ü Jaké jsou důsledky pro farmakogenetiku?

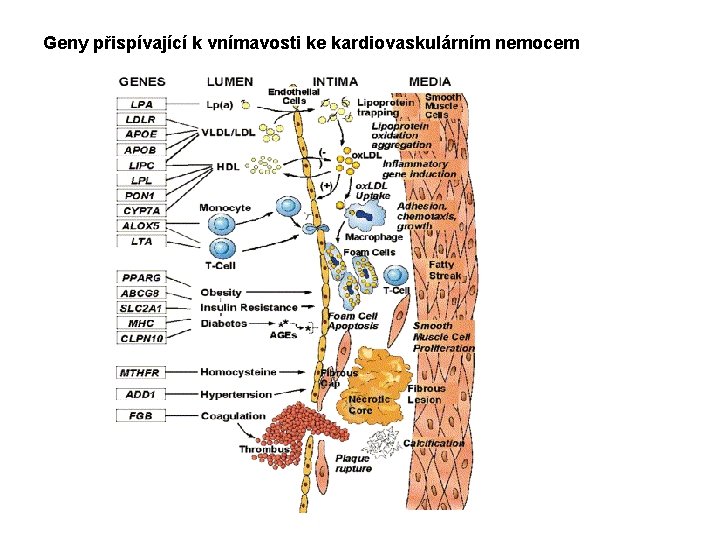
Geny přispívající k vnímavosti ke kardiovaskulárním nemocem

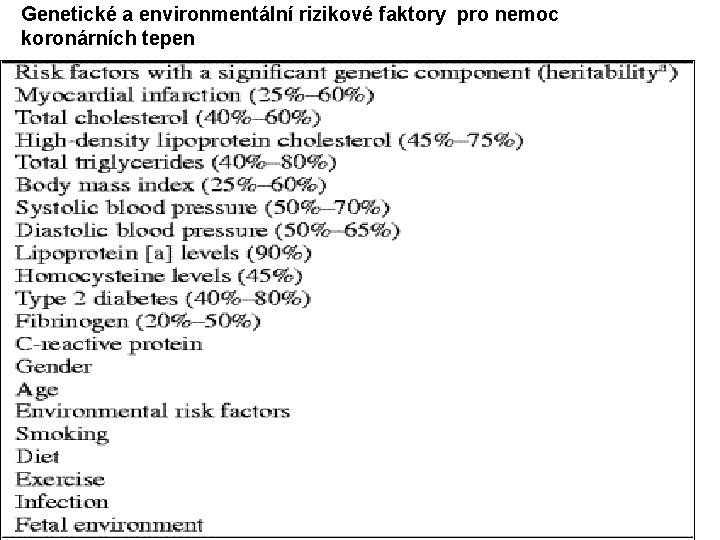
Genetické a environmentální rizikové faktory pro nemoc koronárních tepen

Kandidátní geny - asociace Øs intermediálním fenotypem Øs klinickou manifestací nemoci Øs klinickou závažností nemoci Øs odpovídavostí nemoci na léčbu

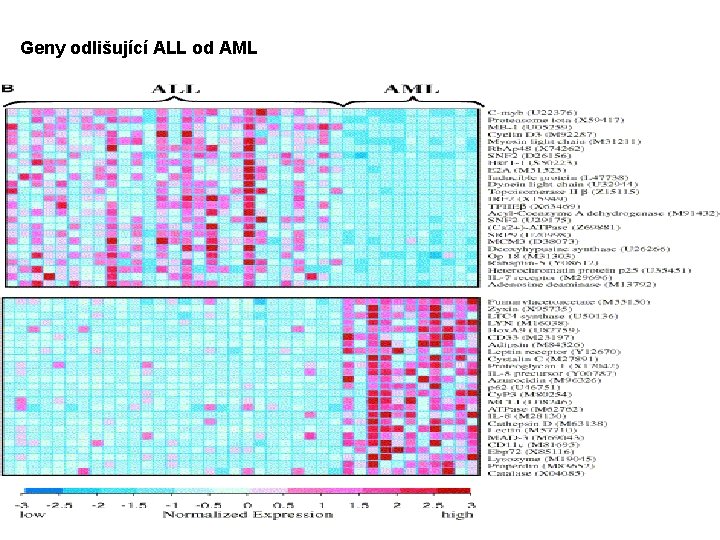
Geny odlišující ALL od AML

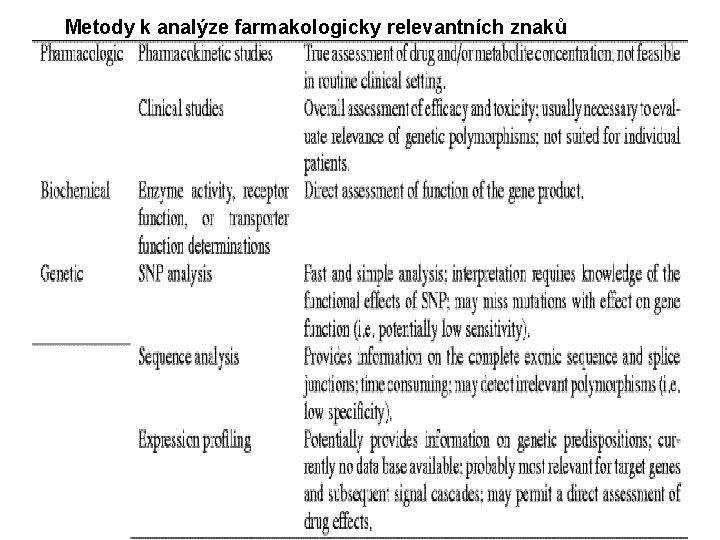
Metody k analýze farmakologicky relevantních znaků

Validita enzymové aktivity ve srovnání s genetickým vyšetřením

Analýza SNP • Hmotnostní spektrometrie • Fluorescenční metody



Analýza SNP pomocí fluorescenčních metod
 Exercitii dislalie
Exercitii dislalie Elektrokonvulzivní terapie zkušenosti
Elektrokonvulzivní terapie zkušenosti Barbora burdova
Barbora burdova Tilen genov
Tilen genov T.trimpe 2006 http sciencespot.net
T.trimpe 2006 http sciencespot.net Pt andalan mama menetapkan taksiran kerugian piutang
Pt andalan mama menetapkan taksiran kerugian piutang 2006
2006 6 november 2006
6 november 2006 Xxxx2006
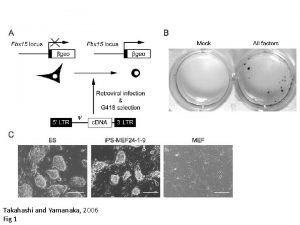
Xxxx2006 Takahashi
Takahashi 2 mars 2006
2 mars 2006 Jass 2006
Jass 2006 2006
2006 Lee 2006
Lee 2006 T. trimpe 2006 http://sciencespot.net/
T. trimpe 2006 http://sciencespot.net/ Regulation 1107/2006
Regulation 1107/2006 May 25 2006
May 25 2006 T. trimpe 2006 http //sciencespot.net/
T. trimpe 2006 http //sciencespot.net/ Friday prayer chant
Friday prayer chant Fingerprint factoid
Fingerprint factoid Giddens 2006
Giddens 2006 Sentencia c-355 de 2006.
Sentencia c-355 de 2006. Boardworks ltd 2006
Boardworks ltd 2006 T. trimpe 2006 http://sciencespot.net/
T. trimpe 2006 http://sciencespot.net/ 17 november 2006
17 november 2006 Charmaz 2006
Charmaz 2006 Boardworks ltd 2006
Boardworks ltd 2006 Zakonske zatezne kamate od 2006.godine do danas
Zakonske zatezne kamate od 2006.godine do danas 2006
2006 A real friend 2006
A real friend 2006 El paso flood 2006
El paso flood 2006 Legge 67 2006
Legge 67 2006 Wolrd cup 2006
Wolrd cup 2006 Http //sciencespot.net/
Http //sciencespot.net/ January 31 2006
January 31 2006 2006 ford ranger 3.0 firing order
2006 ford ranger 3.0 firing order Lei 11.346/2006
Lei 11.346/2006 Adler and rodman 2006
Adler and rodman 2006 Renslucka ventilation
Renslucka ventilation Wolrd cup 2006
Wolrd cup 2006 Ley 1010 de 2006
Ley 1010 de 2006 Rs 234-2006
Rs 234-2006 Marc quinn, self
Marc quinn, self Maturita 2006
Maturita 2006 Ginarvetosti
Ginarvetosti T. trimpe 2006 http://sciencespot.net/
T. trimpe 2006 http://sciencespot.net/ Work and families act 2006
Work and families act 2006 Boardworks ltd 2006
Boardworks ltd 2006 Fair play 2006
Fair play 2006 What is unfair competition
What is unfair competition 2006 hurricane season
2006 hurricane season