GAZY SZLACHETNE HEL ZASTOSOWANIE NEON ZASTOSOWANIE ARGON ZASTOSOWANIE










- Slides: 13

GAZY SZLACHETNE HEL ZASTOSOWANIE NEON ZASTOSOWANIE ARGON ZASTOSOWANIE KRYPTON ZASTOSOWANIE KSENON ZASTOSOWANIE RADON ZASTOSOWANIE Wykonawca: Mateusz Dąbała kl. Ic KONIEC

HEL Hel (He) – pierwiastek chemiczny, z grupy gazów szlachetnych w układzie okresowym. Jest po wodorze drugim najbardziej rozpowszechnionym pierwiastkiem chemicznym we wszechświecie, jednak na Ziemi występuje wyłącznie w śladowych ilościach. Hel na Ziemi występuje głównie w atmosferze. W litosferze hel występuje w niektórych złożach gazu ziemnego. Praktycznie cały hel, który mógł pierwotne istnieć na Ziemi, nie mogąc związać się z żadnym innym pierwiastkiem, jako bardzo lekki opuścił atmosferę Ziemi. Hel jest najmniej aktywnym pierwiastkiem chemicznym, z bardzo wysoką energią jonizacji. Nie udało się z nim uzyskać żadnego trwałego związku chemicznego. Nie ma żadnego znaczenia biologicznego. Hel świecący w silnym polu elektrycznym. MENU

ZASTOSOWANIE HELU • Hel w postaci ciekłej jest używany do chłodzenia tam, gdzie potrzebne są bardzo niskie temperatury, ze względu na jego bardzo niską temperaturę wrzenia. Stosuje się go m. in. do chłodzenia nadprzewodników. • Jako najlżejszy gaz bezpieczny (niepalny) był stosowany do wypełniania statków powietrznych lżejszych od powietrza, czyli aerostatów (balony, sterowce). • Ze względu na niską rozpuszczalność w osoczu krwi, używany jest jako składnik mieszanki do oddychania w głębokim nurkowaniu. • Hel dostarczony do płuc powoduje zmianę wysokości głosu – dzieje się tak, ponieważ częstość drgań w komorze rezonansowej, jaką jest ośrodek mowy, ściśle zależy od gęstości ośrodka, w którym te drgania zachodzą (prędkość dźwięku w helu jest ok. 3 razy większa niż w powietrzu). • Hipotetycznie izotop 3 He może zostać wykorzystany w kontrolowanej reakcji termojądrowej z deuterem do uzyskiwania energii bez powstawania niepożądanych odpadów promieniotwórczych. Na Ziemi 3 He występuje jedynie śladowo, natomiast znaczne ilości tego izotopu występować mogą w gruncie księżycowym, w związku z czym rozważane są projekty jego wydobycia i transportu z Księżyca na Ziemię. MENU

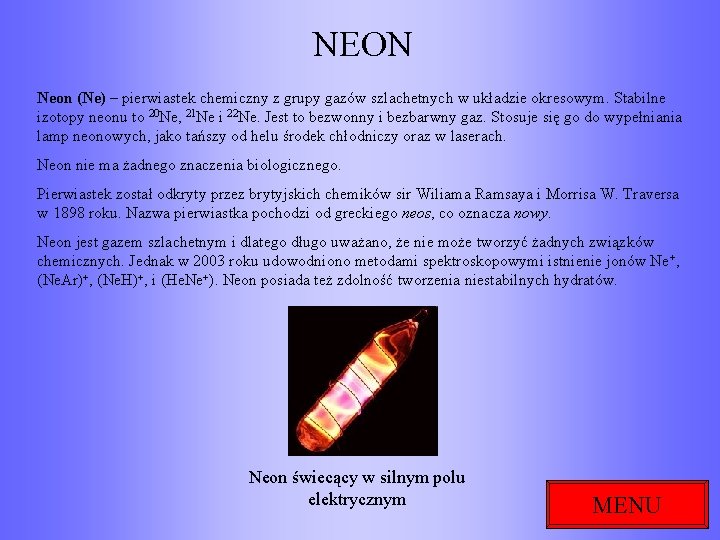
NEON Neon (Ne) – pierwiastek chemiczny z grupy gazów szlachetnych w układzie okresowym. Stabilne izotopy neonu to 20 Ne, 21 Ne i 22 Ne. Jest to bezwonny i bezbarwny gaz. Stosuje się go do wypełniania lamp neonowych, jako tańszy od helu środek chłodniczy oraz w laserach. Neon nie ma żadnego znaczenia biologicznego. Pierwiastek został odkryty przez brytyjskich chemików sir Wiliama Ramsaya i Morrisa W. Traversa w 1898 roku. Nazwa pierwiastka pochodzi od greckiego neos, co oznacza nowy. Neon jest gazem szlachetnym i dlatego długo uważano, że nie może tworzyć żadnych związków chemicznych. Jednak w 2003 roku udowodniono metodami spektroskopowymi istnienie jonów Ne+, (Ne. Ar)+, (Ne. H)+, i (He. Ne+). Neon posiada też zdolność tworzenia niestabilnych hydratów. Neon świecący w silnym polu elektrycznym MENU

ZASTOSOWANIE NEONU • Technika oświetleniowa – neon wykorzystuje się w lampach jarzeniowych. Świeci on na kolor pomarańczowy. • Elektronika – w ekranach telewizorów plazmowych wykorzystuje się właściwości neonu lub ksenonu, które zmieniają się pod wpływem wysokiego napięcia. • Neon służy do chłodzenia urządzeń, używanych do prac w temperaturach bliskich zeru bezwzględnemu (-273°C). • Służy on do napełniania żarówek o dużej mocy. • Stosowany jest jako gaz ochronny przy wytopie i spawaniu niektórych metali (tytanu, cynku, magnezu) i stopów (stali nierdzewnej). MENU

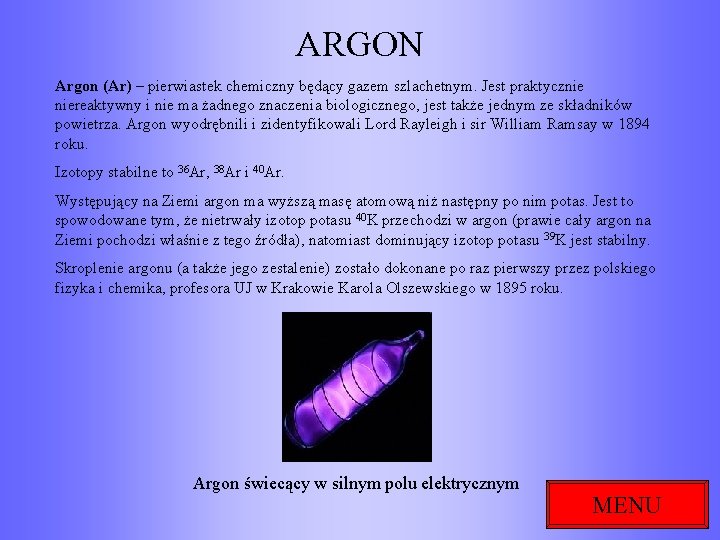
ARGON Argon (Ar) – pierwiastek chemiczny będący gazem szlachetnym. Jest praktycznie niereaktywny i nie ma żadnego znaczenia biologicznego, jest także jednym ze składników powietrza. Argon wyodrębnili i zidentyfikowali Lord Rayleigh i sir William Ramsay w 1894 roku. Izotopy stabilne to 36 Ar, 38 Ar i 40 Ar. Występujący na Ziemi argon ma wyższą masę atomową niż następny po nim potas. Jest to spowodowane tym, że nietrwały izotop potasu 40 K przechodzi w argon (prawie cały argon na Ziemi pochodzi właśnie z tego źródła), natomiast dominujący izotop potasu 39 K jest stabilny. Skroplenie argonu (a także jego zestalenie) zostało dokonane po raz pierwszy przez polskiego fizyka i chemika, profesora UJ w Krakowie Karola Olszewskiego w 1895 roku. Argon świecący w silnym polu elektrycznym MENU

ZASTOSOWANIE ARGONU • Argon jest wykorzystywany do procesów chemicznych potrzebujących niereaktywnej atmosfery, jeśli nawet atmosfera azotu byłaby zbyt reaktywna. Z tego samego powodu jest jednym z podstawowych gazów (obok dwutlenku węgla) stosowanych w spawaniu w atmosferze ochronnej. Jego zaletą jako atmosfery ochronnej jest też jego większa gęstość od gęstości powietrza, dzięki czemu nie jest wypierany z nieszczelnej aparatury, lecz "ściele" się na jej dnie. • Używa się go też w żarówkach, a dzięki niższej od powietrza przewodności cieplnej, podobnie jak krypton, wykorzystywany jest do wypełniania szyb zespolonych w nowoczesnych oknach. • Argonem są wypełniane dyski twarde komputerów, w celu mniejszego zużycia się talerzy i głowicy czytającej. MENU

KRYPTON Krypton (Kr) – pierwiastek chemiczny, z grupy helowców w układzie okresowym. Jest to bezbarwny, praktycznie niereaktywny gaz. Został odkryty w roku 1898 przez W. Ramsaya i M. W. Traversa. Nazwa pochodzi od greckiego kryptos – ukryty. Występuje w atmosferze ziemskiej oraz jest obecny jako jeden z produktów rozpadu promieniotwórczego przy złożach rud uranu i plutonu. Nie ma znaczenia biologicznego. Trwałe są izotopy: 78, 80, 82, 83, 84 i 86. Krypton jest bardzo słabo reaktywny, podobnie jak inne gazy szlachetne. Reaguje tylko z gazowym fluorem pod wysokim ciśnieniem, tworząc fluorki kryptonu. Izotop 86 Kr ma pomarańczowo-czerwoną linię w widmie atomowym. Długość fali elektromagnetycznej tej linii stanowiła do roku 1983 wzorzec metra w systemie SI, według wzoru: 1 metr = 1650763, 73 długości fali tej linii. Krypton świecący w silnym polu elektrycznym. MENU

ZASTOSOWANIE KRYPTONU • Dzięki niskiej przewodności cieplnej, podobnie jak argon, wykorzystywany jest do wypełniania żarówek i szyb zespolonych w nowoczesnych oknach. • Inne jego praktyczne zastosowanie to wyszukiwanie rud uranu, jako że jest jednym z częstych produktów jego rozszczepienia. • Technika oświetleniowa – krypton wykorzystuje się w lampach jarzeniowych. Świeci na kolor biały. • Przemysł lotniczy – lampy stroboskopowe wypełnione kryptonem wykorzystuje się na pasach startowych lotnisk. MENU

KSENON Ksenon (Xe) – pierwiastek chemiczny z grupy gazów szlachetnych w układzie okresowym. Nazwa pochodzi z gr. ksénos 'dziwny', 'obcy'. Został odkryty w 1898 r. przez W. Ramsaya i Morrisa Traversa jako pozostałość po frakcjonowanej destylacji skroplonego kryptonu. Ksenon w warunkach normalnych jest gazem bezbarwnym i bezwonnym. W stanie wolnym występuje w postaci pojedynczych atomów. Zaliczany jest do pierwiastków chemicznie biernych, ale w specjalnych warunkach tworzy związki z fluorem i tlenem, np. H 6 Xe. O 6), a już w temp. pokojowej związek jonowy Xe. Pt. F 6. Ksenon świecący w silnym polu elektrycznym MENU

ZASTOSOWANIE KSENONU • Silniki jonowe - ze względu na dosyć wysoką masę atomową, niską energię jonizacji oraz duży przekrój czynny, wykorzystywany jest w silniku jonowym. • Optyka i oświetlenie - stosowany jest również do wypełniania lamp błyskowych, żarówek dużej mocy i jarzeniówek. • Medycyna - może znaleźć także zastosowanie w medycynie, ponieważ podawany drogą wziewną chroni komórki nerwowe w mózgu i rdzeniu kręgowym przed obumieraniem (np. po urazie czy udarze mózgu). • Energetyka jądrowa - izotop Xe-135 jest jednym z produktów ubocznych rozpadu paliwa uranowego w reaktorach atomowych. Jednocześnie jest silnym pochłaniaczem neutronów, co oznacza że wpływa hamująco na przebieg reakcji łańcuchowej. Nagromadzenie Xe-135 w paliwie, zwane zatruciem ksenonowym, powoduje krótkotrwały ale znaczny spadek mocy reaktora. Jeśli nie jest poprawnie zidentyfikowane, może prowadzić do błędnych i niebezpiecznych decyzji operatorów reaktora. Nierozpoznane zatrucie ksenonowe było jedną z przyczyn katastrofy w Czarnobylu. MENU

RADON Radon (Rn) – pierwiastek chemiczny z grupy gazów szlachetnych w układzie okresowym. Został odkryty w 1900 roku przez Friedricha Dorna. Początkowo był nazywany "emanacją" (symbol Em), proponowano dla niego także nazwę "niton" (Nt). Niektóre jego izotopy nosiły własne nazwy, pochodzące od pierwiastków z których powstały, jak 222 Rn – "radon", 220 Rn – "toron" (symbol Tn) lub 219 Rn – "aktynon" (An). Dopiero po roku 1923 przyjęto jako obowiązującą nazwę najtrwalszego izotopu. Radon jest bezbarwnym, bezwonnym radioaktywnym gazem szlachetnym. Występuje naturalnie, jako produkt rozpadu radu, który z kolei powstaje z obecnego w przyrodzie w sporych ilościach uranu. Jego najstabilniejszy izotop, 222 Rn, ma okres połowicznego rozpadu 3, 8 dnia i jest stosowany w radioterapii. Właściwości chemiczne radonu są stosunkowo słabo znane, ze względu na jego wysoką radioaktywność. Radon należy do grupy gazów szlachetnych, które z definicji powinny być chemicznie obojętne. Mimo to znanych jest kilka jego związków na różnych stopniach utlenienia. Są to m. in. fluorki Rn. F 2, Rn. F 4, Rn. F 6 oraz chlorek Rn. Cl 4. Ze względu na nietrwałość samego radonu nie mają one żadnych zastosowań. MENU

ZASTOSOWANIE RADONU • Medycyna – radon jest pierwiastkiem stosowanym w medycynie – naturalnie występujące wody radonowe stosuje się do kąpieli w rehabilitacji chorób narządów ruchu, zarówno tych pourazowych jak i reumatycznych. Kąpiele radonowe stosowane są też dla leczenia cukrzycy, chorób stawów, chorób tarczycy oraz schorzeń ginekologicznych i andrologicznych. • Geologia – radon odgrywa dużą rolę w poszukiwaniu rud uranu. MENU