Fusin nuclear Sun Cuatro hidrgeno ncleos protones Dos

















- Slides: 31


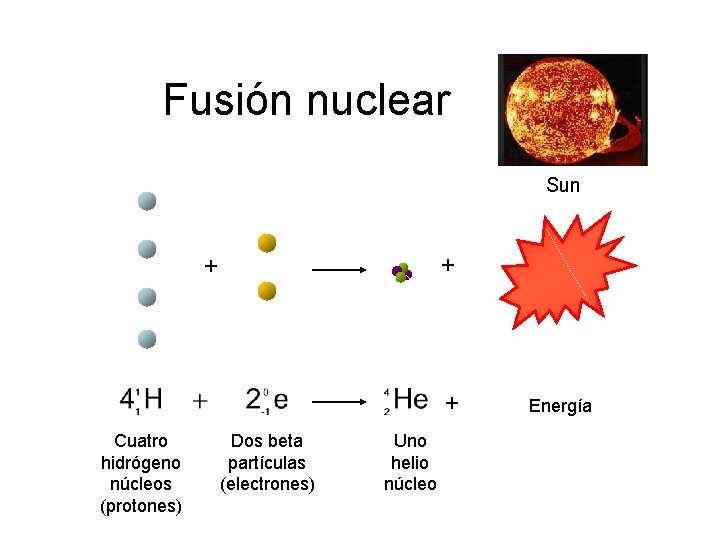
Fusión nuclear Sun + + + Cuatro hidrógeno núcleos (protones) Dos beta partículas (electrones) Uno helio núcleo Energía

Conservación de la masa … la masa se convierte en energía Hidrógeno (H 2) H = amu 1. 008 Helio (He) él = amu 4. 004 FUSIÓN 2 H 2 1 él + ENERGÍA amu 1. 008 x 4 amu 4. 0032 = amu 4. 004 + 0. 028 amu Esta relación fue descubierta por Albert Einstein E = bujía métrica 2 Energy= (masa) (velocidad de la luz)2


Fusión nuclear (Positrón)

Fusión fría • ¿Fraude? • Los experimentos deben ser repetible a ser válido Puente de Varolio de Stanley y Martin Fleischman

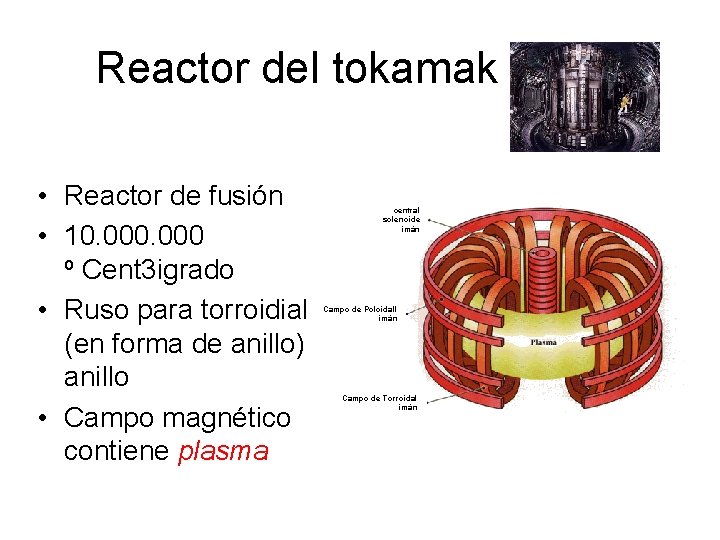
Reactor del tokamak • Reactor de fusión • 10. 000 o Cent 3 igrado • Ruso para torroidial (en forma de anillo) anillo • Campo magnético contiene plasma central solenoide imán Campo de Poloidall imán Campo de Torroidal imán

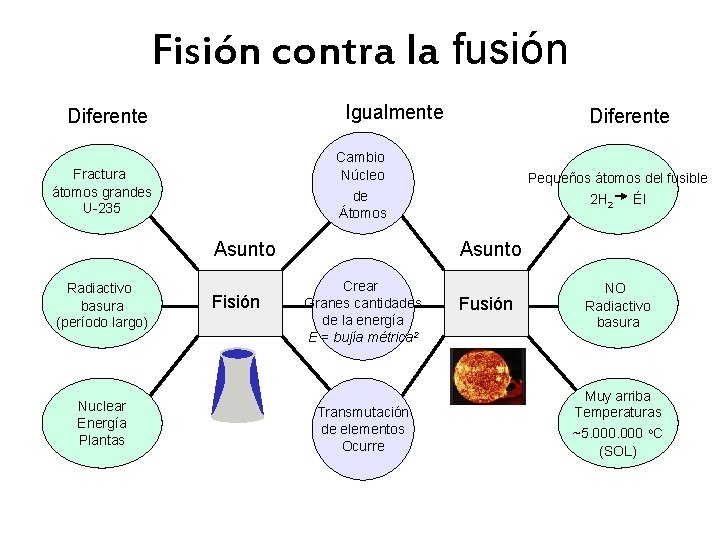
Fisión contra la fusión Igualmente Diferente Cambio Núcleo de Átomos Fractura átomos grandes U-235 Asunto Radiactivo basura (período largo) Nuclear Energía Plantas Diferente Fisión Pequeños átomos del fusible 2 H 2 Él Asunto Crear Granes cantidades de la energía E = bujía métrica 2 Transmutación de elementos Ocurre Fusión NO Radiactivo basura Muy arriba Temperaturas ~5. 000 o. C (SOL)

Estructura atómica • ÁTOMOS carbón contra el oxígeno 6 protones 8 protones – Diferenciar por el número de protones • IONES – Diferenciar por el número de electrones C C 4+ C 4 • ISÓTOPOS 6 e 6 p+ 2 e- e 10 6 p+ – Diferenciar por el número de neutrones C-12 contra C-14 6 e 6 p+ 6 n 0 e 6 8 n 0

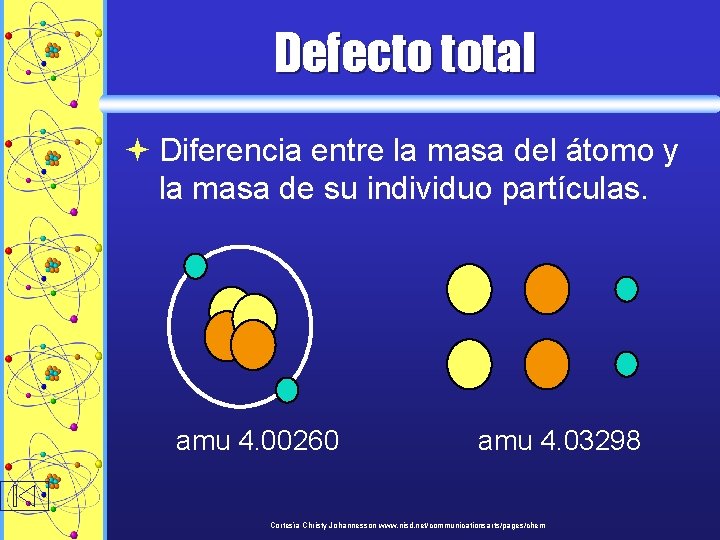
Defecto total ª Diferencia entre la masa del átomo y la masa de su individuo partículas. amu 4. 00260 amu 4. 03298 Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

Energía de enlace nuclear ª La energía lanzó cuando es un núcleo formado de los nucleones. ª Alta energía de enlace = núcleo estable. E: energía (j) m: 2 defecto total (kilog c: velocidad de la lu (3. 00× 108 m/s) E = bujía métrica Cortesía Christy Johannesson www. nisd. net/communicationsarts/pages/chem

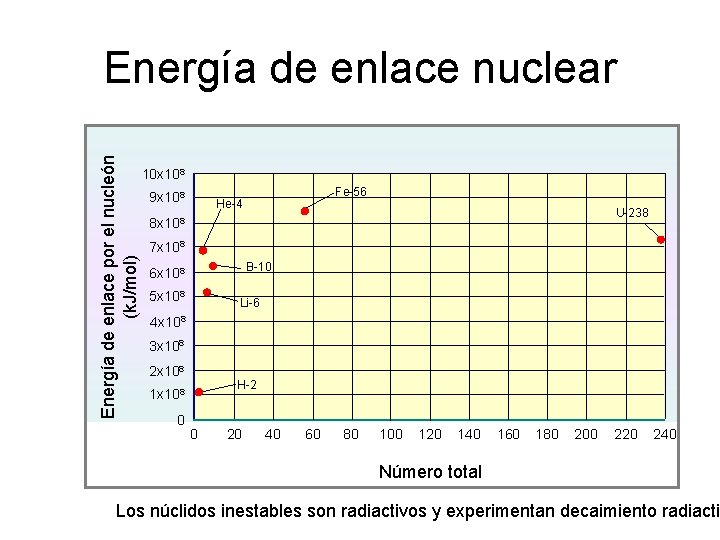
Energía de enlace por el nucleón (k. J/mol) Energía de enlace nuclear 10 x 108 9 x 108 Fe-56 He-4 U-238 8 x 108 7 x 108 B-10 6 x 108 5 x 108 Li-6 4 x 108 3 x 108 2 x 108 H-2 1 x 108 0 0 20 40 60 80 100 120 140 160 180 200 220 240 Número total Los núclidos inestables son radiactivos y experimentan decaimiento radiactiv

Defecto total y estabilidad nuclear 2 protones: (amu 2 x 1. 007276) = amu 2. 014552 2 neutrones: (amu 2 x 1. 008665) = amu 2. 017330 2 electrones: (2 x 0. 0005486 amu) = 0. 001097 amu Masa combinada total: amu 4. 032979 = amu 4. 002602 La masa atómica del él átomo es el amu 4. 002602. Éste es 0. 030368 amu menos que el Massachusetts combinado. Esta diferencia entre la masa de un átomo y la suma de las masas de sus protones, las neuronas, y los electrones se llaman el defecto total.

Energía de enlace nuclear ¿Qué causa la pérdida en masa? Según la ecuación de Einstein E = bujía métrica 2 Defecto total del convertido a las unidades de energía 0. 030368 amu 1. 6605 x 10 -27 kilogramo -29 kilogramo = 5. 0426 x 10 1 amu El equivalente de energía puede ahora ser calculado E = m c 2 E = (5. 0426 x 10 -29 kilogramo) (3. 00 x 108 m/s)2 E = (4. 54 x 10 -12 kilogramo m 2/s 2) = 4. 54 x 10 -12 J Ésta es la ENERGÍA DE ENLACE NUCLEAR, la energía lanzada cuando un núcleo se forma de los nucleones.

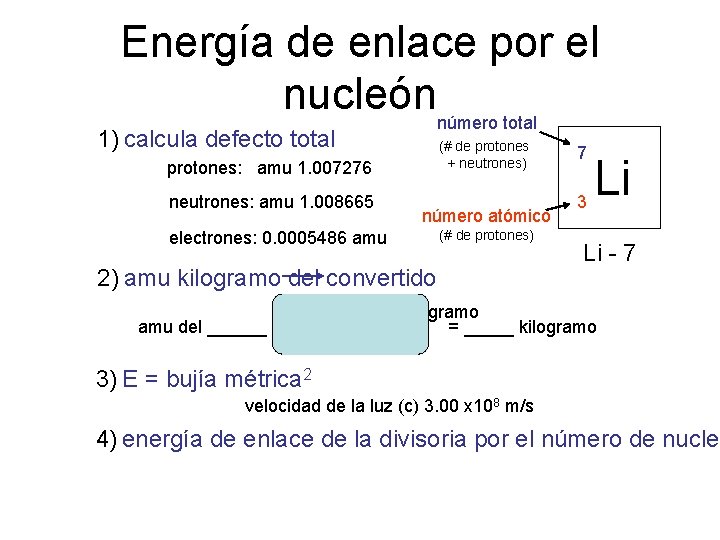
Energía de enlace por el nucleónnúmero total 1) calcula defecto total (# de protones + neutrones) protones: amu 1. 007276 neutrones: amu 1. 008665 número atómico electrones: 0. 0005486 amu (# de protones) 2) amu kilogramo del convertido 7 3 Li Li - 7 1. 6605 x 10 -27 kilogramo amu del ______ = _____ kilogramo 1 amu 3) E = bujía métrica 2 velocidad de la luz (c) 3. 00 x 108 m/s 4) energía de enlace de la divisoria por el número de nucleo

La energía de la fusión La reacción de fusión lanza una cantidad enorme de energía concerniente a masa de los núcleos que se ensamblan en la reacción. Una cantidad tan enorme de energía se lanza porque algo de la masa de los núcleos originales es converted a la energía. La cantidad de energía que es lanzada por esta conversión se pueden calcular usando la ecuación de la relatividad de Einstein E = la bujía mé Suponer que, en un cierto punto en el futuro, la fusión nuclear controlada se convie posible. Usted es científico que experimenta con la fusión y usted quiere a determinar la producción de la energía en los julios producidos por la fusión de un t deuterio (H-2) con un topo del tritio (H-3), según las indicaciones del siguiente ecuación:

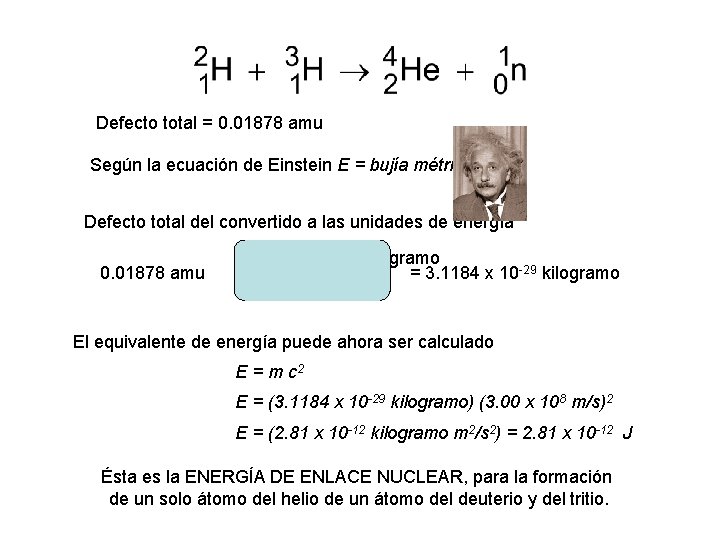
amu 2. 01345 amu 3. 01550 amu 5. 02895 amu 4. 00150 amu 1. 00867 amu 5. 01017 Primero, usted debe calcular la masa que es “perdida” en la reacción de fusión. las masas atómicas de los reactivo y de los productos son como sigue: deuterio (2. 01345 amu), tritio (3. 01550 amu), helium-4 (amu 4. 00150), y un neutrón (amu 1. 00867). Defecto total: 0. 01878 amu

Defecto total = 0. 01878 amu Según la ecuación de Einstein E = bujía métrica 2 Defecto total del convertido a las unidades de energía 0. 01878 amu 1. 6605 x 10 -27 kilogramo -29 kilogramo = 3. 1184 x 10 1 amu El equivalente de energía puede ahora ser calculado E = m c 2 E = (3. 1184 x 10 -29 kilogramo) (3. 00 x 108 m/s)2 E = (2. 81 x 10 -12 kilogramo m 2/s 2) = 2. 81 x 10 -12 J Ésta es la ENERGÍA DE ENLACE NUCLEAR, para la formación de un solo átomo del helio de un átomo del deuterio y del tritio.

Por lo tanto, un topo de helio formó por la fusión de un topo de deuterio y un topo de hidrógeno sería 6. 02 x 1023 mide el tiempo de mayor energía. x 2. 81 x 10 -12 J 6. 02 x 1023 1. 69 x 1012 J de la energía lanzó por el topo del helio formado 1. 690. 000 J La combustión de un topo del propano (C 3 H 8), que tiene una masa de 44 g, lanzamientos 2. 043 x 106 J. Cómo hace esto comparar a la energía lanzada cerca ¿la fusión del deuterio y del tritio, que usted calculaba? C 3 H 8 + O 2 H 2 O + CO 2 + 2. 043 x 106 J (desequilibrado) 44 g él 1. 690. 000 J 44 g C 3 H 8 2. 043. 000 J La fusión produce ~1. 000 x más energía/topo

Lise Meitner y Otto Hahn

Átomos para la paz • Eisenhower Bombardeo de Japón en WW II - Demostrar que la ciencia nuclear no es malvada - Tiene buenas aplicaciones, también. • Irradiación de alimentos • Tratamiento contra el cáncer • Exploración del ANIMAL DOMÉSTICO y de CAT • Destruir las bacterias del ÁNTRAX

Radiología La película fotográfica incluyó en sostenedor resistente a la luz © de los derechos reservados Pearson 2007 Benjamin Cummings. Todos los derechos reservados. Expuesto y convertido película fotográfica

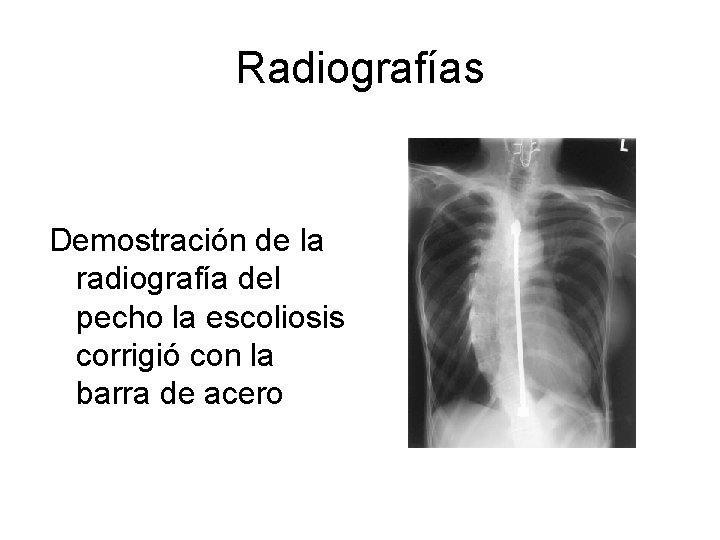
Radiografías Demostración de la radiografía del pecho la escoliosis corrigió con la barra de acero

Radioisótopos • Isótopos radiactivos • Muchas aplicaciones – Diagnósticos médicos – Composición óptima de fertilizantes – Estudios de la abrasión en motores y neumáticos Se inyecta el radioisótopo en la circulación sanguínea a observar la circulación.

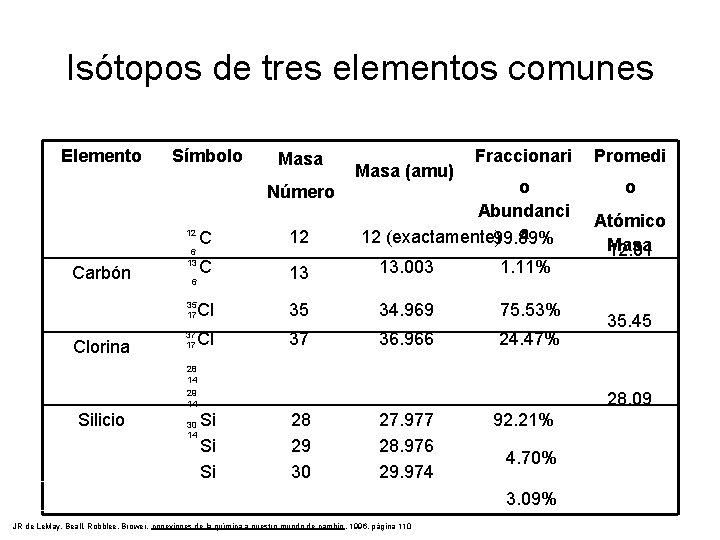
Isótopos de tres elementos comunes Elemento Símbolo Masa Número Clorina o Abundanci a 12 (exactamente)99. 89% C 12 C 13 13. 003 1. 11% 6 35 17 Cl 35 34. 969 75. 53% Cl 37 36. 966 24. 47% 12 Carbón Masa (amu) Fraccionari 6 13 37 17 28 14 29 14 Silicio 30 14 Promedi o Atómico Masa 12. 01 35. 45 28. 09 Si Si Si 28 29 30 27. 977 28. 976 29. 974 92. 21% 4. 70% 3. 09% JR de Le. May, Beall, Robblee, Brower, conexiones de la química a nuestro mundo de cambio , 1996, página 110

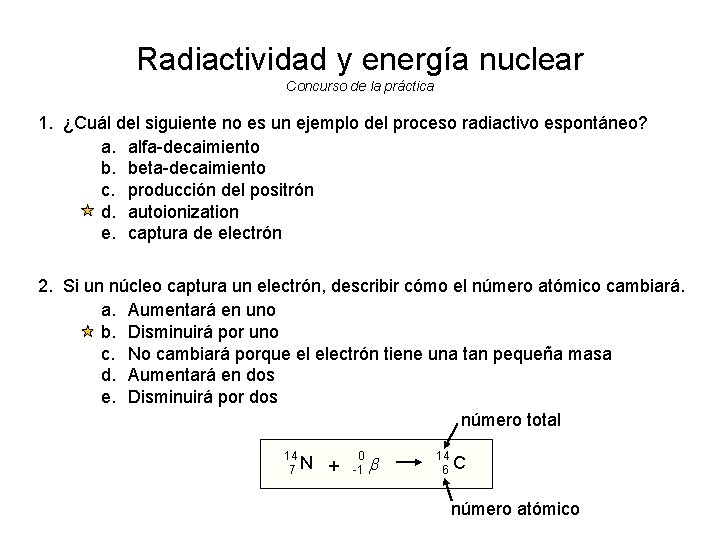
Radiactividad y energía nuclear Concurso de la práctica 1. ¿Cuál del siguiente no es un ejemplo del proceso radiactivo espontáneo? a. alfa-decaimiento b. beta-decaimiento c. producción del positrón d. autoionization e. captura de electrón 2. Si un núcleo captura un electrón, describir cómo el número atómico cambiará. a. Aumentará en uno b. Disminuirá por uno c. No cambiará porque el electrón tiene una tan pequeña masa d. Aumentará en dos e. Disminuirá por dos número total 14 7 N + 0 -1 b 14 6 C número atómico

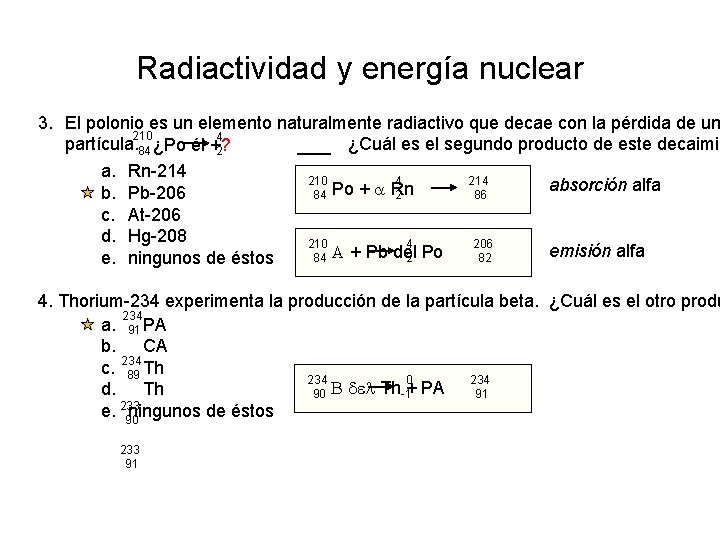
Radiactividad y energía nuclear 3. El polonio es un elemento naturalmente radiactivo que decae con la pérdida de un 210 4 ¿Cuál es el segundo producto de este decaimie partícula. 84 ¿Po él +? 2 a. Rn-214 210 4 214 absorción alfa 84 Po + a Rn b. Pb-206 2 86 c. At-206 d. Hg-208 210 4 206 emisión alfa A + Pb del Po 84 2 82 e. ningunos de éstos 4. Thorium-234 experimenta la producción de la partícula beta. ¿Cuál es el otro produ 234 a. 91 PA b. CA c. 234 89 Th 234 0 234 B del Th + PA d. Th 90 -1 91 233 e. 90 ningunos de éstos 233 91

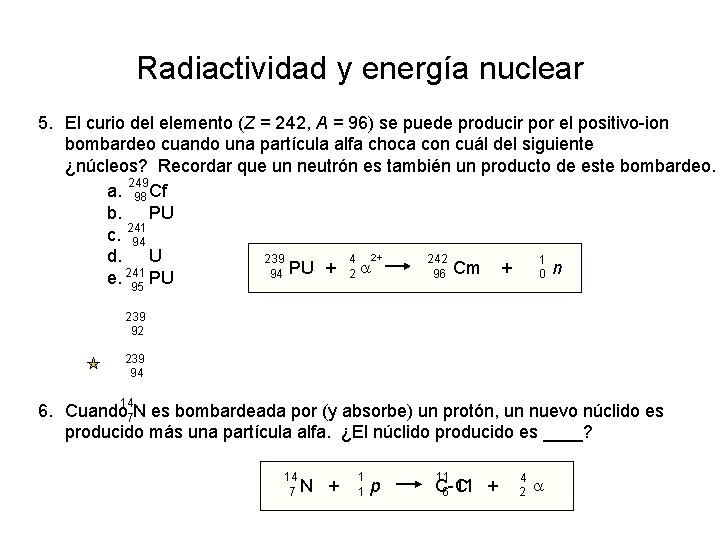
Radiactividad y energía nuclear 5. El curio del elemento (Z = 242, A = 96) se puede producir por el positivo-ion bombardeo cuando una partícula alfa choca con cuál del siguiente ¿núcleos? Recordar que un neutrón es también un producto de este bombardeo. 249 a. 98 Cf b. PU c. 241 94 d. U 239 4 2+ 242 1 a PU + Cm + 94 2 96 0 n e. 241 PU 95 239 92 239 94 14 6. Cuando 7 N es bombardeada por (y absorbe) un protón, un nuevo núclido es producido más una partícula alfa. ¿El núclido producido es ____? 14 7 N + 1 1 p 11 C-11 + 6 C 4 2 a

Radiactividad y energía nuclear 7. Cuando el núcleo uranium-235 se pega con un neutrón, el cesium-144 y los núcleos strontium-90 se producen con algunos neutrones y electrones. a) ¿Se producen cuántos neutrones? b) ¿Se producen cuántos electrones? a. b. c. d. e. 2 3 4 5 6 235 92 U 1 144 90 + Cs +0 senior de 55 n + 2 n + b 38 1 2 3 4 5 1 0 0 -1 8. Cuando el núcleo palladium-106 se pega con una partícula alfa, un protón es producido junto con un nuevo elemento. ¿Cuál es el nuevo elemento? a. cadmium-112 b. cadmium-109 106 4 1 109 Paladio + a p + AG c. silver-108 46 2 1 47 d. silver-109 e. ningunos de éstos

Radiactividad y energía nuclear 9. Strontium-90 del polvillo radiactivo es una amenaza de la salud porque, se incorpora en el hueso. a. yodo El estroncio (Sr) y el calcio (Ca) son b. cesio metales de tierra alcalina. El estroncio es c. hierro químicamente más reactivo que el calcio. d. calcio e. uranio 235 10. La fusión nuclear utiliza núclidos pesados tales 92 como U como combustible. Verda FALSO, La fisión nuclear parte núclidos pesados tales como U-235 para el combustible en reactore La fusión nuclear ensambla núclidos ligeros tales como H-1 en He-4 (el Sun).

Problemas del libro de textos Química moderna Capítulo 22 Revisión de la sección #1 -4 de la página 704 Revisión de la sección #1 -5 de la página 712 Página 715 #1 -4 Página 719 #1 -4 Final del capítulo #25 -47 (página 723 -724) 25. La masa de un átomo Ne-20 es el amu 19. 99244. Calcular su defecto total. 26. La masa de Li-7 es el amu 7. 01600. Calcular su defecto total. 27. Calcular la energía de enlace nuclear de un átomo lithium-6. La masa atómica medida de lithium-6 es el amu 6. 015.