FUNCIN CIDO HIDRCIDO Y FUNCIN CIDO OXCIDO Algunos











- Slides: 12

FUNCIÓN ÁCIDO HIDRÁCIDO Y FUNCIÓN ÁCIDO OXÁCIDO Algunos ácidos se forman por la reacción de un no metal de los grupos VIA y VIIA, con el hidrógeno y se denominan ácidos hidrácidos; otros ácidos se forman por la combinación de u óxido no metálico con el agua y se denominan ácidos oxácidos. Óxido ácido +agua_______ácido oxácido No metal +H 2_____ácido hidrácido

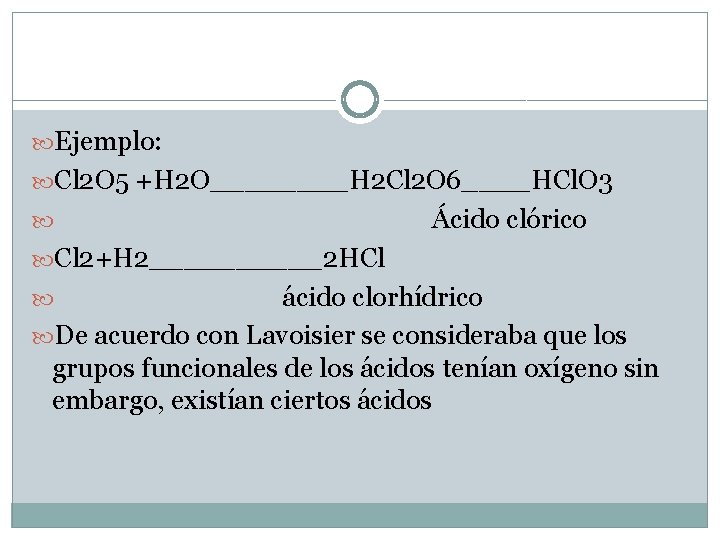
Ejemplo: Cl 2 O 5 +H 2 O____H 2 Cl 2 O 6____HCl. O 3 Ácido clórico Cl 2+H 2_____2 HCl ácido clorhídrico De acuerdo con Lavoisier se consideraba que los grupos funcionales de los ácidos tenían oxígeno sin embargo, existían ciertos ácidos

Como HCl (ácido clorhídrico) y +acido sulfhidríco(H 2 S) que no tenían oxígeno y eran ácidos. El grupo funcional del acido es H+1 por ello se demostraban los dos grupos de ácidos. Los que tienen oxigeno denominados Oxácidos y los que no tienen oxigeno denominados hidrácidos. No metal + Hidrógeno------ácido hidrácido

Br 2+H 2_____2 HBr Bromo+hidrógeno ácido bromhídrico I 2 +H 2 ----2 HI Yodo+Hidrógeno ___Ácido yodhidríco HCl. O+ H+1 +Cl. O Ácido hipocloroso HCl____H+1 +Cl Ácido clorhídrico

HIDRÁCIDOS MÁS COMUNES Fórmula Nombre sistemático Nombre en solu- común F 2+H 2 -2 HF Fluoruro de Hidrógeno Cl 2+H 2_HCl Cloruro de Hidrógeno Se+H 2—H 2 Se Seleniuro ción acuosa ácido fluorhídrico Ácido Clorhídrico Ácido Selenhidrico

Nomenclatura de los ácidos hidrácidos Los hidrácidos se nombran empleando la palabra genérica ácido seguida del nombre del elemento no metálico y la terminación hídrico así: S+H 2 __ H 2 S Azufre Hidrógeno Ácido sulfhídrico F 2 +H 2____HF Fluor Hidrógeno Ácido Fluorhídrico Cl 2+H 2___HCl Cloro Hidrógeno Ácido clorhídrico Los números de oxidación se intercambian Y pasan como subíndice.

NOMENCLATURA DE LOS ÁCIDOS OXÁCIDOS. Óxido ácido +agua----- Ácido oxácido SO 3 +H 2 O------H 2 SO 4 Óxido sulfuroso+agua Ácido sulfúrico Los oxácidos son combinaciones del hidrógeno, oxígeno y un no metal. Los nombres de los oxácidos son similares a los anhídridos de los que provienen, poseen un solo número de oxidación se usa el sufijo ICO.

Ej. H 2 CO 3 Ácido carbónico Cuando el elemento no metálico presenta dos números de oxidación, se emplea la terminación ICO para el de mayor estado de oxidación y la terminación OSO para el de menor. Ej. H 2 PO 3 Ácido fosforoso H 2 PO 4 Ácido fosfórico

¿Qué son y para que sirven las sales? Existe otro grupo funcional que no es ácido ni es básico sino neutro este grupo corresponde a las sales. La unión de un ácido con un hidrácido nos produce una sal. La reacción es: 2 H 2 SO 4 +2 Ca(OH)2____2 Ca. SO 4+4 H 2 O Ácido Hidróxido Sulfuro de Agua Sulfúrico de sodio de calcio

En este caso el átomo de calcio reemplaza a dos átomos de hidrógeno. Esta sal corresponde a una oxisal ya que proviene de un ácido oxácido. Función sales haloideas: Las sales haloideas se forman por la unión de una base y de un ácido hidrácido. Ácido hidrácido +base----Sal +Agua Hcl + Na. OH------Na. CL +H 2 O Ácido Hidróxido Cloruro Agua. Clorhídrico de sodio

¿Cómo se nombran? Para nombrar las sales haloideas se le adiciona la terminación URO al nombre del elemento no metálico, seguida del nombre del metal. Ejemplos: KBr----Bromuro de potasio Ca. Cl 2 ---Cloruro de calcio Mg. I 2 ----Yoduro de magnesio Li. F----Fluoruro de Litio

¿Para qué sirven las sales? La sal más conocida es el cloruro de sodio o sal de cocina. En la naturaleza se encuentra disuelta en el agua de mar o en forma sólida, en el suelo (sal gema)las llamadas salina. Se emplea como materia prima para la obtención del cloro, ácido clorhídrico y sodio en la alimentación. En la consevación de carnes y pieles. En la industria de jabones y colorantes.