FUNCIN ALCOHOL R OH Son compuestos derivados de














- Slides: 20

FUNCIÓN ALCOHOL: (R – OH) Son compuestos derivados de los hidrocarburos por sustitución de uno o más hidrógenos por grupos Hidroxilo (-OH) Donde R es un radical alquilo.

Clasificación de los alcoholes TENIENDO EN CUENTA EL NÚMERO DE GRUPOS –OH UNIDOS A LA CADENA CARBONADA: los alcoholes pueden ser monoles, dioles, trioles; en general, se les llama polioles si tienes varios grupos –OH. CH 3. OH metanol alcohol metílico CH 2 OH – CH 2 OH 1, 2, 3 – propanotriol (Glicerina) CH 2. OH-CH 2. OH etanodiol CH 2 OH–(CHOH)4– CH 2 OH 1, 2, 3, 4, 5, 6 – hexanohexol (Sorbitol)

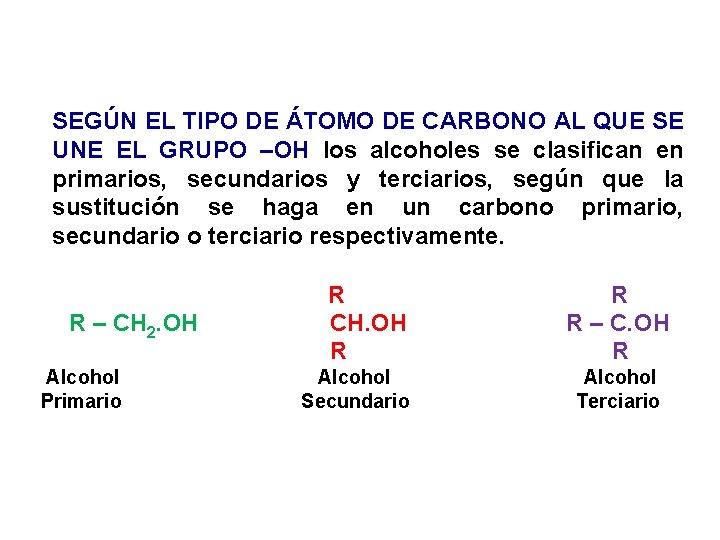
SEGÚN EL TIPO DE ÁTOMO DE CARBONO AL QUE SE UNE EL GRUPO –OH los alcoholes se clasifican en primarios, secundarios y terciarios, según que la sustitución se haga en un carbono primario, secundario o terciario respectivamente. R – CH 2. OH Alcohol Primario R CH. OH R Alcohol Secundario R R – C. OH R Alcohol Terciario

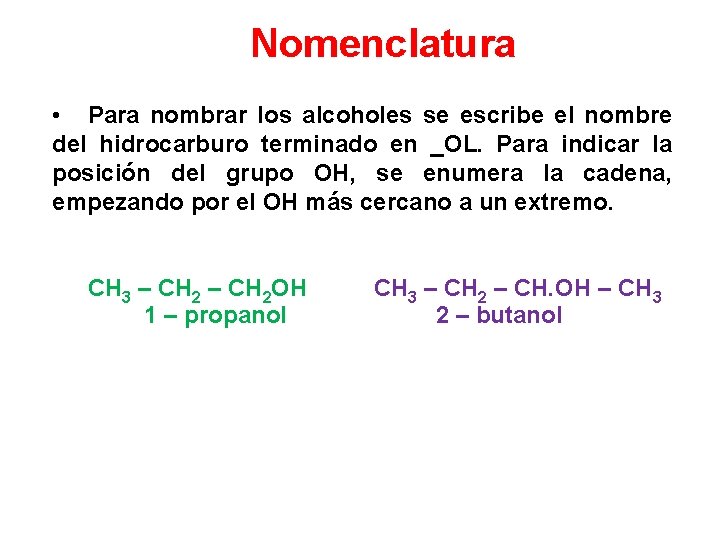
Nomenclatura • Para nombrar los alcoholes se escribe el nombre del hidrocarburo terminado en _OL. Para indicar la posición del grupo OH, se enumera la cadena, empezando por el OH más cercano a un extremo. CH 3 – CH 2 OH 1 – propanol CH 3 – CH 2 – CH. OH – CH 3 2 – butanol

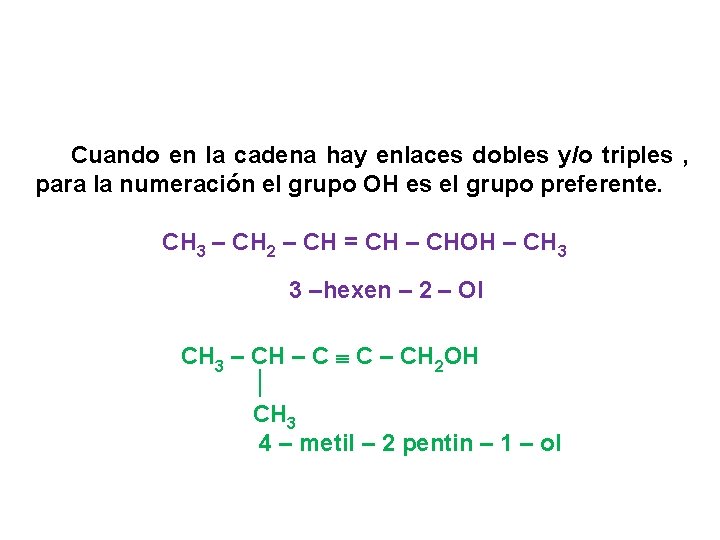
Cuando en la cadena hay enlaces dobles y/o triples , para la numeración el grupo OH es el grupo preferente. CH 3 – CH 2 – CH = CH – CHOH – CH 3 3 –hexen – 2 – Ol CH 3 – CH – C C – CH 2 OH CH 3 4 – metil – 2 pentin – 1 – ol

Propiedades Físicas Las propiedades físicas de los alcoholes están relacionados con el grupo -OH, que es muy polar y es capaz de establecer puentes de hidrógeno con sus moléculas compañeras, con otras moléculas neutras, y con aniones. ASOCIACIÓN DE METANOL CON AGUA

Los puntos de fusión y ebullición de los alcoholes son más altos que los de alcanos, aldehídos, cetonas y éteres de similar cantidad de átomos de carbono. Los alcoholes de bajo peso molecular -como el metanol, el etanol y el propanol- son compuestos líquidos a temperatura ambiente por la presencia del grupo -OH. Debido a sus enlaces, estos alcoholes de bajo peso molecular tienen moléculas polares y, por lo tanto, son solubles en agua.

A medida que aumenta la longitud de la cadena principal, la influencia del grupo polar -OH disminuye y las propiedades de los alcoholes son determinadas por el radical alquilo no polar. Estos alcoholes son sólidos no volátiles.

Propiedades Químicas Los alcoholes son bases muy débiles en el agua. Sus principales reacciones químicas son las siguientes: DESHIDRATACIÓN. A temperaturas elevadas, los alcoholes reaccionan con un ácido fuerte; como por ejemplo el ácido sulfúrico, eliminando agua y formando un alqueno u otras funciones. H 2 SO 4 CH 3 -CH 2 OH Concentrado CH 2=CH 2 + H 2 O

FORMACIÓN DE SALES. Los alcoholes reaccionan con los metales, produciendo sales. CH 3 -OH+ Na Metanol sodio CH 3 ONa + H 2 O metanoato de sodio OXIDACIÓN. Según la clase de alcohol, la oxidación de estos conduce a la formación de aldehídos o de cetonas. Así, los alcoholes primarios dan origen a aldehídos y los secundarios a cetonas. CH 3 -CH 2 -OH + O 2 etanol CH 3 -CHO etanal + H 2 O

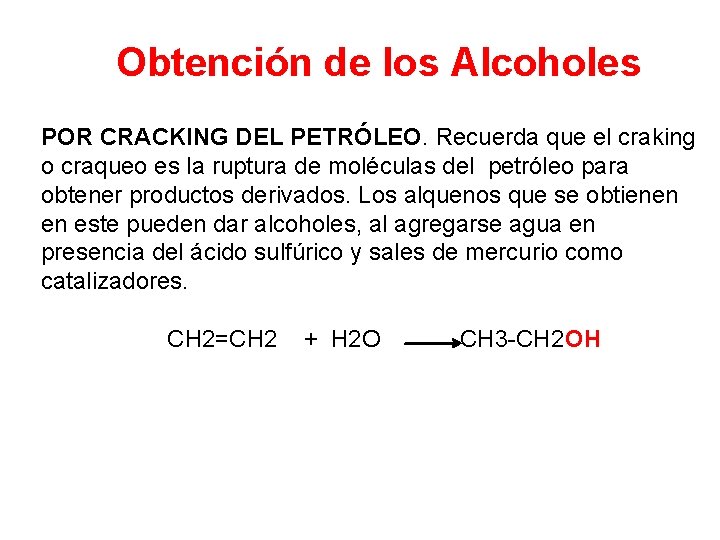
Obtención de los Alcoholes POR CRACKING DEL PETRÓLEO. Recuerda que el craking o craqueo es la ruptura de moléculas del petróleo para obtener productos derivados. Los alquenos que se obtienen en este pueden dar alcoholes, al agregarse agua en presencia del ácido sulfúrico y sales de mercurio como catalizadores. CH 2=CH 2 + H 2 O CH 3 -CH 2 OH

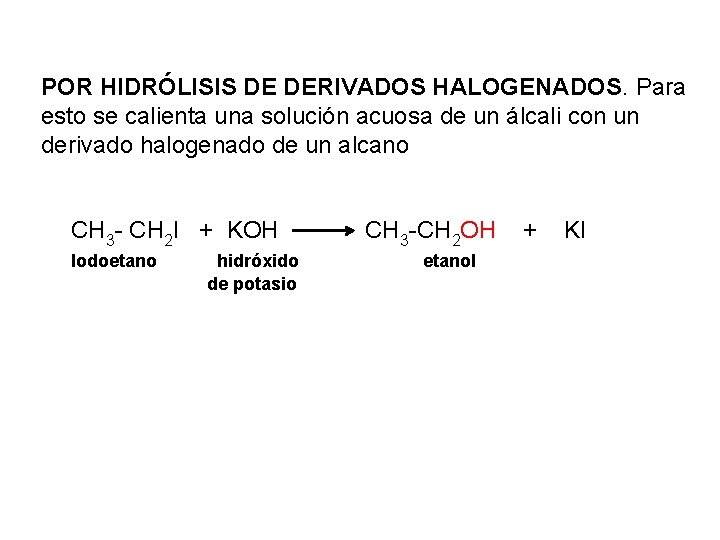
POR HIDRÓLISIS DE DERIVADOS HALOGENADOS. Para esto se calienta una solución acuosa de un álcali con un derivado halogenado de un alcano CH 3 - CH 2 I + KOH Iodoetano hidróxido de potasio CH 3 -CH 2 OH etanol + KI

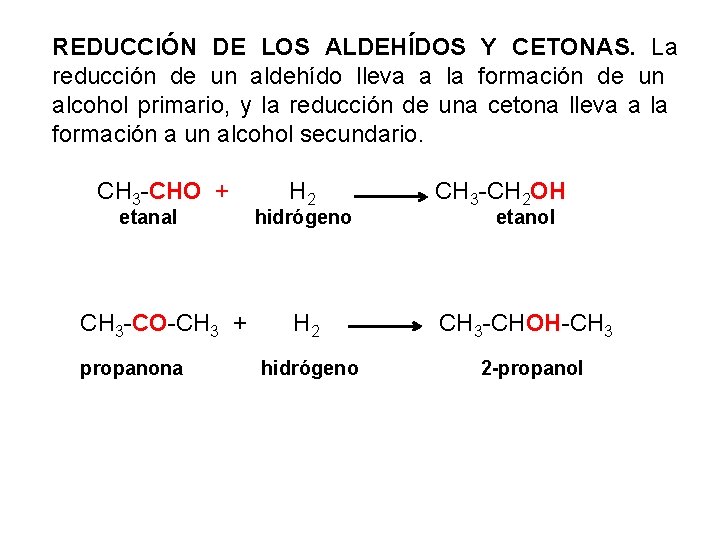
REDUCCIÓN DE LOS ALDEHÍDOS Y CETONAS. La reducción de un aldehído lleva a la formación de un alcohol primario, y la reducción de una cetona lleva a la formación a un alcohol secundario. CH 3 -CHO + etanal CH 3 -CO-CH 3 + propanona H 2 CH 3 -CH 2 OH H 2 CH 3 -CHOH-CH 3 hidrógeno etanol 2 -propanol

Principales Alcoholes : Usos y aplicaciones El etanodiol tiene un punto de congelación bajo, propiedad que se emplea en la formación de soluciones anticongelantes.

ALCOHOL EN EL MOTOR ¡NO EN EL VOLANTE! Todos sabemos que el alcohol y el volante no combinan en absoluto; sin embargo , la situación cambia cuando el alcohol se convierte en un insumo esencial para el automóvil. Es el caso del metanol. Este es un alcohol muy peligroso si lo inhalamos o ingerimos en una pequeña cantidad: bastan dos cucharadas para producir la muerte, y en cantidades menores causa ceguera por destrucción del nervio óptico. A pesar de su toxicidad, el metanol o alcohol metílico es muy importante en los laboratorios, en la industria y también como combustible. Los carros de carrera Fórmula 1 lo utilizan porque es un combustible relativamente limpio, y además su combustión completa tiene un alto rendimiento.

ETANOL O ALCOHOL ETÍLICO CH 2 OH-CH 3 Es un líquido transparente, de olor fuerte y sabor ardiente, volátil, materia prima de numerosas industrias de licores, perfumes, cosméticos y jarabes. También se usa como combustible y desinfectante. El etanol se considera una droga con efectos depresore en el sistema nervioso central. Su ingesta a través de bebidas alcohçolicas trae una serie de efectos, como sedación, vasodilatación cutánea, taquicardia, pérdida del control de las emociones y la coordinación motora. La dosis letal bordea los 500 m. L PROPANOTRIOL CH 2 OH-CH 2 OH Se llama comúnmente glicerina. Es un líquido dulce y denso que se obtiene como subproducto de la fabricación de jabón. Se usa como disolvente edulcorante, en la fabricación de dinamita y para lubricar cuero.

La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de

Butanol o Alcohol butílico, producto orgánico, de fórmula C 4 H 9 OH. Se presenta en cuatro formas diferentes dependiendo de la distribución de los átomos de carbono y de la situación del grupo OH. Dichas formas tienen importantes aplicaciones industriales y se utilizan en la elaboración de disolventes, plásticos, detergentes, y como base para perfumes y fijadores. Una de ellas, el alcohol butílico terciario (metil-2 -propanol), se utiliza para desnaturalizar alcohol etílico (etanol).

Los alcoholes superiores, de mayor masa molecular que el etanol, tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes condimentos y perfumes.
