Fuerzas qumicas Las propiedades qumicas dependen en forma


























- Slides: 57

Fuerzas químicas

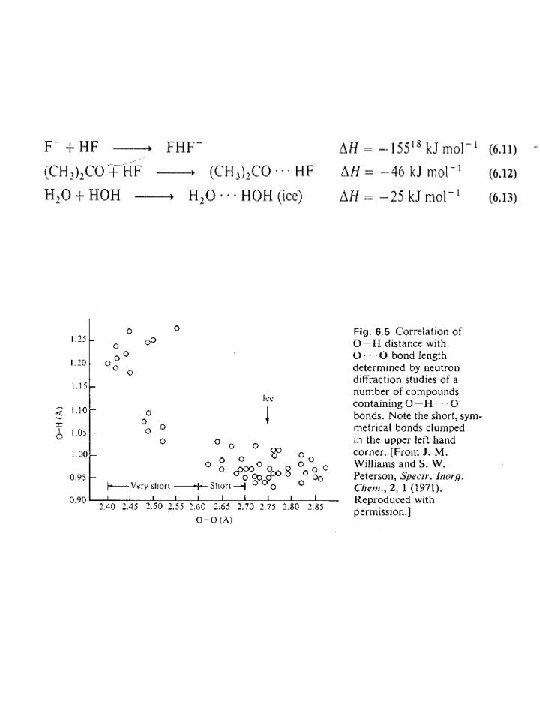
Las propiedades químicas dependen en forma importante de las denominadas fuerzas químicas (interacciones entre atomos e iones) Los aspectos de cada tipo de fuerza son su fuerza relativa, su dependencia de la distancia y si son direccionales o no lo son. Distancias internucleares y radios atómicos Ya que la distancia de enlace es un parámetro muy importante para determinar la fuerza de un enlace es importane determinar el radio de los átomos en un enlace. Desafortunadamente se habla de muchos radios: covalente, ionico, metálico, enlazado, no enlazado y van der Waals. Esta gran cantidad de radios reflejan que es necesario simplificar por una única medida de radio atómico, pero todo tratamiento generalizador conlleva muchos errores.

A continuación se van analizar cada uno de estos radios Radio de van der Waals Si dos átomos de gases nobles se fuerzan a estar juntos sin energía cinética que los separe, ellos van a permanecer unidos. Las fuerza que los sostienen son las débiles fuerzas de London (dipolos instantáneos) La distancia internuclear será la que balancea ls fuerzas de atraccione con las fuerzas de repulsión entre las capas electrónicas. Cuando los dos atómos son idénticos, la mitad de la distancia entre los dos átomos se denomina radio de van der Waals o radio de no enlace. Por ejemplo en xenon sólido consiste de átomos separados a una distancia de 436 pm por lo que el radio del xenon es 218 pm.

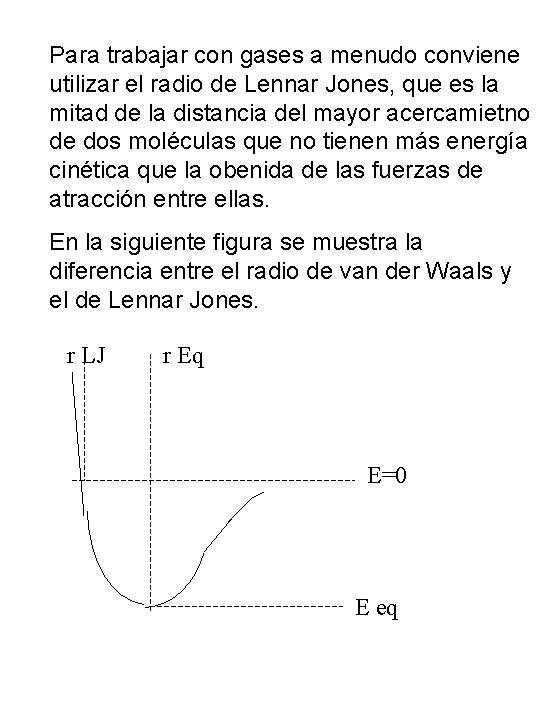
Para trabajar con gases a menudo conviene utilizar el radio de Lennar Jones, que es la mitad de la distancia del mayor acercamietno de dos moléculas que no tienen más energía cinética que la obenida de las fuerzas de atracción entre ellas. En la siguiente figura se muestra la diferencia entre el radio de van der Waals y el de Lennar Jones. r LJ r Eq E=0 E eq


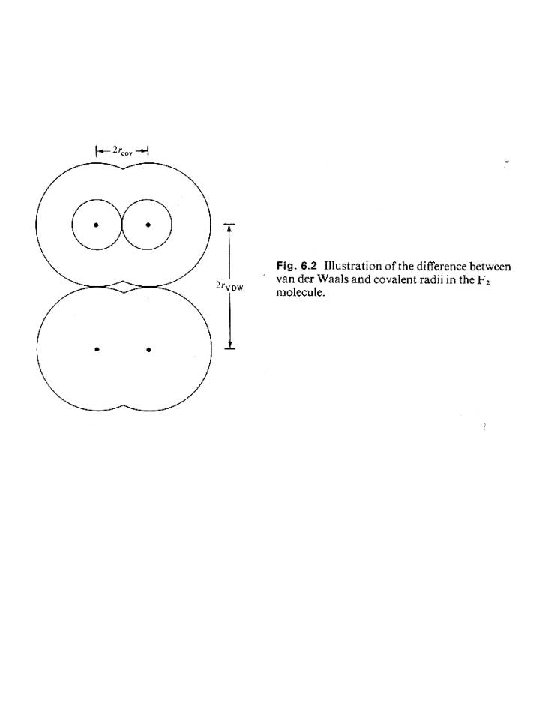
Radio covalente La distancia internuclear de la molécula de Fluor es 142 pm, que es un valor menor a la suma de dos radios de van del Waals La diferencia se debe a que la distancia entre los atómos se hace menor cuando es mayor la sobreposición de los orbitales, dando como resultado la formación de una molécula (distancia de enlace) Las interacciones entre las moléculas son más débiles y las distancias mayores (de no enlace) Ddc Rrcov = dc/2 Ddv. W rv. W=dv. W/2




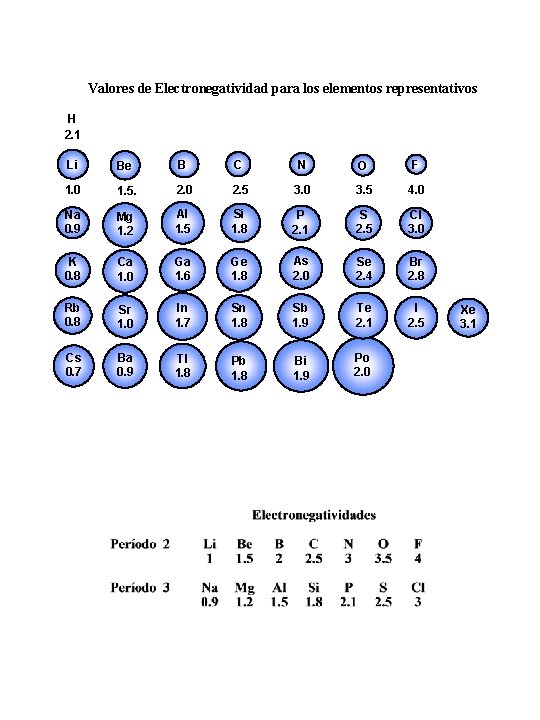
Los radios covalentes se calculan en moléculas homonucleares (mismos atómicos) y cuando se utilizan para calcular moléculas heteronucleares las distancias obtenidas son mayores a las experimentales Esto se debe a la diferencia de electronegatividad que aporta un factor de enlace iónico que disminuye la distancia r. AB = r. A + r. B – 9 = diferencia de electronegatividad

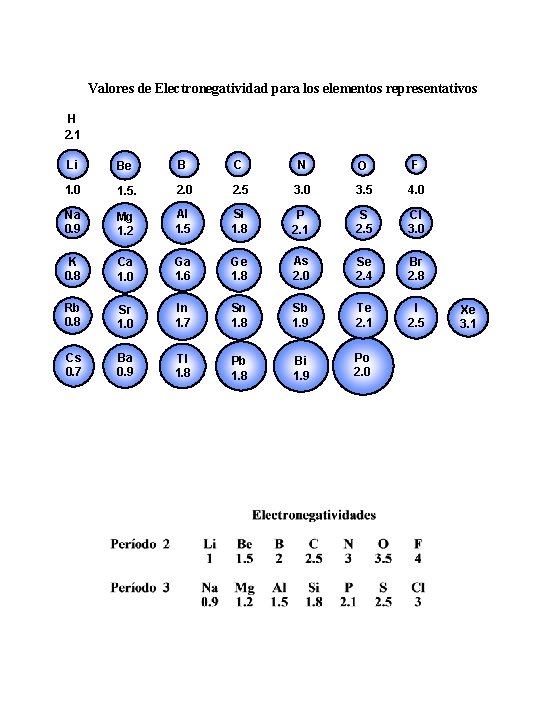
Valores de Electronegatividad para los elementos representativos H 2. 1 Li Be B C N O F 1. 0 1. 5. 2. 0 2. 5 3. 0 3. 5 4. 0 Na 0. 9 Mg 1. 2 Al 1. 5 Si 1. 8 P 2. 1 S 2. 5 Cl 3. 0 K 0. 8 Ca 1. 0 Ga 1. 6 Ge 1. 8 As 2. 0 Se 2. 4 Br 2. 8 Rb 0. 8 Sr 1. 0 In 1. 7 Sn 1. 8 Sb 1. 9 Te 2. 1 I 2. 5 Cs 0. 7 Ba 0. 9 Tl 1. 8 Pb 1. 8 Bi 1. 9 Po 2. 0 Xe 3. 1

Radio atómico Este término tiene muchos significados pues se aplica a radios covalentes y a radios de van der Waals Sin embargo, Bragg y Slater dos investigadores observaron que no importando el tipo de enlace se pueden obtener buenas aproximaciones de las distancias entre nucleos utilizando los “radios atómicos” calculados por ellos, considerando que son las capas internas electrónicas quienes determinan finalmente el tamaño Estos radios son similares a los covalentes y 85 pm más grandes que los de los cationes y 85 pm mas pequeños que los aniones


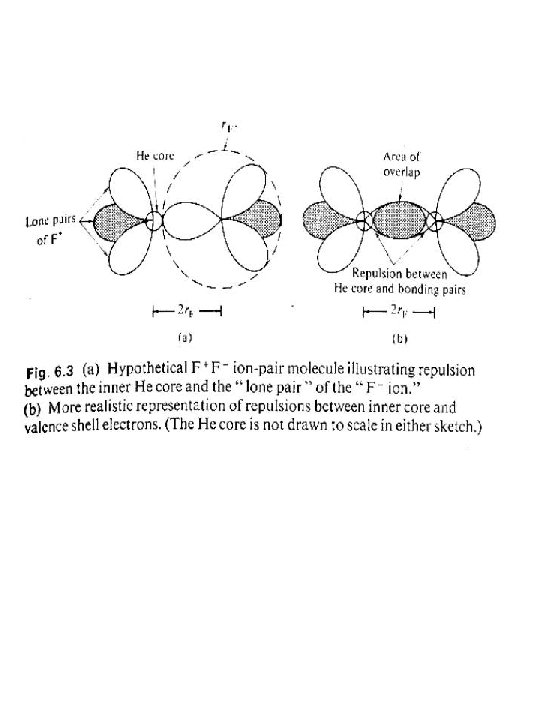
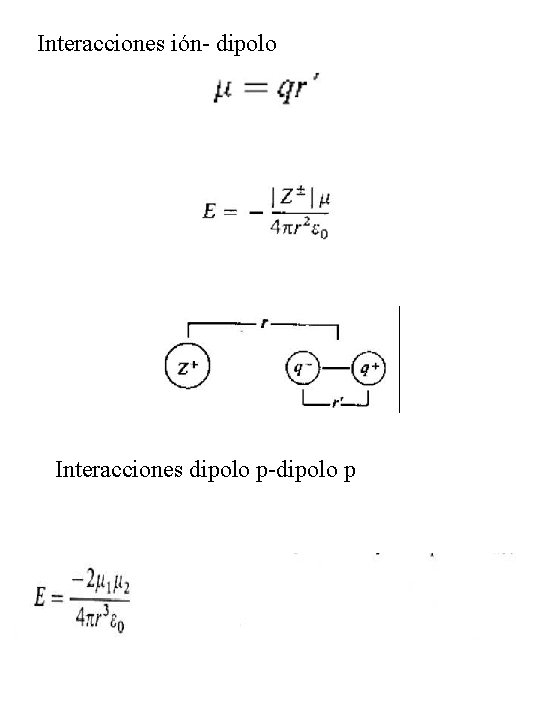
Tipos de enlace Covalente Direccional y se basa en la superpisición de los orbitales atómicos } La relación de la energía con la distancia no permite escribir una función simple como en otros casos. Sin embargo, se puede plantear que la fuerza del enlace decrece rápidamente cuando la distancia aumenta (short-range force) Iónico E= Z+Z-/4 Eo r Ión dipolo

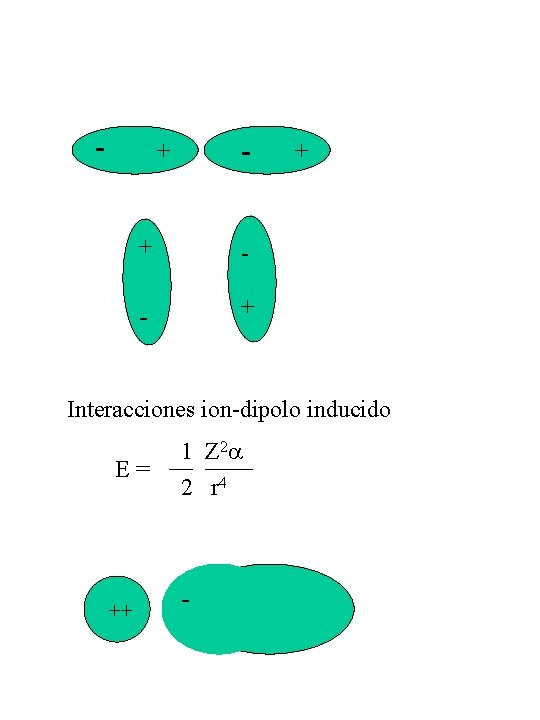
Interacciones ión- dipolo Interacciones dipolo p-dipolo p

- - + + Interacciones ion-dipolo inducido 2 1 Z E = __ ____ 2 r 4 ++ -

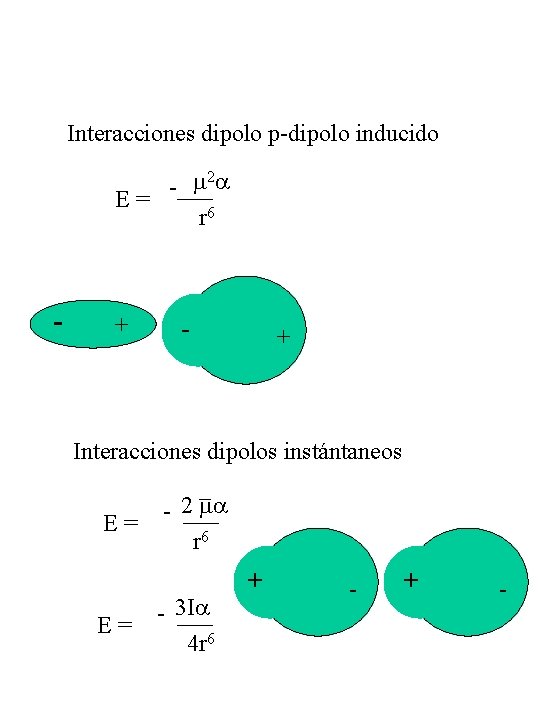
Interacciones dipolo p-dipolo inducido 2 -___ E= r 6 - + Interacciones dipolos instántaneos _ 2___ E= r 6 E= - 3 I ___ 4 r 6 + -







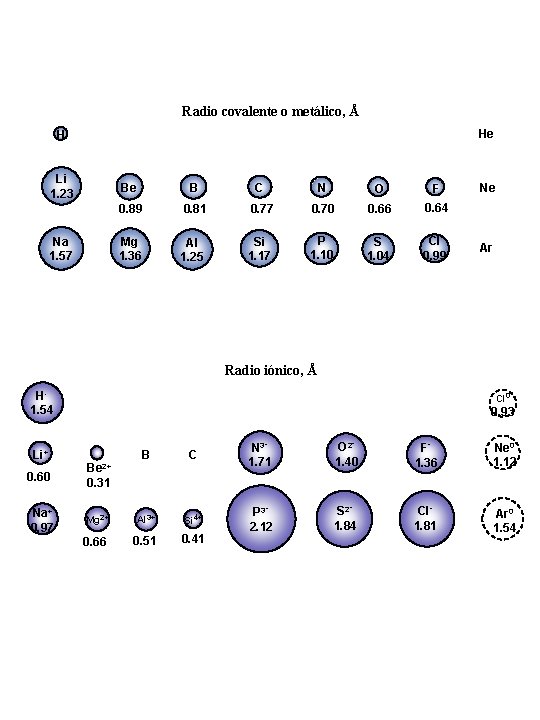
Radio covalente o metálico, Å He H Li 1. 23 Na 1. 57 Be B C N O F 0. 89 0. 81 0. 77 0. 70 0. 66 0. 64 Mg 1. 36 Al 1. 25 Si 1. 17 P 1. 10 S 1. 04 Cl 0. 99 Ne Ar Radio iónico, Å H 1. 54 Cl 0 0. 93 B C N 31. 71 O 21. 40 F 1. 36 Ne 0 1. 12 Mg 2+ Al 3+ Si 4+ S 21. 84 Cl 1. 81 0. 51 Ar 0 1. 54 0. 66 0. 41 P 32. 12 Li+ 0. 60 Na+ 0. 97 Be 2+ 0. 31

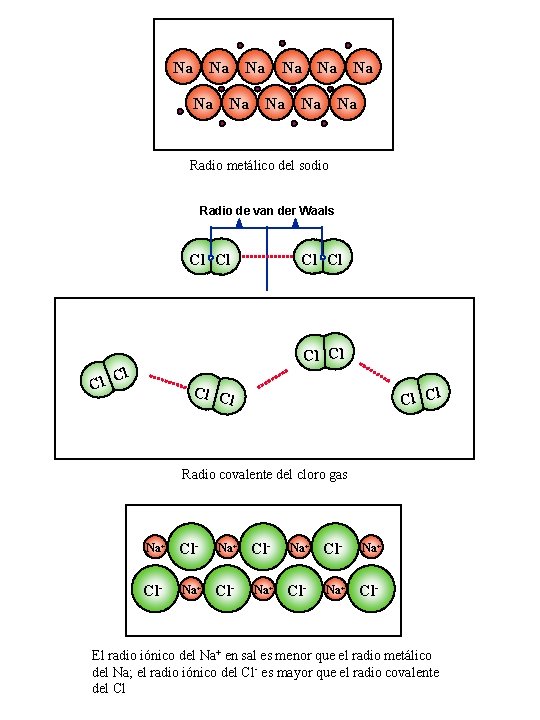
Na Na Na Radio metálico del sodio Radio de van der Waals Cl Cl Cl C l l Cl C Radio covalente del cloro gas Na+ Cl- Na+ Cl- El radio iónico del Na+ en sal es menor que el radio metálico del Na; el radio iónico del Cl- es mayor que el radio covalente del Cl

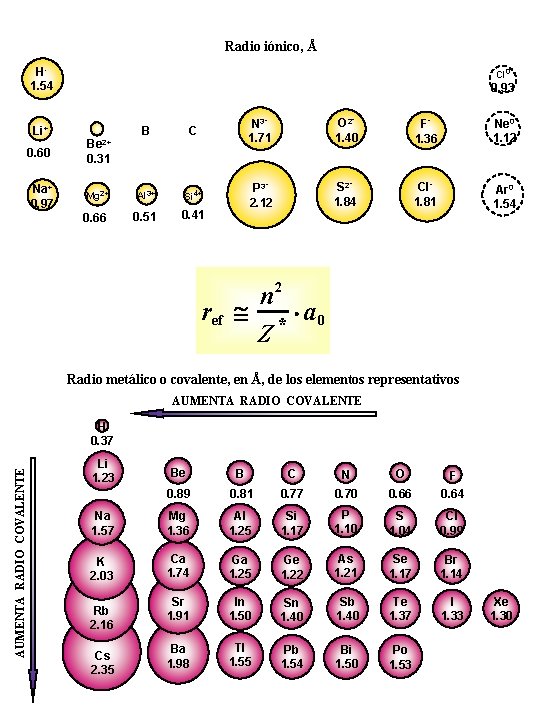
Radio iónico, Å H 1. 54 Cl 0 0. 93 B C N 31. 71 O 21. 40 F 1. 36 Ne 0 1. 12 Mg 2+ Al 3+ Si 4+ S 21. 84 Cl 1. 81 0. 51 Ar 0 1. 54 0. 66 0. 41 P 32. 12 Li+ 0. 60 Na+ 0. 97 Be 2+ 0. 31 ref @ n 2 Z * × a 0 Radio metálico o covalente, en Å, de los elementos representativos AUMENTA RADIO COVALENTE H 0. 37 Li 1. 23 Be B C N O 0. 89 0. 81 0. 77 0. 70 0. 66 F 0. 64 Na 1. 57 Mg 1. 36 Al 1. 25 Si 1. 17 P 1. 10 S 1. 04 Cl 0. 99 K 2. 03 Ca 1. 74 Ga 1. 25 Ge 1. 22 As 1. 21 Se 1. 17 Br 1. 14 Sr 1. 91 In 1. 50 Sn 1. 40 Sb 1. 40 Te 1. 37 I 1. 33 Ba 1. 98 Tl 1. 55 Pb 1. 54 Bi 1. 50 Po 1. 53 Rb 2. 16 Cs 2. 35 Xe 1. 30

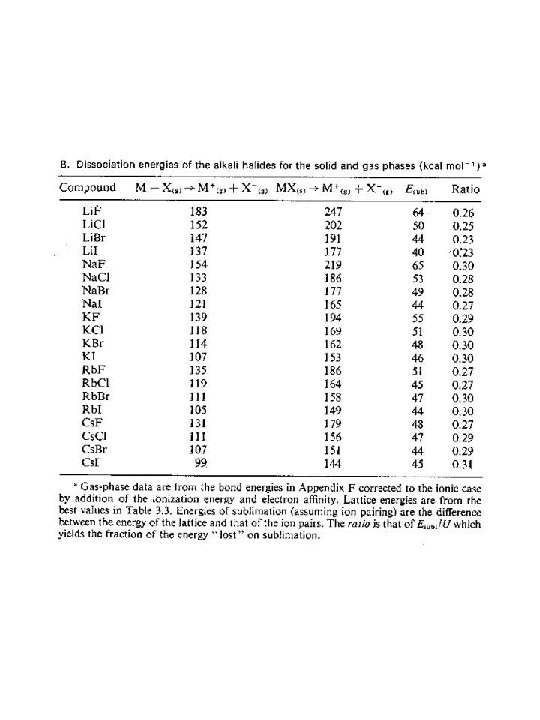
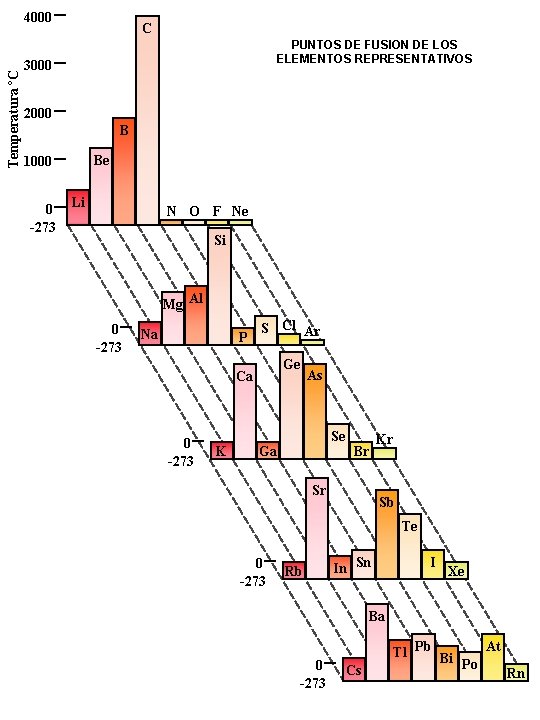
Efectos de las fuerza químicas Puntos de fusión y eblullición Fuerzas covalentes que se rompen = muy altos puntos de fusión y ebullición (1000 -4000 o. C)c Diamante sublima a 3700 o Silice funde 1 710 y ebulle a 2200 Cuando son polímeros y los enlaces que se rompen son los más debiles los puntos de fusión bajan drásticamente a pocos cientos de grados


Fósforo blanco Fósforo negro

Si en compuestos covalentes se rompen fuerzas de London o van der Waals los puntos de fusión y ebucción varían de muy bajos a bajos (-300 hasta 50 o. C) Fuerzas iónicas depende de la Uo y el grado de polarizabilidad pero son relativamente altas (100 -2000 o. C) KF = 880 o. C KCl = 776 o. C KBr = 730 o. C Ag. F = 435 o. C Ag. Cl = 455 o. C Ag. Br= 434 o. C





SOLUBILIDAD Disoluciones ideales en que la energía de los enlaces rotos y formados son aproximadamente iguales G = H –T S Para H = 0 G =–T S S = R (n. A ln A + n. B ln B) donde A , B sonlas fracciones molares del soluto y del solvente.

Valores de Electronegatividad para los elementos representativos H 2. 1 Li Be B C N O F 1. 0 1. 5. 2. 0 2. 5 3. 0 3. 5 4. 0 Na 0. 9 Mg 1. 2 Al 1. 5 Si 1. 8 P 2. 1 S 2. 5 Cl 3. 0 K 0. 8 Ca 1. 0 Ga 1. 6 Ge 1. 8 As 2. 0 Se 2. 4 Br 2. 8 Rb 0. 8 Sr 1. 0 In 1. 7 Sn 1. 8 Sb 1. 9 Te 2. 1 I 2. 5 Cs 0. 7 Ba 0. 9 Tl 1. 8 Pb 1. 8 Bi 1. 9 Po 2. 0 Xe 3. 1

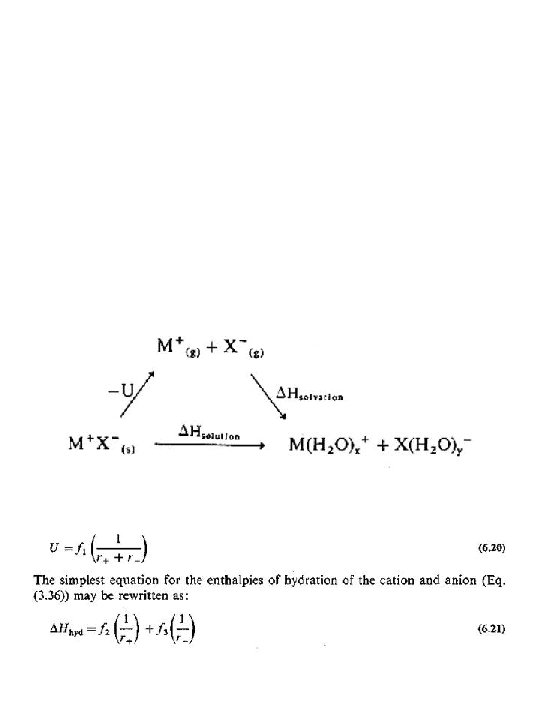
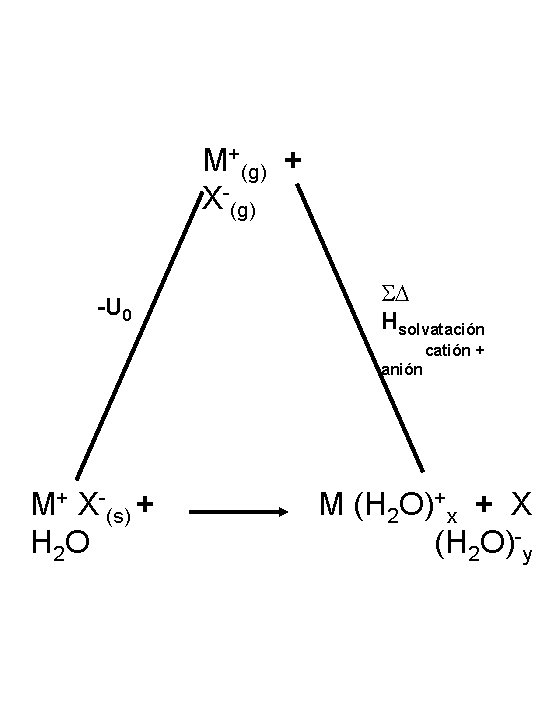
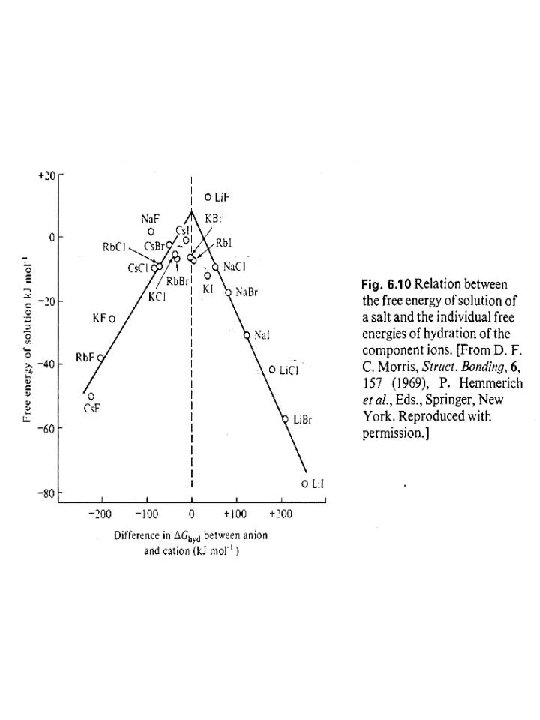
SOLUBILIDAD En los compuestos iónicos hay que considerar varios factores La energía de los enlaces rotos igual a la energía de latice con signo positivo La energía de los enlaces que se forman de hidratación entre el agua y los iones La suma nos da la entalpía de disolución la cual sumada con el aumento de entropía por la temperatura debe dar un valor negativo


M+(g) + X-(g) -U 0 S Hsolvatación catión + anión M+ X-(s) + H 2 O M (H 2 O)+x + X (H 2 O)-y

1

2



H solubilidad = Hsoluto-solvente – Hsoluto-soluto – Hsolvente H solubilidad= 0 se disuelve H solubilidad 0 también se disuelve H solubilidad> 0 y mayor que T S no se disuelve Se puede calentar hasta 100 grados no más a presión ambiental

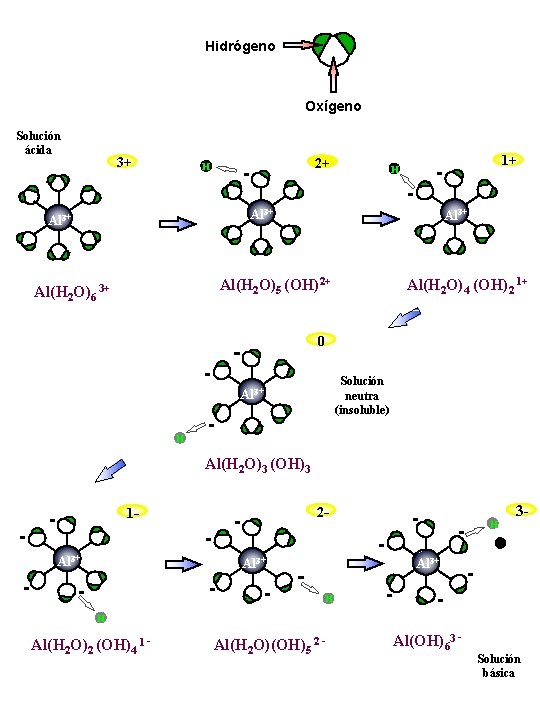
Hidrógeno Oxígeno Solución ácida 3+ 2+ H 1+ H Al 3+ Al(H 2 O)5 (OH)2+ Al(H 2 O)6 3+ Al(H 2 O)4 (OH)2 1+ 0 Solución neutra (insoluble) Al 3+ H Al(H 2 O)3 (OH)3 2 - 1 Al 3+ H 3 - Al 3+ H H Al(H 2 O)2 (OH)4 1 - Al(H 2 O)(OH)5 2 - Al(OH)63 - Solución básica

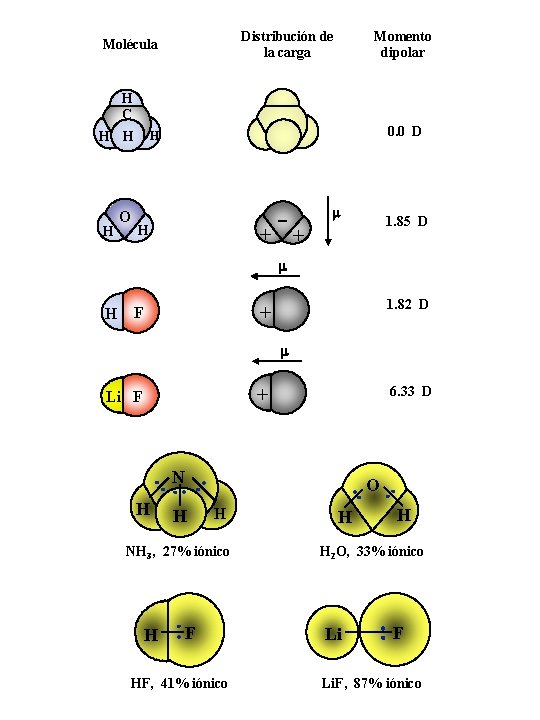
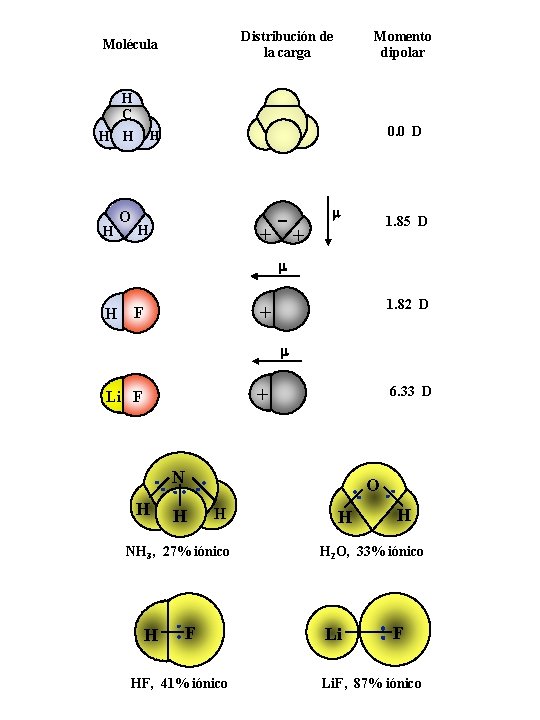
Distribución de la carga Molécula Momento dipolar H C H H H O 0. 0 D H + + H m 1. 85 D m H 1. 82 D + F m + Li F 6. 33 D N H O H H NH 3, 27% iónico H F HF, 41% iónico H H H 2 O, 33% iónico Li F Li. F, 87% iónico

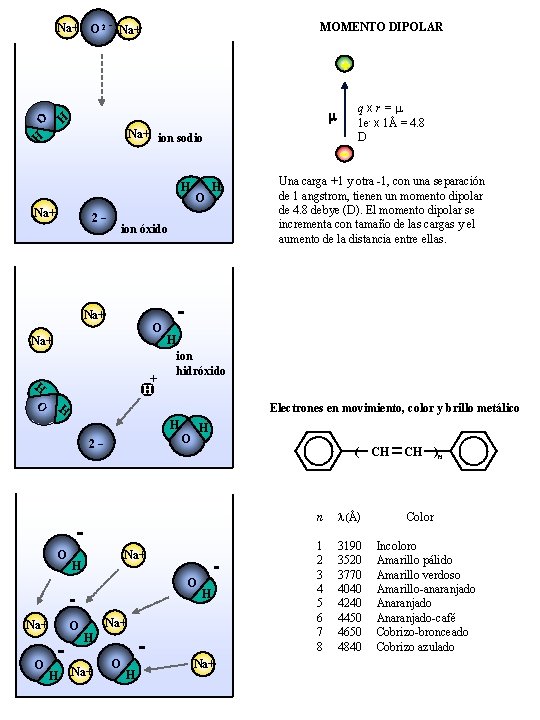
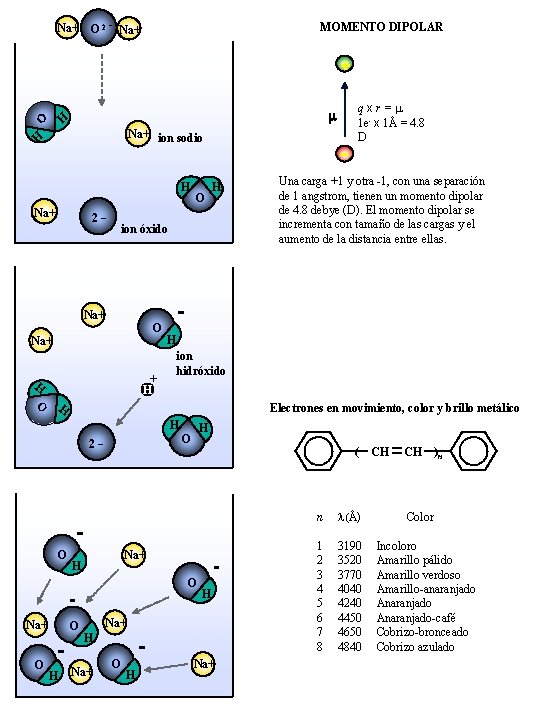
Na+ O 2 - Na+ MOMENTO DIPOLAR + m H Na+ ion sodio H 2 - Na+ O H H O ion óxido qxr= 1 e- x 1Å = 4. 8 D Una carga +1 y otra -1, con una separación de 1 angstrom, tienen un momento dipolar de 4. 8 debye (D). El momento dipolar se incrementa con tamaño de las cargas y el aumento de la distancia entre ellas. Na+ O Na+ + H ion hidróxido H Electrones en movimiento, color y brillo metálico H O H H O 2 - O H ( Na+ H O Na+ O O H H Na+ O H Na+ n l(Å) 1 2 3 4 5 6 7 8 3190 3520 3770 4040 4240 4450 4650 4840 CH CH )n Color Incoloro Amarillo pálido Amarillo verdoso Amarillo-anaranjado Anaranjado-café Cobrizo-bronceado Cobrizo azulado

Temperatura ºC 4000 C PUNTOS DE FUSION DE LOS ELEMENTOS REPRESENTATIVOS 3000 2000 B Be 1000 0 -273 Li N O F Ne Si Mg Al 0 -273 Na P S Cl Ar Ge Ca 0 -273 K As Se Ga Br Sr Kr Sb Te 0 -273 Rb In Sn I Xe Ba 0 -273 Cs At Tl Pb Bi Po Rn

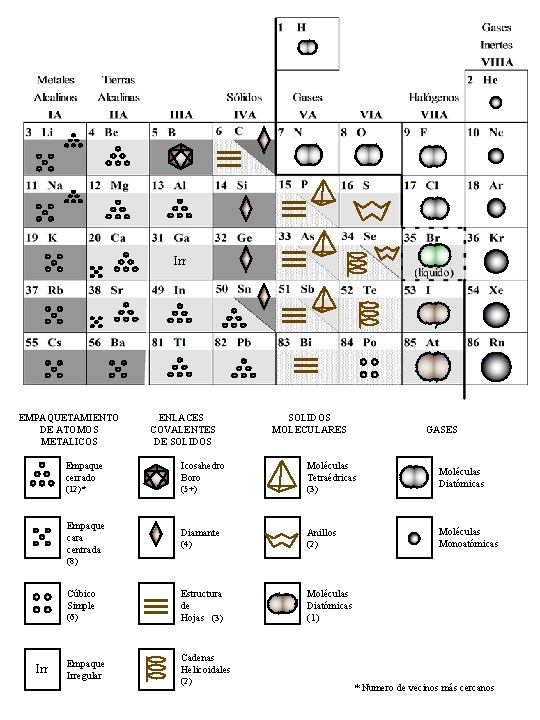
Irr EMPAQUETAMIENTO DE ATOMOS METALICOS ENLACES COVALENTES DE SOLIDOS MOLECULARES GASES Empaque cerrado Icosahedro Boro Moléculas Tetraédricas (12)* (5+) (3) Empaque cara centrada Diamante Anillos (4) (2) Estructura de Hojas (3) Moléculas Diatómicas (1) Moléculas Diatómicas Moléculas Monoatómicas (8) Cúbico Simple (6) Irr Empaque Irregular Cadenas Helicoidales (2) * Numero de vecinos más cercanos

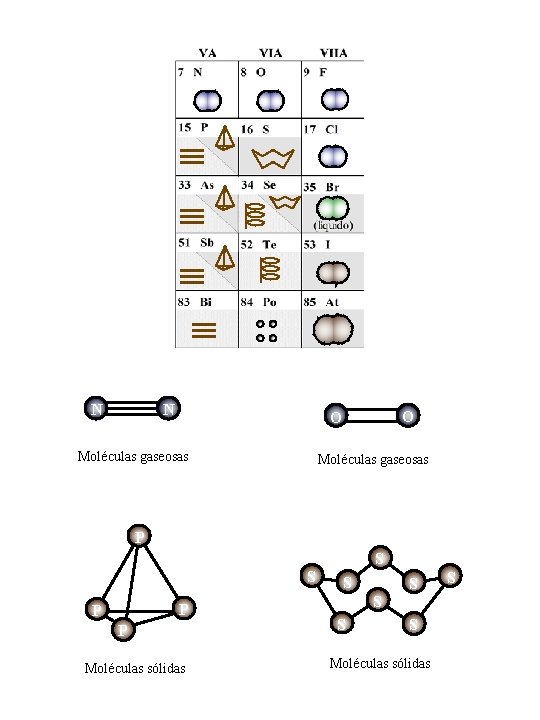
N N O O Moléculas gaseosas P S S P P P Moléculas sólidas S S S Moléculas sólidas S

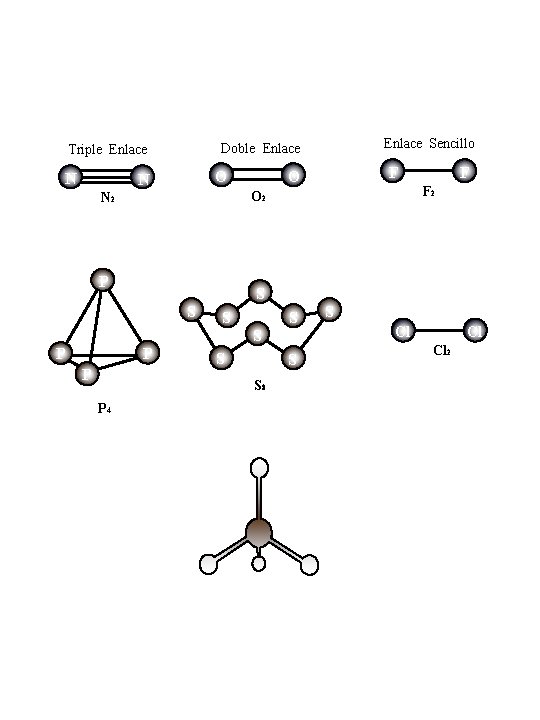
N O N P S S S 8 P 4 F 2 S S P F F O O 2 N 2 P Enlace Sencillo Doble Enlace Triple Enlace S Cl Cl Cl 2

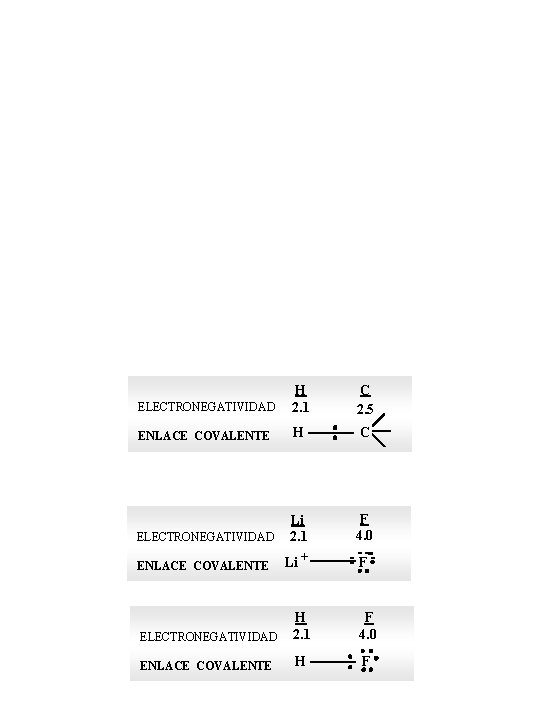
ELECTRONEGATIVIDAD H 2. 1 C 2. 5 ENLACE COVALENTE H C ELECTRONEGATIVIDAD Li 2. 1 F 4. 0 ENLACE COVALENTE Li + F ELECTRONEGATIVIDAD H 2. 1 F 4. 0 ENLACE COVALENTE H F

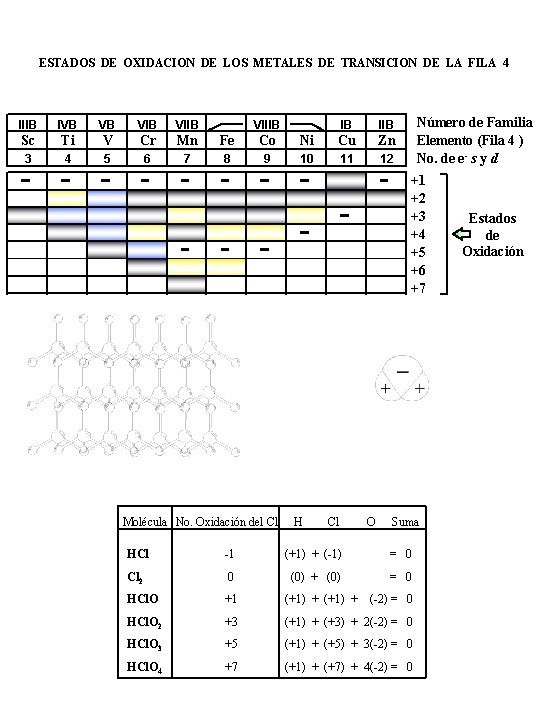
ESTADOS DE OXIDACION DE LOS METALES DE TRANSICION DE LA FILA 4 IIIB IVB VB VIIB VIIIB Sc Ti V Cr Mn Fe Co 3 4 5 6 7 8 9 IB IIB Ni Cu Zn 10 11 12 Número de Familia Elemento (Fila 4 ) No. de e- s y d +1 +2 +3 +4 +5 +6 +7 Molécula No. Oxidación del Cl H Cl O Suma HCl -1 (+1) + (-1) = 0 Cl 2 0 (0) + (0) = 0 HCl. O +1 (+1) + HCl. O 2 +3 (+1) + (+3) + 2(-2) = 0 HCl. O 3 +5 (+1) + (+5) + 3(-2) = 0 HCl. O 4 +7 (+1) + (+7) + 4(-2) = 0 Estados de Oxidación

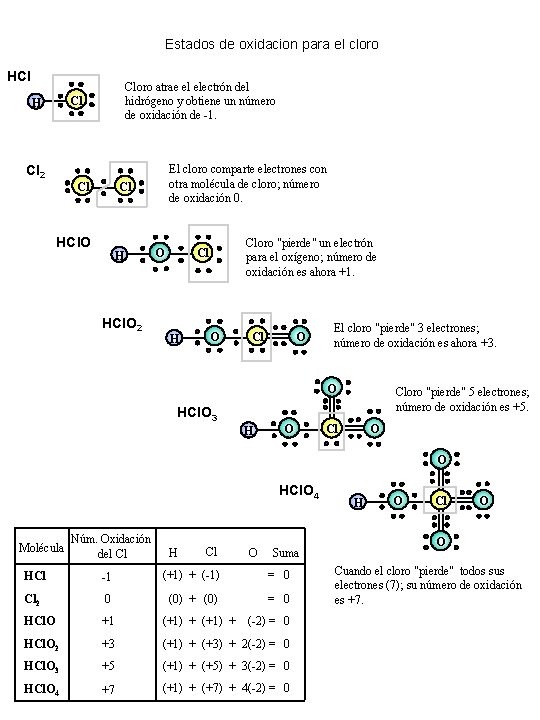
Estados de oxidacion para el cloro HCl Cloro atrae el electrón del hidrógeno y obtiene un número de oxidación de -1. Cl H Cl 2 Cl El cloro comparte electrones con otra molécula de cloro; número de oxidación 0. Cl HCl. O H HCl. O 2 O Cloro "pierde" un electrón para el oxígeno; número de oxidación es ahora +1. Cl H O Cl O El cloro "pierde" 3 electrones; número de oxidación es ahora +3. O HCl. O 3 H O Cloro "pierde" 5 electrones; número de oxidación es +5. Cl O O HCl. O 4 Molécula Núm. Oxidación del Cl H Cl O Suma HCl -1 (+1) + (-1) = 0 Cl 2 0 (0) + (0) = 0 HCl. O +1 (+1) + HCl. O 2 +3 (+1) + (+3) + 2(-2) = 0 HCl. O 3 +5 (+1) + (+5) + 3(-2) = 0 HCl. O 4 +7 (+1) + (+7) + 4(-2) = 0 H O Cl O O Cuando el cloro "pierde" todos sus electrones (7); su número de oxidación es +7.

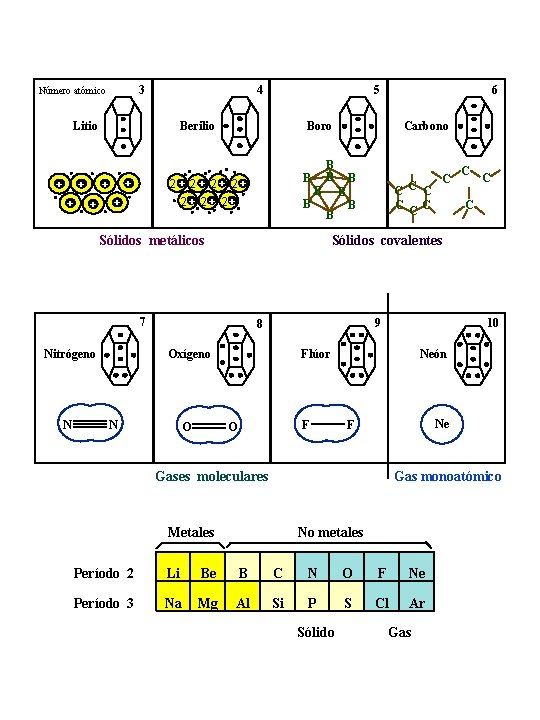
3 Número atómico Litio + + + 5 Berilio + B B B Oxígeno O C C C 9 8 N C C C C Sólidos covalentes 7 N Carbono B B B Sólidos metálicos Nitrógeno 6 Boro 2 + 2+ 2+ 2+ + 4 10 Flúor F O Neón Ne F Gases moleculares Gas monoatómico Metales No metales Período 2 Li Be B C N O F Ne Período 3 Na Mg Al Si P S Cl Ar Sólido Gas

Distribución de la carga Molécula Momento dipolar H C H H H O 0. 0 D H + + H m 1. 85 D m H 1. 82 D + F m + Li F 6. 33 D N H O H H NH 3, 27% iónico H F HF, 41% iónico H H H 2 O, 33% iónico Li F Li. F, 87% iónico

Na+ O 2 - Na+ MOMENTO DIPOLAR + m H Na+ ion sodio H 2 - Na+ O H H O ion óxido qxr= 1 e- x 1Å = 4. 8 D Una carga +1 y otra -1, con una separación de 1 angstrom, tienen un momento dipolar de 4. 8 debye (D). El momento dipolar se incrementa con tamaño de las cargas y el aumento de la distancia entre ellas. Na+ O Na+ + H ion hidróxido H Electrones en movimiento, color y brillo metálico H O H H O 2 - O H ( Na+ H O Na+ O O H H Na+ O H Na+ n l(Å) 1 2 3 4 5 6 7 8 3190 3520 3770 4040 4240 4450 4650 4840 CH CH )n Color Incoloro Amarillo pálido Amarillo verdoso Amarillo-anaranjado Anaranjado-café Cobrizo-bronceado Cobrizo azulado
 Que es una fuerza por contacto
Que es una fuerza por contacto Qumicas
Qumicas Etapas de una relación interpersonal insatisfecha
Etapas de una relación interpersonal insatisfecha Propiedades de forma
Propiedades de forma Contoh soal epq
Contoh soal epq Organismos que dependen de la onu
Organismos que dependen de la onu Mediante tecnicas bioquimicas un biologo celular determino
Mediante tecnicas bioquimicas un biologo celular determino Uji beda mean
Uji beda mean Atribut penelitian adalah
Atribut penelitian adalah Contoh definisi operasional
Contoh definisi operasional Clasificación de las propiedades coligativas
Clasificación de las propiedades coligativas Cuales son las fuerzas internas del mercado
Cuales son las fuerzas internas del mercado Fuerzas 3º eso
Fuerzas 3º eso Estructura de lewis so4
Estructura de lewis so4 Ley orgánica de las fuerzas armadas 2013
Ley orgánica de las fuerzas armadas 2013 Dibujos las fuerzas y sus efectos
Dibujos las fuerzas y sus efectos Como se calcula torque
Como se calcula torque Preguntas sobre las 5 fuerzas de porter
Preguntas sobre las 5 fuerzas de porter Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Teorema de las fuerzas vivas
Teorema de las fuerzas vivas Efecto de la fuerza
Efecto de la fuerza Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Friccion estatica
Friccion estatica Universidad de las fuerzas armadas espe
Universidad de las fuerzas armadas espe Verbo curare forma passiva
Verbo curare forma passiva Esercizi forma attiva e passiva
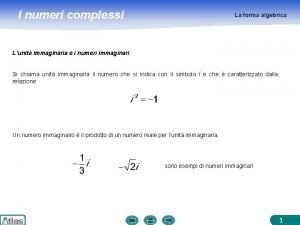
Esercizi forma attiva e passiva Forma algebrica
Forma algebrica Forma interrogativa francese esercizi pdf
Forma interrogativa francese esercizi pdf Pronomi relativi italiano tabella
Pronomi relativi italiano tabella Dalla forma implicita alla forma esplicita
Dalla forma implicita alla forma esplicita Felul adjectivelor prin care se exprima
Felul adjectivelor prin care se exprima Sustancias puras elementos y compuestos
Sustancias puras elementos y compuestos Potencia de una fraccion
Potencia de una fraccion Propiedades de sumatoria
Propiedades de sumatoria Constante ebulloscópica fórmula
Constante ebulloscópica fórmula Objetivo de la luz
Objetivo de la luz Mapa conceptual de la ley 031
Mapa conceptual de la ley 031 Niels henrik bohr aportacion al modelo atomico
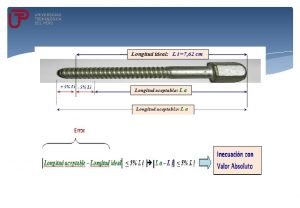
Niels henrik bohr aportacion al modelo atomico Inecuaciones con valor absoluto
Inecuaciones con valor absoluto Que es el conjunto de los numeros enteros
Que es el conjunto de los numeros enteros Propiedades materiales
Propiedades materiales Propiedades sensoriales de los metales
Propiedades sensoriales de los metales Nivel subatómico
Nivel subatómico Descripción de las propiedades de la materia
Descripción de las propiedades de la materia Inecuaciones con valor absoluto
Inecuaciones con valor absoluto Propiedades sumatoria multiplicacion
Propiedades sumatoria multiplicacion Fyqcolindres
Fyqcolindres Propiedad textual de la adecuación
Propiedad textual de la adecuación Desigualdades propiedades
Desigualdades propiedades Grupo carbonilo
Grupo carbonilo Formula del carbonilo
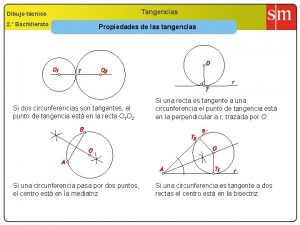
Formula del carbonilo Tangencias 2 bachillerato
Tangencias 2 bachillerato Propiedades de rectangulo cuadrado y triangulo
Propiedades de rectangulo cuadrado y triangulo Propiedades de las igualdades
Propiedades de las igualdades Soluciones amortiguadoras
Soluciones amortiguadoras Propiedades de las potencias 2 eso
Propiedades de las potencias 2 eso Vapor saturado
Vapor saturado