Fuentes exgenas Fuentes endgenas aprox 70 g da



















![TOXICIDAD DEL AMONIACO • A NIVEL CEREBRAL [NH 4+] : Se revierte la reacción TOXICIDAD DEL AMONIACO • A NIVEL CEREBRAL [NH 4+] : Se revierte la reacción](https://slidetodoc.com/presentation_image_h/a727da763e40da002c7d7d5370d8be01/image-34.jpg)




- Slides: 44

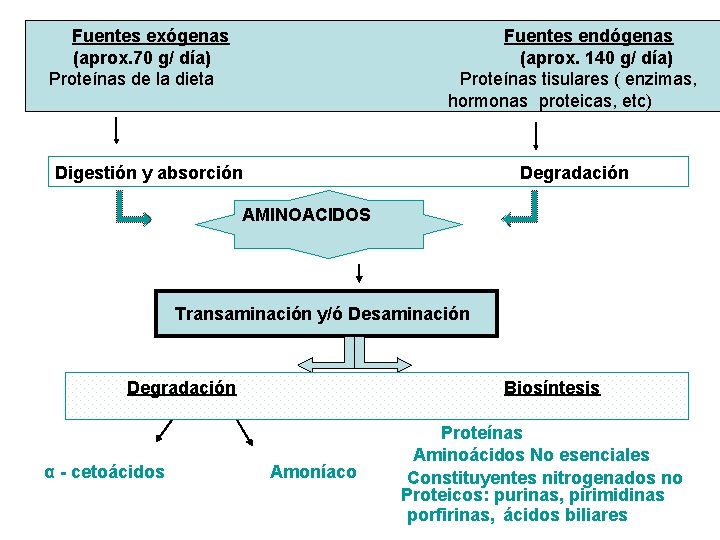
Fuentes exógenas Fuentes endógenas (aprox. 70 g/ día) (aprox. 140 g/ día) Proteínas de la dieta Proteínas tisulares ( enzimas, hormonas proteicas, etc) Digestión y absorción Degradación AMINOACIDOS Transaminación y/ó Desaminación Degradación α - cetoácidos Biosíntesis Amoníaco Proteínas Aminoácidos No esenciales Constituyentes nitrogenados no Proteicos: purinas, pirimidinas porfirinas, ácidos biliares

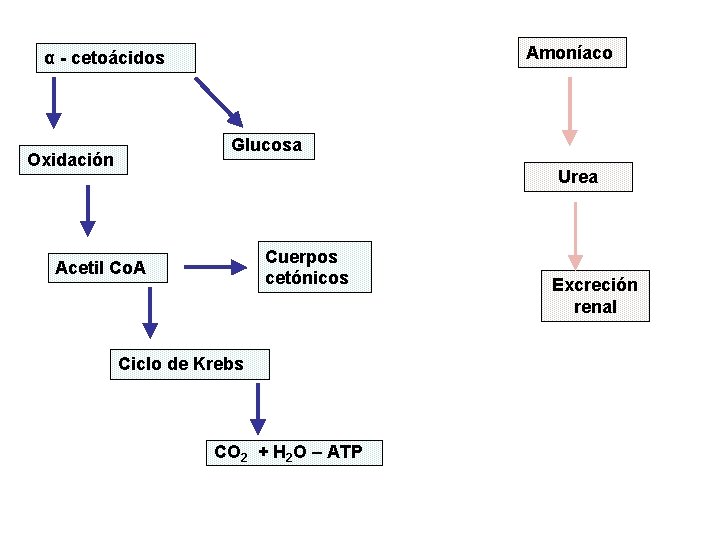
Amoníaco α - cetoácidos Glucosa Oxidación Urea Cuerpos cetónicos Acetil Co. A Ciclo de Krebs CO 2 + H 2 O – ATP Excreción renal


Digestión de Proteinas I) En el estómago GASTRINA Células Parietales HCl Células Principales Pepsinógeno H Cl Pepsina + resto de 42 Aa. Proenzima p. H 1, 5 -2, 5 Enzima activa -NH 2

Como actúa la pepsina? ? • ES UNA ENDOPEPTIDASA • HIDROLIZA UNIONES PEPTIDICAS • ACTUA SOBRE GRUPOS AMINOS DE Aa AROMATICOS

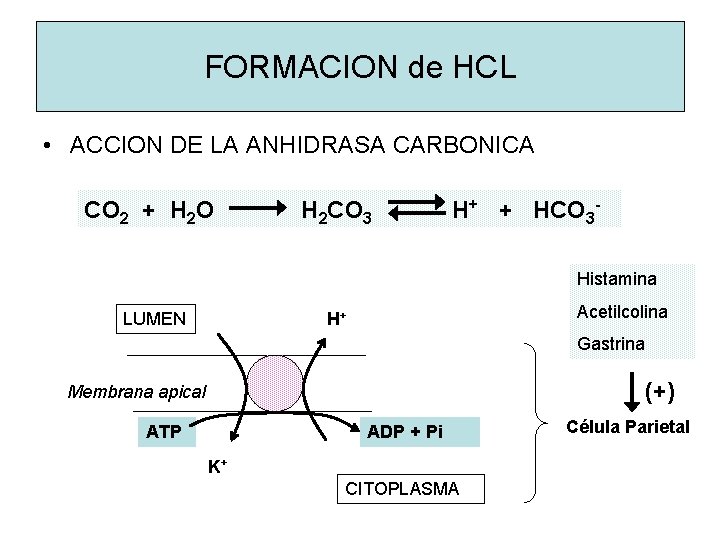
FORMACION de HCL • ACCION DE LA ANHIDRASA CARBONICA CO 2 + H 2 O H 2 CO 3 H+ + HCO 3 Histamina LUMEN Acetilcolina H+ Gastrina (+) Membrana apical ATP ADP + Pi K+ CITOPLASMA Célula Parietal

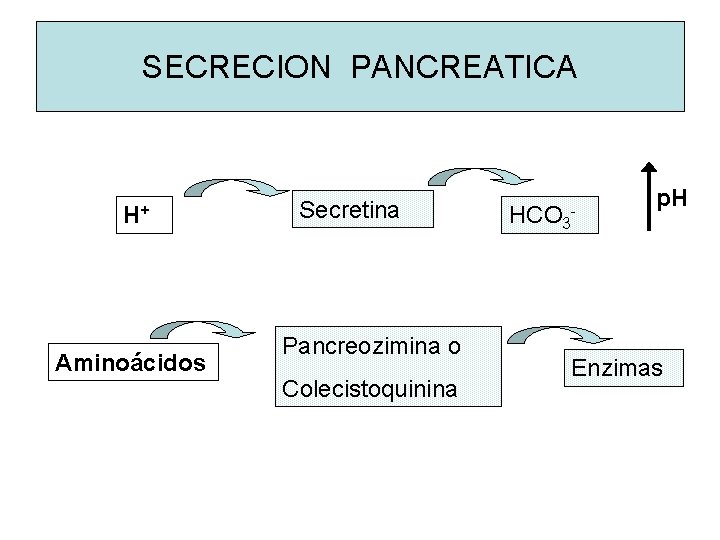
SECRECION PANCREATICA H+ Aminoácidos Secretina Pancreozimina o Colecistoquinina HCO 3 - p. H Enzimas

Digestión de Proteínas II) En Duodeno e Intestino Tripsinógeno Enteroquinasa INACTIVOS Quimotripsinógeno Procarboxipeptidasas Ay. B Proelastasa Tripsina T R I P S I N A ACTIVOS Quimotripsina Carboxipeptidasas Ay. B Elastasa

QUE TIPO DE ENLACES PEPTIDICOS HIDROLIZAN ? ? • Tripsina (endopeptidasa) : grupos carbonilo de lisina y arginina • Quimotripsina (endopeptidasa) grupos carboxilo de fenilalanina, tirosina, triptofano • Las carboxipeptidasas (exopeptidasas) eliminan restos carboxilos terminales.

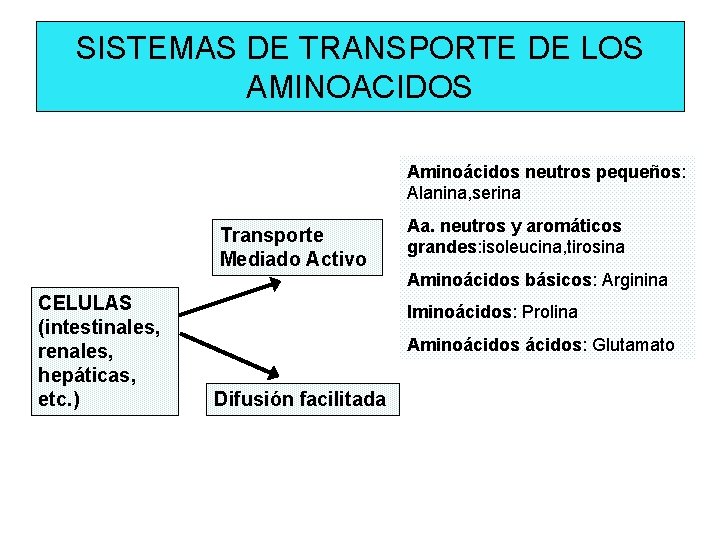
SISTEMAS DE TRANSPORTE DE LOS AMINOACIDOS Aminoácidos neutros pequeños: Alanina, serina Transporte Mediado Activo CELULAS (intestinales, renales, hepáticas, etc. ) Aa. neutros y aromáticos grandes: isoleucina, tirosina Aminoácidos básicos: Arginina Iminoácidos: Prolina Aminoácidos: Glutamato Difusión facilitada

Distribución de los aminoácidos en el período post-pandrial • Glutamina y Asparragina: Intestino y riñón • Aminoácidos de cadena ramificada: Músculo y cerebro • La mayor parte de los aminoácidos: Hígado

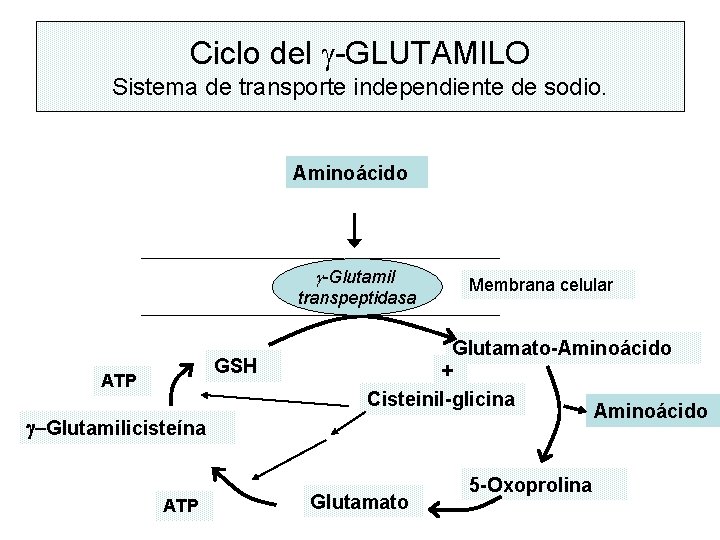
Ciclo del g-GLUTAMILO Sistema de transporte independiente de sodio. Aminoácido g-Glutamil transpeptidasa GSH ATP g-Glutamilicisteína ATP Membrana celular Glutamato-Aminoácido + Cisteinil-glicina Aminoácido Glutamato 5 -Oxoprolina

DEGRADACION DE PROTEINAS ENDOGENAS • Proteasas lisosomales ó CATEPSINAS • Proteasomas • CALPAÍNAS • CASPASAS Extracelulares Citosólicas de vida media larga Organelas citoplasmáticas Proteínas regulatorias: factores de control del ciclo celular, quinasas, etc. Proteasas citosólicas activadas por Ca++ Proteasas que participar en el proceso de muerte celular programada ó apoptosis

Sistema Ubicuitina-Proteasoma Nobel de Química en 2004 Avram Hershko, Aaron Ciechanover, Irwin Rose. Enzima activadora de ubicuitina ETAPA 3 Ubicuitina (Transesterificación) Proteína Ubicuitina ETAPA 1 ( activación) Ubicuitina ETAPA 4 Ubicuitina (proteólisis) ETAPA 2 (conjugación) Ubicuitina: Polipéptido de 76 Aa.

• Proteínas PEST (Pro, Glu, Ser y Thr) contienen sitios de fosforilación queconducenala ubiquitinación. • Proteasoma: Complejo multiproteico 26 S: centro atalitico (proteasoma 20 S) y casquete (20 S) • El proteasoma 20 S contiene aprox. 7 subunidades a y otras 7 b

FONDO COMUN DE AMINOACIDOS • Digestión de Proteínas exógenas • Degradación de Proteínas endógenas • Aminoácidos sintetizados en la célula

DESTINO DE LOS AMINOÁCIDOS EN LA CELULA • Biosíntesis: Proteínas, Compuestos no proteicos, etc. • Gluconeogénesis • Obtención de Energía Los aminoácidos deben degradarse 1º) Pérdida del Grupo Amino 2º) Degradación de la cadena carbonada

PERDIDA DEL GRUPO AMINO • Reacciones de Transaminación • Reacciones de Desaminación Oxidativa • Reacciones de Desaminación no Oxidativa

Reacción General de Transaminación

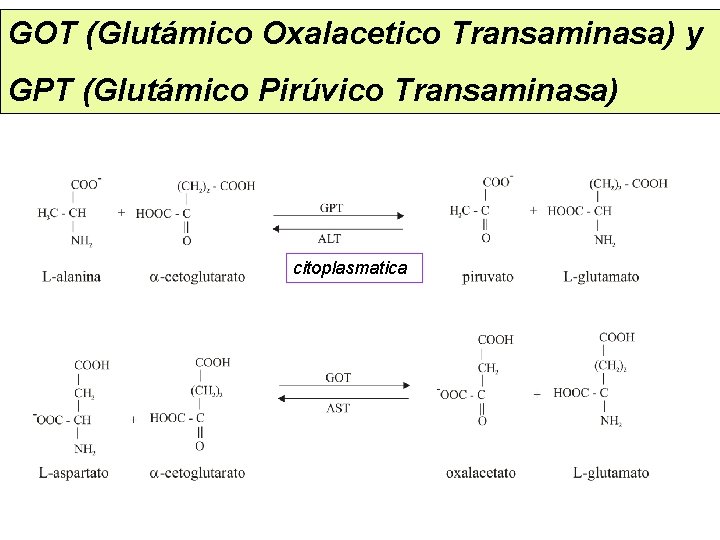
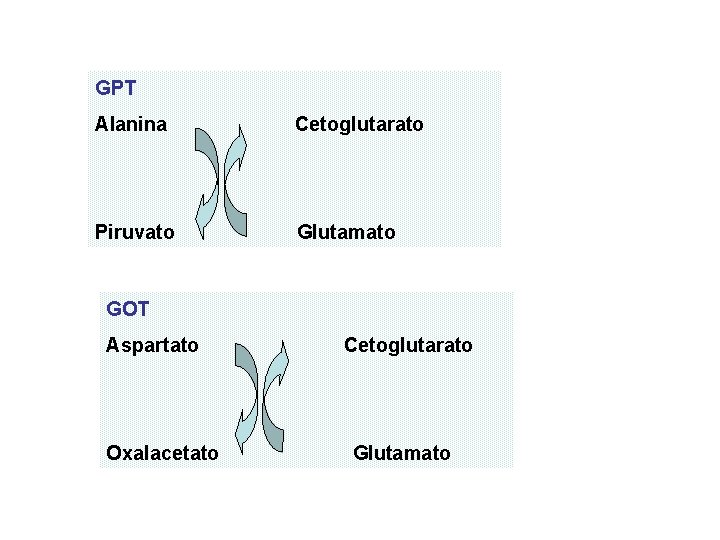
GOT (Glutámico Oxalacetico Transaminasa) y GPT (Glutámico Pirúvico Transaminasa) citoplasmatica

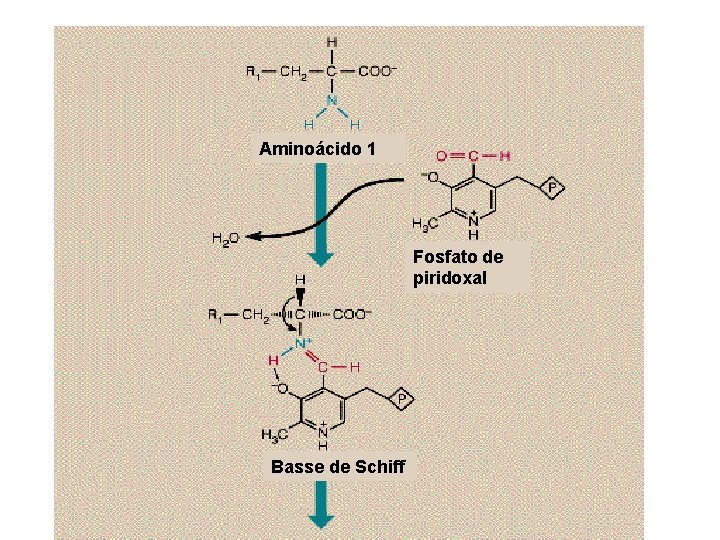
Aminoácido 1 Fosfato de piridoxal Basse de Schiff

Intermediario quinoideo a-cetoácido 1 Aminoácido 2 Carbanión Fosfato de piridoxamina a-cetoácido 2 Fosfato de piridoxal

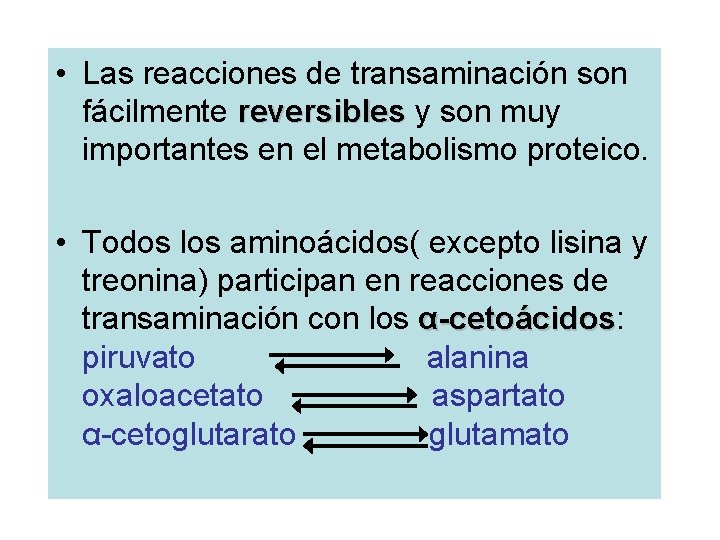
• Las reacciones de transaminación son fácilmente reversibles y son muy reversibles importantes en el metabolismo proteico. • Todos los aminoácidos( excepto lisina y treonina) participan en reacciones de transaminación con los α-cetoácidos: α-cetoácidos piruvato alanina oxaloacetato aspartato α-cetoglutarato glutamato

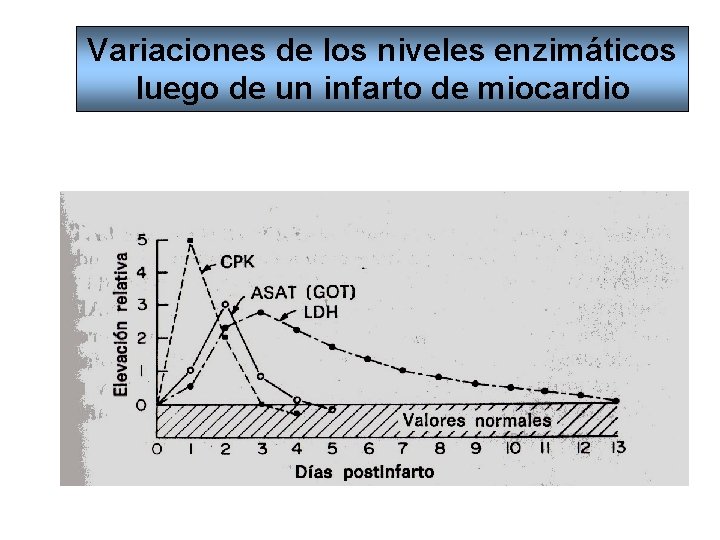
TRANSAMINASAS DE INTERES CLINICO • Infarto de Miocardio (GOT) y Aumentada en afecciones hepáticas principalmente hepatitis con necrosis • Afecciones Hepáticas (GPT)- Los mayores aumentos de GPT se producen como consecuencia de alteraciones hepáticas: colestasis, hepatitis tóxicas, o virales • Hepatitis alcoholicas c/necrosis de tejido: Relación GOT/GPT>1.

GPT Alanina Cetoglutarato Piruvato Glutamato GOT Aspartato Oxalacetato Cetoglutarato Glutamato

DIFERENTES VALORES DE GOT Y GPT EN HEPATITIS • Es útil la relación GOT/GPT o cociente de Ritis que normalmente es de 1. • En las hepatitis alcohólicas con necrosis, éste índice es generalmente > 1 . • Hepatitis virales agudas o crónicas el cociente de Ritis es < 1 ( la GPT suele estar aumentada en mayor grado que la GOT ).

Variaciones de los niveles enzimáticos luego de un infarto de miocardio

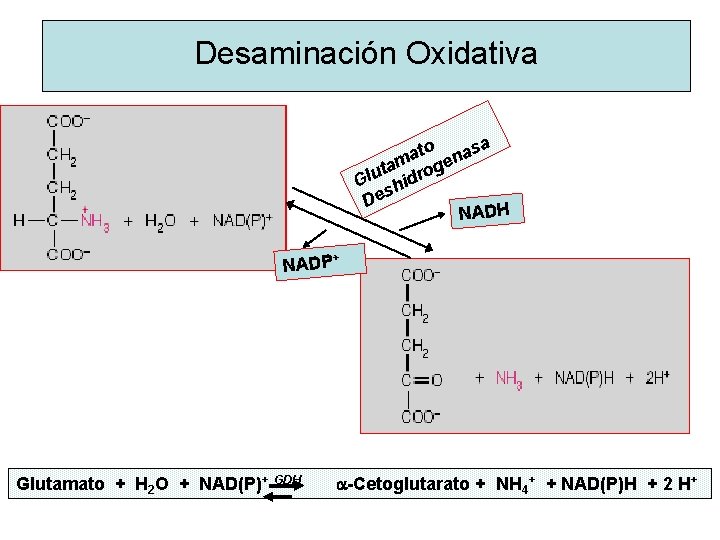
Desaminación Oxidativa to nasa a tam roge u l G hid s De NADH + NADP Glutamato + H 2 O + NAD(P)+ GDH a-Cetoglutarato + NH 4+ + NAD(P)H + 2 H+

REGULACION DE LA GLUTAMATO DESHIDROGENASA • Regulación alostérica ( + ) ADP Y GDP ( - ) ATP Y GTP

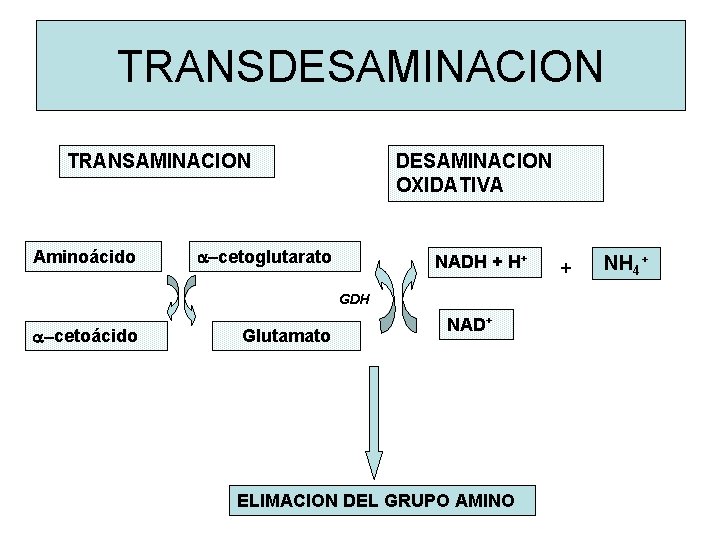
TRANSDESAMINACION TRANSAMINACION Aminoácido DESAMINACION OXIDATIVA a-cetoglutarato NADH + H+ GDH a-cetoácido Glutamato NAD+ ELIMACION DEL GRUPO AMINO + NH 4+

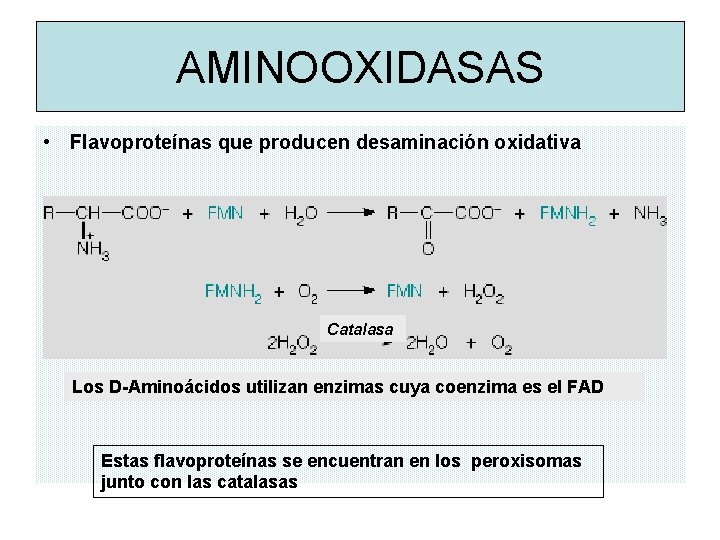
AMINOOXIDASAS • Flavoproteínas que producen desaminación oxidativa Catalasa Los D-Aminoácidos utilizan enzimas cuya coenzima es el FAD Estas flavoproteínas se encuentran en los peroxisomas junto con las catalasas

REACCIONES DE DESAMINACION NO OXIDATIVA • Serina deshidratasa L-Serina PPL Piruvato + NH 4+ • L-Treonina deshidratasa PPL L-Treonina a-cetobutirato + NH 4+

Origen del amoníaco • Reacciones de desaminación: oxidativa y no oxidativas • Bacterias intestinales y posterior absorción. EL AMONIACO Ó ION AMONIO ES TOXICO Y DEBE SER ELIMINADO
![TOXICIDAD DEL AMONIACO A NIVEL CEREBRAL NH 4 Se revierte la reacción TOXICIDAD DEL AMONIACO • A NIVEL CEREBRAL [NH 4+] : Se revierte la reacción](https://slidetodoc.com/presentation_image_h/a727da763e40da002c7d7d5370d8be01/image-34.jpg)
TOXICIDAD DEL AMONIACO • A NIVEL CEREBRAL [NH 4+] : Se revierte la reacción de la glutamato deshidrogenasa [a-cetoglutarato] [ATP] Valores normales: 5 -10 m. M de NH 3 en sangre

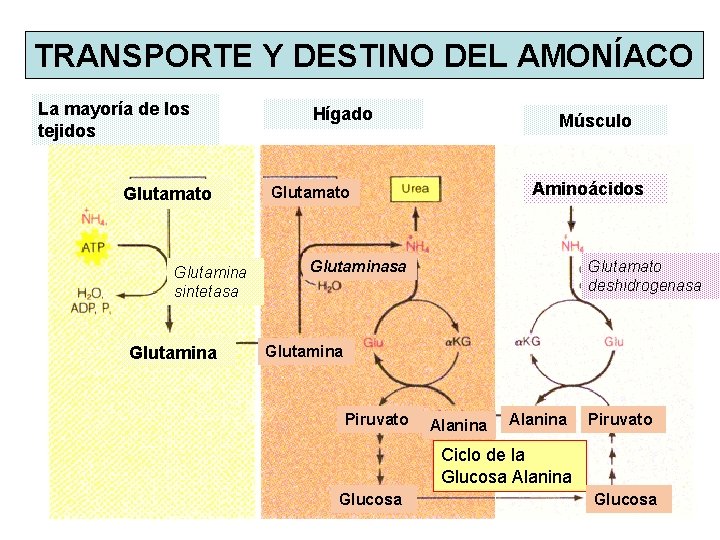
TRANSPORTE Y DESTINO DEL AMONÍACO La mayoría de los tejidos Glutamato Glutamina sintetasa Glutamina Hígado Músculo Aminoácidos Glutamato Glutaminasa Glutamato deshidrogenasa Glutamina Piruvato Alanina Piruvato Ciclo de la Glucosa Alanina Glucosa

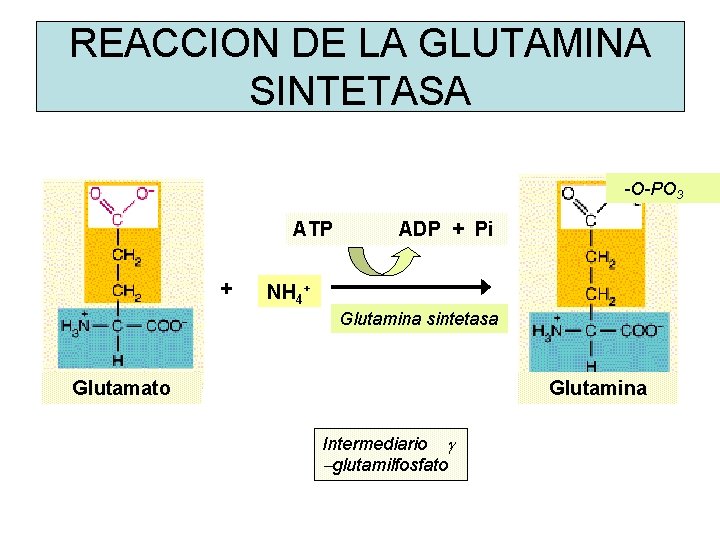
REACCION DE LA GLUTAMINA SINTETASA -O-PO 3 ATP + ADP + Pi NH 4+ Glutamina sintetasa Glutamato Glutamina Intermediario g -glutamilfosfato

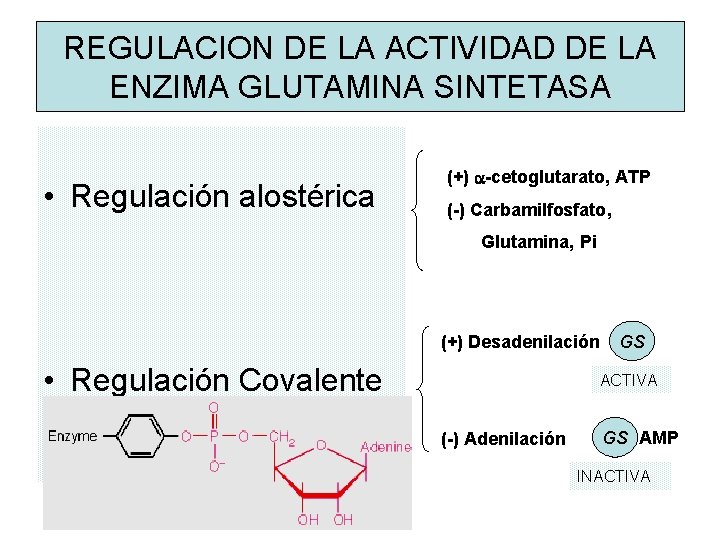
REGULACION DE LA ACTIVIDAD DE LA ENZIMA GLUTAMINA SINTETASA • Regulación alostérica (+) a-cetoglutarato, ATP (-) Carbamilfosfato, Glutamina, Pi (+) Desadenilación • Regulación Covalente GS ACTIVA (-) Adenilación GS AMP INACTIVA

REACCION DE LA GLUTAMINASA + H 2 O + Glutaminasa Glutamina Glutamato Enzima Mitocondrial. Muy activa en hígado, riñón, branquias. NH 4+

ELIMINACION DEL AMONIACO • AMONIOTELICOS: Especies acuáticas como peces óseos. • URICOTELICOS: Aves y reptiles • UREOTELICOS: Animales terrestres NH 3 Acido úrico Urea

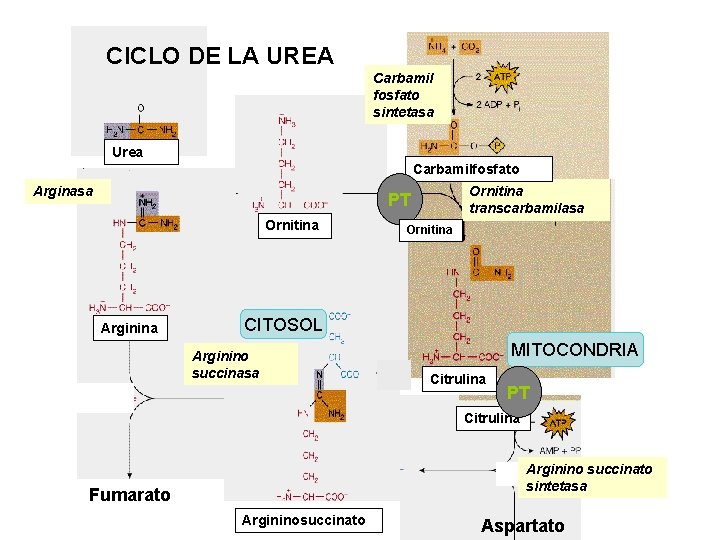
CICLO DE LA UREA Carbamil fosfato sintetasa Urea Carbamilfosfato Arginasa Ornitina transcarbamilasa PT Ornitina Arginina Ornitina CITOSOL Arginino succinasa MITOCONDRIA Citrulina PT Citrulina Arginino succinato sintetasa Fumarato Argininosuccinato Aspartato

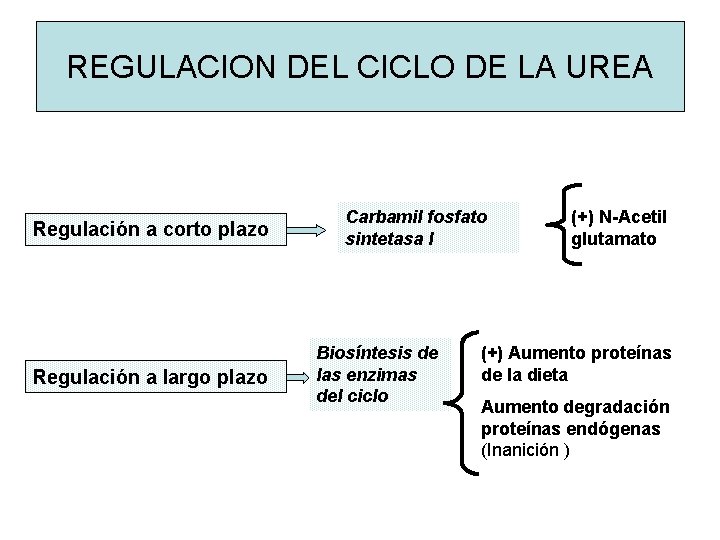
REGULACION DEL CICLO DE LA UREA Regulación a corto plazo Regulación a largo plazo Carbamil fosfato sintetasa I Biosíntesis de las enzimas del ciclo (+) N-Acetil glutamato (+) Aumento proteínas de la dieta Aumento degradación proteínas endógenas (Inanición )

GASTO ENERGETICO DEL CICLO DE LA UREA • Formación de Carbamoil fosfato: 2 ATP • Ingreso de Aspartato: 1 ATP AMP + PPi EN TOTAL: 4 Uniones ricas en energía ó 3 ATP 2 Pi

PROPIEDADES DE LA UREA • Molécula pequeña, sin carga. • Difusible • Soluble • Atóxica • El 50% de su peso es nitrógeno. • Permite la eliminación de 2 productos de desecho: CO 2 y NH 3 • Valores Normales: 25 -30 grs. de urea diarios

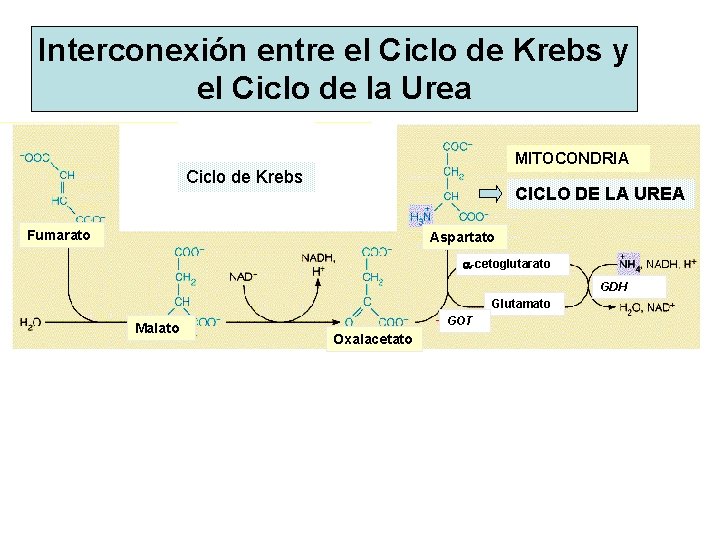
Interconexión entre el Ciclo de Krebs y el Ciclo de la Urea MITOCONDRIA Ciclo de Krebs CICLO DE LA UREA Fumarato Aspartato a-cetoglutarato GDH Glutamato Malato GOT Oxalacetato
 Fuentes del efecto invernadero
Fuentes del efecto invernadero Fuentes bautismales
Fuentes bautismales Fuentes de informacion secundarias
Fuentes de informacion secundarias Fuente epistemológica del currículum
Fuente epistemológica del currículum Fuentes del derecho laboral
Fuentes del derecho laboral Experimento de pasteur
Experimento de pasteur Fuentes dem
Fuentes dem Fuente de invalidacion interna
Fuente de invalidacion interna Espira campo magnetico
Espira campo magnetico Obligaciones mercantiles en mexico
Obligaciones mercantiles en mexico Fuentes de la doctrina social de la iglesia
Fuentes de la doctrina social de la iglesia Fuentes del derecho ambiental
Fuentes del derecho ambiental Fuentes primarias y secundarias de la historia
Fuentes primarias y secundarias de la historia Que es fuentes bibliograficas
Que es fuentes bibliograficas Fuentes reales del derecho
Fuentes reales del derecho Fuentes de consulta
Fuentes de consulta Fuente interna de reclutamiento
Fuente interna de reclutamiento Fuentes de informacion secundarias
Fuentes de informacion secundarias Fuentes cuantitativas
Fuentes cuantitativas Fuentes del derecho laboral en nicaragua
Fuentes del derecho laboral en nicaragua Estructura de la celestina
Estructura de la celestina Que son los fundamentos antropológicos
Que son los fundamentos antropológicos Fuentes del derecho
Fuentes del derecho Myriam fuentes
Myriam fuentes Personajes de chac mool
Personajes de chac mool Inversiones fuentes
Inversiones fuentes Fuentes de financiamiento en salud
Fuentes de financiamiento en salud Fuentes del derecho administrativo
Fuentes del derecho administrativo Slidetodoc.com
Slidetodoc.com Fuentes del derecho
Fuentes del derecho Fuentes formales del derecho fiscal
Fuentes formales del derecho fiscal Analizador de sector magnetico
Analizador de sector magnetico Fuentes de carbohidratos complejos
Fuentes de carbohidratos complejos Recursos literarios de chac mool
Recursos literarios de chac mool Fuentes escritas
Fuentes escritas Fuentes del derecho internacional
Fuentes del derecho internacional Acido ascorbico fuentes
Acido ascorbico fuentes Criterios mecec mep
Criterios mecec mep Fuentes exclusivas
Fuentes exclusivas Fuentes de financiamiento
Fuentes de financiamiento Ejemplo matriz de marco logico
Ejemplo matriz de marco logico Cuales son las fuentes de financiamiento
Cuales son las fuentes de financiamiento 3 preguntas cerradas
3 preguntas cerradas Cuales son las fuentes del derecho tributario
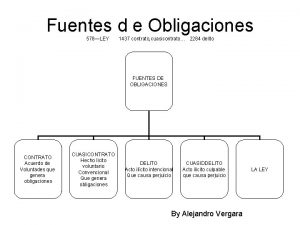
Cuales son las fuentes del derecho tributario Obligaciones civiles
Obligaciones civiles