FSICA PTICA AULA 15 GASES GASES Os gases




















- Slides: 27

FÍSICA ÓPTICA AULA 15 – GASES

GASES Ø Os gases tem por característica não possuírem forma própria nem volume próprio. Ø Assim sendo, a forma e o volume dos gases são a do recipiente que o contém.

GASES Gás ideal Ø O gás ideal nada mais é do que um modelo idealizado para os gases reais (modelo perfeito). Ø A densidade do gás ideal é extremamente baixa. Ø Para que o gás real se aproxime do que chamamos de gás ideal, deve ter baixa pressão (as partículas ficam mais afastadas), e alta temperatura (as partículas vibram com mais energia).

GASES Gás ideal Ø As características de uma gás ideal são: • Partículas puntiformes, ou seja, tamanho desprezível; • Força de interação nula, as partículas devem estar bem afastadas; • Interação durante a colisão, a única força atuante é a da colisão; • Colisão perfeitamente elástica, ou seja, não tem dissipação de energia.

VARIÁVEIS DE UM GÁS Ø As três grandezas físicas envolvidas num gás são: • Volume, • Pressão, • Temperatura. Ø Existe uma dependência entre estas três variáveis em um gás. Ø Assim sendo, vamos considerar um gás perfeito para o nosso estudo.

VARIÁVEIS DE UM GÁS Volume Ø O volume de um gás é o volume do recipiente que o contém, ou seja, as partículas de um gás ocupam toda a superfície interna do recipiente em questão. 1 m 3 = 1000 L

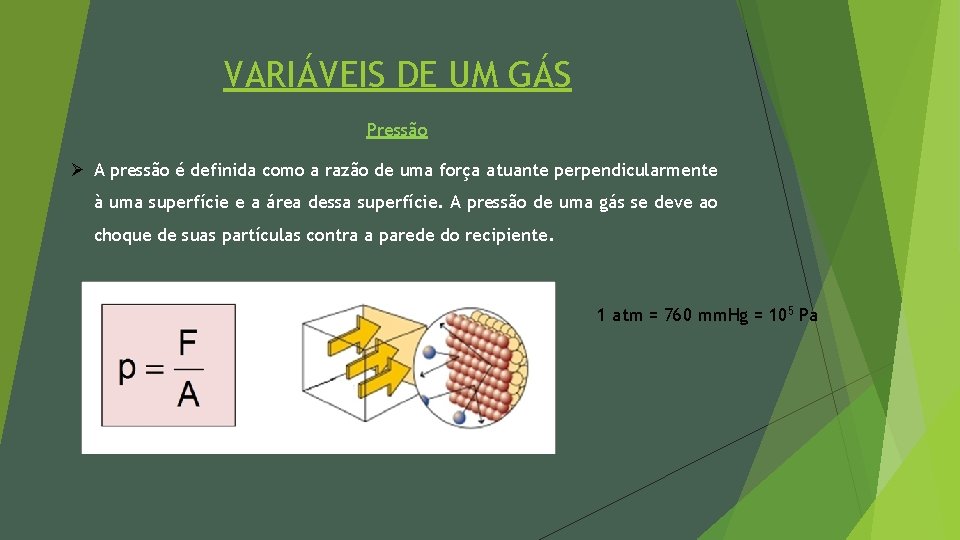
VARIÁVEIS DE UM GÁS Pressão Ø A pressão é definida como a razão de uma força atuante perpendicularmente à uma superfície e a área dessa superfície. A pressão de uma gás se deve ao choque de suas partículas contra a parede do recipiente. 1 atm = 760 mm. Hg = 105 Pa

VARIÁVEIS DE UM GÁS Temperatura Ø A temperatura nada mais é do que o estado de agitação da suas partículas.

TRANSFORMAÇÃO DOS GASES Ø Diz-se que um gás sofre transformação de estado quando pelo menos uma de suas grandezas sofre alteração. Ø Assim para uma determinada porção de gás ideal contida em um recipiente, quando uma variável de estado varia pelo menos uma outra tem que variar. Ø Entre as transformações de um gás se destacam as transformações: • Isotérmica; • Isobárica; • Isovolumétrica (Isocórica ou Isométrica).

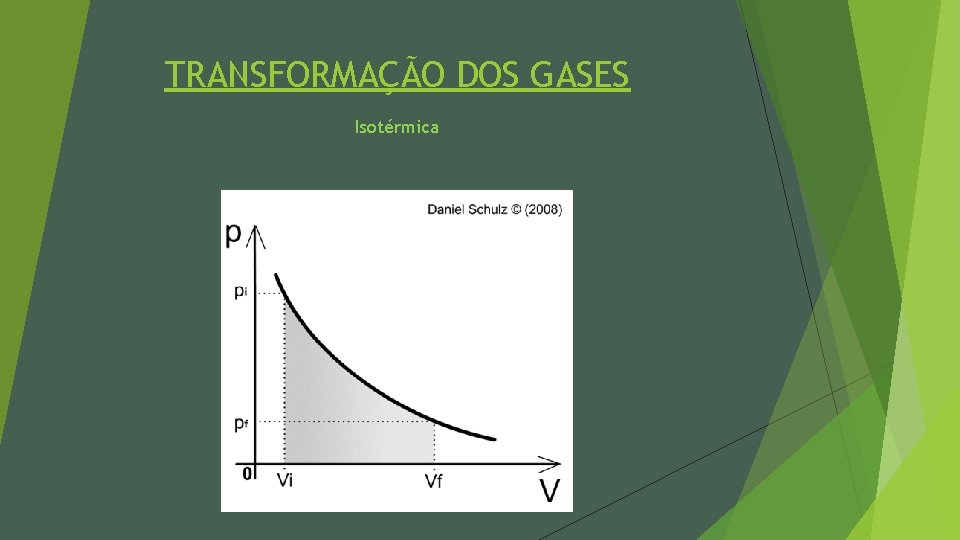
TRANSFORMAÇÃO DOS GASES Isotérmica Ø Uma transformação é isotérmica quando a temperatura permanece constante. Assim, a pressão do gás varia de forma inversamente proporcional ao volume ocupado pelo gás. P. V = Constante P 1. V 1 = P 2. V 2

TRANSFORMAÇÃO DOS GASES Isotérmica

TRANSFORMAÇÃO DOS GASES

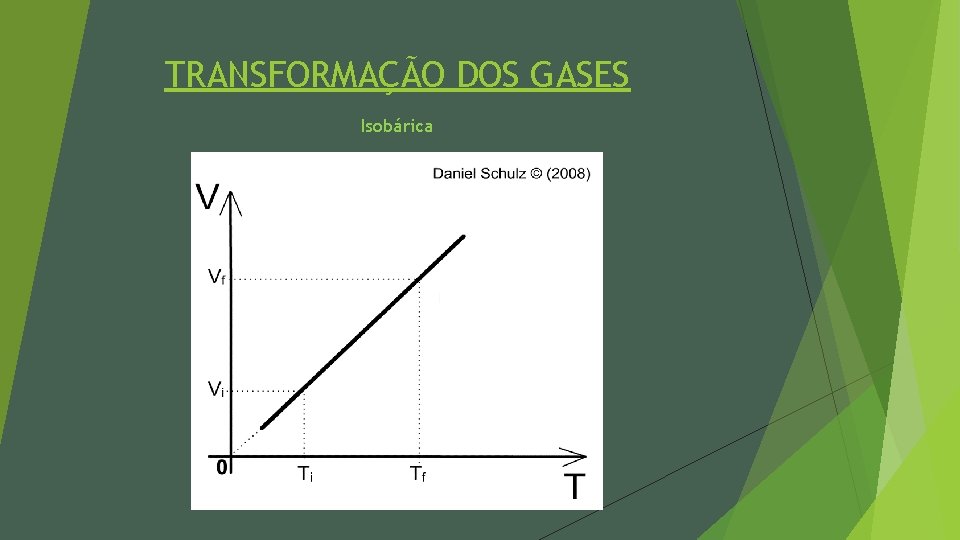
TRANSFORMAÇÃO DOS GASES Isobárica

TRANSFORMAÇÃO DOS GASES

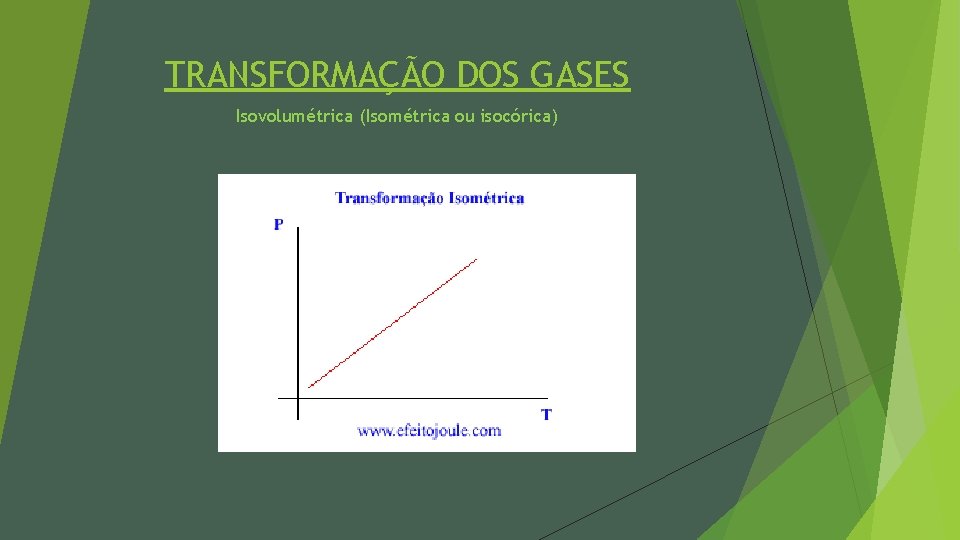
TRANSFORMAÇÃO DOS GASES Isovolumétrica (Isométrica ou isocórica)

TRANSFORMAÇÃO DOS GASES

EQUAÇÃO DE CLAPEYRON

EQUAÇÃO DE CLAPEYRON

EQUAÇÃO DE CLAPEYRON

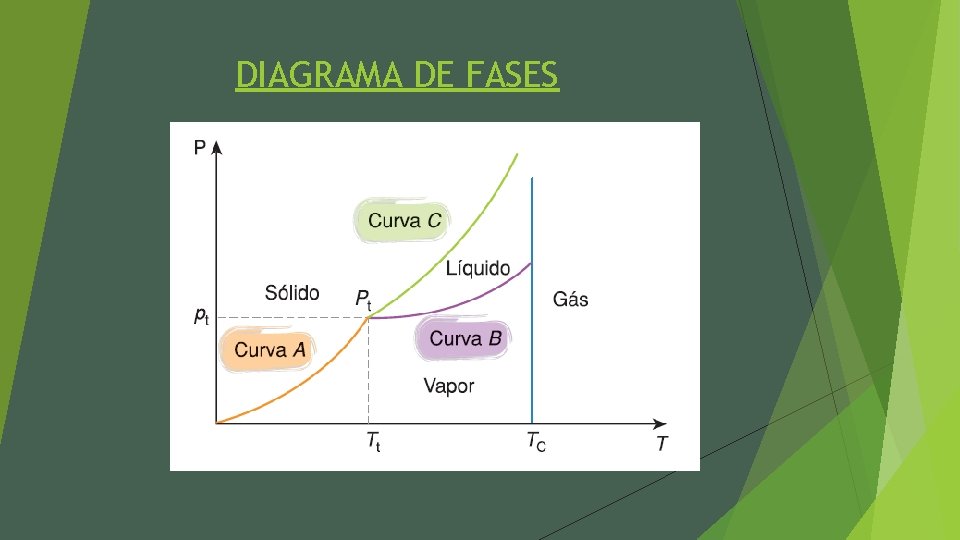
DIAGRAMA DE FASES Ø O diagrama de fases de uma substância consiste na curva que relaciona as grandezas pressão e temperatura. Ø Dependendo da substância, para uma determinada pressão e temperatura esta pode se encontrar nas fases sólida, líquida e gasosa. Assim sendo, cada substância terá valores específicos para o seu diagrama.

DIAGRAMA DE FASES

DIAGRAMA DE FASES Ø Curva A: Faz a separação das fases sólidas e vapor, ou seja é a curva de sublimação. Ø Curva B: Faz a separação das fases líquida e vapor, ou seja, é a curva de vaporização ou condensação. Ø Curva C: Faz a separação das fases sólida e líquida, ou seja, é a curva de solidificação ou fusão. Ø Pt : É um ponto importante no gráfico chamado de ponto tríplice (Pt), onde nesse ponto a substância pode ser encontrada nas 3 fases da matéria (sólido, líquido, vapor).

DIAGRAMA DE FASES Ø Nota-se também que no gráfico existe uma temperatura (Tc), que chamamos de temperatura crítica. Nota-se que abaixo dessa temperatura a substância pode existir nas fases sólida, líquida e vapor, acima dessa temperatura não importa a pressão que a substância esteja ela não pode mais ser encontrada na nestas fases. Dessa forma, podemos diferenciar gás de vapor: Ø Gás: É a fase gasosa onde a substância encontra-se acima da temperatura crítica, uma variação de pressão não irá mudar a fases da substância. Ø Vapor: É fase gasosa onde a substância encontra-se abaixo da temperatura crítica, uma variação de pressão muda a fase desta substância.

DIAGRAMA DE FASES Exceções Ø Algumas substâncias apresentam uma pequena diferença do diagrama visto anteriormente, são elas : água, ferro, bismuto, antimônio e prata.

DIAGRAMA DE FASES Ø As diferenças são basicamente a curva C. Ø Nas exceções uma variação de pressão pode mudar a fase da substância quando comparado com o diagramas das “Não exceções”. Ø As exceções tem seus volumes diminuídos na fusão.

EXEMPLOS 1) Determine o número de mols de um gás que ocupa volume de 90 L. Este gás esta a uma pressão de 2 atm e a uma temperatura de 100 K (Dado R = 0, 082 atm. L/ mol. K) Resposta : 21, 95 mol

EXEMPLOS 2) (Mackenzie-SP) certa massa de um gás ideal sofre uma transformação na qual sua temperatura em graus Celsius é duplicada, a sua pressão é triplicada e seu volume é reduzido a metade. A temperatura do gás em seu estado inicial era de: a) 127 K b) 227 K c) 273 K d) 546 K e) 818 K Resposta : D
 N
N Fsica
Fsica Movimento uniformemente variado (muv)
Movimento uniformemente variado (muv) Division de la fisica clasica
Division de la fisica clasica Identicos
Identicos Fsica
Fsica Vaviao
Vaviao Reacciones estatica
Reacciones estatica Vector unitario de un vector
Vector unitario de un vector Fsica
Fsica Fsica
Fsica Fsica
Fsica Aceleracion relativa
Aceleracion relativa Fisica 2
Fisica 2 Lógica
Lógica Fsica
Fsica Vetores fisica
Vetores fisica Fsica
Fsica Fsica
Fsica 4
4 Particula en movimiento
Particula en movimiento Aceleracion formula
Aceleracion formula Fsica
Fsica Unidades de medida
Unidades de medida Ptica ara
Ptica ara Nandu
Nandu Umanjenice na čić
Umanjenice na čić Razvoj golemih gmazova
Razvoj golemih gmazova



















































