FSICA E QUMICA A 10 A Lio n












- Slides: 15

FÍSICA E QUÍMICA A 10º A

Lição nº Sumário: - Modelo quântico - Configuração eletrónica de outubro de 2011

§ Modelo quântico Evolução do modelo atómico: ü John Dalton, em 1808, propôs a teoria do modelo atómico, onde o átomo é uma minúscula esfera maciça, impenetrável, indestrutível e indivisível. Seu modelo atómico foi apelidado de “modelo atómico da bola de bilhar”. Todos os átomos de um mesmo elemento químico são idênticos: - Átomos de elementos diferentes possuem propriedades diferentes entre si. -Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável. Nas reações químicas, os átomos permanecem inalterados. Na formação dos compostos, os átomos entram em proporções numéricas fixas 1: 1, 1: 2, 1: 3, 2: 5 etc.

ü Em 1897, Joseph John Thomson formulou uma teoria segundo a qual o átomo era como uma esfera de carga positiva que continha corpúsculos (eletrões) de carga negativa distribuídos uniformemente à semelhança de um pudim de passas. O "modelo atómico do pudim com passas", substituiu então ao "modelo da bola de bilhar", mas não eliminou totalmente as deduções de Dalton, apenas foram acrescentadas mais informações.

ü Ernest Rutherford, em 1911, comprovou que o átomo era constituído por um núcleo, de carga positiva (onde se localizava quase toda a massa do átomo), em torno do qual se distribuíam os eletrões de carga negativa. Dada a semelhança com o modelo do sistema solar, este modelo ficou conhecido por modelo planetário.

ü Em 1920, Niels Bohr os eletrões não se encontravam em qualquer posição: movimentavam-se à volta do núcleo em órbitas circulares, fixas e definidas. Bohr definiu também o número de eletrões presentes em cada camada e mostrou que apenas algumas órbitas seriam possíveis, correspondendo cada uma delas a um nível bem definido de energia. Descobriu ainda que as propriedades químicas dos elementos eram determinadas pela camada mais externa.

O modelo atual aceite é o da nuvem eletrónica, onde não se representam as trajetórias (orbitas), já que não são conhecidas, mas as zonas onde há maior probabilidade de encontrar os eletrões (orbitais). A ideia de órbita eletrónica acabou por ficar desconexa, sendo substituída pelo conceito de orbital - determinada região do espaço onde há maior probabilidade de se encontrar um dado eletrão num instante qualquer. É sabido que os eletrões possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atómico. O núcleo atómico é situado no centro do átomo e constituído por protões que são partículas de carga positiva, cuja massa é aproximadamente 1. 837 vezes superior a massa do eletrão, e por neutrões, partículas sem carga e com massa ligeiramente superior à dos protões. O átomo é eletricamente neutro, por possuir números iguais de eletrões e protões.

Números quânticos ü Caracterização das orbitais: • Número quântico principal (n) – relaciona-se com a energia e o tamanho da orbital (o tamanho da energia é tanto maior quanto maior for o valor de n). n = 1, 2, 3, … n=1 n=2 n=3

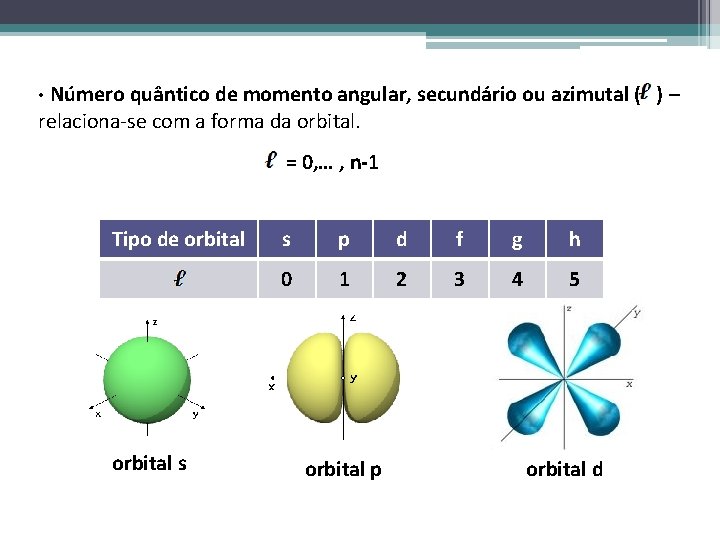
• Número quântico de momento angular, secundário ou azimutal ( ) – relaciona-se com a forma da orbital. = 0, … , n-1 Tipo de orbital s s p d f g h 0 1 2 3 4 5 orbital p orbital d

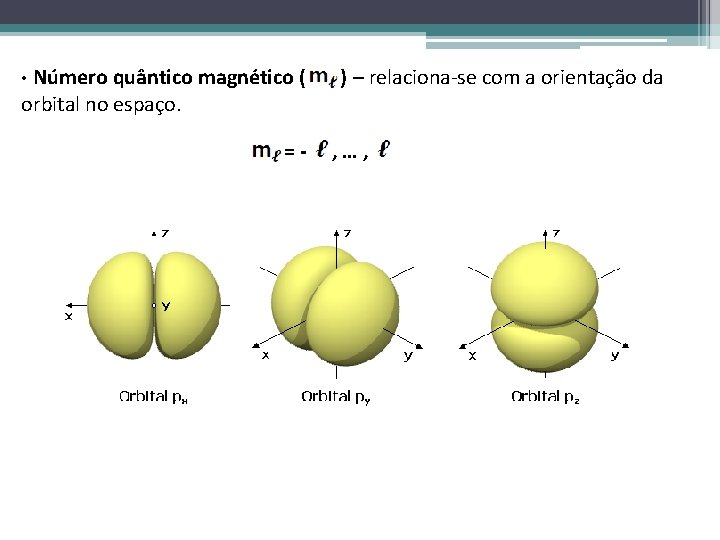
• Número quântico magnético ( orbital no espaço. =- ) – relaciona-se com a orientação da , …,

ü Caracterização do eletrão: • Número quântico de spin (ms) – relaciona-se com o sentido do movimento de rotação do eletrão sobre si próprio. Para caracterizar uma orbital são necessários três números quânticos: n, , Para caracterizar um eletrão são necessários quatro números quânticos: n, , , ms

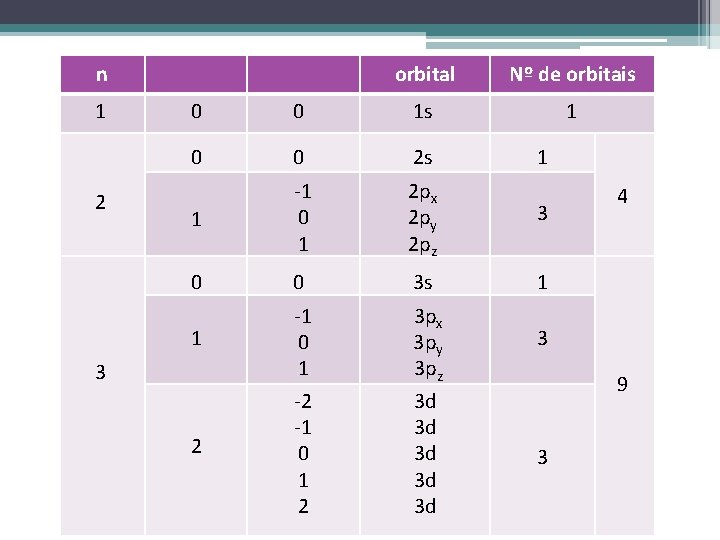
n 1 2 orbital Nº de orbitais 1 0 0 1 s 0 0 2 s 1 -1 0 1 2 px 2 py 2 pz 3 0 0 3 s 1 -1 0 1 -2 -1 0 1 2 3 px 3 py 3 pz 3 d 3 d 3 d 1 3 2 1 4 3 9 3


§ Configuração eletrónica A forma como os eletrões se distribuem nas orbitais dos átomos – configuração eletrónica – deve conferir ao átomo o estado de menor energia possível. Para isso deve obedecer ás seguintes regras e princípios: • Princípio de exclusão de Pauli: na mesma orbital não podem coexistir dois eletrões com o mesmo número quântico de spin. • Princípio de energia mínima: quando um átomo está no estado fundamental, os seus eletrões ocupam as orbitais disponíveis de menor energia. • Regra de Hund: no preenchimento das orbitais da mesma energia (orbitais degeneradas), distribui-se primeiro um eletrão por cada orbital, ficando todos com o mesmo spin, e só depois se completam com sipns opostos – emparelhamento.

1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d …