FSICA E QUMICA A 10 A Lio n




- Slides: 8

FÍSICA E QUÍMICA A 10º A

Lição nº de outubro de 2011 Sumário: Átomo de hidrogénio e estrutura atómica: - O espectro do átomo de hidrogénio - Quantização de energia

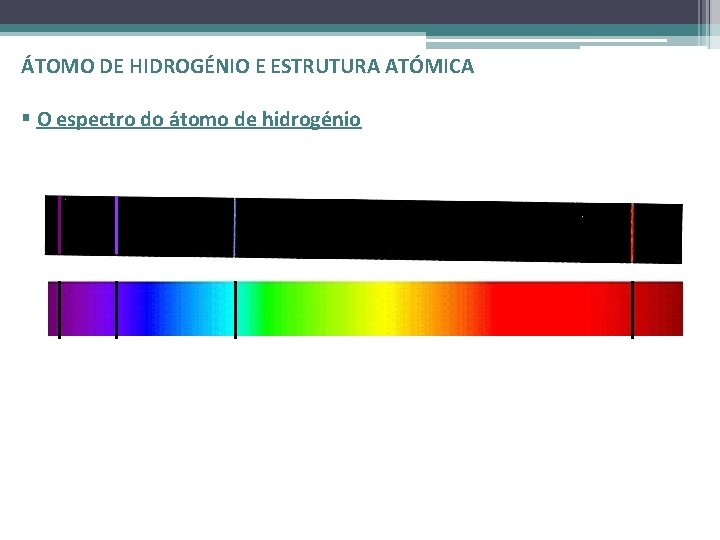
ÁTOMO DE HIDROGÉNIO E ESTRUTURA ATÓMICA § O espectro do átomo de hidrogénio

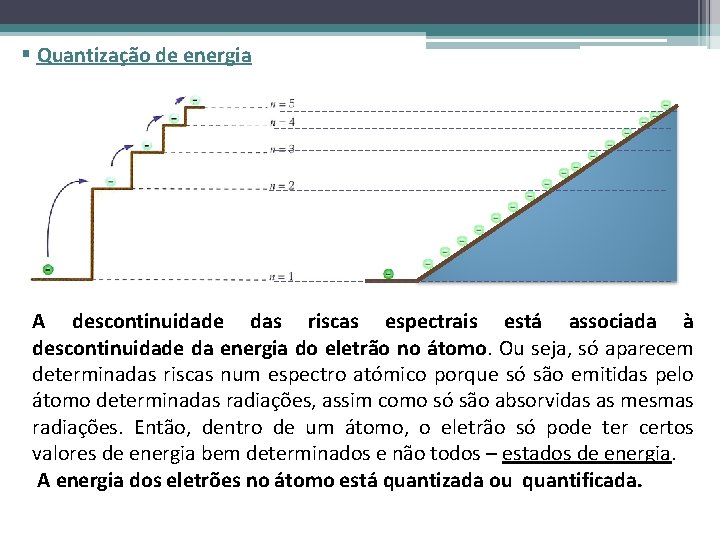
§ Quantização de energia A descontinuidade das riscas espectrais está associada à descontinuidade da energia do eletrão no átomo. Ou seja, só aparecem determinadas riscas num espectro atómico porque só são emitidas pelo átomo determinadas radiações, assim como só são absorvidas as mesmas radiações. Então, dentro de um átomo, o eletrão só pode ter certos valores de energia bem determinados e não todos – estados de energia. A energia dos eletrões no átomo está quantizada ou quantificada.

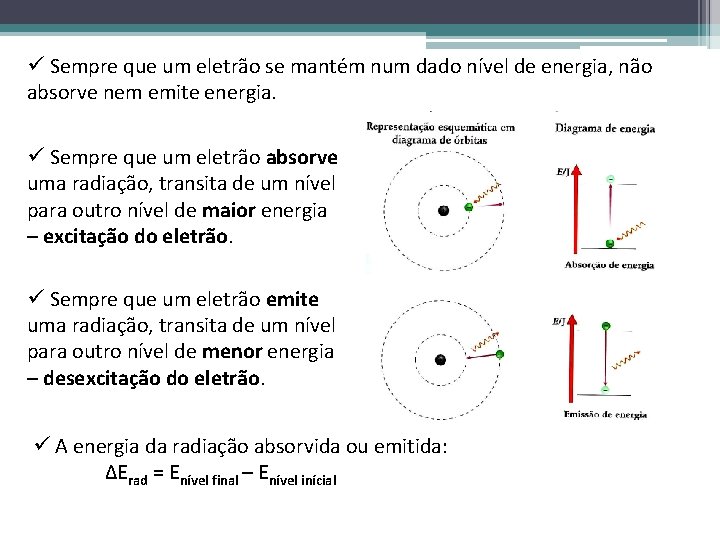
ü Sempre que um eletrão se mantém num dado nível de energia, não absorve nem emite energia. ü Sempre que um eletrão absorve uma radiação, transita de um nível para outro nível de maior energia – excitação do eletrão. ü Sempre que um eletrão emite uma radiação, transita de um nível para outro nível de menor energia – desexcitação do eletrão. ü A energia da radiação absorvida ou emitida: ∆Erad = Enível final – Enível inícial

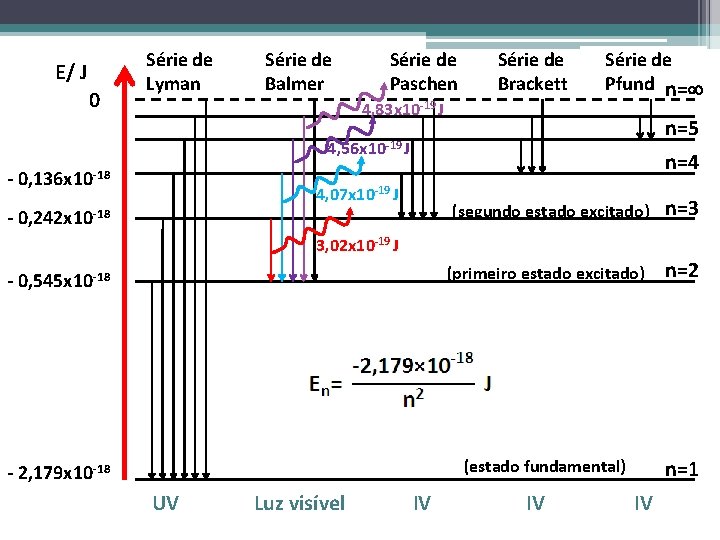
E/ J 0 Série de Lyman Série de Balmer Série de Paschen Série de Brackett 4, 83 x 10 -19 J Série de Pfund n= n=5 4, 56 x 10 -19 J - 0, 136 x 10 -18 n=4 4, 07 x 10 -19 J (segundo estado excitado) n=3 - 0, 545 x 10 -18 (primeiro estado excitado) n=2 - 2, 179 x 10 -18 (estado fundamental) n=1 - 0, 242 x 10 -18 3, 02 x 10 -19 J UV Luz visível IV IV IV

h = 6, 626 x 10 -34 J. s (Constante de Planck) c = 3 x 108 m/s (velocidade da luz no vazio) - comprimento de onda da radiação E = 3, 02 x 10 -19 J = 658 x 10 -9 m = 658 nm E = 4, 07 x 10 -19 J = 488 x 10 -9 m = 488 nm E = 4, 56 x 10 -19 J = 436 x 10 -9 m = 436 nm E = 4, 83 x 10 -19 J = 412 x 10 -9 m = 412 nm

Séries espectrais do átomo de hidrogénio: ü Série de Lyman: transições dos eletrões de estados excitados, n>1, para o estado fundamental (n=1) que envolvem radiações da gama dos ultravioleta. ü Série de Balmer: transições dos eletrões de estados excitados, n>2, para n=2 que envolvem radiações da gama da luz visível. ü Série de Paschen: transições dos eletrões de estados excitados, n>3, para n=3 que envolvem radiações da gama dos infravermelhos. ü Série de Brackett e Pfund: transições dos eletrões de estados excitados para os níveis 4 e 5, respetivamente, que envolvem radiações da gama dos infravermelhos.