Fruchtester Quelle klimasuchtschutz de Quelle gomeal de Ester


![Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Eine Veresterung, die durch Protonen katalysiert Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Eine Veresterung, die durch Protonen katalysiert](https://slidetodoc.com/presentation_image_h/ea2d6e80dd72aa22cdc5b18cfdd99972/image-4.jpg)
![Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Der Katalysator H+ beschleunigt nicht nur Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Der Katalysator H+ beschleunigt nicht nur](https://slidetodoc.com/presentation_image_h/ea2d6e80dd72aa22cdc5b18cfdd99972/image-5.jpg)
















- Slides: 40

Fruchtester Quelle: klima-sucht-schutz. de Quelle: gomeal. de Ester gehören zu den charakteristischen Duftkomponenten von Früchten. Auf welchem Reaktionsweg kann ein Ester synthetisiert werden?

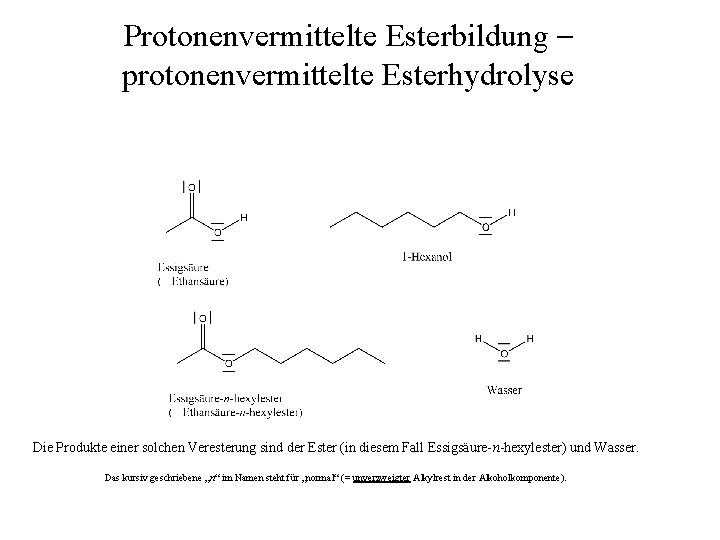
Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse Die Reaktanden bei einer Veresterung sind eine Carbonsäure und ein Alkohol. In diesem Beispiel lassen wir Essigsäure (offiziell Ethansäure genannt) und 1 -Hexanol miteinander reagieren.

Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse Die Produkte einer solchen Veresterung sind der Ester (in diesem Fall Essigsäure-n-hexylester) und Wasser. Das kursiv geschriebene „n“ im Namen steht für „normal“ (= unverzweigter Alkylrest in der Alkoholkomponente).
![Protonenvermittelte Esterbildung protonenvermittelte Esterhydrolyse H Eine Veresterung die durch Protonen katalysiert Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Eine Veresterung, die durch Protonen katalysiert](https://slidetodoc.com/presentation_image_h/ea2d6e80dd72aa22cdc5b18cfdd99972/image-4.jpg)
Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Eine Veresterung, die durch Protonen katalysiert wird (eine solche protonenvermittelte Esterbildung wird auch als säurekatalysierte Veresterung bezeichnet) ist immer eine Gleichgewichtsreaktion!
![Protonenvermittelte Esterbildung protonenvermittelte Esterhydrolyse H Der Katalysator H beschleunigt nicht nur Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Der Katalysator H+ beschleunigt nicht nur](https://slidetodoc.com/presentation_image_h/ea2d6e80dd72aa22cdc5b18cfdd99972/image-5.jpg)
Protonenvermittelte Esterbildung – protonenvermittelte Esterhydrolyse [ H+ ] Der Katalysator H+ beschleunigt nicht nur die Synthese des Esters aus der Carbonsäure und dem Alkohol – er beschleunigt auch die Spaltung des Esters durch Einwirkung des zweiten Produkts, nämlich des Wassers [ protonenvermittelte (= säurekatalysierte) Esterhydrolyse].

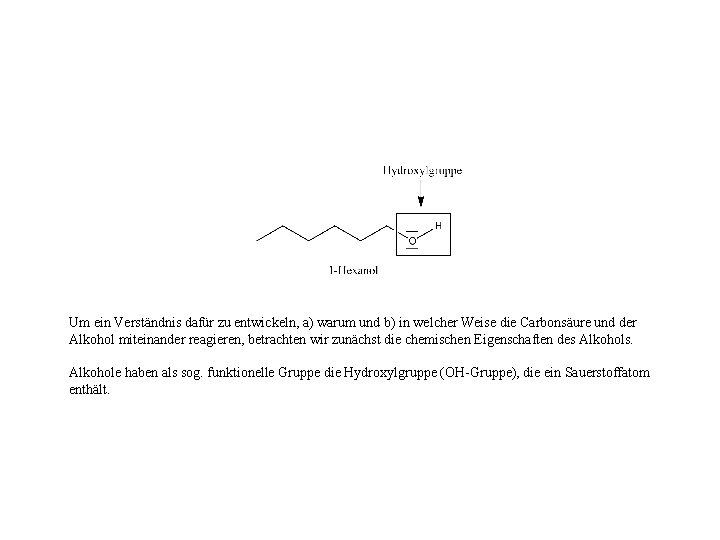
Um ein Verständnis dafür zu entwickeln, a) warum und b) in welcher Weise die Carbonsäure und der Alkohol miteinander reagieren, betrachten wir zunächst die chemischen Eigenschaften des Alkohols. Alkohole haben als sog. funktionelle Gruppe die Hydroxylgruppe (OH-Gruppe), die ein Sauerstoffatom enthält.

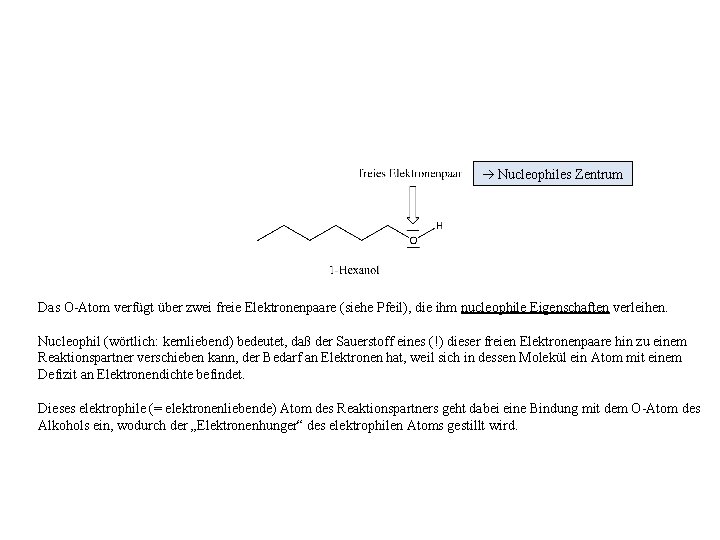
Nucleophiles Zentrum Das O-Atom verfügt über zwei freie Elektronenpaare (siehe Pfeil), die ihm nucleophile Eigenschaften verleihen. Nucleophil (wörtlich: kernliebend) bedeutet, daß der Sauerstoff eines (!) dieser freien Elektronenpaare hin zu einem Reaktionspartner verschieben kann, der Bedarf an Elektronen hat, weil sich in dessen Molekül ein Atom mit einem Defizit an Elektronendichte befindet. Dieses elektrophile (= elektronenliebende) Atom des Reaktionspartners geht dabei eine Bindung mit dem O-Atom des Alkohols ein, wodurch der „Elektronenhunger“ des elektrophilen Atoms gestillt wird.

Der Reaktionspartner für das 1 -Hexanol ist in unserem Beispiel die Essigsäure. Ihre funktionelle Gruppe ist wie bei allen Carbonsäuren die Carboxylgruppe (COOH-Gruppe).

Zum Verständnis der Reaktionen der Carbonsäure betrachten wir die Eigenschaften ihrer Elektronenpaare etwas näher. Genau wie beim Alkohol werden die Kerne der einzelnen Atome durch sog. σ-Bindungen zusammengehalten (siehe Pfeile in der obigen Abbildung).

Das Carboxyl-C-Atom bildet mit einem der O-Atome eine C=O-Doppelbindung aus, d. h. die σ-Bindung zwischen den Atomkernen wird durch eine zusätzliche π –Bindung ergänzt. Deren Elektronenpaar dient im Gegensatz zum Elektronenpaar der σ-Bindung nicht zwingend zum Zusammenhalt zweier Atomkerne und kann somit, wenn dies in einer chemischen Reaktion erforderlich ist, zum elektronegativeren Nachbaratom (in diesem Fall dem O-Atom) hin verschoben werden, ohne daß die Bindung zwischen den Kernen der Atome gebrochen wird.

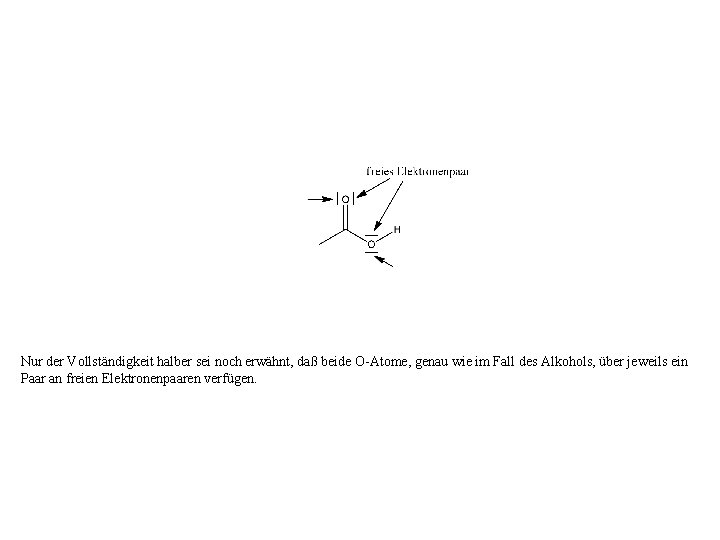
Nur der Vollständigkeit halber sei noch erwähnt, daß beide O-Atome, genau wie im Fall des Alkohols, über jeweils ein Paar an freien Elektronenpaaren verfügen.

Das Elektronenpaar, welches die π –Bindung ausmacht, wird deshalb im Bedarfsfall zum O-Atom hin verschoben und nicht zum C-Atom, weil das Sauerstoffatom in seinem Kern eine höhere Ladungsdichte hat als das Kohlenstoffatom. Deshalb werden die Bindungselektronen stärker zum O-Atom hin verschoben. Man spricht in diesem Fall davon, daß O elektronegativer ist als C. Die Elektronegativitätswerte nach einer von Linus Pauling entwickelten Skala für C (2, 5) und O (3, 5) sind in der obigen Abbildung angegeben.

Die Verschiebung der Bindungselektronen hin zum elektronegativeren Bindungspartner kann, wie hier gezeigt, durch entsprechende Pfeile in den Bindungen wiedergegeben werden.

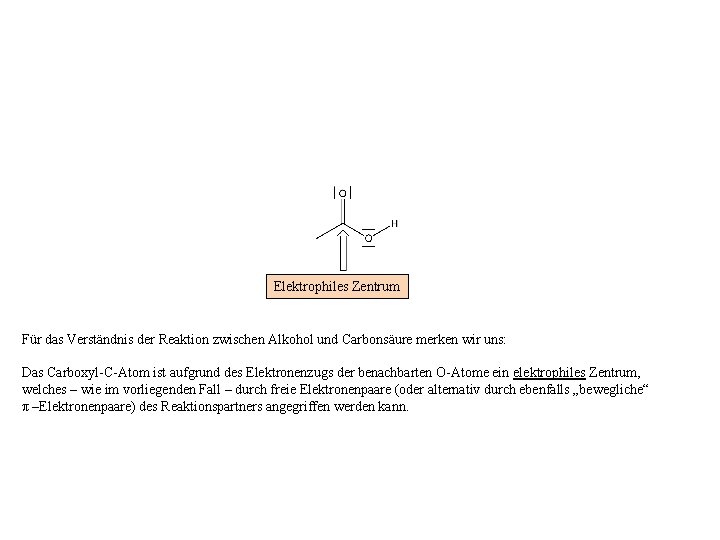
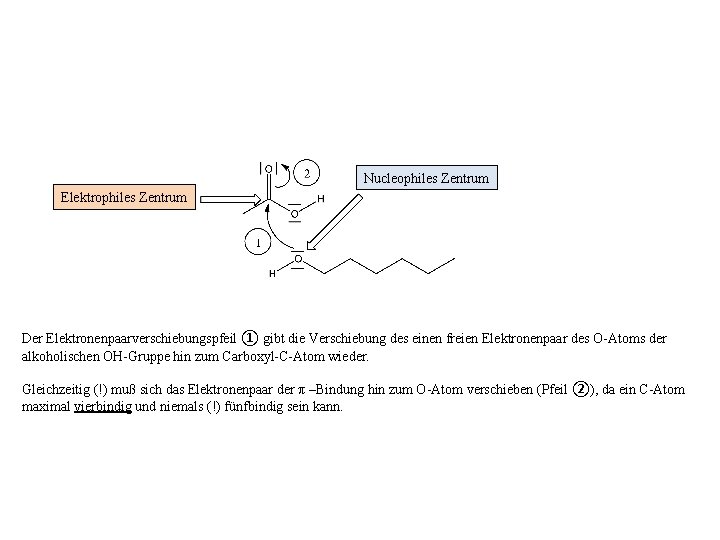
Elektrophiles Zentrum Für das Verständnis der Reaktion zwischen Alkohol und Carbonsäure merken wir uns: Das Carboxyl-C-Atom ist aufgrund des Elektronenzugs der benachbarten O-Atome ein elektrophiles Zentrum, welches – wie im vorliegenden Fall – durch freie Elektronenpaare (oder alternativ durch ebenfalls „bewegliche“ π –Elektronenpaare) des Reaktionspartners angegriffen werden kann.

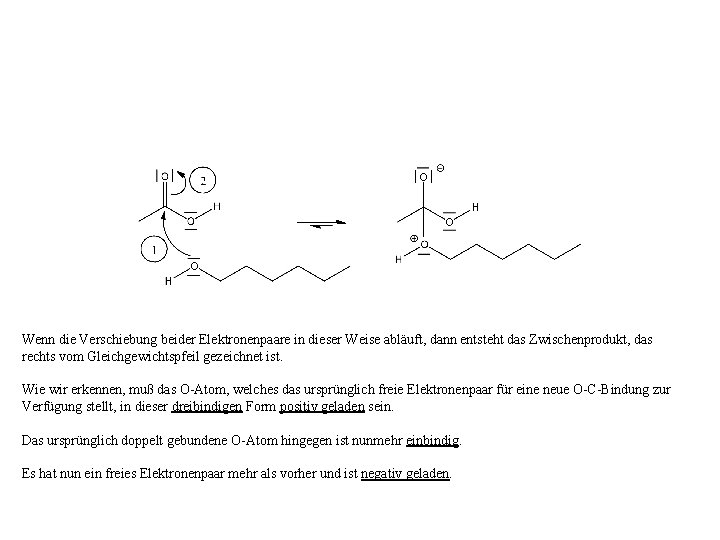
Nucleophiles Zentrum Elektrophiles Zentrum Der Elektronenpaarverschiebungspfeil ① gibt die Verschiebung des einen freien Elektronenpaar des O-Atoms der alkoholischen OH-Gruppe hin zum Carboxyl-C-Atom wieder. Gleichzeitig (!) muß sich das Elektronenpaar der π –Bindung hin zum O-Atom verschieben (Pfeil ②), da ein C-Atom maximal vierbindig und niemals (!) fünfbindig sein kann.

Wenn die Verschiebung beider Elektronenpaare in dieser Weise abläuft, dann entsteht das Zwischenprodukt, das rechts vom Gleichgewichtspfeil gezeichnet ist. Wie wir erkennen, muß das O-Atom, welches das ursprünglich freie Elektronenpaar für eine neue O-C-Bindung zur Verfügung stellt, in dieser dreibindigen Form positiv geladen sein. Das ursprünglich doppelt gebundene O-Atom hingegen ist nunmehr einbindig. Es hat nun ein freies Elektronenpaar mehr als vorher und ist negativ geladen.

Die hier abgebildete Reaktionsschritt würde in der Tat so ablaufen, wenn wir ein Äquivalent Carbonsäure mit einem Äquivalent Alkohol im Reaktionskolben mischen. Die Sache hätte nur einen Nachteil: Dieser Reaktionsschritt und alle folgenden Schritte bis hin zum Carbonsäureester würden sehr viel Zeit in Anspruch nehmen! Damit die Einstellung des Reaktionsgleichgewichts in einem vernünftigen Zeitrahmen abläuft, muß die Reaktion beschleunigt werden.

Zu diesem Zweck kommt die in der Regel zugesetzte konzentrierte Schwefelsäure H 2 SO 4 ins Spiel. Sie dient, wie alle Mineralsäuren, als Protonenlieferant. Wir könnten für unsere Zwecke also ebenso gut konzentrierte Phosphorsäure H 3 PO 4 oder konzentrierte Salzsäure HCl einsetzen.

Das von der Schwefelsäure abgegebene Proton wird – in einer Gleichgewichtsreaktion – vom doppelt gebundenen O -Atom der Essigsäure aufgenommen. Die protonierte Essigsäure ist gegenüber dem nucleophilen Angriff der OH-Gruppe des Alkohols reaktionsfreudiger. Dieser Reaktionsschritt läuft also rascher ab als der entsprechende Angriff auf die nicht protonierte Essigsäure.

Quelle: wikimedia http: //upload. wikimedia. org/wikipedia/commons/e/ef/Bergsattel. jpg Der Reaktionsschritt wird dadurch beschleunigt, indem er über einen anderen Reaktionsweg hin zum Produkt geleitet wird. Ein anschaulicher Vergleich soll dies verdeutlichen: Wir stellen uns die obige Abbildung nicht als einen Längsschnitt durch die Alpen von Ost nach West vor. Wir als Betrachter befinden uns also im Allgäu, und hinter der Tafel- bzw. Monitorebene liegt Südtirol. Das Ziel ist, die Südtiroler Weinstraße hinter dem durch die Berge A, B und C gebildeten Gebirgskamm mittels einer Alpenüberquerung mit dem Fahrrad zu erreichen.

Quelle: wikimedia http: //upload. wikimedia. org/wikipedia/commons/e/ef/Bergsattel. jpg Ein Radfahrer steht nun vor der Wahl, die klassische Straßenroute (rechts) über den Sattel zwischen B und C zu befahren oder einen neu eröffneten Weg entlang zu radeln, der über den Sattel zwischen A und B führt. Der neue Sattel zwischen A und B ist eindeutig niedriger gelegen und der Weg über ihn mit weniger Aufwand zu bewältigen. Jeder Radfahrer, der Kräfte sparen will, wird daher den neuen Weg über den niedriger gelegenen Sattel wählen. Dieses „Eröffnen“ neuer, weniger energieaufwendiger und somit rascher zu überwindender Wege für Reaktanden ist in der Welt der Chemie die Aufgabe eines Katalysators.

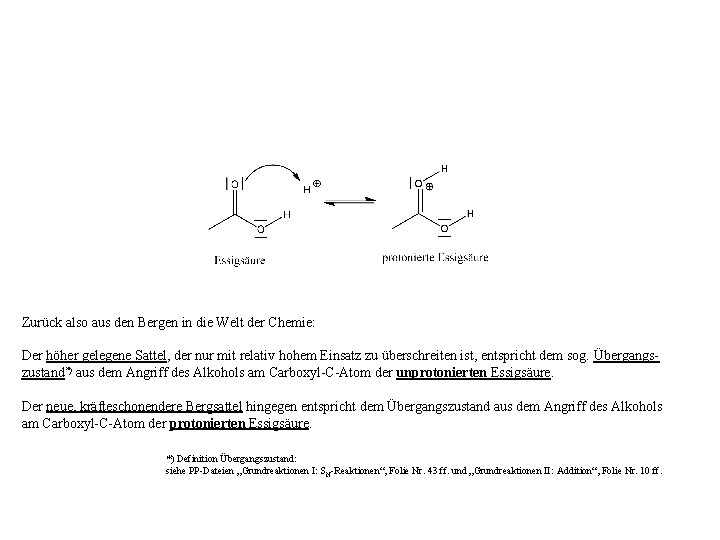
Zurück also aus den Bergen in die Welt der Chemie: Der höher gelegene Sattel, der nur mit relativ hohem Einsatz zu überschreiten ist, entspricht dem sog. Übergangszustand*) aus dem Angriff des Alkohols am Carboxyl-C-Atom der unprotonierten Essigsäure. Der neue, kräfteschonendere Bergsattel hingegen entspricht dem Übergangszustand aus dem Angriff des Alkohols am Carboxyl-C-Atom der protonierten Essigsäure. *) Definition Übergangszustand: siehe PP-Dateien „Grundreaktionen I: S N-Reaktionen“, Folie Nr. 43 ff. und „Grundreaktionen II: Addition“, Folie Nr. 10 ff.

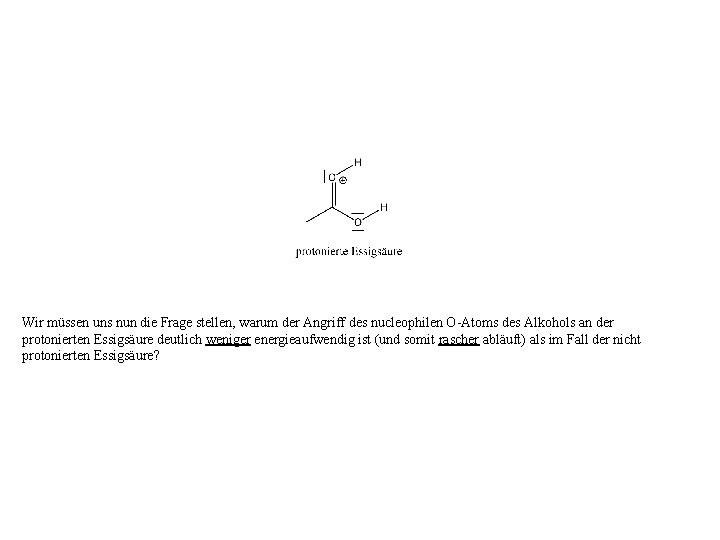
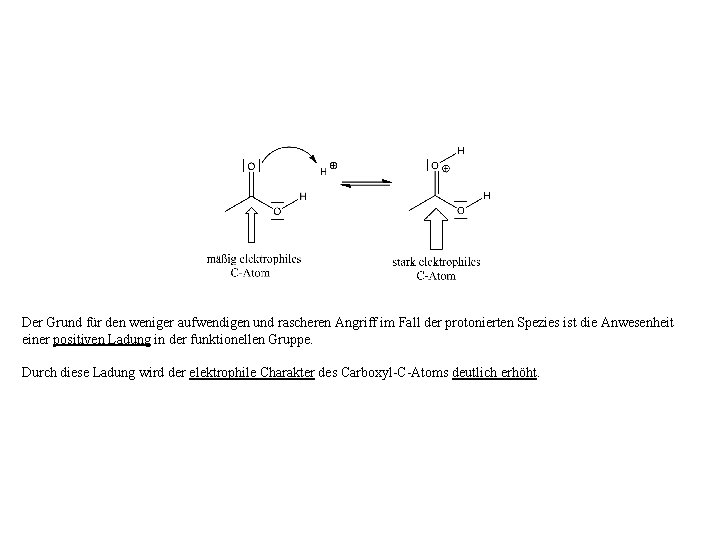
Wir müssen uns nun die Frage stellen, warum der Angriff des nucleophilen O-Atoms des Alkohols an der protonierten Essigsäure deutlich weniger energieaufwendig ist (und somit rascher abläuft) als im Fall der nicht protonierten Essigsäure?

Der Grund für den weniger aufwendigen und rascheren Angriff im Fall der protonierten Spezies ist die Anwesenheit einer positiven Ladung in der funktionellen Gruppe. Durch diese Ladung wird der elektrophile Charakter des Carboxyl-C-Atoms deutlich erhöht.

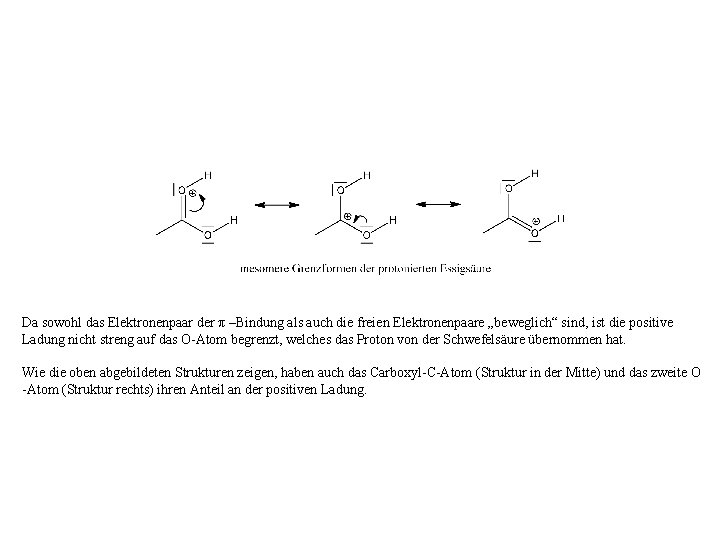
Da sowohl das Elektronenpaar der π –Bindung als auch die freien Elektronenpaare „beweglich“ sind, ist die positive Ladung nicht streng auf das O-Atom begrenzt, welches das Proton von der Schwefelsäure übernommen hat. Wie die oben abgebildeten Strukturen zeigen, haben auch das Carboxyl-C-Atom (Struktur in der Mitte) und das zweite O -Atom (Struktur rechts) ihren Anteil an der positiven Ladung.

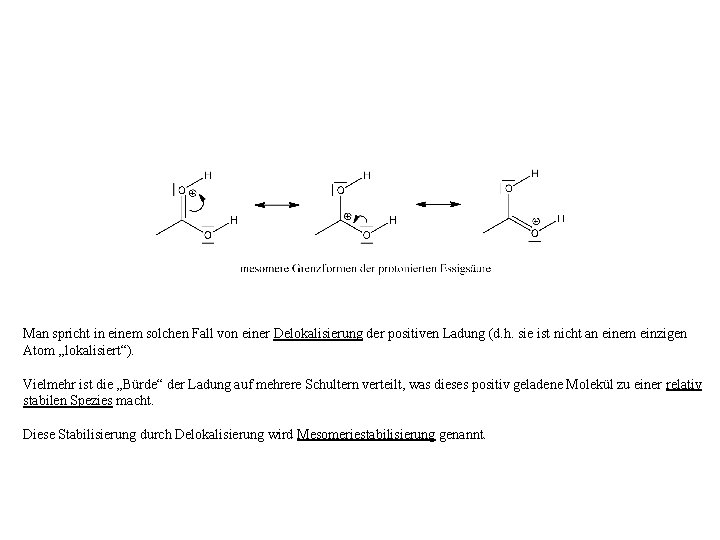
Man spricht in einem solchen Fall von einer Delokalisierung der positiven Ladung (d. h. sie ist nicht an einem einzigen Atom „lokalisiert“). Vielmehr ist die „Bürde“ der Ladung auf mehrere Schultern verteilt, was dieses positiv geladene Molekül zu einer relativ stabilen Spezies macht. Diese Stabilisierung durch Delokalisierung wird Mesomeriestabilisierung genannt.

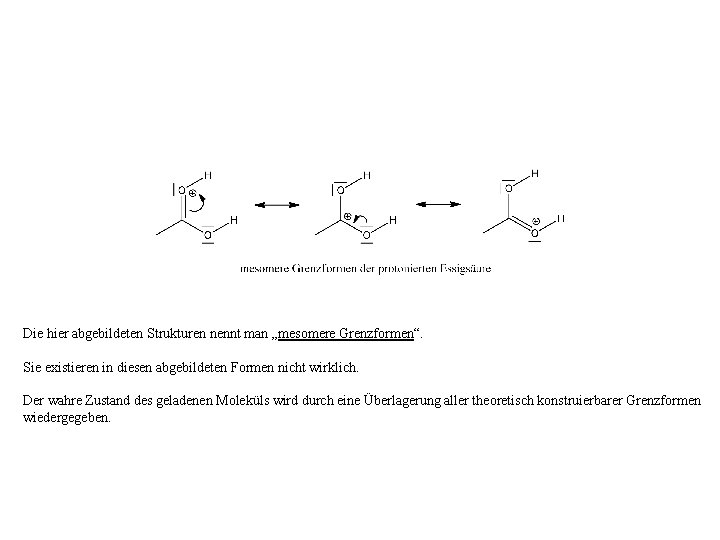
Die hier abgebildeten Strukturen nennt man „mesomere Grenzformen“. Sie existieren in diesen abgebildeten Formen nicht wirklich. Der wahre Zustand des geladenen Moleküls wird durch eine Überlagerung aller theoretisch konstruierbarer Grenzformen wiedergegeben.

Diese Überlagerung aller drei Grenzformen würde zu der oben abgebildeten Struktur führen, in der die Delokalisierung mit gestrichelt gezeichneten Bindungen und die gleichmäßige Verteilung der positiven Ladung durch eine geschweifte Klammer wiedergegeben wird. Diese Darstellung entspricht allerdings nicht der von Lewis entwickelten Schreibweise, die keine gestrichelten Bindungen vorsieht. Lewis gab vielmehr vor, daß Elektronenpaare mit (durchgehend gezeichneten) Strichen wiedergegeben werden.

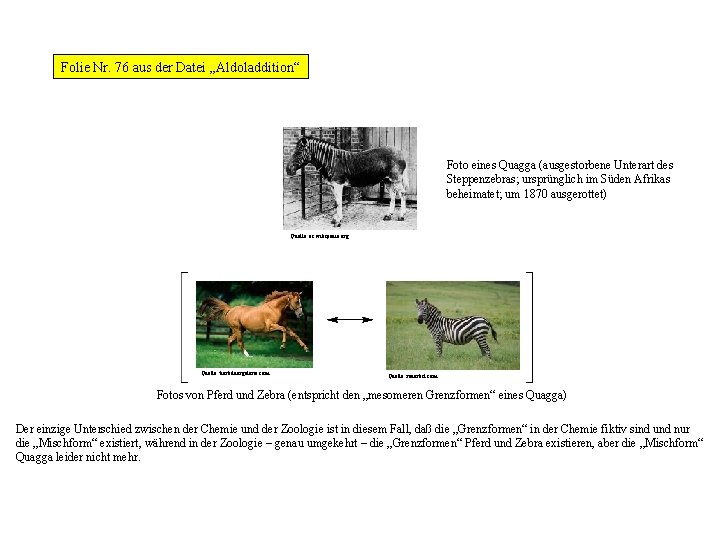
Folie Nr. 75 aus der Datei „Aldoladdition“ Foto eines Quagga (ausgestorbene Unterart des Steppenzebras; ursprünglich im Süden Afrikas beheimatet; um 1870 ausgerottet) Quelle: es. wikipedia. org Quelle: tierbildergalerie. com Quelle: redorbit. com Fotos von Pferd und Zebra (entspricht den „mesomeren Grenzformen“ eines Quagga) Analog dazu könnte man zur Beschreibung eines Quagga (siehe oberes Foto) das Foto eines Pferds und das Foto eines Zebras vorlegen und erklären, daß das, was man wiedergeben möchte (nämlich wie ein Quagga ausgesehen hat), zwischen diesen beiden „Grenzformen“ des Pferds und des Zebras liegt.

Folie Nr. 76 aus der Datei „Aldoladdition“ Foto eines Quagga (ausgestorbene Unterart des Steppenzebras; ursprünglich im Süden Afrikas beheimatet; um 1870 ausgerottet) Quelle: es. wikipedia. org Quelle: tierbildergalerie. com Quelle: redorbit. com Fotos von Pferd und Zebra (entspricht den „mesomeren Grenzformen“ eines Quagga) Der einzige Unterschied zwischen der Chemie und der Zoologie ist in diesem Fall, daß die „Grenzformen“ in der Chemie fiktiv sind und nur die „Mischform“ existiert, während in der Zoologie – genau umgekehrt – die „Grenzformen“ Pferd und Zebra existieren, aber die „Mischform“ Quagga leider nicht mehr.

Um die protonierte Essigsäure als Struktur zu formulieren, wählt man sinnvollerweise eine der drei Grenzstrukturen gemäß der Lewis-Schreibweise aus. Man muß sich aber stets darüber im Klaren sein, daß dies nur eine Grenzform ist, welche die tatsächlich vorliegenden elektronischen Verhältnisse nicht vollständig wiedergibt.

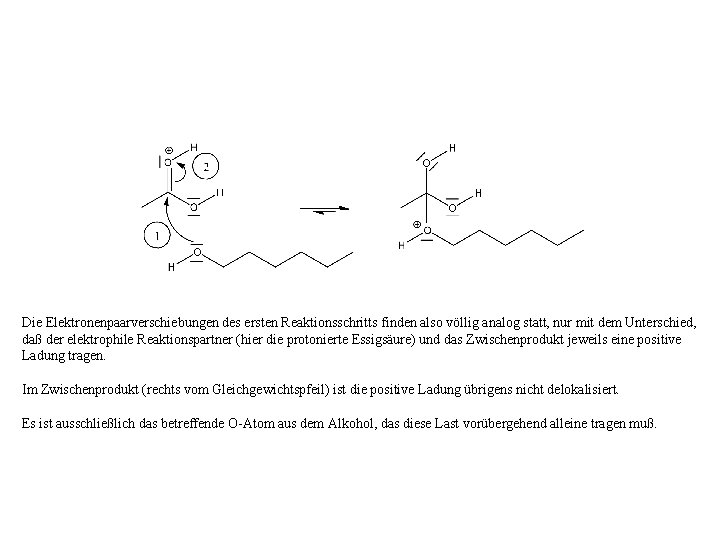
Die Elektronenpaarverschiebungen des ersten Reaktionsschritts finden also völlig analog statt, nur mit dem Unterschied, daß der elektrophile Reaktionspartner (hier die protonierte Essigsäure) und das Zwischenprodukt jeweils eine positive Ladung tragen. Im Zwischenprodukt (rechts vom Gleichgewichtspfeil) ist die positive Ladung übrigens nicht delokalisiert. Es ist ausschließlich das betreffende O-Atom aus dem Alkohol, das diese Last vorübergehend alleine tragen muß.

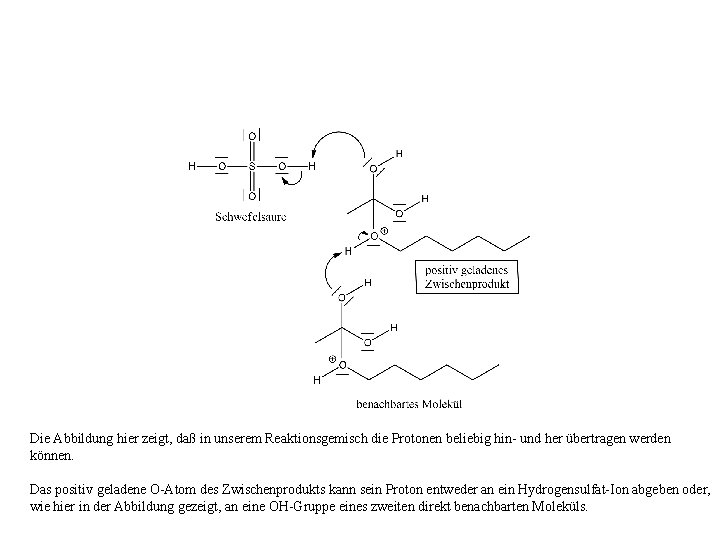
Die Abbildung hier zeigt, daß in unserem Reaktionsgemisch die Protonen beliebig hin- und her übertragen werden können. Das positiv geladene O-Atom des Zwischenprodukts kann sein Proton entweder an ein Hydrogensulfat-Ion abgeben oder, wie hier in der Abbildung gezeigt, an eine OH-Gruppe eines zweiten direkt benachbarten Moleküls.

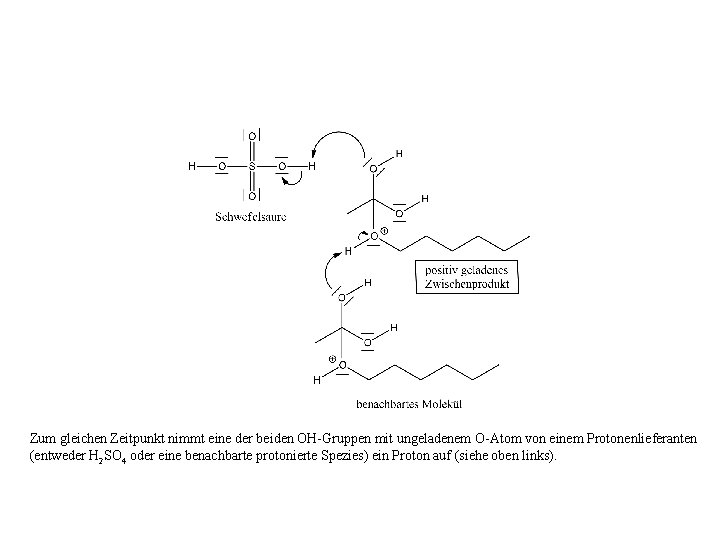
Zum gleichen Zeitpunkt nimmt eine der beiden OH-Gruppen mit ungeladenem O-Atom von einem Protonenlieferanten (entweder H 2 SO 4 oder eine benachbarte protonierte Spezies) ein Proton auf (siehe oben links).

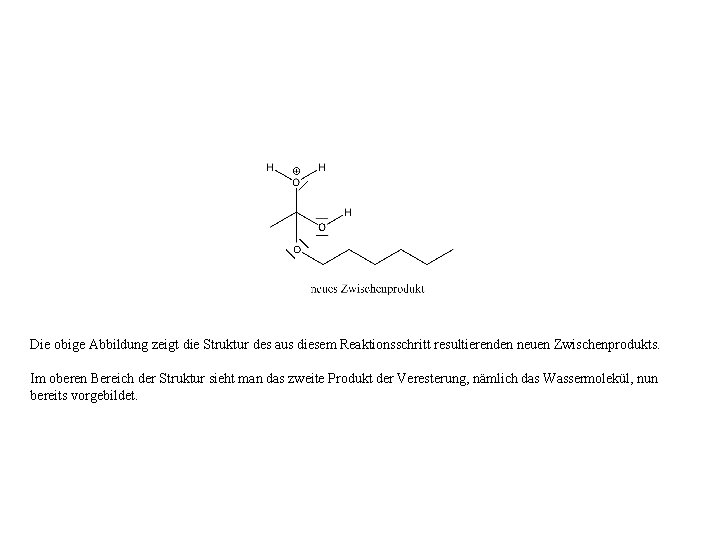
Die obige Abbildung zeigt die Struktur des aus diesem Reaktionsschritt resultierenden neuen Zwischenprodukts. Im oberen Bereich der Struktur sieht man das zweite Produkt der Veresterung, nämlich das Wassermolekül, nun bereits vorgebildet.

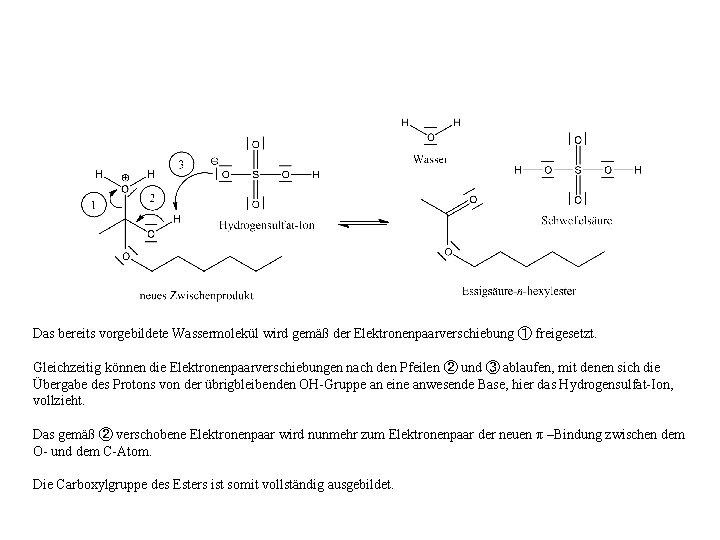
Das bereits vorgebildete Wassermolekül wird gemäß der Elektronenpaarverschiebung ① freigesetzt. Gleichzeitig können die Elektronenpaarverschiebungen nach den Pfeilen ② und ③ ablaufen, mit denen sich die Übergabe des Protons von der übrigbleibenden OH-Gruppe an eine anwesende Base, hier das Hydrogensulfat-Ion, vollzieht. Das gemäß ② verschobene Elektronenpaar wird nunmehr zum Elektronenpaar der neuen π –Bindung zwischen dem O- und dem C-Atom. Die Carboxylgruppe des Esters ist somit vollständig ausgebildet.

Die obige Gleichung gibt die Gesamtreaktion wieder. Beachten Sie den Gleichgewichtspfeil!! In der Rückreaktion wird der Ester also durch Zugabe von Wasser zur entsprechenden Säure und zum entsprechenden Alkohol aufgespalten. Eine solche Aufspaltung durch Wasser nennt man Hydrolyse (gr. : hydor = Wasser, lysis = Spaltung). Auch diese Rückreaktion (Esterhydrolyse) wird selbstverständlich durch Protonenzugabe katalysiert.

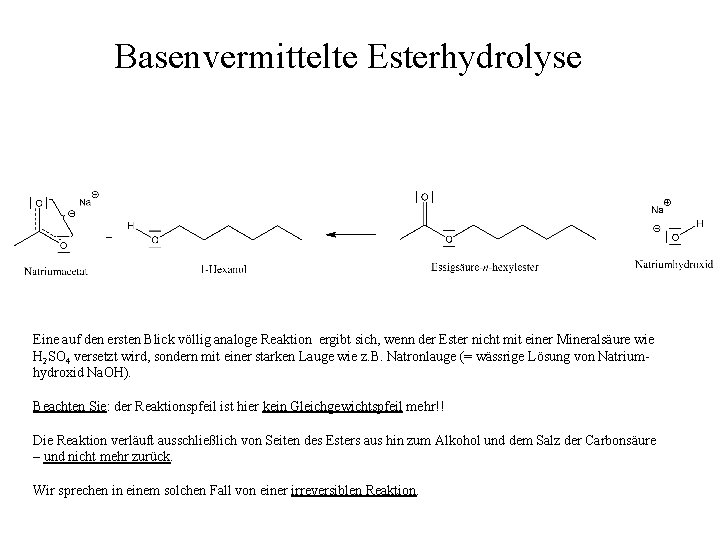
Basenvermittelte Esterhydrolyse Eine auf den ersten Blick völlig analoge Reaktion ergibt sich, wenn der Ester nicht mit einer Mineralsäure wie H 2 SO 4 versetzt wird, sondern mit einer starken Lauge wie z. B. Natronlauge (= wässrige Lösung von Natriumhydroxid Na. OH). Beachten Sie: der Reaktionspfeil ist hier kein Gleichgewichtspfeil mehr!! Die Reaktion verläuft ausschließlich von Seiten des Esters aus hin zum Alkohol und dem Salz der Carbonsäure – und nicht mehr zurück. Wir sprechen in einem solchen Fall von einer irreversiblen Reaktion.

Basenvermittelte Esterhydrolyse Eine Reaktion zwischen dem Salz einer Carbonsäure (hier: Natriumacetat) und einem Alkohol findet demnach nicht statt, wie die Abbildung zeigt. Der Grund für die „Weigerung“ des Natriumacetats, sich mit einem Alkohol wie 1 -Hexanol zu einem Ester zu verbinden, liegt in der absoluten Reaktionsträgheit des Acetat-Ions (bzw. ganz allgemein eines Carboxylat-Ions). Wir erinnern uns: Die Essigsäure selbst hat eine nur sehr geringe partiell positive Ladung am Carboxyl-C-Atom, so daß sie durch Zugabe von H+ protoniert werden muß, um für das nucleophile O-Atom der OH-Gruppe eines Alkohols attraktiv zu werden („attraktiv“ im elektronischen Sinne betrachtet).

Basenvermittelte Esterhydrolyse Carboxyl-C-Atom ohne jegliche positive Partialladung (= ohne jeglichen elektrophilen Charakter) Die deprotonierte Essigsäure – sprich: das Acetat-Ion – hat im Vergleich zur ohnehin nur schwach elektrophilen Carbonsäure überhaupt keinen elektrophilen Charakter am Carboxyl-C-Atom mehr aufzuweisen! Denn: Dieses Carboxyl-C-Atom liegt ja in dem Bereich, über den hinweg die negative Ladung des Anions delokalisiert wird (siehe geschweifte Klammer in der Abbildung). Für positive Partialladungen ist in diesem Bereich wirklich kein Platz mehr. Das O-Atom der OH-Gruppe des Alkohols hat daher nicht den geringsten Anreiz für einen nucleophilen Angriff an diesem C-Atom.
 Esterhydrolyse
Esterhydrolyse Pansement hydrocellulaire pour quelle plaie
Pansement hydrocellulaire pour quelle plaie Ester naamgeving
Ester naamgeving Esteres ejemplos
Esteres ejemplos Fellypressin
Fellypressin Etoksit
Etoksit Ethansäureanhydrid
Ethansäureanhydrid Acetoacetate synthesis
Acetoacetate synthesis Ester 2:21-23
Ester 2:21-23 Ether naming
Ether naming Mersiyeyi ester
Mersiyeyi ester Martin ester sfu
Martin ester sfu Versículo clave del libro de ester
Versículo clave del libro de ester Penamaan lemak
Penamaan lemak Cyclopentane amide
Cyclopentane amide Qualitative test for ester
Qualitative test for ester What are triglycerides
What are triglycerides Alcoholes grupo funcional
Alcoholes grupo funcional Propeenzuur structuurformule
Propeenzuur structuurformule Gugus fungsi adalah
Gugus fungsi adalah Functional isomers of carboxylic acid
Functional isomers of carboxylic acid Ester + lialh4
Ester + lialh4 Momentos en que dios cuida de su pueblo
Momentos en que dios cuida de su pueblo Fotos de la reina ester
Fotos de la reina ester Libro de ester capítulo 4
Libro de ester capítulo 4 Ester nlib
Ester nlib Ester hallo gracia snte dio
Ester hallo gracia snte dio Dna rna
Dna rna Alcohol and carboxylic acid reaction
Alcohol and carboxylic acid reaction Ester suffix
Ester suffix Propansäureethylester
Propansäureethylester Kyselina akrylova
Kyselina akrylova Nitrile functional group
Nitrile functional group Reakcja estryfikacji wzór ogólny
Reakcja estryfikacji wzór ogólny Carboxylic esters
Carboxylic esters Saponification value calculator
Saponification value calculator Ester di napoli
Ester di napoli Zora jandová ester mertová
Zora jandová ester mertová Ester di napoli
Ester di napoli Esther 4:13-17
Esther 4:13-17 Ester bond in fatty acids
Ester bond in fatty acids