Forum Morte Improvvisa stratificazione del rischio Nelle cardiopatie



































- Slides: 47

Forum Morte Improvvisa: stratificazione del rischio Nelle cardiopatie eredo-familiari Leonardo Di Ascenzo, MD, Ph. D U. O. C. Cardiologia del P. O. di San Donà di Piave (VE) – ULSS n. 10 “Veneto Orientale” Leonardo. Diascenzo@ulss 10. veneto. it

Indice degli argomenti 1. Definizione di Morte Improvvisa per il clinico 2. Le cardiopatie eredo-familiari definiamole l’albero genealogico le basi genetiche quando sospettarle la caratterizzazione clinico-fenotipica per porre diagnosi quali sono 3. La stratificazione del rischio di MI nei malati 4. Lo screening familiare: strumento di stratificazione del rischio di M. I. 5. Take Home Message di Leonardo Di Ascenzo, MD, Ph. D

1. Definizione di Morte Improvvisa per il clinico Morte naturale, preceduta da improvvisa perdita di coscienza, avvenuta entro 1 h (o 24 h) circa dall’inizio di eventuali sintomi. Viene considerata morte improvvisa anche la morte naturale: a - avvenuta in assenza di testimoni b - o per la quale non vi sia una diagnosi clinica e/o autoptica di certezza. di Leonardo Di Ascenzo

Indice degli argomenti 1. Definizione di Morte Improvvisa per il clinico 2. Le cardiopatie eredo-familiari definiamole l’albero genealogico le basi genetiche quando sospettarle la caratterizzazione clinico-fenotipica per porre diagnosi quali sono 3. La stratificazione del rischio di MI nei malati 4. Lo screening familiare: strumento di stratificazione del rischio di M. I. 5. Take Home Message di Leonardo Di Ascenzo, MD, Ph. D

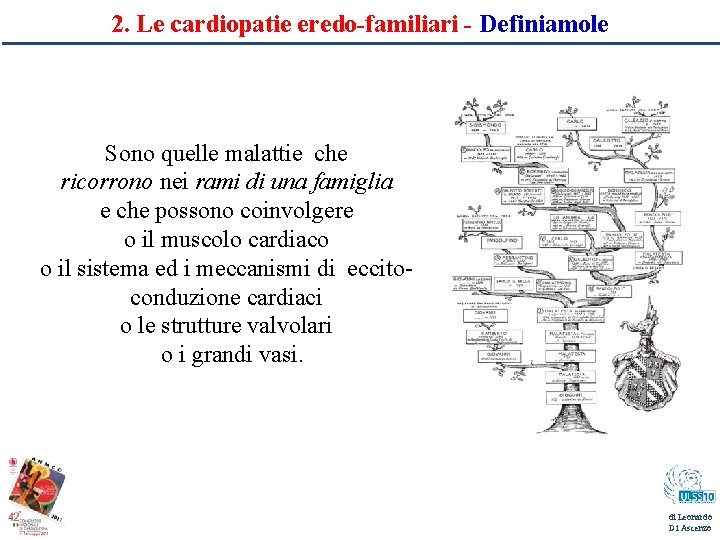
2. Le cardiopatie eredo-familiari - Definiamole Sono quelle malattie che ricorrono nei rami di una famiglia e che possono coinvolgere o il muscolo cardiaco o il sistema ed i meccanismi di eccitoconduzione cardiaci o le strutture valvolari o i grandi vasi. di Leonardo Di Ascenzo

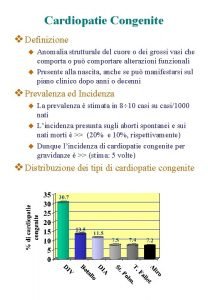
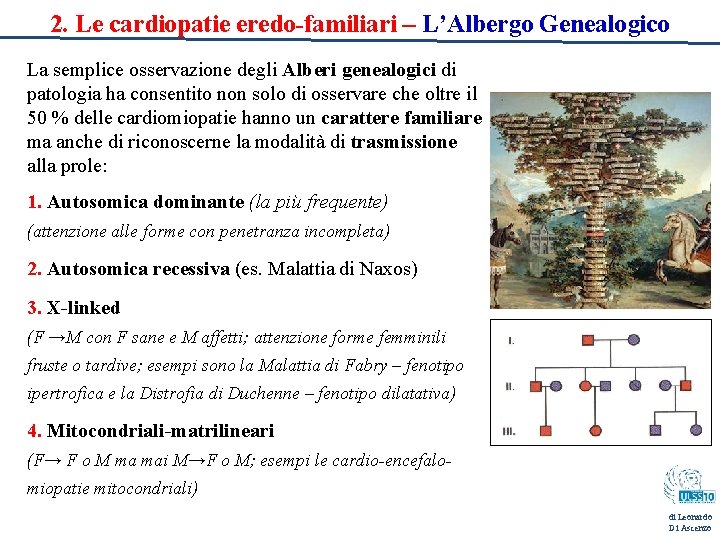
2. Le cardiopatie eredo-familiari – L’Albergo Genealogico La semplice osservazione degli Alberi genealogici di patologia ha consentito non solo di osservare che oltre il 50 % delle cardiomiopatie hanno un carattere familiare ma anche di riconoscerne la modalità di trasmissione alla prole: 1. Autosomica dominante (la più frequente) (attenzione alle forme con penetranza incompleta) 2. Autosomica recessiva (es. Malattia di Naxos) 3. X-linked (F →M con F sane e M affetti; attenzione forme femminili fruste o tardive; esempi sono la Malattia di Fabry – fenotipo ipertrofica e la Distrofia di Duchenne – fenotipo dilatativa) 4. Mitocondriali-matrilineari (F→ F o M ma mai M→F o M; esempi le cardio-encefalomiopatie mitocondriali) di Leonardo Di Ascenzo

2. Le cardiopatie eredo-familiari – Le Basi genetiche Da circa una ventina di anni sono state riconosciute le basi genetiche di queste malattie e si sono cominciati a riconoscere i Geni causativi, causativi i primi dei quali sono stati riconosciuti nella cardiomiopatia ipertrofica Jarcho et al. 1989 Il pz. probando porta all’attenzione clinica non solo il suo caso, ma la stessa famiglia, nella quale oggi si possono riconoscere ben 4 gruppi di individui: 1. i malati, 2. i malati asintomatici e quindi inconsapevoli, Screening clinico 3. i parenti con alterazioni clinico/strumentali potenzialmente predittive di malattia ma non sufficienti per la diagnosi, 4. membri genotipicamente affetti ma fenotipicamente ancora sani (questi ultimi erano pz. sconosciuti prima dell’avvento della genetica e non potevano essere stratificati correndo il rischio di M. I. come prima ed unica manifestazione di malattia) Test genetici

2. Le cardiopatie eredo-familiari – Quando sospettarle Quando di fronte ad un pz. Con stimmate cliniche di una delle cardiopatie eredo-familiari l’ Anamnesi familiare documenti: a) casi noti di cardiopatia b) casi di scompenso cardiaco di origine non determinata c) casi di M. I. soprattutto se giovanile d) storia di aritmie e) storia di impianto di P. M. in giovane età f) disordini neuromuscolari o sensoriali g) storia di sincopi inspiegate e recidivanti In caso di presenza di uno degli elementi anamnestici di cui sopra si dovrà cercare di ricostruire l’ Albero genealogico possibilmente per almeno tre generazioni, dato che già ci consentirà di riconoscerne o almeno ipotizzarne la modalità di trasmissione. di Leonardo Di Ascenzo

2. Le cardiopatie eredo-familiari Corretta caratterizzazione clinico / fenotipica per porre diagnosi deve essere precisa deve considerare l’obiettività generale del pz. Per il clinico un equilibrato e fattibile approccio al Test Genetico passa oggi per un percorso clinico mirato all’indagine di marcatori clinici cardiaci ed extracardiaci, capaci di orientare il test genetico stesso. Tuttavia l’avanzamento di nuove tecnologie per le attività di sequenziamento (highthroughput) consentirà la screening di tutti i geni malattia noti. di Leonardo Di Ascenzo

2. Le cardiopatie eredo-familiari Corretta caratterizzazione clinico / fenotipica per porre diagnosi Esempio 1 – Fenotipo «Ipertrofica» La compresenza di : 1 - Sintomi neurologici generalizzati tipo dolore 2 - Angiocheratomi Cutanei 3 - Proteinuria ed insufficienza renale 4 - Ictus cerebri Può portare al sospetto clinico ed alla diagnosi di Malattia di Fabry. Stratificazione del Rischio di M. I. : può essere suscettibile di trattamento con enzima umano ricombinate. Malattie genetica caratterizzata da deficit dell’enzima α-galattosidasi A, con accumulo multi-organo di glicosfongolipidi. Esempio 2 – Fenotipo «Ipertrofica» La compresenza di : 1 - riconoscimento di Amiloidosi ereditaria 2 - riscontro della mutazione della transtiretina (TTR) di Leonardo Di Ascenzo, MD, Ph. D Stratificazione del Rischio di M. I. : Possibili indicazioni a trapianto di cuore e fegato

2. Le cardiopatie eredo-familiari – Quali sono Cardiomiopatie • ipertrofica (familiare in oltre il 70 %, 12 geni)) • dilatativa (familiare fino al 50 %, almeno 40 geni) • aritmogena (familiare in oltre il 50 %, 8 geni) • restrittiva • ventricolo sinistro non compatto Canalopatie • sindrome di Brugada • sindrome del QT lungo • sindrome del QT corto • sindrome catecolaminergica Definizione ESC di Cardiomiopatia Eur Heart J 2008; 29: 270 -276: malattie del miocardio nelle quali il muscolo cardiaco è strutturalmente e funzionalmente anormale, in assenza di condizioni patologiche quali la malattia coronarica aterosclerotica, l’ipertensione arteriosa, le valvulopatie o le cardiopatie congenite di grado sufficiente a causare le anomalie miocardiche osservate. Definizione AHA di Canalopatie Circulation 2006; 113: 1807 -1816: cardiomiopatie primitive genetiche. Blocco Atrio-Ventricolare familiare: progressiva fibrosi del fascio di His e della branche per mutazione del canale del sodio Prolasso Valvolare Mitralico (gene legato al cromosma X codifcante per la filamina A) Dissezione aortica Bicuspidia aortica di Leonardo Di Ascenzo

Indice degli argomenti 1. Definizione di Morte Improvvisa per il clinico 2. Le cardiopatie eredo-familiari definiamole l’albero genealogico le basi genetiche quando sospettarle la caratterizzazione clinico-fenotipica per porre diagnosi quali sono 3. La stratificazione del rischio di MI nei malati 4. Lo screening familiare: strumento di stratificazione del rischio di M. I. 5. Take Home Message di Leonardo Di Ascenzo, MD, Ph. D

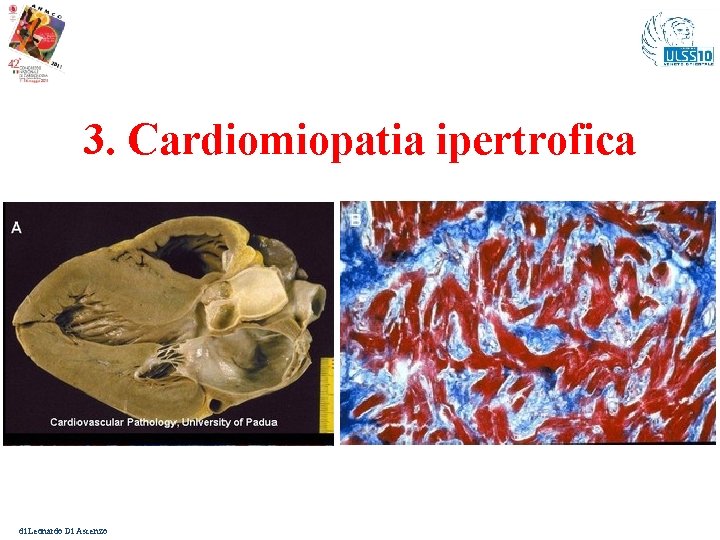
3. Cardiomiopatia ipertrofica di Leonardo Di Ascenzo

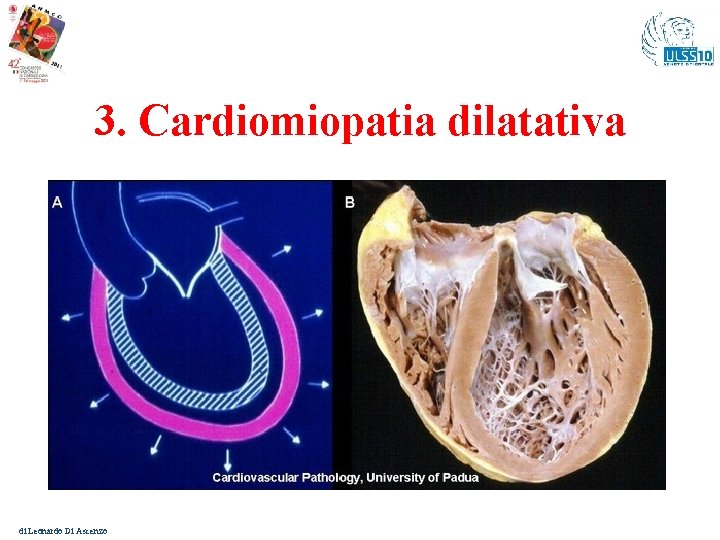
3. Cardiomiopatia dilatativa di Leonardo Di Ascenzo

Cardiomiopatia dilatativa - I Genetica: nel 30 – 50 % dei casi 1 Familiare se: - presente in due o più membri della stessa famiglia - o in presenza di un familiare con storia di M. I. < 35 anni 2 Esordio clinico: tipico, non esclusivo, dell’età adulta (3050 anni). Geni: 40 diversi che codificano per proteine di citoscheletro, sarcomero, dischi Z, membrana nucleare, desmosomi, canali ionici, fattori trascrizionali, geni mitocondriali 3 Trasmissione: Aut. dominante ma anche recessiva ed Xlinked 1. 2. 3. Burkettt EL et al. Clinical and genetic isues in familial dilated cardiomyopathies. Am Heart J 2001; 141: E 1 Mestroni L et al. Guidelines for the study of familial dilated cardiomyopathies. Eur Heart J 1999; 20: 93 -102 Watkins H et al. Inherited Cardiomyopathies. N Engl J Med 2011; 364: 1643 -56. di Leonardo Di Ascenzo

Il Rischio di M. I. nei malati di Cardiomiopatia dilatativa - II Mortalità: a 5 anni è del 20 % per M. I. (50 % per aritmie ventricolari, il restante 50 % da bradicardia, embolia polmonare, dissociazione elettromeccanica) Presentazione: - Aritmie ventricolari asintomatiche e sintomatiche sono frequenti - Sincope con M. I. come prima manifestazione è infrequente Rischio di M. I. : è maggiore nei pz. con indicatori di malattia avanzata, quando è maggiore anche la mortalità per tutte le cause. Indicatori prognostici strumentali (non potenti): Frazione di Eiezione *, il Volume Tele-Diastolico, l’età, l’iponatriemia, la pressione di incuneamento polmonare, ipotensione sistemica, la fibrillazione atriale. * FE < 20 % spesso non ha un valore predittivo positivo elevato per M. I. Indicatori prognostici clinici (più potenti): sincope, TVNS in soggetti con miglior F. E. Non utili: Studio Elettrofisiologico. 1. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006; 8: 746 -837 di Leonardo Di Ascenzo

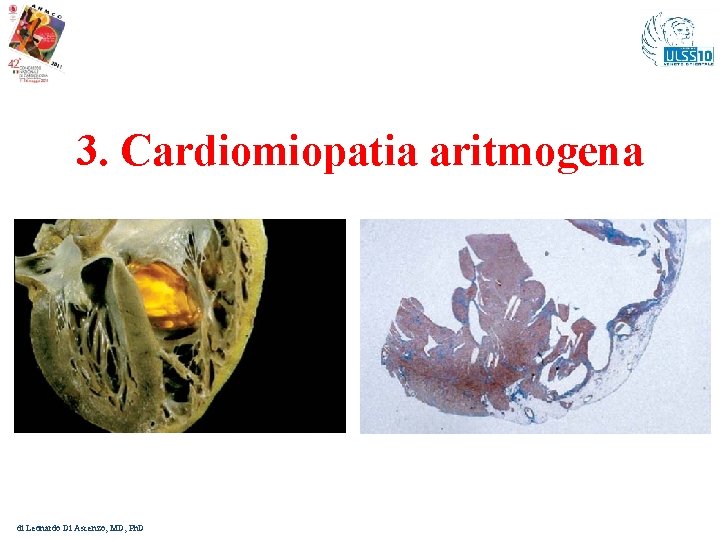
3. Cardiomiopatia aritmogena di Leonardo Di Ascenzo, MD, Ph. D

Cardiomiopatia aritmogena – Aspetti generali In chi va sospettata? : nei giovani maschi con storia di sincopi o presincopi, vertigini, palpitazioni da sforzo con disfunzione biventricolare (più rara e in più adulti) Aritmie: Ventricolari tipo Blocco di Branca Sinistra da sforzo fisico. Diagnosi differenziale: va posta rispetto alle Tachicardie Ventricolari dal tratto di efflusso del Ventricolo destro, le quali non presentano mai l’onda epsilon all’ECG di base, sono più frequenti nelle femmine, possono essere indotte dall’infusione di isoproterenolo. Come si manifesta: Spesso la prima e ultima manifestazione di malattia è la M. I. con incidenza annua dallo 0, 08 al 9 %; è una malattia evolutiva→F. U. sia dei malati che dei portatori “sani” delle mutazioni geniche causative Trasmissione: autosomica dominante prevalente o recessiva nelle più rare forme cardiocutanee (Sdr. di Naxos e di Carvajal); penetranza incompleta. di Leonardo Di Ascenzo

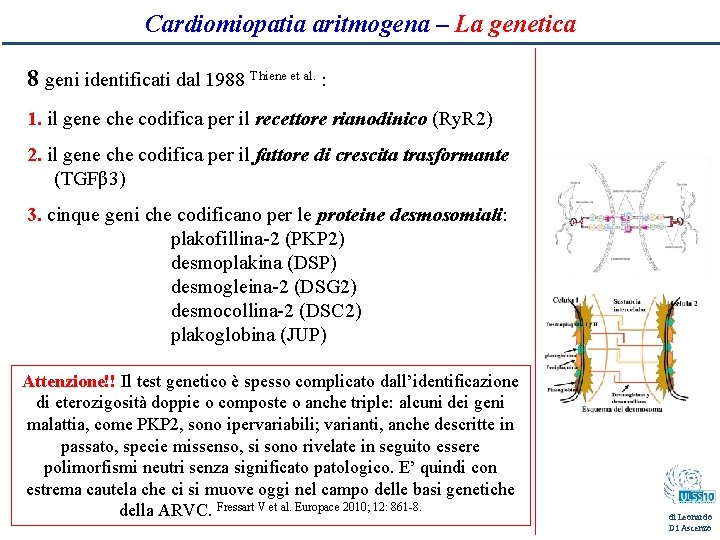
Cardiomiopatia aritmogena – La genetica 8 geni identificati dal 1988 Thiene et al. : 1. il gene che codifica per il recettore rianodinico (Ry. R 2) 2. il gene che codifica per il fattore di crescita trasformante (TGFβ 3) 3. cinque geni che codificano per le proteine desmosomiali: plakofillina-2 (PKP 2) desmoplakina (DSP) desmogleina-2 (DSG 2) desmocollina-2 (DSC 2) plakoglobina (JUP) Attenzione!! Il test genetico è spesso complicato dall’identificazione di eterozigosità doppie o composte o anche triple: alcuni dei geni malattia, come PKP 2, sono ipervariabili; varianti, anche descritte in passato, specie missenso, si sono rivelate in seguito essere polimorfismi neutri senza significato patologico. E’ quindi con estrema cautela che ci si muove oggi nel campo delle basi genetiche della ARVC. Fressart V et al. Europace 2010; 12: 861 -8. di Leonardo Di Ascenzo

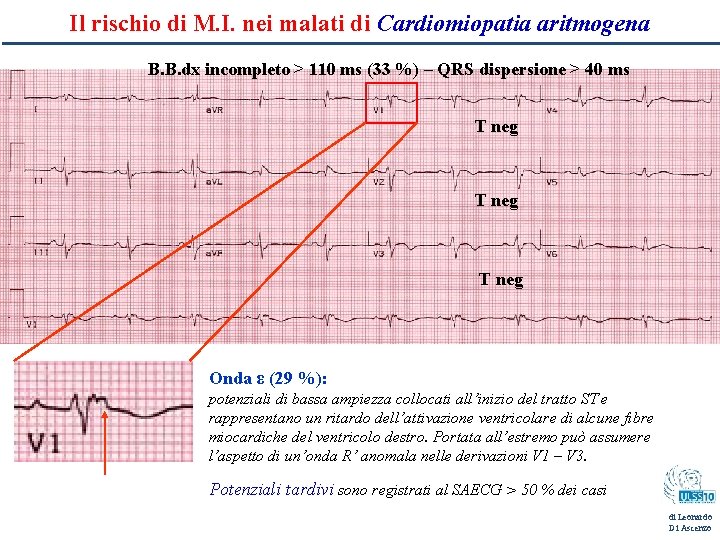
Il rischio di M. I. nei malati di Cardiomiopatia aritmogena B. B. dx incompleto > 110 ms (33 %) – QRS dispersione > 40 ms T neg Onda ε (29 %): potenziali di bassa ampiezza collocati all’inizio del tratto ST e rappresentano un ritardo dell’attivazione ventricolare di alcune fibre miocardiche del ventricolo destro. Portata all’estremo può assumere l’aspetto di un’onda R’ anomala nelle derivazioni V 1 – V 3. Potenziali tardivi sono registrati al SAECG > 50 % dei casi di Leonardo Di Ascenzo

Cardiomiopatia aritmogena – Stratificazione del rischio di M. I. - I Rischio di Morte Improvvisa è maggiore in: 1. soggetti con storia familiare di almeno una M. I. 2. soggetti con storia di sincopi 3. in presenza di coinvolgimento biventricolare 4. in presenza di grave interessamento del V. dx 5. dimostrazione CARTO di ampia “cicatrice elettroanatomica” Corrado et al. 6. in presenza di QRS dispersione all’ECG In questa patologia la Stratificazione del Rischio di Morte Improvvisa passa fondamentalmente attraverso una diagnosi precoce e familiare (su base genetica) al fine di seguire nel tempo i malati ed i portatori del gene data l’evolutività della malattia. di Leonardo Di Ascenzo

Cardiomiopatia aritmogena – Stratificazione del rischio di M. I. - II Classe I 1. ICD indicati nei soggetti in terapia con TVS o FV documentate. (Livello di evidenza B) Classe IIa 1. ICD può essere considerato nelle forme avanzate, quelle con coinvolgimento del ventricolo sinistro, storia di M. I. in famiglia, in caso di sincope inspiegata. (l. e. C) 2. Amiodarone ed il Sotalolo posso essere considerati in caso di TVS o FV quando non si possa impiantare l’ICD. (l. e. C). 3. Ablazione può essere considerata come terapia aggiungtiva nella gestione dei pz. con TV ricorrenti nonostante la terapia medica. (l. e. C). Classe II b Test elettrofisiologici possono essere usati nella stratificazione del rischio di M. I. . (l. e. C). 1. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006; 8: 746 -837 di Leonardo Di Ascenzo

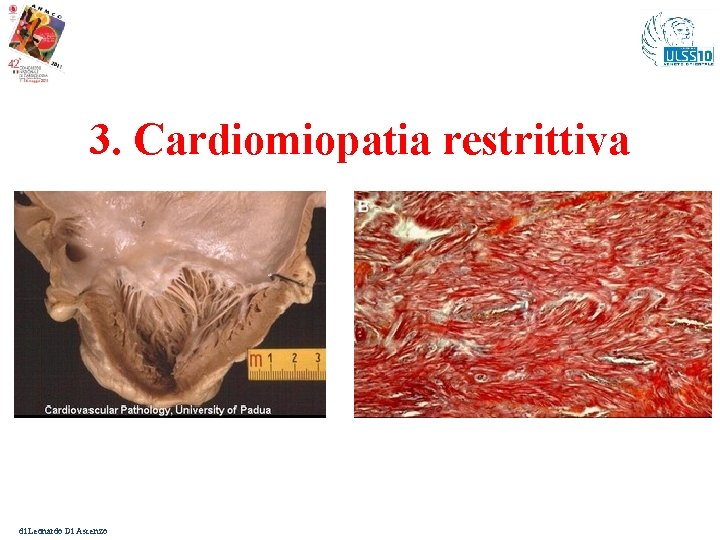
3. Cardiomiopatia restrittiva di Leonardo Di Ascenzo

Cardiomiopatia restrittiva – Valore clinico della diagnosi genetica Diagnosi fenotipica precisa: per non confonderla con forme di c. ipertrofica Caratteristiche fenotipiche: - Fisiologia ventricolare restrittiva, - Volumi diastolici normali o ridotti - Volumi sistolici normali o ridotti - Spessore ventricolare nella norma. Sottogruppi: I. Desminopatie si associa immancabilmentea blocco AV messaggio per il clinico: necessità di PM, evoluzione maligna verso forme terminali di scompenso che richiedono il trapianto cardiaco. II. Troponinopatie messaggio per il clinico: elevato rischio di aritmie ventricolair e M. I. di Leonardo Di Ascenzo

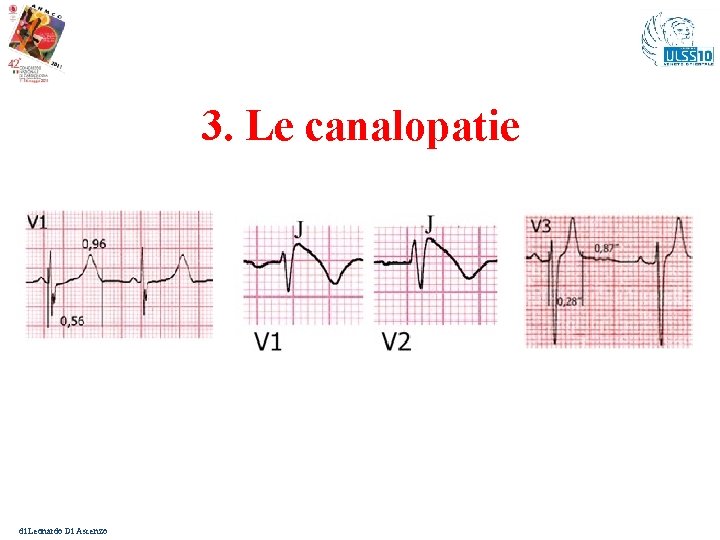
3. Le canalopatie di Leonardo Di Ascenzo

Le canalopatie – Elementi comuni In tutte il primo elemento prognostico in termini di M. I. è rappresentato dalla “severità” delle alterazioni ECGrafiche di base: 1. Sdr. del QT lungo → quando il QTc > 500 ms 2. Sdr. di Brugada → presenza spontanea di sopraslivellamento basale del tratto ST nelle derivazioni precordiali destre L’ ICD trova indicazione di classe I in prevenzione secondaria. Dibattuta è l’indicazione in prevenzione primaria data la giovane età dei malati. Anche considerando che nelle Sdr. del QT lungo e Catecolaminergica la terapia beta-bloccante (classe I) si è dimostrata efficace nel ridurre il rischio di eventi. Nella Sdr. di Brugada non vi è una terapia farmacologica efficace e quindi si deve ricorrere all’impianto di ICD nei pz. ad alto rischio. Le informazioni genetiche hanno un valore nella stratificazione del rischio di Leonardo Di Ascenzo

Sindrome del QT lungo Trasmissione: - più comune è quella autosomica dominante Romano-Ward e Timothy syndrome - più rara e più severa è quella autosomica recessiva (sdr. di Jervell Lange-Nielsen) Geni: - 7 codificano per subunità di canali ionici (LQT 1 -8) - 1 codifica per una proteina di ancoraggio implicata nel posizionamento dei canali ionici sulla mebrana cellulare (JLN 1 -2) Esordio sintomatico: età media intorno ai 12 anni anche con M. I. Aritmie: Tachicardie Ventricolari Polimorfe o Torsioni di punta di Leonardo Di Ascenzo

Sindrome del QT lungo – Stratificazione del Rischio 1. QTc > 500 ms → sintomatici entro i 40 anni di vita 2. i sopravvissuti ad un arresto cardiaco hanno un RR di 12, 9 di un 2° evento 3. il rischio è aumentato nel periodo post-partum 4. a maggior rischio sono i soggetti con Sdr. di Jervell Lange-Nielsen ed altre sdr. omozigote e quando vi sia associata una sindactilia. 5. LQT 1 (durante esercizio e nuoto) e LQT 2 (durante riposo o forti emozioni) con QTc > 500 ms 6. maschi con LQT 3 (durante il riposo e/o il sonno) 7. β-bloccanti sono efficaci in LQT 1 mentre solo parzialmente in LQT 2 e 3. Nota bene: la storia di M. I. familiare non stratifica il rischio Analisi genetiche: sono dunque fondamentali nella Sdr. del QT lungo tanto che i portatori di mutazioni, anche se non sintomatici e/o evidenti all’ECG, vanno: a) trattati con β-bloccanti, b) educati sullo stile di vita, c) informati in merito alla possibilità di trasmettere il genotipo alterato alla prole di Leonardo Di Ascenzo

Sindrome del QT corto Definizione: - descritta per la prima volta nel 2000 da Gussak et al. QT 260 – 275 ms con onde T strette ed appuntite - nel 2003 Gaita et al. QTc < 300 ms con QT < 280 ms - attualmente non vi è un accordo se la definizione debba basarsi sul QT o sul QTc né su quali siano sensibilità/specificità dei differenti intervalli - non sono noti parametri clinici per la diagnosi - la diagnosi va confermata con l’analisi genetica Geni: 3 e codificano per subunità di canali ionici del potassio (SQTS 1 - KCNH 2, SQTS 2 - KCNQ 1, SQTS 3 - KCNJ 2) Nella forma SQTS 1 -KCNH 2 la chinidina ha dimostrato di ridurre l’inducibilità di aritmie ventricolari allo studio elettrofisologico ma non è nota l’efficacia a lungo termine ciò nonostante la genetica ancora non contribuisce alla stratificazione del rischio. Portatori sani: il rischio di eventi cardiaci non è noto di Leonardo Di Ascenzo

Sindrome di Brugada – Caratteristiche Trasmissione: autosomica dominante Espressione: il 90 % degli individui con ECG diagnostico sono Maschi Geni: 1 solo codificante per il canale del sodio (SCN 5 A) identificati anche loci non-SCN 5 A ma i geni sono ancora ignoti Presentazione: sincope o arresto cardiaco ricorrono prevalentemente nei maschi tra la 3° e la 4° decade di vita sono descritti arresti cardiaci anche in neonati e bambini Fattori predisponenti l’arresto cardiaco: febbre. 1. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006; 8: 746 -837 di Leonardo Di Ascenzo

Sindrome di Brugada – Stratificazione del Rischio Storia familiare: non sembra avere valore. ECG: chi presenta un pattern ECG tipo Brugada spontaneo presenta un rischio maggiore di arresto cardiaco Sintomi: soggetti con storia di sincope e pattern ECG tipico presentano un rischio 6 volte più alto di arresto cardiaco rispetto agli asintomatici Elettrofisiologia Brugada et al. Indicano un valore predittivo negativo del 93 % a 3 anni Priori et al. Propongono una stratificazione semplicemente basata su sintomi ed ECG di base Aritmie ventricolari: TV o FV a riposo o nel sonno; non presentano TVNS o BEV isolati all’Holter. Analisi genetiche: utili per i pz. asintomatici per riconscere precoci evidenze di malattia ed ai fini di un counselling genetico ma non per la stratificazione del rischio. di Leonardo Di Ascenzo

Sindrome di Brugada – Raccomandazioni ACC/AHA/ESC Classe I ICD è indicato nei pz. con arresto cardiaco Classe IIa 1. ICD è ragionevole pz. con ST basalmente elevato in V 1, V 2 o V 3 che hanno sincopato con o senza mutazione dimostrata nel gene SCN 5 2. monitoraggio clinico per coloro che presentano l’elevazione del tratto ST indotta 3. ICD è ragionevole per pz. con TV documentate anche se non determinanti arresto 4. L’isoproterenolo può essere usato in uno storm elettric Classe II b Studio elettrofisiologico può essere considerato per la stratificazione dei pz. asintomatici con ST sopraelevato basale con o senza mutazioni del gene SCN 5 A Chinidina può essere ragionevole per il trattamento di storm elettrici Per tutte le indicazioni il livello di evidenza è C. 1. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006; 8: 746 -837 di Leonardo Di Ascenzo

Tachicardie ventricolari polimorfe catecolaminergiche - I Classe I 1. β-bloccanti indicati nei soggetti con diagnosi clinica al test da sforzo. 2. ICD in associazione ai beta-bloccanti è indicato in prevenzione secondaria. Classe IIa 1. β-bloccanti sono indicati nei bambini portatori delle mutazioni genetiche anche se non clinicamente sintomatici 2. ICD con i β-bloccanti può essere utilizzato nei pz. con sincopi con TVS intercorse in terapia. Classe II b β-bloccanti possono essere considerati negli adulti portatori delle mutazioni genetiche anche se non clinicamente sintomatici 1. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006; 8: 746 -837 di Leonardo Di Ascenzo

Tachicardie ventricolari polimorfe catecolaminergiche - II Aritmie: insorgono durante sforzo o emozioni. Esordio: per lo più avviene in età giovanile. Trasmissione: autosomica dominante (50 % mutazione del gene del recettore rianodinico (Ry. R 2) responsabile del rilascio del Ca dai depositi del reticolo sarcoplasmatico) trait autosomico recessivo (mutazione del gene codificante la calsequestrina (CASQ 2) Valore dell’analisi genetica: Classe IIa 1. β-bloccanti sono indicati nei bambini portatori delle mutazioni genetiche anche se non clinicamente sintomatici Classe II b β-bloccanti possono essere considerati negli adulti portatori delle mutazioni genetiche anche se non clinicamente sintomatici di Leonardo Di Ascenzo

Indice degli argomenti 1. Definizione di Morte Improvvisa per il clinico 2. Le cardiopatie eredo-familiari definiamole l’albero genealogico le basi genetiche quando sospettarle la caratterizzazione clinico-fenotipica per porre diagnosi quali sono 3. La stratificazione del rischio di MI nei malati 4. Lo screening familiare: strumento di stratificazione del rischio di M. I. clinico genetico applicato ad alcune cardiopatie eredo-familiari 5. Take Home Message di Leonardo Di Ascenzo, MD, Ph. D

4. Lo screening familiare – Lo screening clinico 1. La screening familiare è indicato in tutti i familiari di 1° grado di un pz. (probando) con cardiomiopatia, a meno che non sia stata dimostrata con certezza una causa acquisita/non genetica. 2. Lo screening va eseguito “a cascata” nei familiari trovati positivi allo screening clinico o genetico. 3. Deve comprendere sempre: ECG, ecocardiogramma e visita clinica. Analisi di 2° livello (monitoraggio Holter, stress-test, ECG ad alta sensibilità) solo in casi selezionati. 4. Età di inizio: 10 -12 anni per tutte le forme, alla nascita per il v. sinistro non compatto. 5. Frequenza: ogni 24 mesi dai 10 fino ai 20 anni di età; ogni 5 anni dai 20 fino ai 50 -60 anni di età. (si considerino i fenotipi età dipendenti) 6. Timing, frequenza e modalità dello screening possono essere individualizzati in base a specifiche caratteristiche cliniche, familiari o in base a particolari necessità individuali (es. pianificazione di una gravidanza, idoneità ad attività sportiva). 7. Lo screening può essere interrotto precocemente qualora il soggetto sia esente da malattia e non sia stata riscontrata la mutazione causale presente nel probando. Riferimento: Eur Heart J 2010 Nov; 31(22): 2715 -26 di Leonardo Di Ascenzo

4. Lo screening familiare – Lo screenig genetico Eur Heart J 2010 Nov; 31(22): 2715 -26 di Leonardo Di Ascenzo

Indagine genetica nella Cardiomiopatia dilatativa Ha un valore per confermare il carattere familiare e quindi sottoporre a screening (direi ecocardiografico) anche i familiari asintomatici. L’indagine genetica ha un una buona probabilità di “genotipizzare” (oggi intorno al 30 %) nelle forme associate a: a) Blocco AV (laminopatie), aumentato rischio di M. I. anche per FE ancora non severamente depresse per cui vi è indicazione ad impianto di PM con funzione di ICD. N Engl J, Med 2006; 354: 209 -210 b) Aumento delle CPK in contesto X-linked (distrofinopatie ed emerinopatie) c) Granulocitopenia ciclica con LVNC (tafazzinopatie X-linked) d) Lattacidemie (forme a trasmissione mitrocondriale matrilineare) e) Sordità (epicardinopatie autosomiche dominanti) f) Cataratta giovanile autos. dom. (mutazioni del gene CRYAB) Per indirizzare i test genetici il cardiologo clinico deve porre molta attenzione alla valutazione clinica globale del pz. e della sua famiglia, nella quale i membri affetti possono presentare la malattia in fasi evolutive diverse o mostrare tratti fenotipici vari nei diversi membri. di Leonardo Di Ascenzo

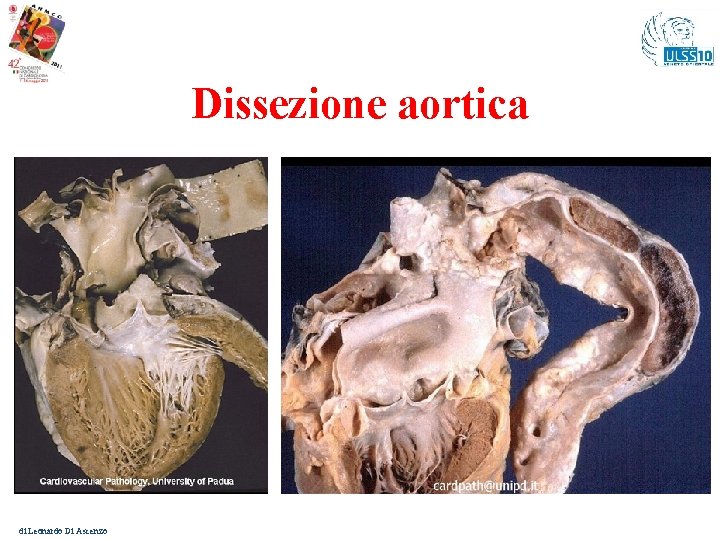
Dissezione aortica di Leonardo Di Ascenzo

Dissezione Aortica Più di una sono le patologie congenite/ereditarie e quindi familiari che possono essere complicate da Dissezione Aortica con M. I. . 1. Sindrome di Marfan (diagnosi mediante Criteri di Ghent) mutazione sul gene fibrillina 1 (FBN 1) La stratificazione del Rischio di M. I. nelle forme frustre passa attraverso il test genetico 2. Sindrome di Loyes-Dietz (fenotipo simile al Marfan) mutazioni nei geni TGFBR 1 (alterazioni scheletriche più accentuate e coinvolgimento vascolare più precoce) e TGFBR 2 (fenotipo meno severo) 3. Sindrome di Ehlers-Danlos (iperelasticità cutanea e iperlassità legamentosa) tipo IV o “vascolare” presenta un difetto nella produzione del procollagene di tipo III (rischio di rottura arteriosa, aneurismi, dissecazioni) 4. Dissecazione aortica familiare mutazione nel gene ACTA 2 (codifica per l’α-actina delle cellule muscolari lisce) mutazione del gene MYH 11 (codifica la catena pesante della miosina) di Leonardo Di Ascenzo

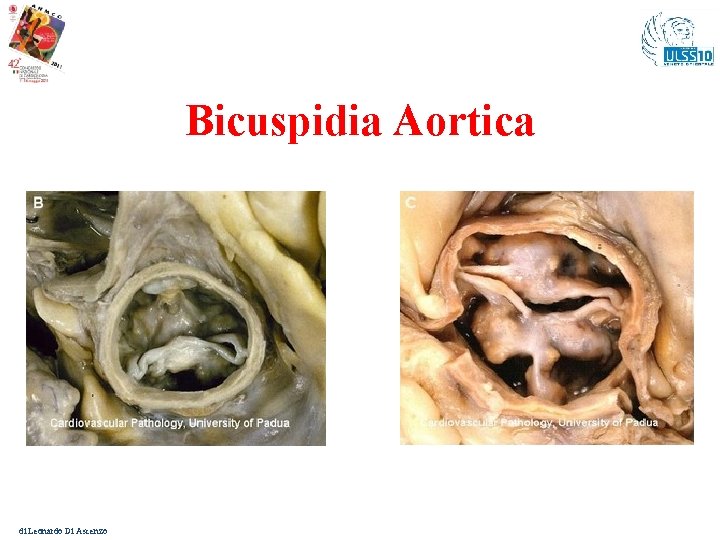
Bicuspidia Aortica di Leonardo Di Ascenzo

Bicuspidia aortica Frequenza: circa il 2 % nella popolazione. Trasmissione: può presentarsi in forma familiare con trasmissione tipo autosomico dominante. Genetica: uno dei geni legati alla forma familiare è NOTCH 1, le cui mutazioni comportano, oltre alla presenza di aorta bicuspide, anche calcificazioni delle cuspidi Clinica: può essere considerata una condizione benigna nell’età giovanile, tuttavia con l’aumentare dell’età emergono rischi consistenti di complicazioni. Il meccanismo di M. I. è la dissezione aortica. Screening familiare: ecocardiografico nei familiari di pz. Giunti all’attenzione per bicuspidia aortica familiare. 1. Garg V et al. Mutations in NOTCH 1 cause aortic valve disease. Nature 2005; 437: 270 -4. di Leonardo Di Ascenzo

Indice degli argomenti 1. Definizione di Morte Improvvisa per il clinico 2. Le cardiopatie eredo-familiari definiamole l’albero genealogico le basi genetiche quando sospettarle la caratterizzazione clinico-fenotipica per porre diagnosi quali sono 3. La stratificazione del rischio di MI nei malati 4. Lo screening familiare: strumento di stratificazione del rischio di M. I. clinico genetico applicato ad alcune cardiopatie eredo-familiari 5. Take Home Message di Leonardo Di Ascenzo, MD, Ph. D

5. Take Home Message Nelle cardiopatie eredo-familiari, più che in altre forme di malattie cardiovascolari, il dovere dello specialista cardiologo non si esaurisce nel formulare una diagnosi precisa ed impostare un adeguato trattamento e follow-up del soggetto malato ma si continua nel fornire valide informazioni sulle possibili implicazioni della patologia a livello personale e familiare e sociale. Al cardiologo, nella sua pratica clinica, non è richiesto di espletare percorsi diagnostico-terapeuticiassistenziali tali da portare alla diagnosi genetica ma semplicemente di cominciare a spostare l’attenzione dal paziente singolo alla sua famiglia, di applicare nelle proprie valutazioni, non solo le conoscenza cardiologiche cuore-specifiche, ma quelle cliniche più ampie e d’insieme, perché il pz. con cardiopatia eredo-familiare non è solo il cuore ma anche la sua famiglia. Arbustini E et al. di Leonardo Di Ascenzo, MD, Ph. D

Grazie per la Vostra cortese attenzione! diascenzo@libero. it Scoletta del Santo, Padova Francesco Vecellio, 1511 Miracolo dell’Avaro Il cuore dell’avaro viene ritrovato dal cerusico là dove la sua anima era rimasta per tutta la vita: non nel corpo umano ma nel forziere, tra i suoi denari. Per gentile concessione dell’Arciconfraternita di sant’Antonio di Padova

Rischio di M. I. nei malati di Cardiomiopatia ipertrofica - I Malattia genetica relativamente diffusa: incidenza 1 / 500 nati vivi In almeno il 50 % dei soggetti affetti si possono riconoscere i geni causativi. Circa 500 diverse mutazioni: > 75 % il gene coinvolto è quello della catena pesante della miosina (MYH 7) o della proteina C legante la miosina (MYBPC 3) 10 -15 % mutazioni su geni che codificano per il complesso della troponina (TNNT 2, TNNI 3, TPM 1). Trasmissione: usualmente autosomica dominante, Espressività: variabile Penetranza: incompleta L’età di insorgenza delle forme sarcomeriche è quella puberale. Può rappresentare la manifestazione clinica di forme patologiche sindromiche come la Malattia di Fabry e la Malattia di Danon (con trasmisisone X-linked) oppure più raramente, parte di disordini mitocondriali. di Leonardo Di Ascenzo

2. Le cardiopatie eredo-familiari – Il test genetico Quando e/o Perché è appropriato? 1. Per la diagnosi eziologica. 2. Nel probando, come condizione indispensabile per un’eventuale screening di genetica molecolare nei familiari. 3. Nei familiari di un pz. con cardiomiopatia, nel caso in cui sia stata identificata una precisa mutazione causale nel probando. 4. Per la stratificazione prognostica in un paziente con cardiomiopatia. 5. Da considerare solo in casi selezionati, con caratteristiche fenotipiche suggestive di particolari mutazioni (es. laminopatie o Mrb. di Fabry). Riferimento: Eur Heart J 2010 Nov; 31(22): 2715 -26 di Leonardo Di Ascenzo
 Qt lungo neonato forum
Qt lungo neonato forum Misure di mitigazione del rischio
Misure di mitigazione del rischio Perimenopausa
Perimenopausa Fasi del rischio clinico
Fasi del rischio clinico Gestione del rischio
Gestione del rischio Figure semantiche
Figure semantiche In morte del fratello giovanni
In morte del fratello giovanni La morte del cavaliere di celano
La morte del cavaliere di celano Rima con tormento
Rima con tormento Foscolo in morte del fratello giovanni
Foscolo in morte del fratello giovanni Rischio chimico
Rischio chimico Slide formazione specifica lavoratori rischio medio
Slide formazione specifica lavoratori rischio medio Formazione specifica rischio alto slide
Formazione specifica rischio alto slide Slide corso antincendio rischio basso
Slide corso antincendio rischio basso Estroprogestinici
Estroprogestinici Slide corso rspp datore di lavoro rischio basso
Slide corso rspp datore di lavoro rischio basso Pittogrammi rischio chimico
Pittogrammi rischio chimico Segnale rischio biologico
Segnale rischio biologico Rischio paese sace
Rischio paese sace Rischio chimico
Rischio chimico Fattori di rischio
Fattori di rischio Rischio cesoiamento
Rischio cesoiamento Rischio reputazionale definizione
Rischio reputazionale definizione Rischio biologico coronavirus | titolo x d.lgs. 81/08
Rischio biologico coronavirus | titolo x d.lgs. 81/08 Rischio clinico slide
Rischio clinico slide Rischio clinico slide
Rischio clinico slide Rischio clinico definizione
Rischio clinico definizione Segregazione alternata
Segregazione alternata Film disney con metamorfosi
Film disney con metamorfosi Osmosi patata
Osmosi patata Sangue occulto nelle feci falso allarme
Sangue occulto nelle feci falso allarme Determinazione del ferro con ortofenantrolina
Determinazione del ferro con ortofenantrolina Lifedeep learning significato
Lifedeep learning significato Il cibo nelle religioni scuola primaria
Il cibo nelle religioni scuola primaria I diritti nelle fiabe
I diritti nelle fiabe L'acqua nelle religioni scuola primaria
L'acqua nelle religioni scuola primaria Simboli cristiani nelle catacombe
Simboli cristiani nelle catacombe Triplo fosfato nelle urine
Triplo fosfato nelle urine Plattegrond van nelle fabriek
Plattegrond van nelle fabriek Risorsa limitata
Risorsa limitata Quis quid
Quis quid Perché vediamo cose nelle nuvole
Perché vediamo cose nelle nuvole Plano de aula ensino religioso vida e morte
Plano de aula ensino religioso vida e morte C'est ne pas une pomme
C'est ne pas une pomme Dead nature painting
Dead nature painting Salmo 116 15
Salmo 116 15 La morte di plinio il vecchio zanichelli
La morte di plinio il vecchio zanichelli Tales de mileto data de nascimento e morte
Tales de mileto data de nascimento e morte