FORMULACIN INORGNICA IUPAC International Union of Pure and






































- Slides: 39

FORMULACIÓN INORGÁNICA

IUPAC International Union of Pure and Applied Chemistry COORDINA NORMAS DE FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS

NÚMERO DE OXIDACIÓN (N. O. ) ELECTRONES GANADOS O PERDIDOS POR UN ÁTOMO EN UN COMPUESTO SUPONIENDO QUE ESTE ES COMPLETAMENTE IÓNICO SIEMPRE TIENE UN SIGNO ( + ó -) SE CUMPLE QUE: N. O. ÁTOMO ELEMENTO LIBRE = 0 N. O. HIDRÓGENO -1 CON METALES Y +1 CON NO METALES N. O. OXÍGENO -2 EXCEPTO CON PERÓXIDOS (-1) N. O. METALES ES SIEMPRE POSITIVO ∑N. O. DE LOS ÁTOMOS DE UNA MOLÉCULA = 0

TIPOS DE NOMENCLATURA TRADICIONAL INCLUYE NOMBRES VULGARES NO RECOMENDADA POR LA IUPAC SISTEMÁTICA APOYADA EN PREFIJOS NUMÉRICOS GRIEGOS EXPRESAMENTE RECOMENDADA POR LA IUPAC STOCK INDICA ENTRE PARÉNTESIS EL N. O. EN CASO DE N. O. MÚLTIPLES TAMBIÉN ACEPTADA POR LA IUPAC

1. ELEMENTOS COMBINACIONES CONSTITUIDAS POR ÁTOMOS IGUALES CONSIDERACIONES: GASES NOBLES SON MONOATÓMICOS: He, Ar METALES REPRESENTADOS POR SU SÍMBOLO: Fe, Cu EXISTEN NO METALES GASEOSOS DIATÓMICOS: H 2, Cl 2 ALGUNOS NO METALES FORMAN AGREGADOS: P 4, 03, S 8

2. COMPUESTOS BINARIOS FORMADOS POR COMBINACIÓN DE DOS ELEMENTOS DISTINTOS: 2. 1. ÓXIDOS OXÍGENO (-2) + METAL/NO METAL 2. 2. PERÓXIDOS OXÍGENO (-1) ( PEROXO) + METAL 2. 3. HIDRUROS HIDRÓGENO + METAL/NO METAL 2. 4. SALES BINARIAS METAL + NO METAL 2. 5. HIDRÓXIDOS METAL + GRUPO OH

2. COMPUESTOS BINARIOS FORMULACIÓN: A CON N. O. m Y B CON N. O. n SE INTERCAMBIAN LOS N. O. An. Bm SE SIMPLIFICA SI ES POSIBLE. EJEMPLO: ÓXIDO DE AZUFRE (VI): S+6 O-2 S 2 O 6 AMBOS SUBÍNDICES DIVISIBLES ENTRE 2 SO 3

2. 1. ÓXIDOS OXÍGENO + METAL/NO METAL NOMENCLATURA SISTEMÁTICA: SE ANTEPONEN LOS PREFIJOS MONO-, DI-, TRI-, TETRA-, PENTA-, HEXA-, HEPTA-, OCTA-, … A LA PALABRA ÓXIDO Y SE ANTEPONE EL MISMO PREFIJO AL NOMBRE DEL OTRO ELEMENTO SIEMPRE SEGÚN EL NÚMERO DE ÁTOMOS QUE TENGA DE CADA ELEMENTO Fe 2 O 3 TRIÓXIDO DE DIHIERRO Cu 2 O MONÓXIDO DE DICOBRE SO 3 TRIÓXIDO DE AZUFRE

2. 1. ÓXIDOS OXÍGENO + METAL/NO METAL NOMENCLATURA DE STOCK: “ÓXIDO DE” + NOMBRE DEL METAL /NO METAL Y ENTRE PARÉNTESIS EL NÚMERO DE OXIDACIÓN EN NÚMEROS ROMANOS (SI TIENE MÁS DE UN N. O. ) Fe 2 O 3 ÓXIDO DE HIERRO (III) Cu 2 O ÓXIDO DE COBRE (I) SO 3 ÓXIDO DE AZUFRE (VI)

2. 2. PERÓXIDOS COMBINACIÓN DEL GRUPO PEROXO (-O-O) MÁS UN METAL. EL OXÍGENO ACTÚA CON N. O. -1 (O 2)-2 SISTEMÁTICA: SE ESCRIBE LA PALABRA ÓXIDO CONTINUADA POR EL NOMBRE DEL OTRO ELEMENTO, CADA UNO CON SUS PREFIJOS STOCK: PERÓXIDO + EL NOMBRE DEL ELEMENTO EJEMPLO: Rb 2 O 2 DIÓXIDO DE DIRUBIDIO/PERÓXIDO DE RUBIDIO Ca. O 2 DIÓXIDO DE CALCIO/PERÓXIDO DE CALCIO

2. 3. HIDRUROS NO METÁLICOS GRUPOS 16 Y 17 (F, Cl, Br, I, S, Se, Te) SISTEMÁTICA: NOMBRE DEL NO METAL TERMINADO EN –URO Y SE AÑADE “DE HIDRÓGENO” TRADICIONAL: SE UTILIZA LA PALABRA ÁCIDO SEGUIDA DEL NOMBRE DEL NO METAL ACABADO EN – HÍDRICO HF FLUORURO DE HIDRÓGENO/ÁCIDO FLUORHÍDRICO H 2 Se SELENIURO DE HIDRÓGENO/ÁCIDO SELENHÍDRICO

2. 3. HIDRUROS NO METÁLICOS GRUPOS 13, 14 Y 15 SISTEMÁTICA: SE UTILIZA LA PALABRA HIDRURO PRECEDIDA DEL PREFIJO QUE INDIQUE EL NÚMERO DE HIDRÓGENOS Y SE AÑADE LA PALABRA “DE” SEGUIDA DEL NOMBRE DEL NO METAL TRADICIONAL: NOMBRES ESPECÍFICOS ACEPTADOS POR IUPAC NH 3 TRIHIDRURO DE NITRÓGENO/AMONÍACO CH 4 TETRAHIDRURO DE CARBONO/METANO

2. 3. HIDRUROS NO METÁLICOS GRUPOS 13, 14 Y 15 NOMBRES TRADICIONALES: BH 3: BORANO CH 4: METANO SIH 4: SILANO NH 3: AMONÍACO PH 3: FOSFINA O FOSFAMINA As. H 3: ARSINA Sb. H 3: ESTIBINA

2. 3. HIDRUROS METÁLICOS NOMENCLATURA SISTEMÁTICA: SE ANTEPONEN LOS PREFIJOS MONO-, DI-, TRI-, TETRA-, PENTA-, HEXA-, HEPTA-, OCTA-, … A LA PALABRA HIDRURO Y SE ANTEPONE EL MISMO PREFIJO AL NOMBRE DEL OTRO ELEMENTO SIEMPRE SEGÚN EL NÚMERO DE ÁTOMOS QUE TENGA DE CADA ELEMENTO

2. 3. HIDRUROS METÁLICOS NOMENCLATURA DE STOCK: “HIDRURO DE” + NOMBRE DEL METAL Y ENTRE PARÉNTESIS EL NÚMERO DE OXIDACIÓN EN NÚMEROS ROMANOS (SI TIENE MÁS DE UN N. O. ) EJEMPLOS: Li. H MONOHIDRURO DE LITIO/HIDRURO DE LITIO Co. H 3 TRIHIDRURO DE COBALTO/HIDRURO DE COBALTO (III)

2. 4. SALES BINARIAS METAL + NO METAL SISTEMÁTICA : NOMBRE DEL NO METAL TERMINADO EN –URO SEGUIDO DEL NOMBRE DEL METAL, AMBOS CON EL PREFIJO QUE LES CORRESPONDA STOCK: NOMBRE DEL NO METAL TERMINADO EN –URO SEGUIDO DEL NOMBRE DEL METAL, INDICANDO ENTRE PARÉNTESIS EL N. O. DE ESTE ÚLTIMO Fe. Br 2 DIBROMURO DE HIERRO/BROMURO DE HIERRO (II) Au 2 S 3 TRISULFURO DE DIORO/SULFURO DE ORO (III)

2. 5. HIDRÓXIDOS METAL + GRUPO OH SISTEMÁTICA: HIDRÓXIDO DE + EL NOMBRE DEL METAL, PRECEDIDOS DE LOS PREFIJOS CORRESPONDIENTES STOCK: HIDRÓXIDO DE + NOMBRE DEL METAL, CON SU N. O. ENTRE PARÉNTESIS SI TIENE MÁS DE UNO Ca(OH)2 DIHIDRÓXIDO DE CALCIO/HIDRÓXIDO DE CALCIO Sn(OH)4 TETRAHIDRÓXIDO DE ESTAÑO/ HIDRÓXIDO DE ESTAÑO (IV)

EJERCICIOS DE REPASO Formula: Peróxido de potasio Óxido de berilio Dihidruro de cobalto Óxido de plomo (IV) Monóxido de dipotasio Pentaóxido de diyodo Hidruro de potasio Hidruro de platino (IV) Ácido fluorhídrico Metano Sulfuro de dipotasio Bromuro de cobre (II) Hidruro de mercurio (I) Trihidróxido de hierro Nombra de dos formas diferentes: NH 3 Si. H 4 Fe. Cl 2 Al. Cl 3 Cl 2 O 3 Na 2 O Mn. O 2 Pb. O Se. O 3 Li 2 O 2 Ba. O 2 Cu(OH) Au(OH)3 H 2 Se

3. COMPUESTOS TERNARIOS 3. 1. ÁCIDOS OXOÁCIDOS FORMADOS POR HIDRÓGENO, OXÍGENO Y UN NO METAL (O UN METAL COMO V, Cr o Mn) FÓRMULA GENERAL: Hx. My. Oz 3. 2. OXISALES NEUTRAS FORMADAS POR UN METAL, UN ÁTOMO CENTRAL NO METAL (O Mn, Cr o V) Y OXÍGENO FÓRMULA GENERAL: Mx(my. Oz)n

3. 1. ÁCIDOS OXOÁCIDOS HIDRÓGENO CON N. O. +1 OXÍGENO CON N. O. -2 NO METAL CON N. O. POSITIVO N. O. DE TODOS LOS ELEMENTOS MULTIPLICADOS POR SUS SUBÍNDICES ES CERO

3. 1. ÁCIDOS OXOÁCIDOS SISTEMÁTICA: PREFIJO QUE INDICA EL NÚMERO DE ÁTOMOS DE OXÍGENO: OXO, DIOXO, TRIOXO RAÍZ CON EL NOMBRE DEL ÁTOMO CENTRAL ACABADO EN –ATO CON EL NÚMERO DE OXIDACIÓN DEL MISMO ENTRE PARÉNTESIS EN NÚMEROS ROMANOS TERMINACIÓN: “DE HIDRÓGENO” H 2 SO 4 TETRAOXOSULFATO (VI) DE HIDRÓGENO

3. 1. ÁCIDOS OXOÁCIDOS STOCK: SE ESCRIBE LA PALABRA “ÁCIDO” SE AÑADE UN PREFIJO QUE REPRESENTA EL NÚMERO DE ÁTOMOS DE OXÍGENO (OXO, DIOXO, …) SE AGREGA LA RAÍZ DEL NOMBRE DEL ÁTOMO CENTRAL ACABADO EN –ICO (CON EL NÚMERO DE OXIDACIÓN EN NÚMEROS ROMANOS) H 2 SO 4 ÁCIDO TETRAOXOSULFÚRICO (VI)

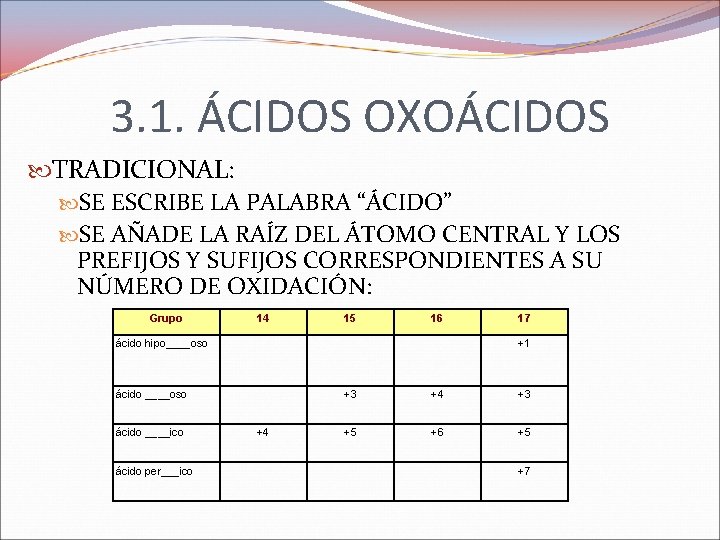
3. 1. ÁCIDOS OXOÁCIDOS TRADICIONAL: SE ESCRIBE LA PALABRA “ÁCIDO” SE AÑADE LA RAÍZ DEL ÁTOMO CENTRAL Y LOS PREFIJOS Y SUFIJOS CORRESPONDIENTES A SU NÚMERO DE OXIDACIÓN: Grupo 14 15 16 ácido hipo____oso +1 ácido ____oso ácido ____ico ácido per___ico 17 +4 +3 +5 +6 +5 +7

3. 1. ÁCIDOS OXOÁCIDOS H 2 SO 3: ÁCIDO SULFUROSO H 2 SO 4: ÁCIDO SULFÚRICO HCl. O: ÁCIDO HIPOCLOROSO HCl. O 2: ÁCIDO CLOROSO HCl. O 3: ÁCIDO CLÓRICO HCl. O 4: ÁCIDO PERCLÓRICO

3. 1. ÁCIDOS OXOÁCIDOS SIMPLES POLIHIDRATADOS (moléculas de agua): Meta- : una molécula de agua Orto- : tres moléculas de agua ISOPOLIÁCIDOS (diácidos y triácidos) PEROXOÁCIDOS (sustituimos el grupo oxo _O 2 -_ por el peroxo _O 22 -_) TIOÁCIDOS (sustituimos grupos O 2 - por grupos S 2 -)

OXOÁCIDOS POLIHIDRATADOS Meta- : se le añade una molécula de agua al óxido para formar el oxoácido Orto- : se añaden tres moléculas de agua al óxido para formar el oxoácido B 2 O 3 + H 2 O HBO 2 – dioxoborato (III) de hidrógeno / ácido metabórico B 2 O 3 + 3 H 2 O H 3 BO 3 – trioxoborato (III) de hidrógeno / ácido ortobórico

ISOPOLIÁCIDOS LOS PREFIJOS DI-, TRI-, TETRA- INDICAN EL GRADO DE POLIMERIZACIÓN DE LOS ÁCIDOS. EL PREFIJO DI- INDICA QUE EL ÁCIDO SE HA FORMADO QUITANDO UNA MOLÉCULA DE AGUA A DOS MOLÉCULAS DE ÁCIDO DISULFÚRICO (heptaoxodisulfato (VI) de hidrógeno): 2 H 2 SO 4 – H 2 O = H 4 S 2 O 8 – H 2 O = H 2 S 2 O 7 ÁCIDO DIFOSFÓRICO (heptaoxodifosfato (V) de hidrógeno): 2 H 3 PO 4 – H 2 O = H 6 P 2 O 8 – H 2 O = H 2 P 2 O 7

ISOPOLIÁCIDOS REGLA GENERAL: SE ELIMINA UNA MOLÉCULA DE AGUA MENOS QUE EL NÚMERO QUE INDICA EL GRADO DE POLIMERIZACIÓN DEL ÁCIDO TRIFOSFÓRICO (DECAOXOTRIFOSFATO (V) DE HIDRÓGENO): 3 H 3 PO 4 – 2 H 2 O H 5 P 3 O 10

PEROXOÁCIDOS SUSTITUIMOS EL GRUPO OXO (O 2 -) POR EL GRUPO PEROXO O 22 DEL HCl. O 4 OBTENEMOS HCl. O 5 , lo que indica que del ácido perclórico hemos obtenido el ácido peroxoperclórico DEL H 2 CO 3 OBTENEMOS H 2 CO 4, lo que indica que del ácido carbónico hemos obtenido el ácido peroxocarbónico

TIOÁCIDOS SE SUSTITUYEN LOS GRUPOS O-2 POR S-2 PROCEDE DEL GRIEGO “THEION” = AZUFRE § H 2 S 2 O 3 ÁCIDO TIOSULFÚRICO/TRIOXOTIOSULFATO (VI) DE HIDRÓGENO/ ÁCIDO TRIOXOTIOSULFÚRICO (VI) § H 2 S 2 O 2 ÁCIDO TIOSULFUROSO/DIOXOTIOSULFATO (IV) DE HIDRÓGENO/ ÁCIDO DIOXOTIOSULFUROSO (IV)

TIOÁCIDOS § H 3 PO 3 S ÁCIDO TIOFOSFÓRICO/TRIOXOTIOFOSFATO (V) DE HIDRÓGENO/ ÁCIDO TRIOXOTIOFOSFÓRICO (V)

EJERCICIOS DE REPASO (II) Nombra de dos formas: Formula H 2 SO 4 Oxoclorato (I) de hidrógeno Fe(OH)2 Ácido crómico H 3 PO 3 S Ácido peroxonítrico H 2 Cr. O 4 Ácido silícico HCl. O Trioxofosfato (III) de hidrógeno HNO 3 Peróxido de magnesio HBr. O 4 Oxoyodato (I) de hidrógeno HIO 2 Tetraoxobromato (VII) de hidrógeno HCl. O 3 Ácido mangánico H 3 As. O 3 Ácido teluroso HBO 2 Tetraoxomanganto (VI) de hidrógeno H 2 Cr 2 O 7 Ácido selénico H 3 BO 3 Trioxosilicato (IV) de hidrógeno H 2 S 2 O 7 Ácido nítrico

3. 2. OXISALES NEUTRAS PROCEDEN DE LA SUSTITUCIÓN DE LOS HIDRÓGENOS DE LOS OXOÁCIDOS POR METALES FÓRMULA GENERAL: Mx(Ny. Oz)n SE ESCRIBE EL METAL Y A CONTINUACIÓN EL ANIÓN FORMADO POR EL RESTO DEL ÁCIDO SIN LOS HIDRÓGENOS (TENDRÁ TANTAS CARGAS NEGATIVAS COMO HIDRÓGENOS HAYA ELIMINADO) H 3 PO 4 EL PO 4 TIENE TRES CARGAS NEGATIVAS AL PERDER TRES HIDRÓGENOS (N. O. = -3)

3. 2. OXISALES NEUTRAS SISTEMÁTICA: PREFIJO QUE INDICA EL NÚMERO DE ÁTOMOS DE OXÍGENO (OXO, DIOXO, …) RAÍZ CON EL NOMBRE DEL ÁTOMO CENTRAL TERMINADO EN –ATO Y SU N. O. ENTRE PARÉNTESIS EN NÚMEROS ROMANOS AÑADIMOS EL NOMBRE DEL METAL Y SU N. O. ENTRE PARÉNTESIS EN NÚMEROS ROMANOS

3. 2. OXISALES NEUTRAS STOCK: SE ESCRIBE EL RADICAL DEL ÁCIDO: SULF-, CLOR-, CARBON SE CAMBIA LA TERMINACIÓN –OSO DE LOS OXOÁCIDOS POR –ITO Y LA TERMINACIÓN –ICO DE LOS OXOÁCIDOS POR –ATO, RESPECTIVAMENTE SE AÑADE EL NOMBRE DEL METAL CON SU N. O. EN NÚMEROS ROMANOS ENTRE PARÉNTESIS Cu 3(PO 4)2 TETRAOXOFOSFATO (V) DE COBRE (II)/ FOSFATO DE COBRE (II) Cu. CO 3 TRIOXOCARBONATO (IV) DE COBRE (II) / CARBONATO DE COBRE (II)

4. COMPUESTOS CUATERNARIOS 4. 1. SALES ÁCIDAS SE SUSTITUYE UNO DE LOS HIDRÓGENOS DE LOS ÁCIDOS CON VARIOS HIDRÓGENOS POR UN METAL SISTEMÁTICA: COMO OXISALES NEUTRAS SE ANTEPONE LA PALABRA HIDRÓGENO CON EL PREFIJO CORRESPONDIENTE, SE AÑADE LA RAÍZ DEL NOMBRE DEL ÁTOMO CENTRAL ACABADA EN –ATO CON SU N. O. ENTRE PARÉNTESIS Y SE SE AGREGA EL NOMBRE DEL METAL CON SU N. O. ENTRE PARÉNTESIS

4. COMPUESTOS CUATERNARIOS 4. 1. SALES ÁCIDAS SE SUSTITUYE UNO DE LOS HIDRÓGENOS DE LOS ÁCIDOS QUE CONTIENEN VARIOS HIDRÓGENOS POR UN METAL TRADICIONAL RADICAL DEL ÁCIDO CAMBIANDO –OSO POR –ITO E –ICO POR –ATO, AÑADIENDO LA PALABRA “ÁCIDO” ANTES DE NOMBRAR EL METAL Na. HSO 4 HIDROGENOTETRAOXOSULFATO (VI) DE SODIO/ SULFATO ÁCIDO DE SODIO KH 2 PO 4 HIDROGENOTETRAOXOFOSFATO (V) DE POTASIO/ FOSFATO ÁCIDO DE POTASIO

IONES POSITIVOS CATIONES NH 4+ IÓN AMONIO NEGATIVOS ANIONES O 2 -2 IÓN PERÓXIDO O-2 IÓN ÓXIDO OH- IÓN HIDRÓXIDO Cl- IÓN CLORURO S 2 - IÓN SULFURO N 3 - IÓN NITRURO C 4 - IÓN CARBURO

EJERCICIOS DE REPASO (III) Nombra de dos formas: Formula Na 2 SO 4 Perclorato de potasio Na. HSO 4 Trioxosulfato (IV) de sodio Cu. CO 3 Nitrato de cobre (I) KCl. O Bromito de litio Cs. Cl. O 4 Iodato de hierro (II) Ba(HCr 2 O 7)2 Hidrogenotetraoxosulfato (VI) de sodio Al. BO 3 Fosfato ácido de potasio Au. IO 2 Fosfato diácido de sodio Cu(H 2 PO 4) Hidrogenocarbonato de plata Li 3 As. O 3 Ión carburo Fe(BO 2)3 Ión peróxido NH 4+ Trioxoseleniato (IV) de mercurio (I) Cl- Hidrogenosulfito de hierro (III) Rb 2 S 2 O 7 Silicato de bario
 Iupap
Iupap Nomenclatura
Nomenclatura Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Union union all intersect
Union union all intersect International union of forest research organizations
International union of forest research organizations Nitrilo grupo funcional
Nitrilo grupo funcional Katlma
Katlma Polimer adlandırma
Polimer adlandırma Priority of functional groups
Priority of functional groups What is the iupac name of ch3ch2ch2ch2ch2i?
What is the iupac name of ch3ch2ch2ch2ch2i? Primary amine structure
Primary amine structure Iupac kuralı
Iupac kuralı Iupac stands for
Iupac stands for Iupac name for cycloalkane
Iupac name for cycloalkane Ketone iupac name
Ketone iupac name Slidetodoc.com
Slidetodoc.com Propiedades fisicas de las cetonas
Propiedades fisicas de las cetonas C10h22 organic or inorganic
C10h22 organic or inorganic Synthesis of chlorbutanol
Synthesis of chlorbutanol Nomenclatura hci
Nomenclatura hci Clonazepam iupac name
Clonazepam iupac name How to name carboxylic acid
How to name carboxylic acid Na pcl6 iupac name
Na pcl6 iupac name Blm gold book
Blm gold book Propan butan hexan heptan
Propan butan hexan heptan Sodium hydroxide iupac id sodium oxidanide
Sodium hydroxide iupac id sodium oxidanide Iupac name search by image
Iupac name search by image Pentanal
Pentanal C6h14 structural isomers
C6h14 structural isomers Iupac nomenklatur
Iupac nomenklatur Na pcl6 iupac name
Na pcl6 iupac name Caoutchoutique
Caoutchoutique Butane condensed structural formula
Butane condensed structural formula Nama asam karboksilat
Nama asam karboksilat Ketone iupac
Ketone iupac Idruri covalenti
Idruri covalenti