FOR INTERNAL USE ONLY STRICTLY CONFIDENTIAL DO NOT

















- Slides: 40

FOR INTERNAL USE ONLY. STRICTLY CONFIDENTIAL. DO NOT COPY, DETAIL OR DISTRIBUTE EXTERNALLY.

• “ Este material contiene información científica no aprobada en el registro sanitario local y la recomendación del producto en esta situación es de exclusiva responsabilidad del médico tratante. ” 2 MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI DISTRIBUIR EXTERNAMENTE.

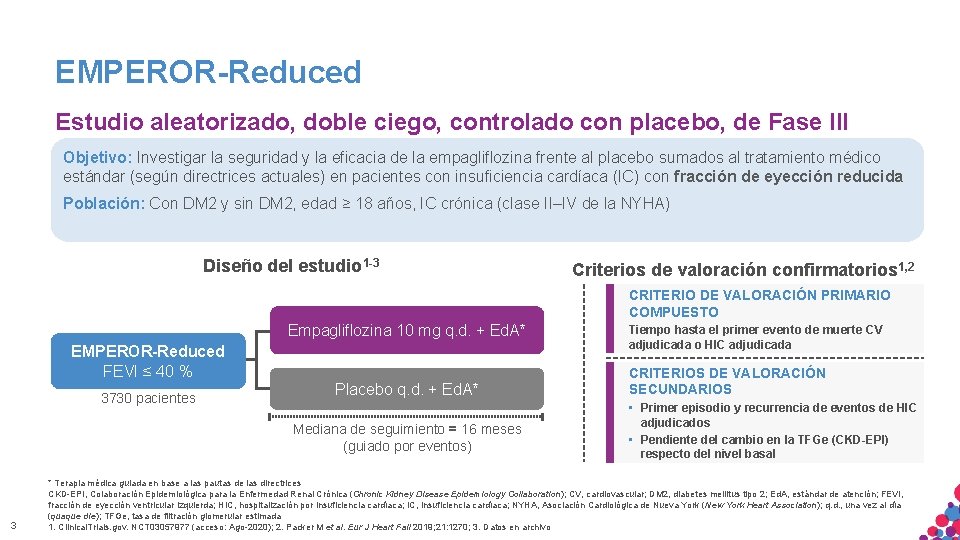
EMPEROR-Reduced Estudio aleatorizado, doble ciego, controlado con placebo, de Fase III Objetivo: Investigar la seguridad y la eficacia de la empagliflozina frente al placebo sumados al tratamiento médico estándar (según directrices actuales) en pacientes con insuficiencia cardíaca (IC) con fracción de eyección reducida Población: Con DM 2 y sin DM 2, edad ≥ 18 años, IC crónica (clase II–IV de la NYHA) Diseño del estudio 1 -3 Criterios de valoración confirmatorios 1, 2 CRITERIO DE VALORACIÓN PRIMARIO COMPUESTO Empagliflozina 10 mg q. d. + Ed. A* EMPEROR-Reduced FEVI ≤ 40 % 3730 pacientes Placebo q. d. + Ed. A* Mediana de seguimiento = 16 meses (guiado por eventos) 3 Tiempo hasta el primer evento de muerte CV adjudicada o HIC adjudicada CRITERIOS DE VALORACIÓN SECUNDARIOS • Primer episodio y recurrencia de eventos de HIC adjudicados • Pendiente del cambio en la TFGe (CKD-EPI) respecto del nivel basal * Terapia médica guiada en base a las pautas de las directrices CKD-EPI, Colaboración Epidemiológica para la Enfermedad Renal Crónica (Chronic Kidney Disease Epidemiology Collaboration); CV, cardiovascular; DM 2, diabetes mellitus tipo 2; Ed. A, estándar de atención; FEVI, fracción. MATERIAL de eyección ventricular izquierda; HIC, USO hospitalización por insuficiencia cardíaca; IC, CONFIDENCIAL. insuficiencia cardíaca; NO NYHA, Asociación Cardiológica de Nueva York (New York Heart Association); q. d. , una vez al día SÓLO APTO PARA INTERNO. ESTRICTAMENTE COPIAR, CITAR NI (quaque die); TFGe, tasa de filtración glomerular estimada DISTRIBUIR EXTERNAMENTE. 1. Clinical. Trials. gov. NCT 03057977 (acceso: Ago-2020); 2. Packer M et al. Eur J Heart Fail 2019; 21: 1270; 3. Datos en archivo

Criterios de valoración específicos para las pruebas jerárquicas EMPEROR-Reduced Criterio de valoración primario: Evento adjudicado de muerte CV u hospitalización por insuficiencia cardíaca Criterio de valoración secundario clave: Eventos adjudicados de primer episodio y recurrencia de hospitalización por insuficiencia cardíaca Criterio de valoración secundario clave: Pendiente de la TFGe 4 MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI DISTRIBUIR EXTERNAMENTE. CV, cardiovascular; TFGe, tasa de filtración glomerular estimada

Criterios de inclusión y exclusión del estudio Criterios de inclusión 1, 2 Criterios de exclusión 1, 2 Edad ≥ 18 años (Japón, edad ≥ 20 años) en la selección IM, cirugía de bypass de arteria coronaria u otra cirugía CV mayor, accidente cerebrovascular o AIT ≤ 90 días antes de la Visita 1 IC crónica clase II−IV de la NYHA ICFEr (FEVI ≤ 40 %) y NT-pro. BNP elevado FE (%) NT-pro. BNP (pg/ml) Pacientes sin FA* ≥ 36 a ≤ 40 ≥ 2500 ≥ 31 a ≤ 35 ≥ 1000 ≤ 30 ≥ 600 ≤ 40 % + HIC dentro ≥ 600 de los 12 meses Dosis de la terapia médica para la IC que es concordante con las directrices y que ha sido estable durante ≥ 1 semana previo a la selección y a lo largo de todo el período de selección Aplican criterios de inclusión adicionales 5 * El valor de corte para. SÓLO los pacientes FA es. USO el doble en EMPEROR-Reduced MATERIAL APTOcon PARA INTERNO. ESTRICTAMENTE CONFIDENCIAL. Véanse. DISTRIBUIR las notas de las. EXTERNAMENTE. diapositivas para las definiciones de las abreviaturas 1. Clinical. Trials. gov. NCT 03057977 (acceso: Ago-2020); 2. Zannad F et al. ESC-HF 2018; póster P 1755 Receptor de trasplante de corazón, o en lista de espera para trasplante de corazón IC descompensada aguda PAS ≥ 180 mm. Hg en la Visita 2 Hipotensión sintomática y/o PAS < 100 mm. Hg TFGe < 20 ml/min/1, 73 m 2 o necesidad de diálisis Aplican criterios de exclusión adicionales NO COPIAR, CITAR NI

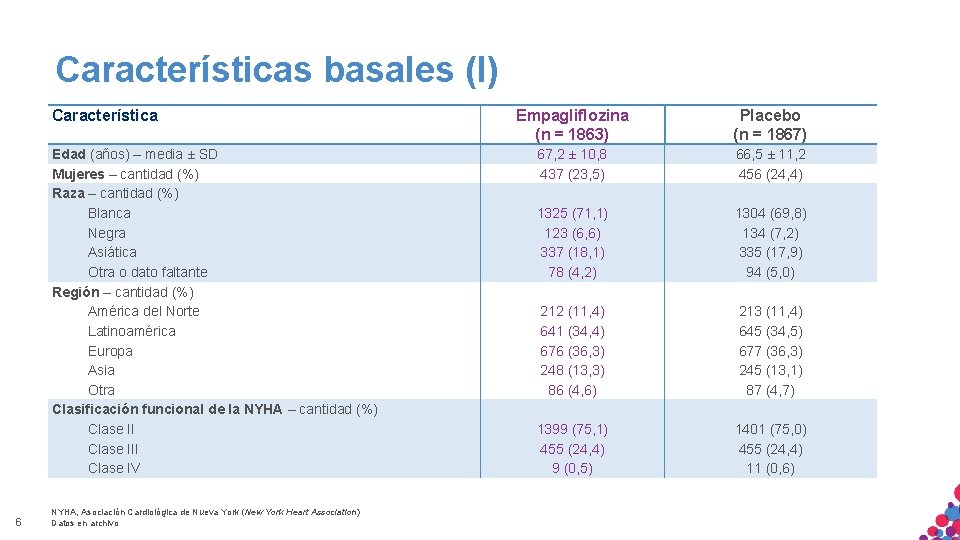
Características basales (I) Característica Edad (años) – media ± SD Mujeres – cantidad (%) Raza – cantidad (%) Blanca Negra Asiática Otra o dato faltante Región – cantidad (%) América del Norte Latinoamérica Europa Asia Otra Clasificación funcional de la NYHA – cantidad (%) Clase III Clase IV 6 NYHA, Asociación Cardiológica de Nueva York (New York Heart Association) Datos en archivo Empagliflozina (n = 1863) Placebo (n = 1867) 67, 2 ± 10, 8 437 (23, 5) 66, 5 ± 11, 2 456 (24, 4) 1325 (71, 1) 123 (6, 6) 337 (18, 1) 78 (4, 2) 1304 (69, 8) 134 (7, 2) 335 (17, 9) 94 (5, 0) 212 (11, 4) 641 (34, 4) 676 (36, 3) 248 (13, 3) 86 (4, 6) 213 (11, 4) 645 (34, 5) 677 (36, 3) 245 (13, 1) 87 (4, 7) 1399 (75, 1) 455 (24, 4) 9 (0, 5) 1401 (75, 0) 455 (24, 4) 11 (0, 6)

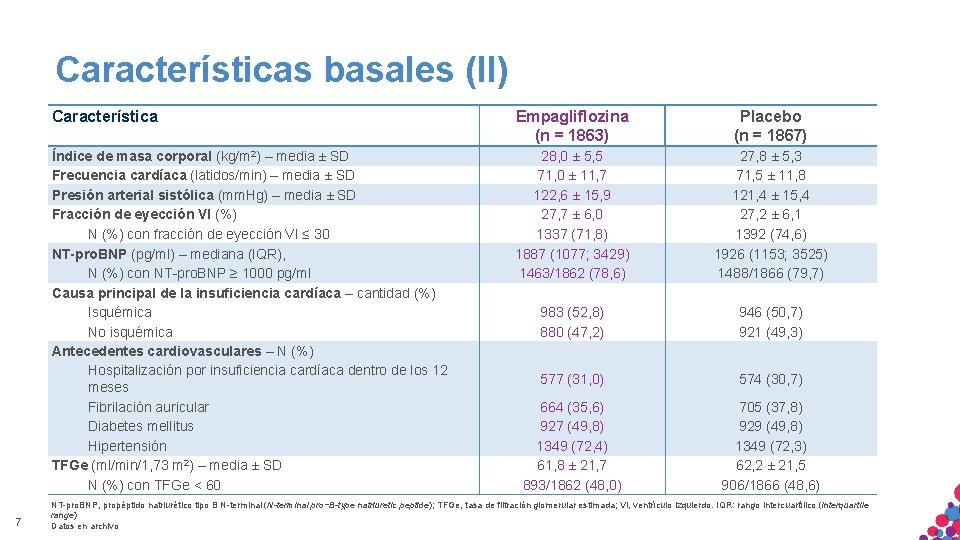
Características basales (II) 7 Característica Empagliflozina (n = 1863) Placebo (n = 1867) Índice de masa corporal (kg/m 2) – media ± SD Frecuencia cardíaca (latidos/min) – media ± SD Presión arterial sistólica (mm. Hg) – media ± SD Fracción de eyección VI (%) N (%) con fracción de eyección VI ≤ 30 NT-pro. BNP (pg/ml) – mediana (IQR), N (%) con NT-pro. BNP ≥ 1000 pg/ml Causa principal de la insuficiencia cardíaca – cantidad (%) Isquémica No isquémica Antecedentes cardiovasculares – N (%) Hospitalización por insuficiencia cardíaca dentro de los 12 meses Fibrilación auricular Diabetes mellitus Hipertensión TFGe (ml/min/1, 73 m 2) – media ± SD N (%) con TFGe < 60 28, 0 ± 5, 5 71, 0 ± 11, 7 122, 6 ± 15, 9 27, 7 ± 6, 0 1337 (71, 8) 1887 (1077; 3429) 1463/1862 (78, 6) 27, 8 ± 5, 3 71, 5 ± 11, 8 121, 4 ± 15, 4 27, 2 ± 6, 1 1392 (74, 6) 1926 (1153; 3525) 1488/1866 (79, 7) 983 (52, 8) 880 (47, 2) 946 (50, 7) 921 (49, 3) 577 (31, 0) 574 (30, 7) 664 (35, 6) 927 (49, 8) 1349 (72, 4) 61, 8 ± 21, 7 893/1862 (48, 0) 705 (37, 8) 929 (49, 8) 1349 (72, 3) 62, 2 ± 21, 5 906/1866 (48, 6) NT-pro. BNP, propéptido natriurético tipo B N-terminal (N-terminal pro−B-type natriuretic peptide); TFGe, tasa de filtración glomerular estimada; VI, ventrículo izquierdo. IQR: rango intercuartílico (interquartile range) Datos en archivo

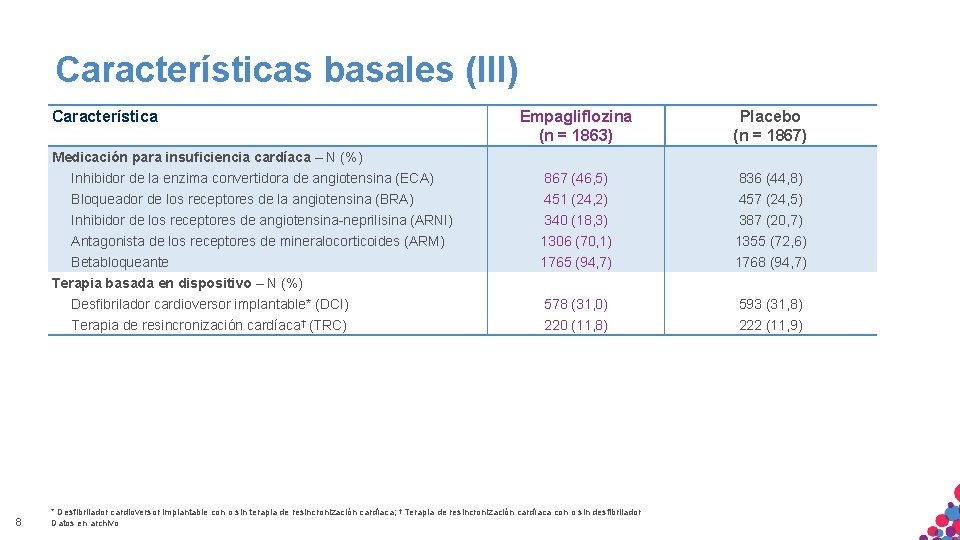
Características basales (III) Característica Empagliflozina (n = 1863) Placebo (n = 1867) Inhibidor de la enzima convertidora de angiotensina (ECA) 867 (46, 5) 836 (44, 8) Bloqueador de los receptores de la angiotensina (BRA) 451 (24, 2) 457 (24, 5) Inhibidor de los receptores de angiotensina-neprilisina (ARNI) 340 (18, 3) 387 (20, 7) Antagonista de los receptores de mineralocorticoides (ARM) 1306 (70, 1) 1355 (72, 6) Betabloqueante 1765 (94, 7) 1768 (94, 7) Desfibrilador cardioversor implantable* (DCI) 578 (31, 0) 593 (31, 8) Terapia de resincronización cardíaca† (TRC) 220 (11, 8) 222 (11, 9) Medicación para insuficiencia cardíaca – N (%) Terapia basada en dispositivo – N (%) 8 * Desfibrilador cardioversor implantable con o sin terapia de resincronización cardíaca; † Terapia de resincronización cardíaca con o sin desfibrilador Datos en archivo

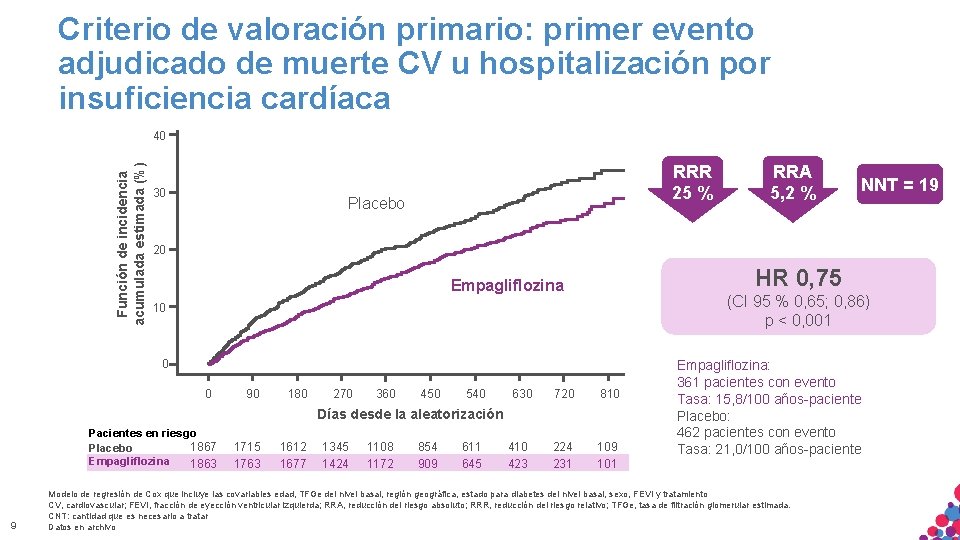
Criterio de valoración primario: primer evento adjudicado de muerte CV u hospitalización por insuficiencia cardíaca Función de incidencia acumulada estimada (%) 40 30 RRR 25 % Placebo NNT = 19 20 HR 0, 75 Empagliflozina (CI 95 % 0, 65; 0, 86) p < 0, 001 10 0 0 90 180 270 360 450 540 630 720 810 224 231 109 101 Días desde la aleatorización Pacientes en riesgo 1867 Placebo Empagliflozina 1863 9 RRA 5, 2 % 1715 1763 1612 1677 1345 1424 1108 1172 854 909 611 645 410 423 Empagliflozina: 361 pacientes con evento Tasa: 15, 8/100 años-paciente Placebo: 462 pacientes con evento Tasa: 21, 0/100 años-paciente Modelo de regresión de Cox que incluye las covariables edad, TFGe del nivel basal, región geográfica, estado para diabetes del nivel basal, sexo, FEVI y tratamiento CV, cardiovascular; fracción de eyección ventricular izquierda; ESTRICTAMENTE RRA, reducción del riesgo absoluto; RRR, reducción del riesgo. CITAR relativo; NI TFGe, tasa de filtración glomerular estimada. MATERIALFEVI, SÓLO APTO PARA USO INTERNO. CONFIDENCIAL. NO COPIAR, CNT: cantidad que es necesario a tratar DISTRIBUIR EXTERNAMENTE. Datos en archivo

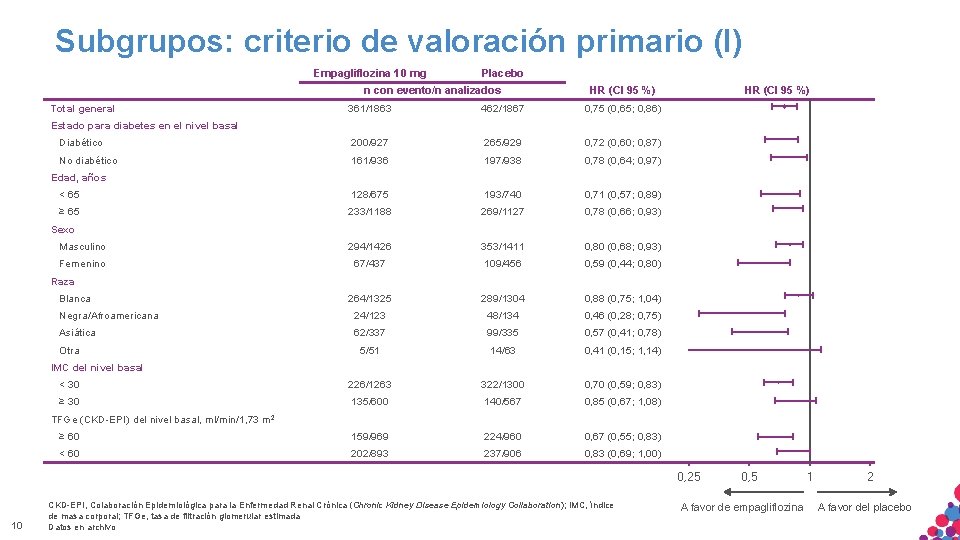
Subgrupos: criterio de valoración primario (I) Empagliflozina 10 mg Placebo n con evento/n analizados Total general HR (CI 95 %) 361/1863 462/1867 0, 75 (0, 65; 0, 86) Diabético 200/927 265/929 0, 72 (0, 60; 0, 87) No diabético 161/936 197/938 0, 78 (0, 64; 0, 97) < 65 128/675 193/740 0, 71 (0, 57; 0, 89) ≥ 65 233/1188 269/1127 0, 78 (0, 66; 0, 93) Masculino 294/1426 353/1411 0, 80 (0, 68; 0, 93) Femenino 67/437 109/456 0, 59 (0, 44; 0, 80) 264/1325 289/1304 0, 88 (0, 75; 1, 04) Negra/Afroamericana 24/123 48/134 0, 46 (0, 28; 0, 75) Asiática 62/337 99/335 0, 57 (0, 41; 0, 78) 5/51 14/63 0, 41 (0, 15; 1, 14) 226/1263 322/1300 0, 70 (0, 59; 0, 83) 135/600 140/567 0, 85 (0, 67; 1, 08) ≥ 60 159/969 224/960 0, 67 (0, 55; 0, 83) < 60 202/893 237/906 0, 83 (0, 69; 1, 00) HR (CI 95 %) Estado para diabetes en el nivel basal Edad, años Sexo Raza Blanca Otra IMC del nivel basal < 30 ≥ 30 TFGe (CKD-EPI) del nivel basal, ml/min/1, 73 m 2 0, 25 10 CKD-EPI, Colaboración Epidemiológica para la USO Enfermedad Renal Crónica (Chronic Kidney Disease Epidemiology. NO Collaboration); índice. NI MATERIAL SÓLO APTO PARA INTERNO. ESTRICTAMENTE CONFIDENCIAL. COPIAR, IMC, CITAR de masa corporal; TFGe, tasa de filtración glomerular estimada DISTRIBUIR EXTERNAMENTE. Datos en archivo 0, 5 A favor de empagliflozina 1 2 A favor del placebo

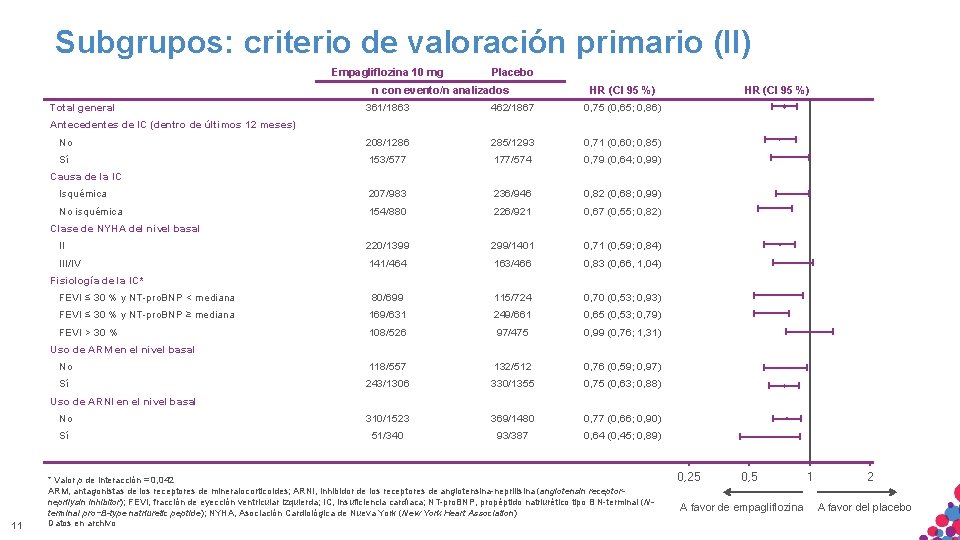
Subgrupos: criterio de valoración primario (II) Empagliflozina 10 mg Placebo n con evento/n analizados Total general HR (CI 95 %) 361/1863 462/1867 0, 75 (0, 65; 0, 86) No 208/1286 285/1293 0, 71 (0, 60; 0, 85) Sí 153/577 177/574 0, 79 (0, 64; 0, 99) Isquémica 207/983 236/946 0, 82 (0, 68; 0, 99) No isquémica 154/880 226/921 0, 67 (0, 55; 0, 82) II 220/1399 299/1401 0, 71 (0, 59; 0, 84) III/IV 141/464 163/466 0, 83 (0, 66, 1, 04) FEVI ≤ 30 % y NT-pro. BNP < mediana 80/699 115/724 0, 70 (0, 53; 0, 93) FEVI ≤ 30 % y NT-pro. BNP ≥ mediana 169/631 249/661 0, 65 (0, 53; 0, 79) FEVI > 30 % 108/526 97/475 0, 99 (0, 76; 1, 31) No 118/557 132/512 0, 76 (0, 59; 0, 97) Sí 243/1306 330/1355 0, 75 (0, 63; 0, 88) No 310/1523 369/1480 0, 77 (0, 66; 0, 90) Sí 51/340 93/387 0, 64 (0, 45; 0, 89) HR (CI 95 %) Antecedentes de IC (dentro de últimos 12 meses) Causa de la IC Clase de NYHA del nivel basal Fisiología de la IC* Uso de ARM en el nivel basal Uso de ARNI en el nivel basal 11 * Valor p de interacción = 0, 042 ARM, antagonistas de los receptores de mineralocorticoides; ARNI, inhibidor de los receptores de angiotensina-neprilisina (angiotensin receptorneprilysin inhibitor); FEVI, fracción de eyección ventricular izquierda; IC, insuficiencia cardíaca; NT-pro. BNP, propéptido natriurético tipo B N-terminal (NMATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI terminal pro−B-type natriuretic peptide); NYHA, Asociación Cardiológica de Nueva York (New York Heart Association) DISTRIBUIR EXTERNAMENTE. Datos en archivo 0, 25 0, 5 A favor de empagliflozina 1 2 A favor del placebo

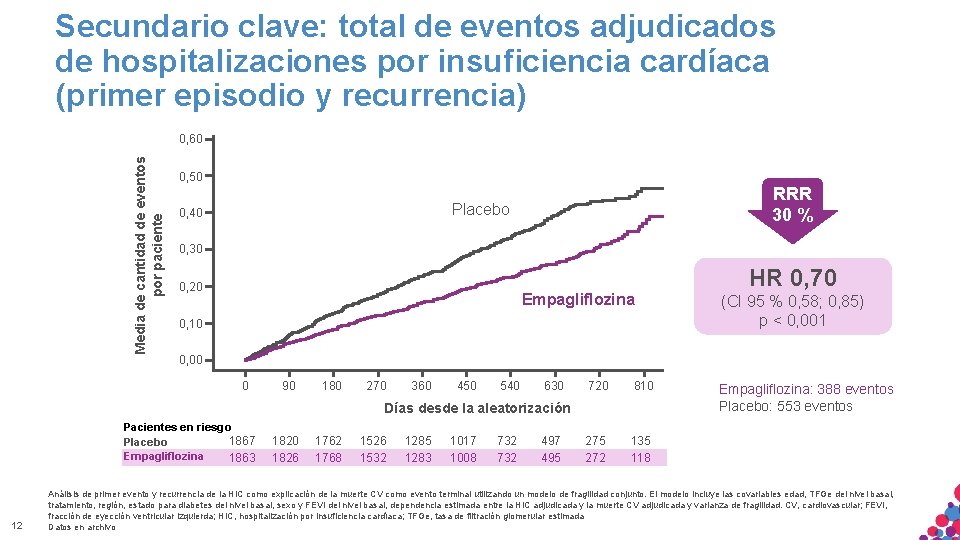
Secundario clave: total de eventos adjudicados de hospitalizaciones por insuficiencia cardíaca (primer episodio y recurrencia) Media de cantidad de eventos por paciente 0, 60 0, 50 RRR 30 % Placebo 0, 40 0, 30 0, 20 Empagliflozina (CI 95 % 0, 58; 0, 85) p < 0, 001 0, 10 0, 00 0 90 180 270 360 450 540 630 720 810 275 272 135 118 Días desde la aleatorización Pacientes en riesgo 1867 Placebo Empagliflozina 1863 12 HR 0, 70 1826 1762 1768 1526 1532 1285 1283 1017 1008 732 497 495 900 Empagliflozina: 388 eventos Placebo: 553 eventos Análisis de primer evento y recurrencia de la HIC como explicación de la muerte CV como evento terminal utilizando un modelo de fragilidad conjunto. El modelo incluye las covariables edad, TFGe del nivel basal, tratamiento, región, estado para diabetes del nivel basal, sexo y FEVI del nivel basal, dependencia estimada entre NO la HIC adjudicada. CITAR y la muerte MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. COPIAR, NI CV adjudicada y varianza de fragilidad. CV, cardiovascular; FEVI, fracción. DISTRIBUIR de eyección ventricular izquierda; HIC, hospitalización por insuficiencia cardíaca; TFGe, tasa de filtración glomerular estimada EXTERNAMENTE. Datos en archivo

Cambio en la pendiente de la TFGe* respecto del nivel basal Durante el tratamiento doble ciego Media del(SE) cambio del nivel basal Media ajustada derespecto TFGe (ml/min/1, 73 2 en la TFGe m 2) (ml/min/1, 73 m ) 0 13 Retiro tras la finalización del estudio† -1 Empagliflozina Placebo -2 -3 -4 Empagliflozina Placebo -5 Empagliflozina vs. placebo (tras el retiro) + 3, 3 ml/min/m 2 (CI 95 % 1, 8; 4, 9) p < 0, 001 +1, 73 -6 Diferencia en la pendiente de la TFGe, ml/min/1, 73 m 2 por año -7 p < 0, 001 -8 0 26 52 78 Semanas desde la aleatorización 104 130 Último valor Sin tratamiento durante Último valorobtenido Sin durante el tratamiento 23 -45 días doble ciego El MMRM incluye edad y valor del nivel basal de TFGe (CKD-EPI)cr como covariables lineales, y puntaje del nivel basal por visita, visita por tratamiento, sexo, región, FEVI del nivel basal, semana alcanzable y † El análisis se realizó en 966 pacientes con datos apareados. CKD-EPI, Colaboración Epidemiológica para la Enfermedad Renal Crónica (Chronic estado MATERIAL para diabetes del nivel APTO basal como efectos fijos. INTERNO. * (CKD-EPI); ESTRICTAMENTE SÓLO PARA USO CONFIDENCIAL. NO COPIAR, CITAR NI Kidney. DISTRIBUIR Disease Epidemiology Collaboration); FEVI, fracción de eyección ventricular izquierda; MMRM, modelo de efectos mixtos para medidas repetidas (mixed model repeated measures); TFGe, tasa de filtración EXTERNAMENTE. glomerular estimada. Datos en archivo

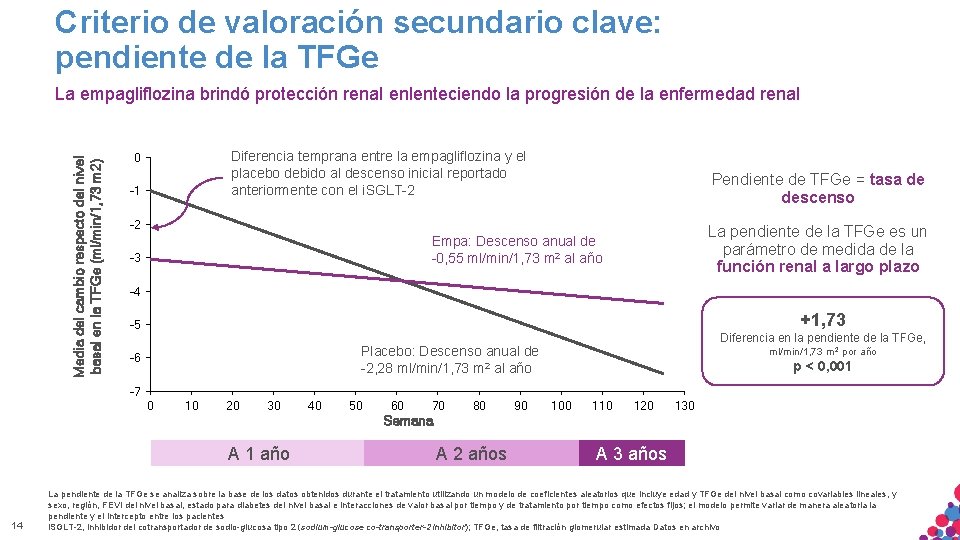
Criterio de valoración secundario clave: pendiente de la TFGe Media del cambio respecto del nivel basal en la TFGe (ml/min/1, 73 m 2) La empagliflozina brindó protección renal enlenteciendo la progresión de la enfermedad renal Diferencia temprana entre la empagliflozina y el placebo debido al descenso inicial reportado anteriormente con el i. SGLT-2 0 -1 Pendiente de TFGe = tasa de descenso -2 La pendiente de la TFGe es un parámetro de medida de la función renal a largo plazo Empa: Descenso anual de -0, 55 ml/min/1, 73 m 2 al año -3 -4 +1, 73 -5 Diferencia en la pendiente de la TFGe, Placebo: Descenso anual de -2, 28 ml/min/1, 73 m 2 al año -6 ml/min/1, 73 m 2 por año p < 0, 001 -7 0 10 20 30 40 50 60 70 80 90 100 110 120 130 Semana A 1 año 14 A 2 años A 3 años La pendiente de la TFGe se analiza sobre la base de los datos obtenidos durante el tratamiento utilizando un modelo de coeficientes aleatorios que incluye edad y TFGe del nivel basal como covariables lineales, y sexo, región, FEVI del. SÓLO nivel basal, estado para diabetes del nivel basal e interacciones de valor basal por tiempo y NO de tratamiento tiempo NI como efectos fijos; el modelo permite variar de manera aleatoria la MATERIAL APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. COPIAR, por. CITAR pendiente y el intercepto entre los pacientes DISTRIBUIR EXTERNAMENTE. i. SGLT-2, inhibidor del cotransportador de sodio-glucosa tipo 2 (sodium-glucose co-transporter-2 inhibitor); TFGe, tasa de filtración glomerular estimada Datos en archivo

Resultados de eficacia destacados: reseña de tres criterios de valoración especificados para las pruebas jerárquicas EMPEROR-Reduced Criterio de valoración primario: Evento adjudicado de muerte CV u hospitalización por insuficiencia cardíaca Confirmatorio* HR 0, 75 (CI 95 %: 0, 65; 0, 86) p < 0, 001 Criterio de valoración secundario clave: Eventos adjudicados de primer episodio y recurrencia de hospitalización por insuficiencia cardíaca Confirmatorio† HR 0, 70 (CI 95 %: 0, 58; 0, 85) p < 0, 001 Criterio de valoración secundario clave: Pendiente de la TFGe Confirmatorio‡ Diferencia en la pendiente 1, 73 ml/min/1, 73 m 2 al año, (CI 95 %: 1, 1; 2, 4) p < 0, 001 15 * Modelo de regresión de Cox con a = 0, 0496, † Modelo de fragilidad conjunto de eventos adjudicados de HIC y muerte CV con a = 0, 0496, ‡ Modelo con términos aleatorios en intercepto y pendiente con a = 0, 001 MATERIAL SÓLOlas. APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, Todos los modelos incluyen covariables edad, TFGe del nivel basal, región, estado para diabetes del nivel basal, sexo y FEVI CITAR NI DISTRIBUIR EXTERNAMENTE. CV, cardiovascular; FEVI, fracción de eyección ventricular izquierda; HIC, hospitalización por insuficiencia cardíaca; TFGe, tasa de filtración glomerular estimada Datos en archivo

Resultados de eficacia destacados: reseña de tres criterios de valoración especificados para las pruebas jerárquicas EMPEROR-Reduced 16 Criterio de valoración primario: Evento adjudicado de muerte CV u hospitalización por insuficiencia cardíaca Confirmatorio* Criterio de valoración secundario clave: Eventos adjudicados de primer episodio y recurrencia de hospitalización por insuficiencia cardíaca Confirmatorio† Criterio de valoración secundario clave: Pendiente de la TFGe Confirmatorio‡ * Modelo de regresión de Cox con a = 0, 0496, † Modelo de fragilidad conjunto de eventos adjudicados de HIC y muerte CV con a = 0, 0496, ‡ Modelo con términos aleatorios en intercepto y pendiente con a = 0, 001 MATERIAL SÓLOlas. APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, Todos los modelos incluyen covariables edad, TFGe del nivel basal, región, estado para diabetes del nivel basal, sexo y FEVI CITAR NI DISTRIBUIR EXTERNAMENTE. CV, cardiovascular; FEVI, fracción de eyección ventricular izquierda; HIC, hospitalización por insuficiencia cardíaca; TFGe, tasa de filtración glomerular estimada Datos en archivo

Criterios de valoración exploratorios FOR INTERNAL USE ONLY. STRICTLY CONFIDENTIAL. DO NOT COPY, DETAIL OR DISTRIBUTE EXTERNALLY.

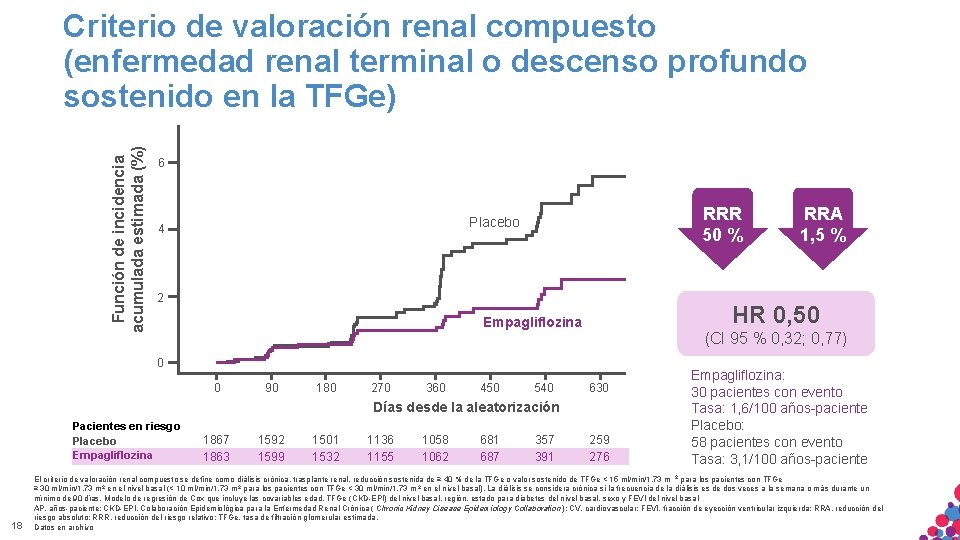
Función de incidencia acumulada estimada (%) Criterio de valoración renal compuesto (enfermedad renal terminal o descenso profundo sostenido en la TFGe) 6 RRR 50 % Placebo 4 2 HR 0, 50 Empagliflozina (CI 95 % 0, 32; 0, 77) 0 0 90 180 270 360 450 540 630 Días desde la aleatorización Pacientes en riesgo Placebo Empagliflozina 18 1867 1863 1592 1599 1501 1532 1136 1155 1058 1062 681 687 357 391 RRA 1, 5 % 259 276 720 Empagliflozina: 30810 pacientes con evento Tasa: 1, 6/100 años-paciente Placebo: 58 pacientes con evento Tasa: 3, 1/100 años-paciente El criterio de valoración renal compuesto se define como diálisis crónica, trasplante renal, reducción sostenida de ≥ 40 % de la TFGe o valor sostenido de TFGe < 15 ml/min/1, 73 m 2 para los pacientes con TFGe ≥ 30 ml/min/1, 73 m 2 en el nivel basal (< 10 ml/min/1, 73 m 2 para los pacientes con TFGe < 30 ml/min/1, 73 m 2 en el nivel basal). La diálisis se considera crónica si la frecuencia de la diálisis es de dos veces a la semana o más durante un mínimo de 90 días. Modelo de regresión de Cox que incluye las covariables edad, TFGe (CKD-EPI) del nivel basal, región, estado para diabetes del nivel basal, sexo y FEVI del nivel basal MATERIAL APTO PARA USO ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI AP, años-paciente; CKD-EPI, SÓLO Colaboración Epidemiológica para INTERNO. la Enfermedad Renal Crónica ( Chronic Kidney Disease Epidemiology Collaboration ); CV, cardiovascular; FEVI, fracción de eyección ventricular izquierda; RRA, reducción del riesgo absoluto; RRR, reducción del riesgo relativo; TFGe, tasa de filtración glomerular estimada. DISTRIBUIR EXTERNAMENTE. Datos en archivo

Criterio de valoración primario: primer evento adjudicado de muerte CV u hospitalización por insuficiencia cardíaca Función de incidencia acumulada estimada (%) 40 30 RRR 25 % Placebo RRA 5, 2 % NNT = 19 20 HR 0, 75 Empagliflozina (CI 95 % 0, 65; 0, 86) p < 0, 001 10 0 0 90 180 270 360 450 540 630 720 810 224 231 109 101 Días desde la aleatorización Pacientes en riesgo 1867 Placebo Empagliflozina 1863 19 1715 1763 1612 1677 1345 1424 1108 1172 854 909 611 645 410 423 Empagliflozina: 361 pacientes con evento Tasa: 15, 8/100 años-paciente Placebo: 462 pacientes con evento Tasa: 21, 0/100 años-paciente Modelo de regresión de Cox que incluye las covariables edad, TFGe del nivel basal, región geográfica, estado para diabetes del nivel basal, sexo, FEVI y tratamiento CV, cardiovascular; fracción de eyección ventricular izquierda; ESTRICTAMENTE RRA, reducción del riesgo absoluto; RRR, reducción del riesgo. CITAR relativo; NI TFGe, tasa de filtración glomerular estimada. MATERIALFEVI, SÓLO APTO PARA USO INTERNO. CONFIDENCIAL. NO COPIAR, CNT: cantidad que es necesario a tratar DISTRIBUIR EXTERNAMENTE. Datos en archivo

EMPEROR-Reduced: efecto en los componentes individuales del criterio de valoración primario Empagliflozina (n = 1863) Criterio de valoración compuesto primario Primera hospitalización por insuficiencia cardíaca Muerte cardiovascular 20 Placebo (n = 1867) Cociente de riesgos instantáneos [HR] (CI 95 %) Cantidad de eventos (%) Eventos/ 100 añospaciente 361 (19, 4) 15, 8 462 (24, 7) 21, 0 0, 75 (0, 65; 0, 86) 246 (13, 2) 10, 7 342 (18, 3) 15, 5 0, 69 (0, 59; 0, 81) 187 (10, 0) 7, 6 202 (10, 8) 8, 1 0, 92 (0, 75; 1, 12) MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI DISTRIBUIR EXTERNAMENTE. Datos en archivo Valor p < 0, 001

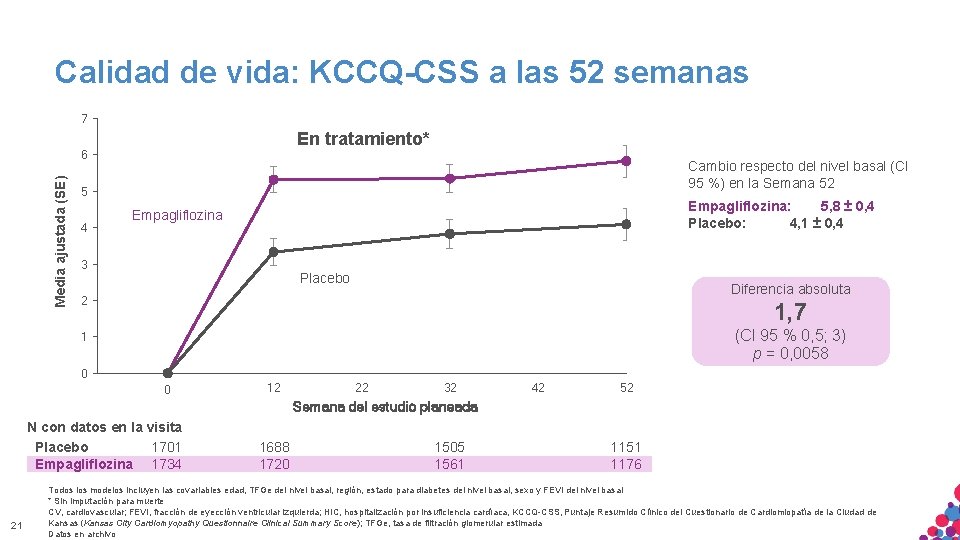
Calidad de vida: KCCQ-CSS a las 52 semanas 7 En tratamiento* Media ajustada (SE) 6 Cambio respecto del nivel basal (CI 95 %) en la Semana 52 5 Empagliflozina: 5, 8 ± 0, 4 Placebo: 4, 1 ± 0, 4 Empagliflozina 4 3 Placebo Diferencia absoluta 2 1, 7 (CI 95 % 0, 5; 3) p = 0, 0058 1 0 -8 0 2 12 22 32 42 52 Semana del estudio planeada N con datos en la visita Placebo 1701 Empagliflozina 1734 21 1688 1720 1505 1561 1151 1176 Todos los modelos incluyen las covariables edad, TFGe del nivel basal, región, estado para diabetes del nivel basal, sexo y FEVI del nivel basal * Sin imputación para muerte MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI CV, cardiovascular; FEVI, fracción de eyección ventricular izquierda; HIC, hospitalización por insuficiencia cardíaca, KCCQ-CSS, Puntaje Resumido Clínico del Cuestionario de Cardiomiopatía de la Ciudad de EXTERNAMENTE. Kansas. DISTRIBUIR (Kansas City Cardiomyopathy Questionnaire Clinical Summary Score); TFGe, tasa de filtración glomerular estimada Datos en archivo

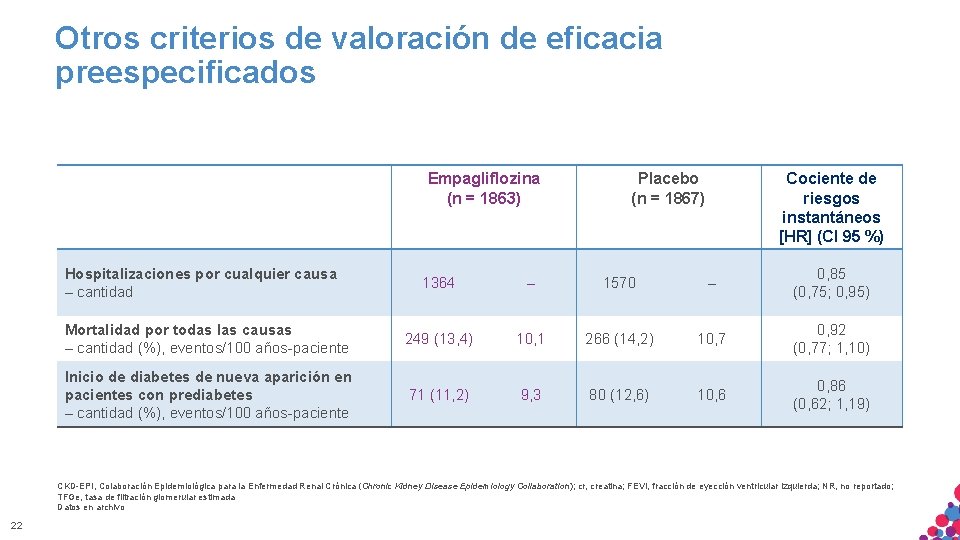
Otros criterios de valoración de eficacia preespecificados Empagliflozina (n = 1863) Hospitalizaciones por cualquier causa – cantidad Placebo (n = 1867) Cociente de riesgos instantáneos [HR] (CI 95 %) 1364 – 1570 – 0, 85 (0, 75; 0, 95) Mortalidad por todas las causas – cantidad (%), eventos/100 años-paciente 249 (13, 4) 10, 1 266 (14, 2) 10, 7 0, 92 (0, 77; 1, 10) Inicio de diabetes de nueva aparición en pacientes con prediabetes – cantidad (%), eventos/100 años-paciente 71 (11, 2) 9, 3 80 (12, 6) 10, 6 0, 86 (0, 62; 1, 19) CKD-EPI, Colaboración Epidemiológica para la Enfermedad Renal Crónica (Chronic Kidney Disease Epidemiology Collaboration); cr, creatina; FEVI, fracción de eyección ventricular izquierda; NR, no reportado; TFGe, tasa de filtración glomerular estimada MATERIAL Datos en archivo SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI 22 DISTRIBUIR EXTERNAMENTE.

Cambios en los signos vitales y los hallazgos de laboratorio Mediciones de laboratorio y de otro tipo (cambio entre el nivel basal y la semana 52) Empagliflozina (n = 1863) Placebo (n = 1867) Hemoglobina glicosilada (%) en pacientes con diabetes – media (SE) -0, 29 ± 0, 03 -0, 10 ± 0, 03 -0, 19 (-0, 27 a -0, 10) Hematocrito (%) – media (SE) 2, 08 ± 0, 10 -0, 31 ± 0, 10 2, 40 (2, 12; 2, 68) -247 (-912; 260) -145 (-766; 567) 0, 87 (0, 82; 0, 93) -0, 73 ± 0, 13 0, 08 ± 0, 13 -0, 82 (-1, 18 a -0, 45) -2, 4 ± 0, 4 -1, 7 ± 0, 4 -0, 7 (-1, 8 a 0, 4) NT-pro. BNP (pg/ml) – mediana (IQR) Peso corporal (kg) – media (SE) Presión arterial sistólica (mm Hg) – media (SE) 23 Cociente de riesgos instantáneos [HR] (CI 95 %) CKD-EPI, Colaboración Epidemiológica para la USO Enfermedad Renal Crónica (Chronic Kidney Disease Epidemiology. NO Collaboration); creatina; MATERIAL SÓLO APTO PARA INTERNO. ESTRICTAMENTE CONFIDENCIAL. COPIAR, cr, CITAR NIFEVI, fracción de eyección ventricular izquierda; NT-pro. BNP, propéptido. EXTERNAMENTE. natriurético tipo B N-terminal (N-terminal pro−B-type natriuretic peptide); TFGe, tasa de filtración glomerular estimada DISTRIBUIR Datos en archivo

Eventos adversos serios y eventos adversos de interés preespecificados Pacientes con EA de cualquier tipo EA serios de especial interés Depleción del volumen Hipotensión sintomática Cetoacidosis Eventos de hipoglucemia severa confirmados‡ En pacientes con diabetes tipo 2 En pacientes sin diabetes tipo 2 Infecciones de las vías urinarias complicadas Infecciones genitales complicadas Fracturas óseas Eventos que condujeron a amputación de miembro inferior Empagliflozina (n = 1863) – N (%) Placebo (n = 1863) – N (%) 1420 (76, 2) 772 (41, 4) 1463 (78, 5) 896 (48, 1) 197 (10, 6) 176 (9, 4) 106 (5, 7) 0 (0, 0) 27 (1, 4) 20 (2, 2) 7 (0, 7) 91 (4, 9) 19 (1, 0) 31 (1, 7) 6 (0, 3) 45 (2, 4) 184 (9, 9) 163 (8, 7) 103 (5, 5) 0 (0, 0) 28 (1, 5) 22 (2, 4) 6 (0, 6) 83 (4, 5) 15 (0, 8) 12 (0, 6) 5 (0, 3) 42 (2, 3) 13 (0, 7) 10 (0, 5) Los datos que se presentan corresponden a eventos adversos (EA) producidos hasta 7 días después de la interrupción de la medicación del estudio, pero los datos de amputaciones de miembro inferior corresponden al lapso que abarca hasta el fin del estudio † Sobre la base de los términos preferentes reportados de lesión renal aguda, preinsuficiencia renal, * Incluye todos los EASÓLO cardíacos (los cuales comprenden, entre otros, EA de insuficiencia cardíaca); MATERIAL APTO PARA USO ‡INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI azotemia, nefropatía tóxica, oliguria y deterioro renal; EA de hipoglucemia con un valor de glucosa plasmática de ≤ 70 mg/dl o que requirieron tratamiento. Datos en archivo 24 DISTRIBUIR EXTERNAMENTE.

Resultados en contexto FOR INTERNAL USE ONLY. STRICTLY CONFIDENTIAL. DO NOT COPY, DETAIL OR DISTRIBUTE EXTERNALLY.

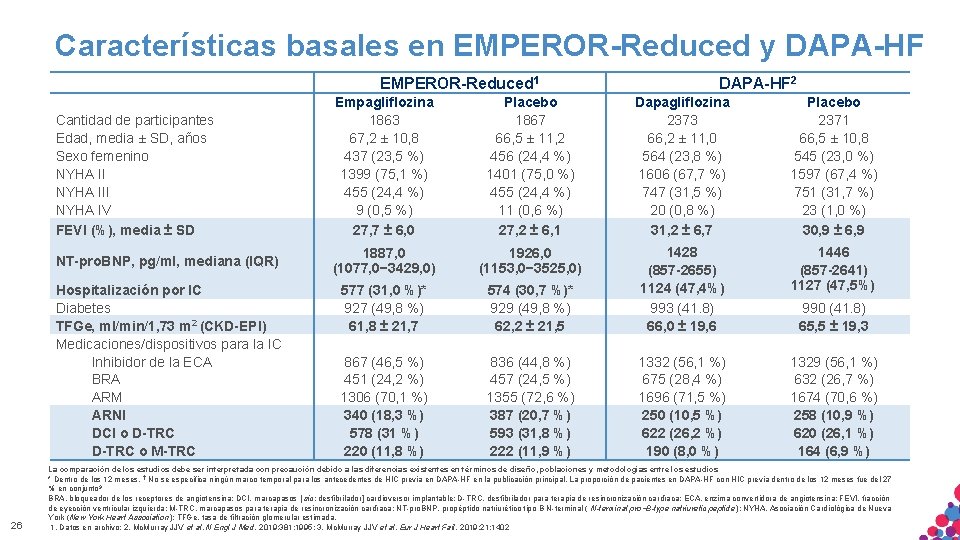
Características basales en EMPEROR-Reduced y DAPA-HF EMPEROR-Reduced 1 Cantidad de participantes Edad, media ± SD, años Sexo femenino NYHA III NYHA IV FEVI (%), media ± SD NT-pro. BNP, pg/ml, mediana (IQR) Hospitalización por IC Diabetes TFGe, ml/min/1, 73 m 2 (CKD-EPI) Medicaciones/dispositivos para la IC Inhibidor de la ECA BRA ARM ARNI DCI o D-TRC o M-TRC 26 DAPA-HF 2 Empagliflozina 1863 67, 2 ± 10, 8 437 (23, 5 %) 1399 (75, 1 %) 455 (24, 4 %) 9 (0, 5 %) 27, 7 ± 6, 0 Placebo 1867 66, 5 ± 11, 2 456 (24, 4 %) 1401 (75, 0 %) 455 (24, 4 %) 11 (0, 6 %) 27, 2 ± 6, 1 Dapagliflozina 2373 66, 2 ± 11, 0 564 (23, 8 %) 1606 (67, 7 %) 747 (31, 5 %) 20 (0, 8 %) 31, 2 ± 6, 7 Placebo 2371 66, 5 ± 10, 8 545 (23, 0 %) 1597 (67, 4 %) 751 (31, 7 %) 23 (1, 0 %) 30, 9 ± 6, 9 1887, 0 (1077, 0− 3429, 0) 1926, 0 (1153, 0− 3525, 0) 577 (31, 0 %)* 927 (49, 8 %) 61, 8 ± 21, 7 574 (30, 7 %)* 929 (49, 8 %) 62, 2 ± 21, 5 1428 (857 -2655) 1124 (47, 4%) 993 (41. 8) 66, 0 ± 19, 6 1446 (857 -2641) 1127 (47, 5%) 867 (46, 5 %) 451 (24, 2 %) 1306 (70, 1 %) 340 (18, 3 %) 578 (31 %) 220 (11, 8 %) 836 (44, 8 %) 457 (24, 5 %) 1355 (72, 6 %) 387 (20, 7 %) 593 (31, 8 %) 222 (11, 9 %) 1332 (56, 1 %) 675 (28, 4 %) 1696 (71, 5 %) 250 (10, 5 %) 622 (26, 2 %) 190 (8, 0 %) 1329 (56, 1 %) 632 (26, 7 %) 1674 (70, 6 %) 258 (10, 9 %) 620 (26, 1 %) 164 (6, 9 %) 990 (41. 8) 65, 5 ± 19, 3 La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios * Dentro de los 12 meses. † No se especifica ningún marco temporal para los antecedentes de HIC previa en DAPA-HF en la publicación principal. La proporción de pacientes en DAPA-HF con HIC previa dentro de los 12 meses fue del 27 % en conjunto 3 BRA, bloqueador de los receptores de angiotensina; DCI, marcapasos [ sic: desfibrilador] cardioversor implantable; D-TRC, desfibrilador para terapia de resincronización cardíaca; ECA, enzima convertidora de angiotensina; FEVI, fracción MATERIAL SÓLO M-TRC, APTOmarcapasos PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO tipo COPIAR, CITAR NI pro−B-type natriuretic peptide); NYHA, Asociación Cardiológica de Nueva de eyección ventricular izquierda; para terapia de resincronización cardíaca; NT-pro. BNP, propéptido natriurético B N-terminal ( N-terminal York (New York Heart Association); TFGe, tasa de filtración glomerular estimada. DISTRIBUIR EXTERNAMENTE. 1. Datos en archivo; 2. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995; 3. Mc. Murray JJV et al. Eur J Heart Fail. 2019; 21: 1402

Criterios de inclusión y exclusión del estudio Criterios de inclusión EMPEROR-Reduced 1, 2 Edad ≥ 18 años (Japón, edad ≥ 20 años) en la selección IC crónica clase II−IV de la NYHA ICFEr (FEVI ≤ 40 %) Niveles elevados de NT-pro. BNP FE (%) NT-pro. BNP (pg/ml) Pacientes sin FA* ≥ 36 a ≤ 40 ≥ 2500 ≥ 31 a ≤ 35 ≥ 1000 ≤ 30 ≥ 600 ≤ 40 % + HIC dentro de los ≥ 600 12 meses Aplican criterios de inclusión adicionales EMPEROR-Reduced TFGe < 20 ml/min/1, 73 m 2 o necesidad de diálisis DAPA-HF 3 Edad ≥ 18 años IC crónica clase II−IV de la NYHA ICFEr (FEVI ≤ 40 %) NT-pro. BNP ≥ 600 pg/ml o NT-pro. BNP ≥ 400 pg/ml en pacientes con HIC dentro de los 12 meses Pacientes sin FA† Aplican criterios de inclusión adicionales Criterios de exclusión de TFGe Aplican criterios de exclusión adicionales DAPA-HF TFGe < 30 ml/min/1, 73 m 2 o función renal con descenso rápido * El valor de corte para los pacientes con FA es el doble en EMPEROR-Reduced; †En DAPA-HF, los pacientes con FA o aleteo auricular debían tener un valor de NT-pro. BNP ≥ 900 pg/ml independientemente de sus antecedentes de HIC 27 CV, cardiovascular; FA, fibrilación auricular; FE, fracción de eyección; FEVI, fracción de eyección ventricular izquierda; HIC, hospitalización por insuficiencia cardíaca; IC, insuficiencia cardíaca; ICFEp, insuficiencia MATERIAL PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, NI tipo B N-terminal (N-terminal pro−B-type natriuretic peptide); NYHA, cardíaca con fracción de. SÓLO eyección. APTO preservada; ICFEr, insuficiencia cardíaca con fracción de eyección reducida; NT-pro. BNP, propéptido. CITAR natriurético Asociación Cardiológica de. EXTERNAMENTE. Nueva York (New York Heart Association) DISTRIBUIR 1. Clinical. Trials. gov. NCT 03057977 (acceso: Ago-2020); 2. Zannad F et al. ESC-HF 2018; póster P 1755; 3. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995

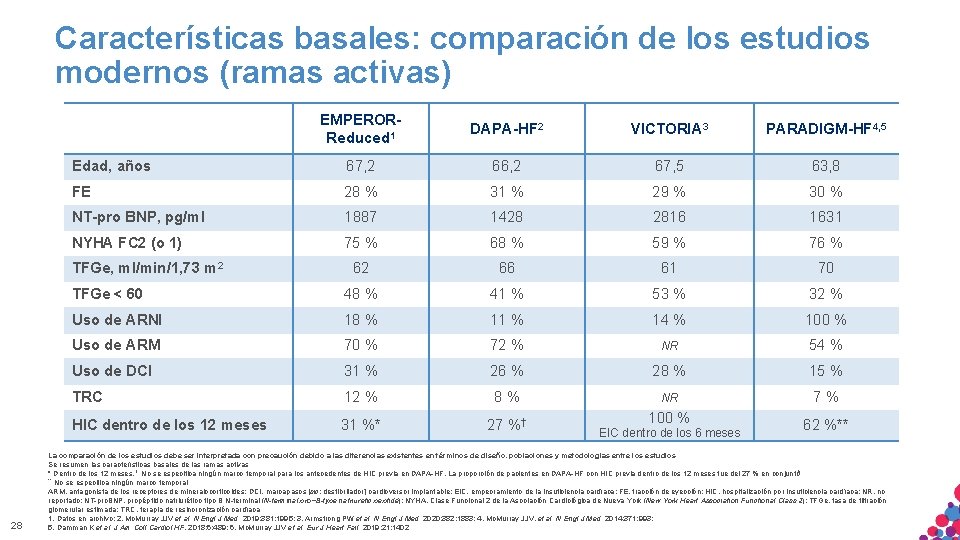
Características basales: comparación de los estudios modernos (ramas activas) EMPERORReduced 1 DAPA-HF 2 VICTORIA 3 PARADIGM-HF 4, 5 Edad, años 67, 2 66, 2 67, 5 63, 8 FE 28 % 31 % 29 % 30 % NT-pro BNP, pg/ml 1887 1428 2816 1631 NYHA FC 2 (o 1) 75 % 68 % 59 % 76 % 62 66 61 70 TFGe < 60 48 % 41 % 53 % 32 % Uso de ARNI 18 % 11 % 14 % 100 % Uso de ARM 70 % 72 % NR 54 % Uso de DCI 31 % 26 % 28 % 15 % TRC 12 % 8% NR 7% HIC dentro de los 12 meses 31 %* 27 %† TFGe, ml/min/1, 73 m 2 28 100 % EIC dentro de los 6 meses 62 %** La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios Se resumen las características basales de las ramas activas * Dentro de los 12 meses. † No se especifica ningún marco temporal para los antecedentes de HIC previa en DAPA-HF. La proporción de pacientes en DAPA-HF con HIC previa dentro de los 12 meses fue del 27 % en conjunto 6 ** No se especifica ningún marco temporal ARM, antagonista de los receptores de mineralocorticoides; DCI, marcapasos [sic: desfibrilador] cardioversor implantable; EIC, empeoramiento de la insuficiencia cardíaca; FE, fracción de eyección; HIC, hospitalización por insuficiencia cardíaca; NR, no reportado; NT-pro. BNP, propéptido natriurético tipo B N-terminal (N-terminal pro−B-type natriuretic peptide); NYHA, Clase Funcional 2 de la Asociación Cardiológica de Nueva York (New York Heart Association Functional Class 2); TFGe, tasa de filtración MATERIAL PARAcardíaca USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI glomerular estimada; TRC, SÓLO terapia de. APTO resincronización 1. Datos. DISTRIBUIR en archivo; 2. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995; 3. Armstrong PW et al. N Engl J Med. 2020; 382: 1883; 4. Mc. Murray JJV, et al. N Engl J Med. 2014; 371: 993; EXTERNAMENTE. 5. Damman K et al. J Am Coll Cardiol HF. 2018; 6: 489; 6. Mc. Murray JJV et al. Eur J Heart Fail. 2019; 21: 1402

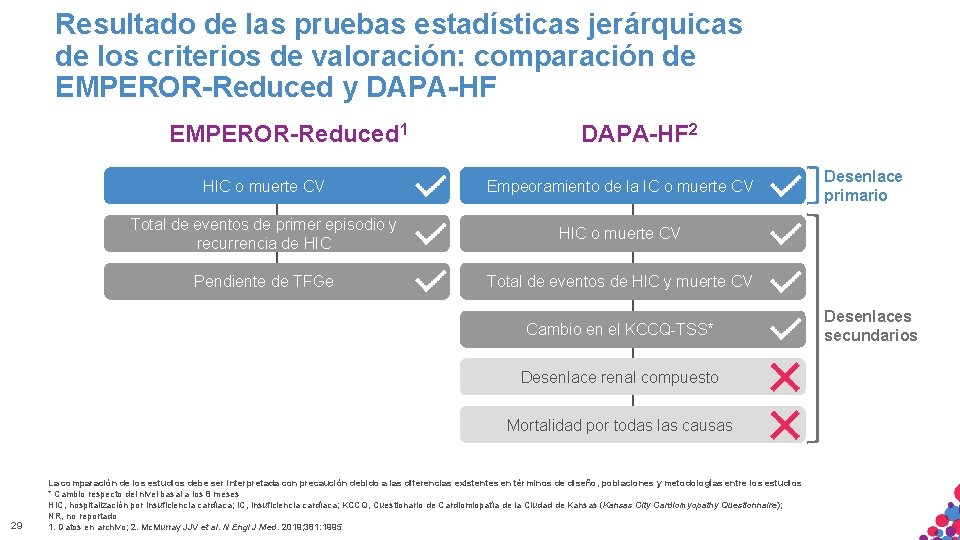
Resultado de las pruebas estadísticas jerárquicas de los criterios de valoración: comparación de EMPEROR-Reduced y DAPA-HF EMPEROR-Reduced 1 DAPA-HF 2 HIC o muerte CV Empeoramiento de la IC o muerte CV Total de eventos de primer episodio y recurrencia de HIC o muerte CV Pendiente de TFGe Total de eventos de HIC y muerte CV Cambio en el KCCQ-TSS* Desenlace renal compuesto Mortalidad por todas las causas 29 La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios * Cambio respecto del nivel basal a los 8 meses HIC, hospitalización insuficiencia cardíaca; KCCQ, Cuestionario de Cardiomiopatía de la Ciudad de Kansas (Kansas MATERIALpor SÓLO APTOcardíaca; PARA IC, USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI City Cardiomyopathy Questionnaire); NR, no. DISTRIBUIR reportado EXTERNAMENTE. 1. Datos en archivo; 2. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995 Desenlace primario Desenlaces secundarios

Resultados del criterio de valoración primario de los estudios modernos Rama de tratamiento activo n (%) EMPEROR-Reduced 1 DAPA-HF 2 PARADIGM-HF 3, 4 VICTORIA 5 30 361 (19, 4 %) Eventos/ 100 añospaciente 15, 8 Placebo/comparador n (%) 462 (24, 7 %) Eventos/ 100 añospaciente HIC + muerte CV* HR: RRA† NNT† 19 21 0, 75 (0, 65; 0, 86) 4, 9 A lo largo de 18 meses A lo largo de 27 meses 5, 2 386 (16, 3 %) 11, 6 502 (21, 2 %) 15, 6 0, 74 (0, 65; 0, 85) 914 (21, 8) 10, 5 1117 (26, 5 %) 13, 2 0, 80 (0, 73; 0, 87) 4, 7 897 (35, 5 %) 33, 6 972 (38, 5 %) 37, 8 0, 90 (0, 82; 0, 98) 3 A lo largo de 16 meses 21 21 36 A lo largo de 11 meses La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios * El criterio de valoración primario para DAPA-HF fue un criterio de valoración compuesto de empeoramiento de la insuficiencia cardíaca o muerte CV. El empeoramiento de la insuficiencia cardíaca se definió como una hospitalización no programada o una consulta de urgencia que conduce a terapia intravenosa para insuficiencia cardíaca. † La información relativa a la RRA y la NNT corresponde a datos no publicados y ha sido calculada. Los datos de RRA se calcularon (fórmula) utilizando los eventos/100 años-paciente (NNT = 1/RRA) MATERIAL APTO USO INTERNO. ESTRICTAMENTE NO COPIAR, CITAR NI NNT, cantidad que es SÓLO necesario tratar; PARA HIC, hospitalización por insuficiencia cardíaca; RRA, CONFIDENCIAL. reducción del riesgo absoluto DISTRIBUIR EXTERNAMENTE. 1. Datos en archivo; 2. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995; 3. Mc. Murray JJV, et al. N Engl J Med. 2014; 371: 993; Butler J et al. Circulation. 2020; doi: 10. 1161/CIRCULATIONAHA. 120. 047086; 5. Armstrong PW et al. N Engl J Med. 2020; 382: 1883

Metaanálisis de DAPA-HF y EMPEROR-Reduced Primera hospitalización por IC o muerte CV i. SGLT-2, n/N (%) Placebo, n/N (%) HR (CI 95 %) EMPEROR-Reduced 361/1863 (19, 4) 462/1867 (24, 7) 0, 75 (0, 65; 0, 86) DAPA-HF 386/2373 (16, 3) 502/2371 (21, 2) 0, 74 (0, 65; 0, 85) Estudio Total HR (CI 95 %) 0, 74 (0, 68; 0, 82) Prueba para el efecto del tratamiento general, p < 0, 0001 Prueba para la heterogeneidad del efecto, p = 0, 89 0 0, 5 1 A favor del fármaco 1, 5 A favor del placebo Muerte CV i. SGLT-2, n/N (%) Placebo, n/N (%) HR (CI 95 %) EMPEROR-Reduced 187/1863 (10, 0) 202/1867 (10, 8) 0, 92 (0, 75; 1, 12) DAPA-HF 227/2373 (9, 6) 273/2371 (11, 5) 0, 82 (0, 69; 0, 98) Estudio Total HR (CI 95 %) 0, 86 (0, 76; 0, 98) Prueba para el efecto del tratamiento general, p = 0, 027 Prueba para la heterogeneidad del efecto, p = 0, 40 0 0, 5 1 A favor del fármaco MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI 31 IC, insuficiencia cardíaca; i. SGLT-2, inhibidor del cotransportador de sodio-glucosa tipo 2 (sodium-glucose co-transporter-2) DISTRIBUIR EXTERNAMENTE. Datos en archivo 1, 5 A favor del placebo

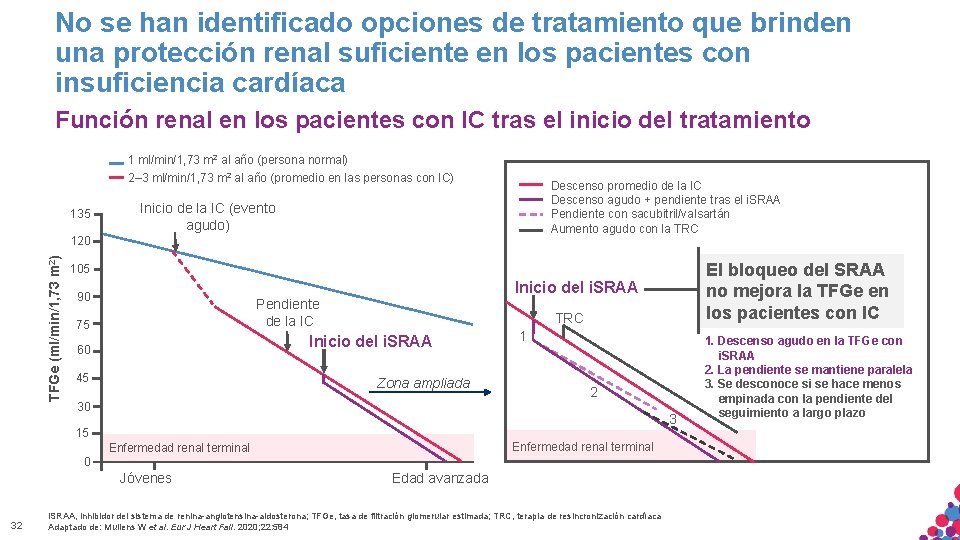
No se han identificado opciones de tratamiento que brinden una protección renal suficiente en los pacientes con insuficiencia cardíaca Función renal en los pacientes con IC tras el inicio del tratamiento 1 ml/min/1, 73 m 2 al año (persona normal) 2– 3 ml/min/1, 73 m 2 al año (promedio en las personas con IC) 135 Descenso promedio de la IC Descenso agudo + pendiente tras el i. SRAA Pendiente con sacubitril/valsartán Aumento agudo con la TRC Inicio de la IC (evento agudo) TFGe (ml/min/1, 73 m 2) 120 Inicio del i. SRAA 90 Pendiente de la IC 75 TRC Inicio del i. SRAA 60 45 Zona ampliada 1 2 30 3 15 Enfermedad renal terminal 0 Jóvenes Edad avanzada MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI 32 El bloqueo del SRAA no mejora la TFGe en los pacientes con IC 105 i. SRAA, DISTRIBUIR inhibidor del sistema de renina-angiotensina-aldosterona; TFGe, tasa de filtración glomerular estimada; TRC, terapia de resincronización cardíaca EXTERNAMENTE. Adaptado de: Mullens W et al. Eur J Heart Fail. 2020; 22: 584 1. Descenso agudo en la TFGe con i. SRAA 2. La pendiente se mantiene paralela 3. Se desconoce si se hace menos empinada con la pendiente del seguimiento a largo plazo

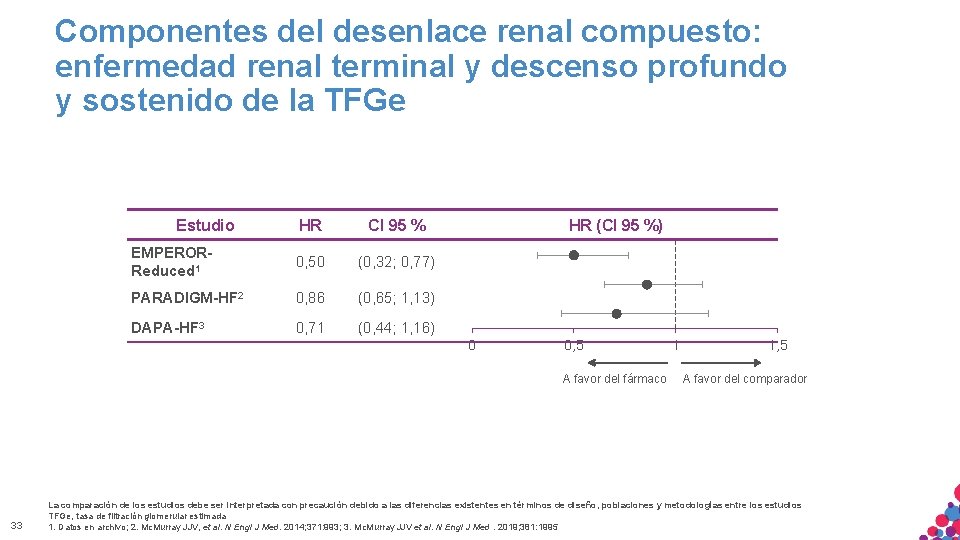
Componentes del desenlace renal compuesto: enfermedad renal terminal y descenso profundo y sostenido de la TFGe HR CI 95 % EMPERORReduced 1 0, 50 (0, 32; 0, 77) PARADIGM-HF 2 0, 86 (0, 65; 1, 13) DAPA-HF 3 0, 71 (0, 44; 1, 16) Estudio HR (CI 95 %) 0 0, 5 A favor del fármaco 33 1 1, 5 A favor del comparador La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI TFGe, DISTRIBUIR tasa de filtración. EXTERNAMENTE. glomerular estimada 1. Datos en archivo; 2. Mc. Murray JJV, et al. N Engl J Med. 2014; 371: 993; 3. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995

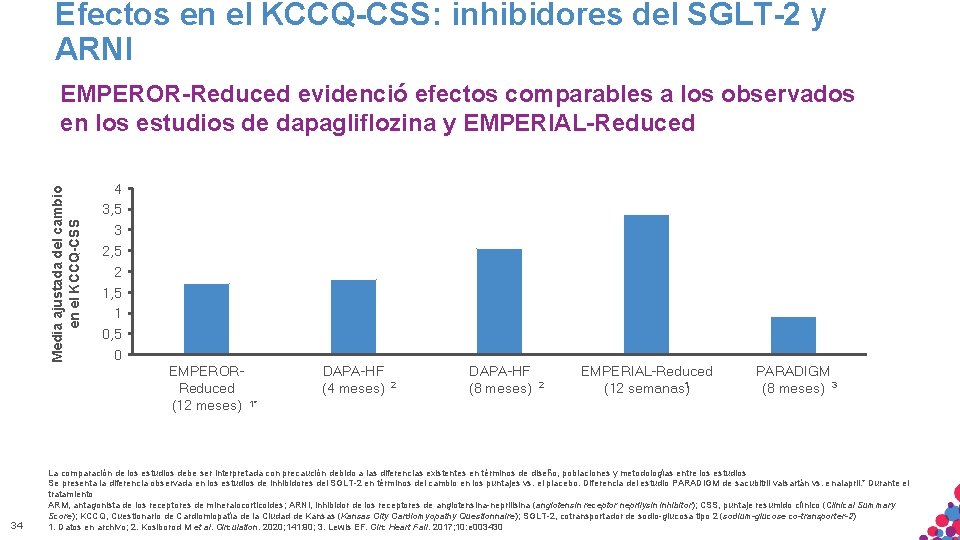
Efectos en el KCCQ-CSS: inhibidores del SGLT-2 y ARNI Media ajustada del cambio en el KCCQ-CSS EMPEROR-Reduced evidenció efectos comparables a los observados en los estudios de dapagliflozina y EMPERIAL-Reduced 4 3, 5 3 2, 5 2 1, 5 1 0, 5 0 EMPERORReduced (12 meses) 34 DAPA-HF (4 meses) 2 DAPA-HF (8 meses) 2 EMPERIAL-Reduced (12 semanas)1 PARADIGM (8 meses) 3 1* La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios Se presenta la diferencia observada en los estudios de inhibidores del SGLT-2 en términos del cambio en los puntajes vs. el placebo. Diferencia del estudio PARADIGM de sacubitril valsartán vs. enalapril. * Durante el tratamiento ARM, antagonista de los receptores de. PARA mineralocorticoides; ARNI, inhibidor de los receptores. CONFIDENCIAL. de angiotensina-neprilisina (angiotensin receptor MATERIAL SÓLO APTO USO INTERNO. ESTRICTAMENTE NO COPIAR, CITAR NIneprilysin inhibitor); CSS, puntaje resumido clínico (Clinical Summary Score); DISTRIBUIR KCCQ, Cuestionario de Cardiomiopatía de la Ciudad de Kansas (Kansas City Cardiomyopathy Questionnaire); SGLT-2, cotransportador de sodio-glucosa tipo 2 (sodium-glucose co-transporter-2) EXTERNAMENTE. 1. Datos en archivo; 2. Kosiborod M et al. Circulation. 2020; 141: 90; 3. Lewis EF. Circ Heart Fail. 2017; 10: e 003430

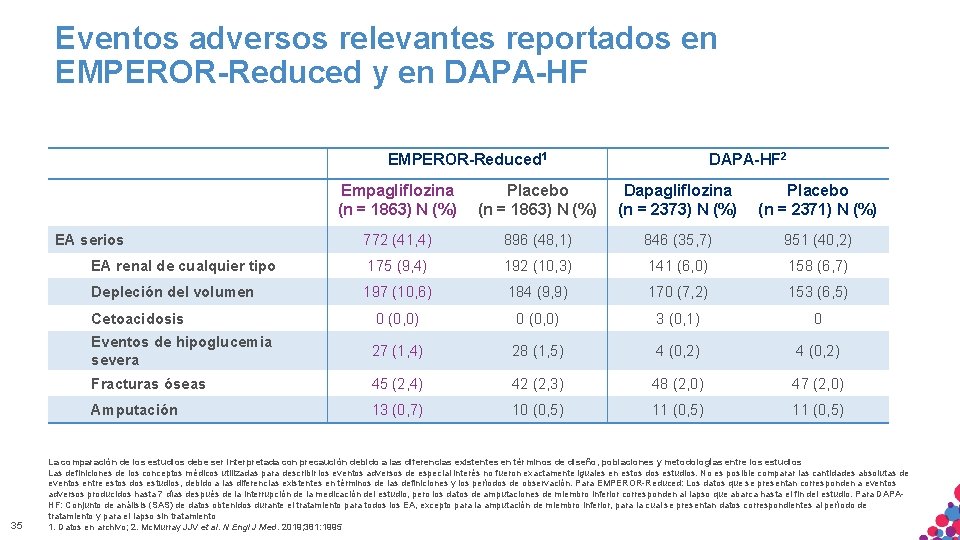
Eventos adversos relevantes reportados en EMPEROR-Reduced y en DAPA-HF EMPEROR-Reduced 1 Empagliflozina (n = 1863) N (%) Placebo (n = 1863) N (%) Dapagliflozina (n = 2373) N (%) Placebo (n = 2371) N (%) 772 (41, 4) 896 (48, 1) 846 (35, 7) 951 (40, 2) EA renal de cualquier tipo 175 (9, 4) 192 (10, 3) 141 (6, 0) 158 (6, 7) Depleción del volumen 197 (10, 6) 184 (9, 9) 170 (7, 2) 153 (6, 5) Cetoacidosis 0 (0, 0) 3 (0, 1) 0 Eventos de hipoglucemia severa 27 (1, 4) 28 (1, 5) 4 (0, 2) Fracturas óseas 45 (2, 4) 42 (2, 3) 48 (2, 0) 47 (2, 0) Amputación 13 (0, 7) 10 (0, 5) 11 (0, 5) EA serios 35 DAPA-HF 2 La comparación de los estudios debe ser interpretada con precaución debido a las diferencias existentes en términos de diseño, poblaciones y metodologías entre los estudios Las definiciones de los conceptos médicos utilizadas para describir los eventos adversos de especial interés no fueron exactamente iguales en estos dos estudios. No es posible comparar las cantidades absolutas de eventos entre estos dos estudios, debido a las diferencias existentes en términos de las definiciones y los períodos de observación. Para EMPEROR-Reduced: Los datos que se presentan corresponden a eventos adversos producidos hasta 7 días después de la interrupción de la medicación del estudio, pero los datos de amputaciones de miembro inferior corresponden al lapso que abarca hasta el fin del estudio. Para DAPAHF: Conjunto de análisis (SAS)APTO de datos obtenidos durante el tratamiento para todos los EA, CONFIDENCIAL. excepto para la amputación de miembro inferior, NI para la cual se presentan datos correspondientes al período de MATERIAL SÓLO PARA USO INTERNO. ESTRICTAMENTE NO COPIAR, CITAR tratamiento y para el lapso sin tratamiento DISTRIBUIR EXTERNAMENTE. 1. Datos en archivo; 2. Mc. Murray JJV et al. N Engl J Med. 2019; 381: 1995

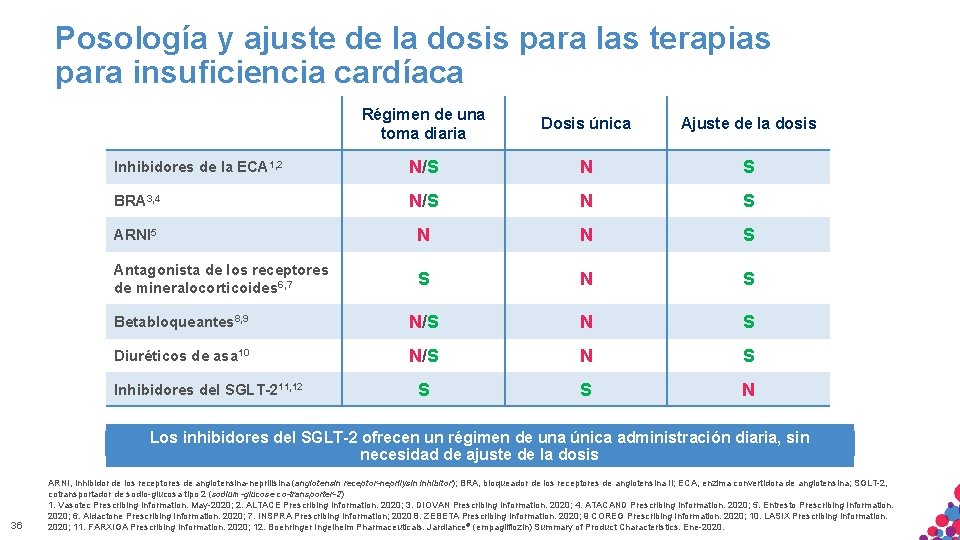
Posología y ajuste de la dosis para las terapias para insuficiencia cardíaca Régimen de una toma diaria Dosis única Ajuste de la dosis Inhibidores de la ECA 1, 2 N/S N S BRA 3, 4 N/S N S ARNI 5 N N S Antagonista de los receptores de mineralocorticoides 6, 7 S N S Betabloqueantes 8, 9 N/S N S Diuréticos de asa 10 N/S N S S S N Inhibidores del SGLT-211, 12 Los inhibidores del SGLT-2 ofrecen un régimen de una única administración diaria, sin necesidad de ajuste de la dosis 36 ARNI, inhibidor de los receptores de angiotensina-neprilisina (angiotensin receptor-neprilysin inhibitor); BRA, bloqueador de los receptores de angiotensina II; ECA, enzima convertidora de angiotensina; SGLT-2, cotransportador de sodio-glucosa tipo 2 (sodium-glucose co-transporter-2) 1. Vasotec Prescribing. SÓLO Information. May-2020; ALTACE Prescribing Information. 2020; 3. DIOVAN Prescribing Information. 2020; CITAR 4. ATACAND MATERIAL APTO PARA 2. USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, NI Prescribing Information. 2020; 5. Entresto Prescribing Information. 2020; 6. Aldactone Prescribing Information. 2020; 7. INSPRA Prescribing Information; 2020 8. ZEBETA Prescribing Information. 2020; 9 COREG Prescribing Information. 2020; 10. LASIX Prescribing Information. DISTRIBUIR EXTERNAMENTE. 2020; 11. FARXIGA Prescribing Information. 2020; 12. Boehringer Ingelheim Pharmaceuticals. Jardiance® (empagliflozin) Summary of Product Characteristics. Ene-2020.

Desequilibrios de electrolitos asociados con las terapias con efecto diurético ARM 1 Hiperpotasemia Diuréticos de asa 2 Tiazidas 5 Acetazolamida 6 Sí Sí Hipopotasemia Hipomagnesemia Sí Sí Sí Hiponatremia Sí Sí Sí Hiperuricemia Sí Sí Sí Hipercalcemia Sí Sí Hipocalcemia Sí Sí Alcalosis hipoclorémica Sí Sí Acidosis metabólica 37 Inhibidores del SGLT-23, 4 Sí Sí ARM, antagonista de los receptores de mineralocorticoides; SGLT-2, cotransportador de sodio-glucosa tipo 2 (sodium-glucose co-transporter-2) 1. Pfizer. Aldactone (spironolactone) Information. Jun-2020; 2. Pfizer. Lasix ® (furosemide) Prescribing Information. Abr-2018; 3. Astra. Zeneca. Farxiga® (dapagliflozin) Prescribing Information. May-2020; MATERIAL SÓLO APTOPrescribing PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI ® (empagliflozin) Summary of Product Characteristics. Ene-2020; 5. Mylan. Hydrochlorothiazide Prescribing Information. May-2011; 6. Duramed Pharmaceuticals. 4. Boehringer Ingelheim Pharmaceuticals. Jardiance DISTRIBUIR EXTERNAMENTE. Diamox® (acetazolamide) Prescribing Information. Nov-2004.

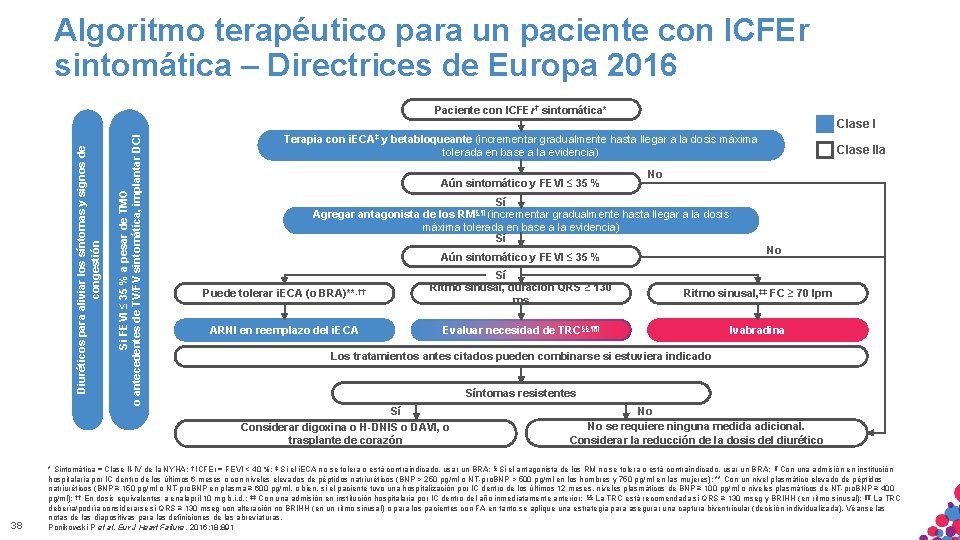
Algoritmo terapéutico para un paciente con ICFEr sintomática – Directrices de Europa 2016 Paciente con ICFEr† sintomática* 38 Si FEVI ≤ 35 % a pesar de TMO o antecedentes de TV/FV sintomática, implantar DCI Diuréticos para aliviar los síntomas y signos de congestión Clase I Terapia con i. ECA‡ y betabloqueante (incrementar gradualmente hasta llegar a la dosis máxima tolerada en base a la evidencia) Aún sintomático y FEVI ≤ 35 % No Sí Agregar antagonista de los RM§, ¶ (incrementar gradualmente hasta llegar a la dosis máxima tolerada en base a la evidencia) Sí Aún sintomático y FEVI ≤ 35 % Puede tolerar i. ECA (o BRA)**, †† ARNI en reemplazo del i. ECA Sí Ritmo sinusal, duración QRS ≥ 130 ms Clase IIa No Ritmo sinusal, ‡‡ FC ≥ 70 lpm Evaluar necesidad de TRC§§, ¶¶ Ivabradina Los tratamientos antes citados pueden combinarse si estuviera indicado Síntomas resistentes Sí Considerar digoxina o H-DNIS o DAVI, o trasplante de corazón No No se requiere ninguna medida adicional. Considerar la reducción de la dosis del diurético * Sintomática = Clase II-IV de la NYHA; † ICFEr = FEVI < 40 %; ‡ Si el i. ECA no se tolera o está contraindicado, usar un BRA; § Si el antagonista de los RM no se tolera o está contraindicado, usar un BRA; ¶ Con una admisión en institución hospitalaria por IC dentro de los últimos 6 meses o con niveles elevados de péptidos natriuréticos (BNP > 250 pg/ml o NT-pro. BNP > 500 pg/ml en los hombres y 750 pg/ml en las mujeres); ** Con un nivel plasmático elevado de péptidos natriuréticos (BNP ≥ 150 pg/ml o NT-pro. BNP en plasma ≥ 600 pg/ml, o bien, si el paciente tuvo una hospitalización por IC dentro de los últimos 12 meses, niveles plasmáticos de BNP ≥ 100 pg/ml o niveles plasmáticos de NT-pro. BNP ≥ 400 pg/ml); †† En dosis equivalentes a enalapril 10 mg b. i. d. ; ‡‡ Con una admisión en institución hospitalaria por IC dentro del año inmediatamente anterior; §§ La TRC está recomendada si QRS ≥ 130 mseg y BRIHH (en ritmo sinusal); ¶¶ La TRC MATERIAL SÓLO APTO PARA USO INTERNO. CONFIDENCIAL. NOse. COPIAR, CITAR NI debería/podría considerarse si QRS ≥ 130 mseg con alteración no BRIHH (en. ESTRICTAMENTE un ritmo sinusal) o para los pacientes con FA en tanto aplique una estrategia para asegurar una captura biventricular (decisión individualizada). Véanse las notas de. DISTRIBUIR las diapositivas para las definiciones de las abreviaturas. EXTERNAMENTE. Ponikowski P et al. Eur J Heart Failure. 2016; 18: 891

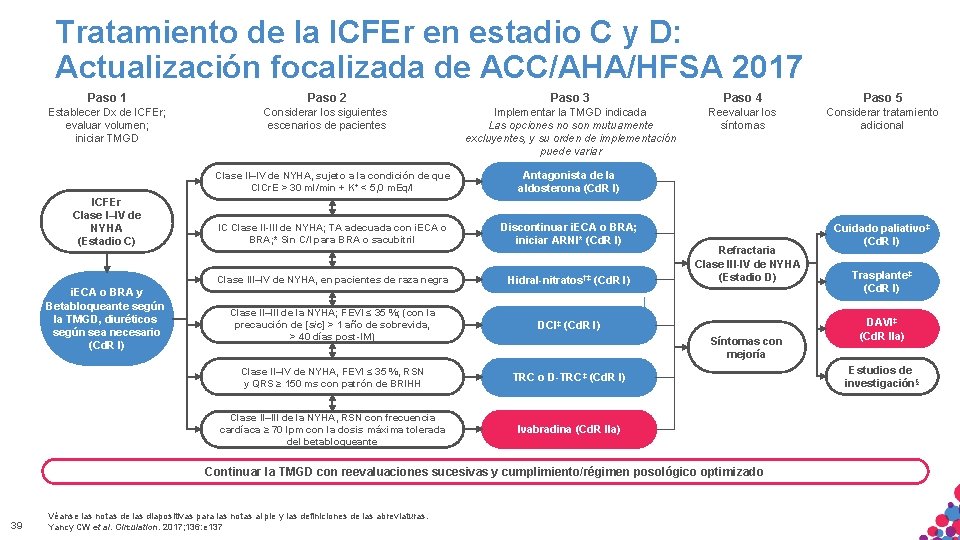
Tratamiento de la ICFEr en estadio C y D: Actualización focalizada de ACC/AHA/HFSA 2017 Paso 1 Paso 2 Paso 3 Paso 4 Paso 5 Establecer Dx de ICFEr; evaluar volumen; iniciar TMGD Considerar los siguientes escenarios de pacientes Implementar la TMGD indicada Las opciones no son mutuamente excluyentes, y su orden de implementación puede variar Reevaluar los síntomas Considerar tratamiento adicional ICFEr Clase I–IV de NYHA (Estadio C) i. ECA o BRA y Betabloqueante según la TMGD, diuréticos según sea necesario (Cd. R I) Clase II–IV de NYHA, sujeto a la condición de que Cl. Cr. E > 30 ml/min + K+ < 5, 0 m. Eq/l Antagonista de la aldosterona (Cd. R I) IC Clase II-III de NYHA; TA adecuada con i. ECA o BRA; * Sin C/I para BRA o sacubitril Discontinuar i. ECA o BRA; iniciar ARNI* (Cd. R I) Clase III–IV de NYHA, en pacientes de raza negra Hidral-nitratos†‡ (Cd. R I) Clase II–III de la NYHA; FEVI ≤ 35 %; (con la precaución de [sic] > 1 año de sobrevida, > 40 días post-IM) DCI‡ (Cd. R I) Clase II–IV de NYHA, FEVI ≤ 35 %, RSN y QRS ≥ 150 ms con patrón de BRIHH TRC o D-TRC‡ (Cd. R I) Clase II–III de la NYHA, RSN con frecuencia cardíaca ≥ 70 lpm con la dosis máxima tolerada del betabloqueante Ivabradina (Cd. R IIa) Refractaria Clase III-IV de NYHA (Estadio D) Síntomas con mejoría Continuar la TMGD con reevaluaciones sucesivas y cumplimiento/régimen posológico optimizado MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI 39 Véanse. DISTRIBUIR las notas de las. EXTERNAMENTE. diapositivas para las notas al pie y las definiciones de las abreviaturas. Yancy CW et al. Circulation. 2017; 136: e 137 Cuidado paliativo‡ (Cd. R I) Trasplante‡ (Cd. R I) DAVI‡ (Cd. R IIa) Estudios de investigación§

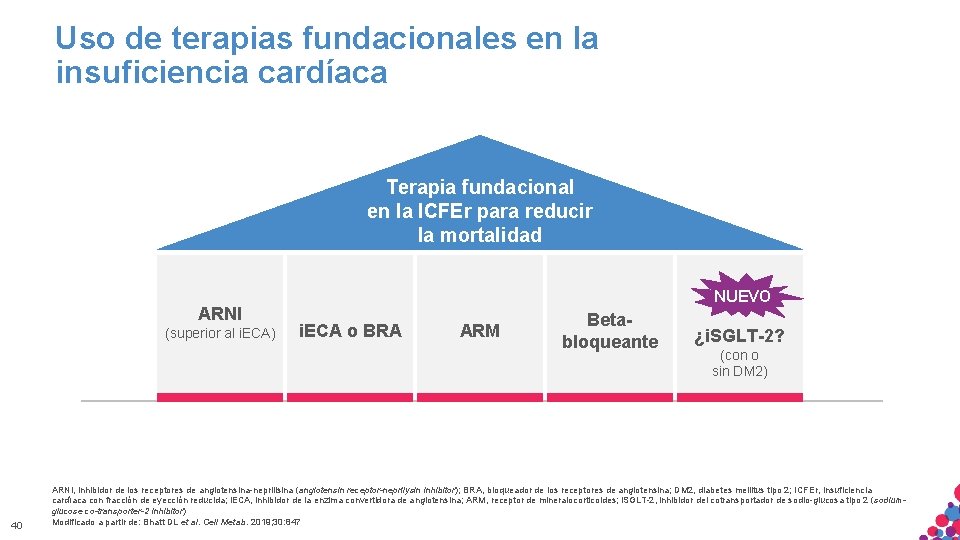
Uso de terapias fundacionales en la insuficiencia cardíaca Terapia fundacional en la ICFEr para reducir la mortalidad ARNI (superior al i. ECA) 40 NUEVO i. ECA o BRA ARM Betabloqueante ¿i. SGLT-2? (con o sin DM 2) ARNI, inhibidor de los receptores de angiotensina-neprilisina (angiotensin receptor-neprilysin inhibitor); BRA, bloqueador de los receptores de angiotensina; DM 2, diabetes mellitus tipo 2; ICFEr, insuficiencia cardíaca con fracción de eyección reducida; i. ECA, inhibidor de la enzima convertidora de angiotensina; ARM, receptor de mineralocorticoides; i. SGLT-2, inhibidor del cotransportador de sodio-glucosa tipo 2 (sodium. MATERIAL SÓLO APTO PARA USO INTERNO. ESTRICTAMENTE CONFIDENCIAL. NO COPIAR, CITAR NI glucose co-transporter-2 inhibitor) DISTRIBUIR EXTERNAMENTE. Modificado a partir de: Bhatt DL et al. Cell Metab. 2019; 30: 847