Fontana di P zza Maggiore Perugia Restauro della











- Slides: 16

Fontana di P. zza Maggiore Perugia Restauro della fontana e ripristino Del progetto originario 1247 Utilizzo di Titanio in sostituzione del ferro piombato originario per correggere la sostituzione in acciaio. Titanio ottima resistenza agli agenti Atmosferici, ridotto coefficiente di dilatazione e conduzione termica. Effetti della T sui materiali e … l’ambiente Acropolis Atene Eretteo: sostituzione di armature in acciaio con strutture in Titanio. Esempi di restauro “negativo” acciaio contro ferro sigillato in piombo. Recupero di restauri “inopportuni” con sostituzione mediante materiali opportuni. Partenone, Athena Nike.

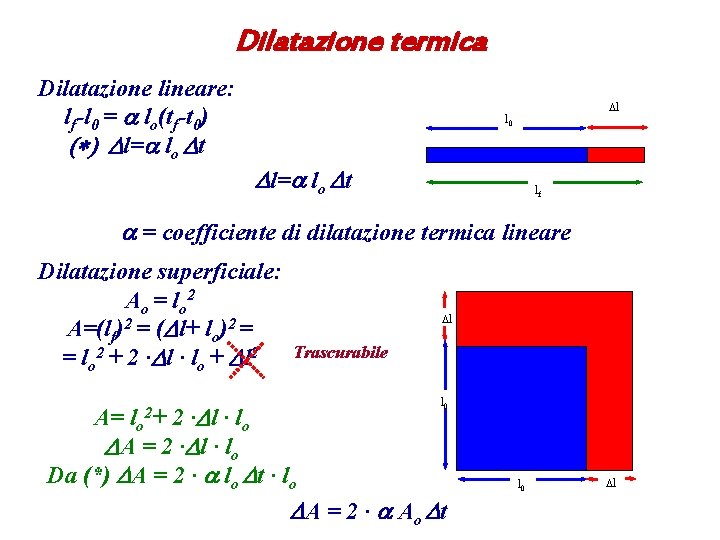
Dilatazione termica Dilatazione lineare: lf-l 0 = a lo(tf-t 0) (*) Dl=a lo Dt Dl l 0 Dl=a lo Dt lf a = coefficiente di dilatazione termica lineare Dilatazione superficiale: Ao = lo 2 A=(lf)2 = (Dl+ lo)2 = = lo 2 + 2 ∙Dl ∙ lo + Dl 2 Dl Trascurabile A= 2 ∙Dl ∙ l o DA = 2 ∙ Dl ∙ l o Da (*) DA = 2 ∙ a lo Dt ∙ lo lo 2+ l 0 DA = 2 ∙ a Ao Dt l 0 Dl

L’effetto della dilatazione superficiale può essere visto come un ingrandimento. Dilatazione cubica: per induzione abbiamo: DV= 3 ∙ a ∙ Vo ∙ Dt Per solidi e fluidi (liquidi e gas) : coefficiente di dilatazione cubica si indica con b. b = 3∙a. Pertanto DV= b ∙ Vo ∙ Dt Per i fluidi non ha senso il coefficiente di dilatazione lineare Sostanza a [10 -6 ºC-1] b [10 -4 ºC-1] Acciaio 304 17. 3 Acqua 2. 1 Ferro 11. 7 Mercurio 1. 8 Titanio 8. 5 Invar 0. 7

Perché all’aumentare di T si ha dilatazione = Ep Maggiore temperatura = Maggiore energia interna = maggiore energia cinetica.

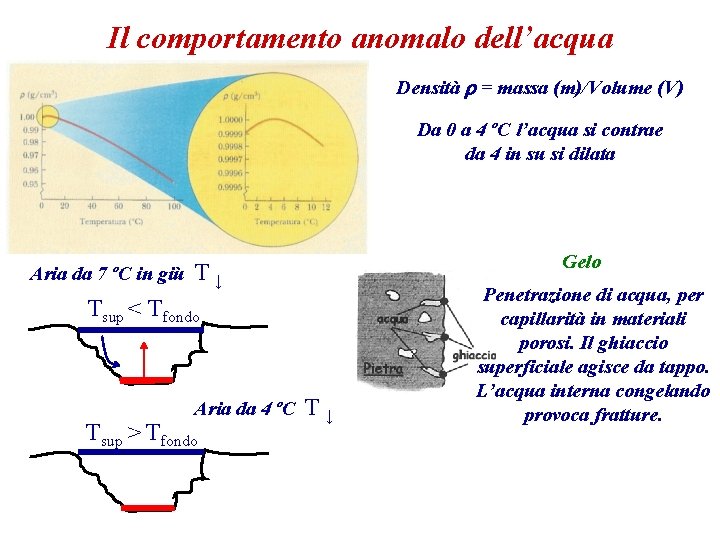
Il comportamento anomalo dell’acqua Densità r = massa (m)/Volume (V) Da 0 a 4 ºC l’acqua si contrae da 4 in su si dilata Aria da 7 ºC in giù Gelo T↓ Tsup < Tfondo Aria da 4 ºC Tsup > Tfondo T↓ Penetrazione di acqua, per capillarità in materiali porosi. Il ghiaccio superficiale agisce da tappo. L’acqua interna congelando provoca fratture.

1976 U. S. Standard dell’aria L’ambiente dove si trova un opera d’arte l’aria: una miscela di gas Azoto Ossigeno Argon Anidride carbonica Neone Elio Kripton Xenon Metano Acqua N 2 O 2 Ar CO 2 Neon He Kr Xe CH 4 H 2 O 78. 08 % 20. 95% 0. 93 % 0. 0314% 0. 001818 0. 000524 0. 000114 0. 0000087 0. 0002 0. 00005 T = 288. 15 K, Pressione 101325 (1. 013 105) Pa (760 mm Hg) Densità 1225 g/m 3 ( 1. 225 g/l )

Grandezze Fisiche ed unità di misura: Unità di misura della LUNGHEZZA Il piede: era letteralmente il piede del re. La iarda: distanza tra l’estremità del braccio disteso e la parte posteriore del collo. Il pollice: distanza tra l’estremità e la nocca del pollice del re. Dopo la rivoluzione francese: l’Assemblea Nazionale incarica l’Accademia delle Scienze di Parigi. Viene definito il sistema metrico decimale. 1791 METRO = 1/10. 000 della distanza polo-equatore Campione in platino-iridio del metro BIPM a Parigi Campione italiano a Roma c/o Ufficio Metrico centrale 1960 metro ottico: 1650763. 73 volte la lunghezza d’onda nel vuoto della luce rosso arancione del (86 Kr) 1983 dalla velocità della luce 299792458 m/s si deriva il campione di 1 metro: distanza percorsa in 1/299792458 s dalla luce nel vuoto

Unità di misura della MASSA Massa: quantità di materia presente in un corpo. 1795 - 1 kilogrammo quantità di materia contenuta in 1000 cm 3 di acqua a 0 ºC. 1799 - 1 kilogrammo quantità di acqua contenuta in 1000 cm 3 di acqua a 4 ºC. 1889 ad oggi – 1 kilogrammo massa del prototipo di platino-iridio, cilindro di h=39 mm e d=39 mm, depositato c/o BIPM a parigi. Campioni italiani a Roma c/o Ufficio Metrico Centrale Unità di massa atomica 1/12 del 12 C = 1. 664 ∙ 10 -27 kg Unità di misura del Tempo Per misurare il tempo si utilizza un fenomeno periodico. Per esempio la rotazione della terra. La suddivisione storica in 24 h, 60’, 60” ha origine dalla civiltà Babilonese, come la suddivisione degli angoli. L’accademia delle scienza ha provato ad utilizzare il sistema decimale senza risultato. 1 sec la durata di 9192631770 oscillazioni di radiazione 133 Cs

Grandezze derivate e analisi dimensionale Energia Cinetica misurata in Joule Energia potenziale grav. misurata in Joule Analisi dimensionale: velocità della luce: Pressione: 1 atm = 1. 013 ∙ 105 Pa = 1013 mbar = 760 Torr = 14. 7 psi (lbf/inch 2)

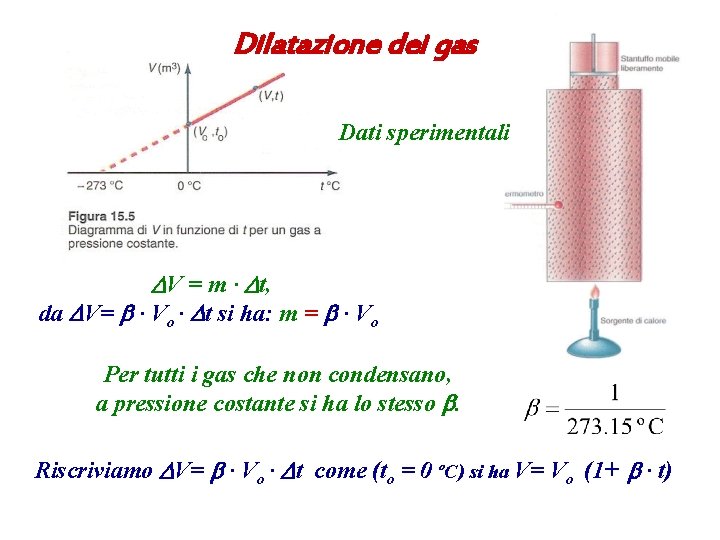
Dilatazione dei gas Dati sperimentali DV = m ∙ Dt, da DV= b ∙ Vo ∙ Dt si ha: m = b ∙ Vo Per tutti i gas che non condensano, a pressione costante si ha lo stesso b. Riscriviamo DV= b ∙ Vo ∙ Dt come (to = 0 ºC) si ha V= Vo (1+ b ∙ t)

Utilità della scala assoluta K o Kelvin tk = T = tc + 273. 16 Conversione di T in gradi Kelvin da ° Celsius 1ª legge di Gay-Lussac o (Volta Gay-Lussac)

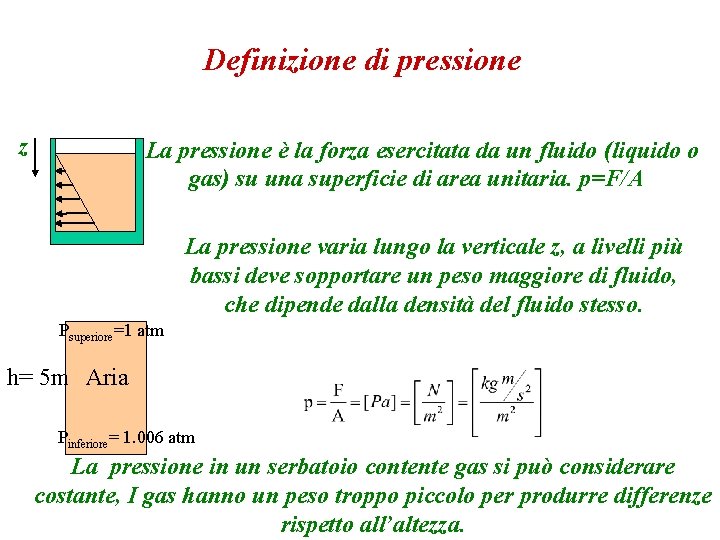
Definizione di pressione z La pressione è la forza esercitata da un fluido (liquido o gas) su una superficie di area unitaria. p=F/A La pressione varia lungo la verticale z, a livelli più bassi deve sopportare un peso maggiore di fluido, che dipende dalla densità del fluido stesso. Psuperiore=1 atm h= 5 m Aria Pinferiore= 1. 006 atm La pressione in un serbatoio contente gas si può considerare costante, I gas hanno un peso troppo piccolo per produrre differenze rispetto all’altezza.

2 nda legge di Gay-Lussac Dp = m’ ∙ Dt, Anche in questo caso si ha m’ = b ∙ po, come per la variazione di volume si aveva m = b ∙ Vo Quindi si ha: 2ª legge di Gay-Lussac o (Volta Gay-Lussac)

Legge di Boyle -Mariotte Si comprima un gas rarefatto con un sistema di termostatazione che permetta di mantenere costante la temperatura, si ottiene il comportamento riportato sopra. Posso riscrivela quindi p 1 V 1= costante p. V= costante e p 2 V 2 =costante ↓ p 1 V 1 = p 2 V 2

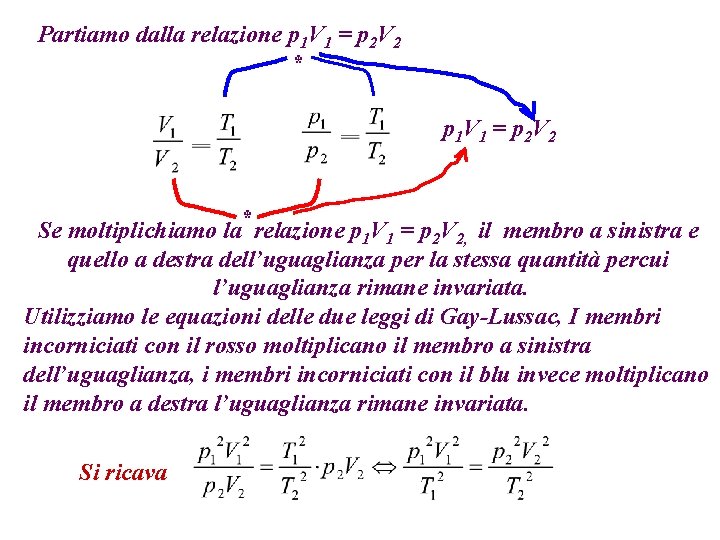
Partiamo dalla relazione p 1 V 1 = p 2 V 2 * p 1 V 1 = p 2 V 2 Se moltiplichiamo la* relazione p 1 V 1 = p 2 V 2, il membro a sinistra e quello a destra dell’uguaglianza per la stessa quantità percui l’uguaglianza rimane invariata. Utilizziamo le equazioni delle due leggi di Gay-Lussac, I membri incorniciati con il rosso moltiplicano il membro a sinistra dell’uguaglianza, i membri incorniciati con il blu invece moltiplicano il membro a destra l’uguaglianza rimane invariata. Si ricava

Equazione di Stato dei Gas perfetti Leggi delle proporzioni costanti e delle proporzioni multiple, per i gas considerando i volumi come esempio si ha: 2 v di idrogeno si combinano con 1 v di Ossigeno per ottenere 2 volumi di vapore acqueo: 2 H 2 + O 2 = 2 H 2 O. Hanno portato alle legge di Avogadro: stessi volumi di gas in condizioni di p e T simile contengono lo stesso numero di molecole. 1 mole a T = 0 °C e p = 1 atm occupa un volume di 22. 4 l. n = numero di moli 1 mole contiene NA=6. 022 1023 molec/mole, n. di Avogadro Numero di Loschmidt NL =2. 69 1019 molec/cm 3
 Complesso maggiore di istocompatibilità funzione
Complesso maggiore di istocompatibilità funzione Chiesa san giacomo maggiore messina
Chiesa san giacomo maggiore messina Manifesto del romanticismo italiano
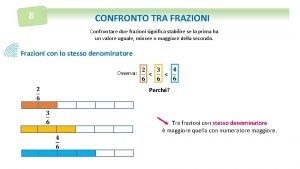
Manifesto del romanticismo italiano Confronto di frazioni
Confronto di frazioni Maria stella della nuova evangelizzazione
Maria stella della nuova evangelizzazione Trapezi scuola primaria
Trapezi scuola primaria Quatremere de quincy restauro
Quatremere de quincy restauro Gustavo giovannoni obras
Gustavo giovannoni obras Istituto centrale restauro
Istituto centrale restauro Boito restauro
Boito restauro Gustavo giovannoni restauro
Gustavo giovannoni restauro Alessandro volta perugia
Alessandro volta perugia Ic pg 6
Ic pg 6 Ic perugia 13
Ic perugia 13 Liceo scientifico galilei perugia
Liceo scientifico galilei perugia Università ecampus fi
Università ecampus fi Aldo capitini perugia
Aldo capitini perugia