Fmek s vegyleteik A fmek kz tartozik az













![Alkálifémek al kili [„alkáli”, „kálium”] (arab) = hamu (K 2 CO 3 = hamuzsír) Alkálifémek al kili [„alkáli”, „kálium”] (arab) = hamu (K 2 CO 3 = hamuzsír)](https://slidetodoc.com/presentation_image_h/9562571977193aa243ac9a1e4e467be8/image-14.jpg)










































- Slides: 58

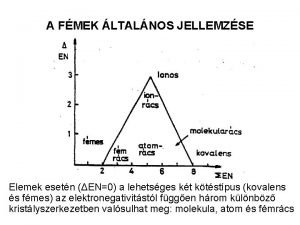
Fémek és vegyületeik A fémek közé tartozik az ismert elemek nagyobbik része (négyötöde). Éles határ nincs a fémek és a nemfémek tulajdonságai között, de elektromos vezetőképességük hőmérsékletemelés hatására bekövetkező változása alapján az elemek e két csoportját egymástól egyértelműen megkülönböztethetjük.

Elhelyezkedésük a periódusos rendszerben

Fémek szerkezete: A pozitív töltésű fématomtörzsek és a vegyértékelektronokból álló szabadon mozgó elektronfelhő közötti vonzást fémes kötésnek nevezzük. A fémes kötés elsőrendű kémiai kötés. A fémes kötés eredménye a fémrács. • Nagyméretű atomok • Kevés és lazán kötött vegyértékelektron • A fémrácsban a vegyértékelektronok az egész rácsra kiterjedő delokalizált elektronrendszert alkotnak • A fémrács háromféle lehet (lapon középpontos kockarács, térben középpontos kockarács, hatszöges rács), befolyásolja a fém megmunkálhatóságát, sűrűségét

A fémek rácstípusai LAPON CENTRÁLT KÖBÖS N=12 Ca, Sr, Ni, Pd, Pt, Cu, Ag, Au TÉRBEN CENTRÁLT KÖBÖS N=14 [8 + 6(15%-al távolabb)] Li, Na, K, Cr, Mo, W HEXAGONÁLIS N=12 (legszorosabb illeszkedés) Mg, Ti, Zr, Hf, Zn, Cd, sok Ln

A fémek fizikai tulajdonságai Jó hő és elektromos vezetőképesség a fémek vezetőképessége a hőmérséklet emelésével csökken ( a nemfémeké ezzel párhuzamosan nő). A fémek elsőfajú vezetők, azaz bennük elektronok vezetnek (nem ionok). A legjobban vezető fémek között van az ezüst és az arany, valamint a réz. Szilárd halmazállapotúak (kivéve higany). A gallium (Ga) olvadáspontja 30 o. C körül van, már az ember tenyerében megolvad! Szürke színűek (kivéve réz és arany) Fémes fény (kis fényáteresztő képesség, nagy fény visszaverő képesség), finom eloszlásban fekete porok (a beeső fényt elnyelik) Szag: a fémek számunkra szagtalanok. Az egyetlen kivétel az ozmium (Os), aminek szúrós szaga van. Keménység: a legpuhább fémek késsel vághatóak (nátrium, kálium), a legkeményebbek közé az ozmium (Os), iridium (Ir), wolfrám (W), a titán(Ti) vagy a króm(Cr) tartozik

A fémek fizikai tulajdonságai Jó megmunkálhatóság (nyújthatók, hajlíthatók, rugalmasak): a fém-fém kötés közepes energiájú és nincs kitüntetett iránya Oldhatóságuk rossz, egymás olvadékában általában oldódnak (ötvözetek keletkeznek): helyettesítéses, vegyület Sűrűség: változó - megkülönböztetünk könnyűfémeket (5 g/cm 3 sűrűség alatt) és nehézfémeket (5 g/cm 3 sűrűség fölött) csoportban lefelé nő (Li 0, 53 g/cm 3, Os 22, 6 g/cm 3) Olvadáspont, forráspont: többségüké magas (> 1000 °C) cseppfolyós fémek: Hg, Cs, Ga olvadáspont tartomány: Hg: -38°C, W: 3410 °C

A fémek kémiai tulajdonságai Pozitív oxidációs állapot kialakítására való hajlam (ionos vagy kovalens vegyületek egyaránt) Oxidjaik: alacsony oxidációs állapotúak bázikusak, a magasak savasak, a közbensőek amfoterek Reakcióképességük széles határok között változik (alkáli fémektől a platina fémekig) mivel szembeni reakcióképesség: hard-szoft sajátság szemcseméret, védőréteg (Al, Fe)

Ötvözetek • Az ötvözetek fémes kötésű összetett anyagok • A folyékony állapotban összekeveredett fémolvadékok a megszilárdulás során nem válnak el egymástól • Ötvözéssel számunkra megfelelőbb tulajdonságú (keményebb, rugalmasabb, korrózióálló) fémek gyárthatók gépalkatrészek, épületelemek, járműgyártás. . . • Fontosabb ötvözetek: • • Bronz: Cu + Sn Ékszerarany: Au + Ag Forrasztóón (cin): Sn + Pb Acél: Fe + C Az ötvözetek összetevője lehet nemfémes elem is • Amalgámok: a higany ötvözetei Ezüstamalgám: Ag + Hg – régen fogtömések anyaga volt.

Ötvözetek típusai Helyettesítéses ötvözet Ha a két fématom mérete hasonló, az ötvöző fém atomjai véletlenszerűen helyettesítik az ötvözendő fém atomjait a rácsban Pl. Au-Ag ékszerarany Rácsközi ötvözet Ha az ötvöző elem atomjai kicsik, beleférnek az ötvözendő fém kristályrácsainak a hézagaiba Pl. Fe-C acél Eutektikum Ha a két fém a kihűlés során külön kristályosodik, az ötvözetben a két fém kristályainak a keveréke lesz jelen Pl. Sn-Pb forrasztóón

Fémek előfordulása Elemi állapotban: az oxigénnel szemben kis reakció-képességű szoft nemesfémek: Au, Ag, Pt +1 - +3(+4) oxidációs állapotú rosszul oldódó sóik (karbonátok, foszfátok, szulfátok) vagy oxidok/hidroxidok (HARD), illetve szulfidok, arzidok (SZOFT) formájában Az üledékes kőzetek a fő nyersanyagforrások. A magmás kőzetek fizikai, mechanikai és kémiai mállásának eredményei kémiai mállás (e/r értéktől függően): <4: oldatba megy és oldatban marad (Na, Mg, Ca) <12: oxoanionként (szulfát, foszfát, kromát, molibdát, stb. ) rosszul oldódó vegyületeket képeznek közbülsők: redukáló közegben oldatba mennek, oxidálóban kiválnak (pl. Fe, Mn)

Fémek előállítása Elektrolitikus redukció • olvadékból: alkáli és alkáli földfémek kloridjai, Al oxidja • oldatból: Cu (réz raffinálás), Co, Ni, Cr, Mn, Ga, Cd, Cementálás nemesebb fémek kiválasztása kevésbé nemes fémekkel (fémhulladékok feldolgozása): In, Tl, Ge, Re, Pt-fémek 2 In 3+ + 3 Fe = 2 In + 3 Fe 2+ Ciánlúgozás (arany- és ezüstércek feldolgozása) érc + 0, 1% Na. CN oldat + levegő 4 Au + 8 Na. CN + 2 H 2 O + O 2 = 4 Na[Au(CN)2] + Na. OH majd Zn-por hozzáadása az oldathoz 4 Na[Au(CN)2] + 2 Zn = 2 Na 2[Zn(CN)4] + 4 Au

Fémek előállítása TERMIKUS BONTÁS drága eljárások nagy tisztaságú fémek előállítására (jodidok, karbonilok, oxidok, azidok hőbontása) van Arkel-de Boer eljárás: a fémjodid (Ti. I 4, Zr. I 4, Hf. I 4, Th. I 4, Bi. I 3) gőzeit vékony ízzó W szálra kondenzáltatják, ahol termikusan bomlik és a fém a szálra rakódik. Fém-karbonilok bontása (Ni(CO)4, W(CO)6, Mo(CO)6) 50°C 230°C Ni + 4 CO —→ Ni(CO)4 —→ Ni + 4 CO (Mond eljárás) 150°C, 20 bar 1 bar Fémhidridek bontása (Ti, V, Nb, Ta, Zr, ritkaföldfémek) Fémoxidok bontása 2 Hg. O → 2 Hg + O 2 Ag 2 CO 3 → Ag 2 O + CO 2 → 2 Ag + ½ O 2

Fémek felhasználása Szerkezeti anyagok megmunkálhatók, könnyűek, kemények, korrózióállóak ötvözetek készíthetők belőlük könnyűfém ötvözetek (Al, Ti, Mg), Fe ötvözetek, nem-Fe ötvözetek, Elektromos vezetők: Cu, Al, W, Kémiai reaktánsok: Na, Ca, Mg, Al, Zn, Katalizátorok: Pt, Pd, Ni, Fe, (és vegyületeik),
![Alkálifémek al kili alkáli kálium arab hamu K 2 CO 3 hamuzsír Alkálifémek al kili [„alkáli”, „kálium”] (arab) = hamu (K 2 CO 3 = hamuzsír)](https://slidetodoc.com/presentation_image_h/9562571977193aa243ac9a1e4e467be8/image-14.jpg)
Alkálifémek al kili [„alkáli”, „kálium”] (arab) = hamu (K 2 CO 3 = hamuzsír) natrun [„nátrium”] (arab) = szóda (Na 2 CO 3) mumifikálás → a testek kiszárítása Alkálifémek felfedezése Nátrium előállítása: 1807 Sir Humphery Davy Na. OH elektrolízise Kálium előállítása: 1807 Sir Humphery Davy Na. OH elektrolízise Sir Humphry Davy (1778 1829) Rubídium: 1861 Bunsen and Kirchhoff spektroszkópia Cézium: 1860 Bunsen and Kirchhoff spektroszkópia Robert W. Bunsen (1811– 1899) Gustav Kirchhoff (1824– 1887)

Alkálifémek I. A oszlop elemei (kivéve hidrogén) • Elektronszerkezet: ns 1 • Vegyérték: 1; oxidációs szám: +1 • Elektronegativitás: 0. 7 -1 (ionvegyületeket képeznek, +1 töltésű ionjaik elektronszerkezete nemesgázszerű, nagyon stabil, ionizációs energia kicsi) • Természetes körülmények között szilárd halmazállapotúak, térközepes kockarácsot alkotnak • Periódusos rendszerben ↓ egyre reakcióképesebbek (egyre könnyebben oxidálódnak) • Periódusos rendszerben ↓ növekvő atomsugár → egyre gyengébb fémes kötés az egyre nagyobb atomok között → csökkenő Op. • lángfestés —Na → sárgára; K → fakóibolyára; Li → kárminvörösre festi a lángot

Alkálifémek Fizikai tulajdonságok • • fémrács → jó áram-, hővezetők puhák, késsel vághatóak szürkék → vágási felületük fémesen csillog levegőn (O 2) maguktól tönkremennek → kéreg (nem véd → petróleum alatt tárolni őket [Li: kicsi sűrűség → paraffinolajban]) • alacsony Op. (~100°C) Kémiai tulajdonságok • kicsi EN, feszültségi sor bal szélén → erős redukálószerek • égésük: 4 Li + O 2 = 2 Li 2 O (Li-oxid) 2 Na + O 2 = Na 2 O 2 (Na-peroxid [O 22 -]) K + O 2 = KO 2 (K-szuperoxid [O 2 -]) • Halogénekkel reagálnak: 2 Na + Cl 2 = 2 Na. Cl • Vízzel hevesreakcióba lépnek: 2 Na + 2 H 2 O = 2 Na. OH + H 2 / 2 K + 2 H 2 O = 2 KOH + H 2 Na. OH → lúgos → lila ← fenolftalein)

Alkálifémek Előfordulás: csak vegyületeikben: Na. Cl (tengervíz, sóbánya), Na 2 CO 3 (Hortobágy), KCl (fedősó) Előállítás: olvadék- vagy oldatelektrolízis kősó olvadékelektrolízise: 2 Na. Cl = (elektromos áram) 2 Na + Cl 2 Felhasználásuk: Li: felhasználás pl. Li-elem Na: folyékony Na hűtéses atomreaktorok, redukálószer K: redukálószer Rb: frekvenciastandard (atomórák) Cs: infravörös lámpák és detektorok, atomóra

Alkálifémek Na és fontosabb vegyületei Nátrium • Nagyon reaktív: 2 Na + 2 H 2 O = 2 Na. OH + H 2 • Természetben fő előfordulási formája: Na. Cl, Na 2 CO 3 • Előállítás: Na. Cl olvadék elektrolízisével • Felhasználás: redukálószer, nátriumgőzlámpa Nátrium-hidroxid (Na. OH) • Fehér kristály (vizes oldata színtelen), nagyon erős bázis • Kristályos állapotban rendkívül higroszkópos, levegőből H 2 O-t, CO 2 -t megköti • Előállítás: Na. Cl-oldat elektrolízisével • Felhasználás: textil- és papíriparban, szappan és mosószergyártás Nátrium-klorid (Na. Cl) • Színtelen kristály • Előfordulás: tengervízben (2. 7%), kősótelepeken, állati szervezetben (emberi vérben 0. 85%) • Előállítás: sóbányákból • Felhasználás: fémnátrium, nátriumvegyületek, klórvegyületek előállítására

Alkálifémek K és fontosabb vegyületei Kálium • Nátriumhoz hasonló, de nála reakcióképesebb (kisebb EN miatt) • Természetben fő előfordulási formája: KCl kősótelepeken Na. Cl kísérőjeként • Előállítás: KCl, KOH vagy K 2 CO 3 olvadék elektrolízisével • Felhasználás: műtrágyagyártás, pirotechnika, robbanóanyag-gyártás Kálium-klorid (KCl) • Jelentőség: növényi szervezetben • Felhasználás: műtrágyagyártás, K és KOH előállítás, méreginjekció, Kálium-hidroxid (KOH) • Fehér kristály (vizes oldata színtelen), Na. OH-nál is erős bázis • Kristályos állapotban rendkívül higroszkópos, levegőből H 2 O-t, CO 2 -t megköti • Oldja az üveget. • Előállítás: KCl-oldat elektrolízisével • Felhasználás: textil- és papíriparban, szappan és mosószergyártás, élelmiszeriparban gyümölcs héjának eltávolítása Kálium-nitrát (KNO 3) • Felhasználás: műtrágya, feketelőpor, füstbomba, élelmiszer tartósítószer (E 252)

Az alkálifémek további fontosabb vegyületei Li 2 CO 3: mániákus depresszió kezelése Li. H, Li. Al. H 4: laboratóriumi redukálószer Na. Cl: konyhasó, laboratóriumban HCl fejlesztés cc H 2 SO 4 + Na. Cl(s) = Na. HSO 4 + HCl(g) (cc H 2 SO 4 + 2 Na. Cl = Na 2 SO 4 + 2 HCl) Sóvidék, Erdély Wieliczka sóbánya, Lengyelország

Az alkálifémek további fontosabb vegyületei Na. OH: nátrium-hidroxid, vizes oldata a nátronlúg laboratóriumban lúg, iparban pl. bauxit feltárása, szappangyártás előállítása Na. Cl vizes oldatának elektrolízise: 2 Na. Cl(aq) + 2 H 2 O(l) = 2 Na. OH(aq) + Cl 2(g) + H 2(g) Na 2 SO 4: nátrium-szulfát, glaubersó laboratóriumban pl. szárítószer (vizet kristályvízként köti meg) iparban pl. papírgyártás Na 2 CO 3: nátrium-karbonát, szóda, sziksó laboratóriumban pl. CO 2 fejlesztés iparban üveggyártás Na. HCO 3: szódabikarbóna (sütőpor) Na. NO 3: nátrium-nitrát, chilei salétrom: műtrágya, régebben puskaporgyártás Na 3 PO 4: nátrium-foszfát: vízlágyítás KCl: kálium-klorid, ásványként: szilvin felhasználás műtrágyaként K 2 CO 3: kálium-karbonát, hamuzsír sziksó, Alföld

Alkáliföldfémek II. A csoport elemei Átmenetet képeznek az alkálifémek és a földfémek között, nevüket is ezért kapták. alkáli: oxidjaik bázis anhidridek, hidroxidjaik lúgos kémhatásúak földfém: oxidjai vízben nem oldódnak „föld”, csak hidroxidjaik nem vagy csak alig oldódnak. Felfedezésük: Be: első előállítás F. Wöhler és A. B. Bussynak 1828, (előtte berill ásvány ism. ) Mg, Ca, Sr, Ba első előállítása: Davy 1808 Ra felfedezése: Pierre és Marie Curie 1911 Elemek neve: Berillium (Be) beryllos (görög: berill féldrágakő) Magnézium (Mg) magnesia (görög: szappankő, talkum) Kálcium (Ca) calx (latin: mész) Stroncium (Sr) Strontian (Skóciában levő ólombánya) Bárium (Ba) barys (görög: nehéz) Rádium (Ra) radius (latin: sugárzó) Szigorúan véve csak a Ca, Sr és Ba igazi alkáliföldfém.

Alkáliföldfémek szerkezete • • • Páros rendszámúak - több stabil izotóp Atomok sugara kisebb - rácsenergia nagyobb mint az alkálifémeké Elektronszerkezet (vegyértékhéj): ns 2 Vegyérték: 2; oxidációs szám: +2 Elektronegativitás: 0. 9 -1. 5 (Mg-tól lefelé ionvegyületeket képeznek, +2 töltésű ionjaiknak nemesgáz elektronszerkezete van, ionizációs energia kicsi) • Berillium nagyobb elektronegativitása (1. 5) miatt inkább kovalens vegyületet képez, bizonyos esetekben a Mg is • Rácsszerkezetük: Lapon centrált kockarács (Ca, Sr) Köbös centrált kockarács (Ba, Ra) • jó elektromos és hővezetők - alkálifémeknél rosszabb - telített s-alhéj • Gőzeik egyatomosak Berillium (félfém-kilóg) - op. , fp. magasabb, rideg, nehezen megmunkálható • Rádium természetes radioaktív elem (t 1/2 = 1600 év)

Alkáliföldfémek Fizikai tulajdonságok • Természetes körülmények között szilárd halmazállapotúak • Sűrűségük, keménységük kicsi (nagyobb mint az alkálifémeké) • Lángfestés jellemző: Stroncium élénkvörös Bárium fakózöld Rádium kárminvörös • Oldódás: egymásban, cseppfolyós ammóniában Kémiai tulajdonságok • Oxigénnel, vízzel reagálnak (kevésbé intenzíven mint az alkálifémek), aktivitásuk a rendszámmal nő (ahogy EN csökken) • Erős redukálószerek (gyengébbek mint az alkálifémek) Cu. O + Mg = Cu + Mg. O • Nagy reakciókészség, a csoportban fentről lefelé nő. (Oxidációsszám +2 vegyületeikben) • Berillium amfoter (nem túl reakcióképes, mert a felületén összefüggő, védő oxidréteg van) Be + 2 HCl = Be. Cl 2 + H 2 Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] +H 2 Komplexképző sajátság

Alkáliföldfémek Előfordulás: Csak vegyületeikben fordulnak elő. A Ca és a Mg a leggyakoribb elemek közé tartozik. • Legfontosabb ásványaik: magnezit (Mg. CO 3), dolomit [Ca. Mg(CO 3)2], mészkő(Ca. CO 3), - utóbbi kettő hegységeket alkot, apatit [Ca 5(PO 4)3 F], anhidrit (Ca. SO 4), gipsz (Ca. SO 4· 2 H 2 O), fluorit vagy folypát (Ca. F 2). • A tengervízben a Na után a legnagyobb mennyiségben a Mg (Mg. Cl 2, Mg. SO 4), majd a Ca(Ca. SO 4) fordul elő. Nagyon gyakoriak szilikátjaik is. • A Be ritka elem, legfontosabb érce a berill (Be-Al-szilikát), amelynek néhány tized% króm(III) - oxiddal szennyezett változata a zöld smaragd drágakő. • A Sr és a Ba közepes gyakoriságú, általában a Ca kísérői, önálló ásványuk a viszonylag ritka stroncianit (Sr. CO 3) és a nagyobb mennyiségben előforduló barit vagy súlypát(Ba. SO 4). Előállítás: leginkább kloridjaik olvadékelektrolízisével történik. Felhasználás: elemenként, vegyületenként változó

Alkáliföldfémek Mg és fontosabb vegyületei Magnézium • Ezüstfehér, könnyű fém. • Természetben csak vegyületben fordul elő: magnezit (Mg. CO 3), a dolomit (Ca. CO 3. Mg. CO 3), • Felületén védő oxidréteg (Mg. O) képződik • Jellegzetes az égése, vakító fehér fényt bocsát ki (égéshő -603 k. J/mol) • Előállítás: Mg. Cl 2 olvadék elektrolízisével, karbonát hevítésével kapott oxid redukciójával • Felhasználás: villanófény, víz alatti fáklya, ötvözetek előállítása repülőgépekhez Magnézium ötvözetek: kis sűrűségű, de nagy szilárdságúak • Magnálium: Al + 5 -50% Mg + nyomokban egyéb elemek kevés Mg: szilárd: repülőgép és autó alkatrészek sok Mg: törékeny, a por gyúlékony: pirotechnikában csillagszóró • Duralumínium: repülőgépek szerkezeti anyagának nagy része

Alkáliföldfémek Mg és fontosabb vegyületei Magnézium-hidroxid (Mg(OH)2) • Gyenge lúg, vízben rosszul oldódik (Mg-O kötés erősen kovalens jellegű) • Előállítás: természetben ásvány formájában előfordul • Felhasználás: gyomorsav megkötő, konzerv gyümölcsök, zöldségek színének tartósítása (E 528) Magnézium-klorid (Mg. Cl 2) • Gyenge sav (savasan hidrolizál): Mg 2+ + 2 H 2 O = Mg(OH)2 + 2 H+ (2 H 3 O+) • Előfordulás: természetben ásvány formájában • Felhasználás: Mg illetve Mg vegyületek előállítására, cementgyártás, USA-ban utak jégtelenítésére • Hidrogéntárolás egy formája: Mg(NH 3)6 Cl 2 formájában sok ammóniát köt meg, mely hevítés hatására könnyen távozik Magnézium-szulfát (Mg. SO 4) keserűsó, Epson-só • Előállítás: természetben heptahidrát formájában (Mg. SO 4. 7 H 2 O) előfordul • Felhasználás: nagy magnézium-igényű növények (burgonya, bors, rózsa) trágyázása, gyógyászatban bélmozgás elősegítő, hashajtó

Alkálifödfémek Ca és fontosabb vegyületei Kalcium • Ezüstfehér színű, könnyű fém. • Lángfestés: téglavörös • Természetben csak vegyületben fordul elő: mészkő, kalcit, márvány (Ca. CO 3), dolomit (Ca. CO 3. Mg. CO 3), fluorit (Ca. F 2) • Előállítás: Ca. Cl 2 ill. Ca. Cl 2+Ca. F 2 olvadék elektrolízisével • Felhasználás: redukálószer, ötvözetek (csapágyfémben 0. 7 %) fluorit kalcit kristályon

Alkáliföldfémek Ca és fontosabb vegyületei Kalcium-karbonát (Ca. CO 3) • Természetben leggyakrabban előforduló Ca-vegyület • Felhasználás: építőipar, csiszolópor, tisztítószer • CO 2 -t tartalmazó vízben hidrokarbonát képződése formájában oldódik, az analóg módon képződő Mg(HCO 3)2 -vel együtt a víz változó keménységét okozva. Ca. CO 3 + H 2 O + CO 2 Ca(HCO 3)2 • változó: forralással megszüntethető (visszaalakulás, CO 2 gáz eltávozik) Állandó keménységet okozó sók: Ca. Cl 2, Ca(NO 3)2, Ca. SO 4, Mg. Cl 2, Mg(NO 3)2, Mg. SO 4 Megszüntetés (vízlágyítás): Ca 2+ és Mg 2+ ionokat csapadék formájában leválasztani, majd szűréssel eltávolítani: Ca 2+ + Na 2 CO 3 = Ca. CO 3 + 2 Na+ 3 Ca 2+ + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 6 Na+ Ioncserélővel: • lágyvíz: lecserélni a Ca 2+ és Mg 2+-ionokat Na+-ionokra • ionmentes víz: a víz összes idegen ionját lecserélni H 3 O+ illetve OH—ionokra.

Alkáliföldfémek Ca és fontosabb vegyületei 1 Kalcium-szulfát (Ca. SO 4. 2 H 2 O) = gipsz • Természetben gipsz 1 ill. evaporit 2 ásványok formájában • Felhasználás: építőipar (cement), iskolai kréta, gyógyászat (gipszelés), tűzálló fal • 100 -150 ºC-ra hevítve a kristályvíz 75%-a távozik (cement, orvosi gipsz): Ca. SO 4. 2 H 2 O → Ca. SO 4. ½H 2 O + 1½H 2 O (tűzálló falban lassan melegszik, mert előbb a kristályvíz távozására fordítódik a hő) • teljesen kiégetett gipsz már nem tud vizet felvenni Kalcium-hidroxid Ca(OH)2 • Ca. CO 3 → CO 2 + Ca. O (égetett mész) • Égetett mészből vízzel (mészoltás): Ca. O + H 2 O → Ca(OH)2 (oltott mész) • Felhasználás: építőiparban habarcs készítésre: Ca(OH)2 + CO 2 → Ca. CO 3 + H 2 O (megkötés a csapadékként kiváló Ca. CO 3 miatt) 2

Alkáliföldfémek Ba és Ra Bárium (Ba) és fontosabb vegyületei: • Természetben Ba. SO 4 (barit) ill. Ba. CO 3 formájában • Lángfestés: sárgászöld • Előállítás: Ba. Cl 2 elektrolízisével • Felhasználás: kontrasztanyagként Ba. SO 4 formájában (jól elnyeli a Röntgen sugarakat) és tűzijátékban. Rádium (Ra) és fontosabb vegyületei • Ritka elem, urán és tóriumásványok mellett, mint azok radioaktív bomlásának terméke • 28 izotópja van, mind radioaktív • A szervezetbe került rádium a csontokba beépül • Felhasználás: régebben sugárterápiára, ma már vannak olcsóbb sugárforrások neutronforrás: Be + a-sugárzás(Ra-ból) → neutronok

Az alkáliföldfémek fontosabb vegyületei Vízkeménység A vízben oldott Ca 2+ és Mg 2+ sók. Lehet: • Változó keménység: Ca(HCO 3)2, Mg(HCO 3)2 forralással megszüntethető A vízben oldott Ca(HCO 3)2 és Mg(HCO 3)2 adja a víz változó keménységét. Forralással az ennek megfelelő Ca 2+ és Mg 2+ ion mennyisége kicsapható, így eltávolítható. • Állandó keménység: kalcium és magnézium szulfátjai, kloridjai, nitrátjai. A vízben oldott egyéb Ca- és Mg-vegyületek adják a víz állandó keménységét. Vízlágyító szerrel az ennek megfelelő Ca 2+ és Mg 2+ ion mennyisége kicsapható, így eltávolítható. Német keménységi fok (nko): 1 dm 3 vízben 10 mg Ca. O-val egyenértékű Ca és Mg só van oldva. [Ca 2+] = 1 mmol , 6 nko kemény víz > 15 nko

A vízkeménység hatása: • vízkőkiválás (mosógép, kazánok, bojlerek) • mosásnál a szappan oldhatatlan vegyületet képez a kalcium és magnézium ionnal • főzésnél csapadékok válnak ki a fehérjékkel • romlik a hővezetés, így a fűtőszálra rárakódva rontja a melegítés hatékonyságát • eltömíti a csöveket A kazánok falára kirakódott réteg megrepedésekor a kazán falával érintkező forró víz gőzzé alakulva robbanást okozhat • a kemény víz mosásra alkalmatlan, mert a szappan részecskéivel oldhatatlan csapadékot képez Vízlágyítás: a vízlágyítás során az oldott kalcium és magnéziumionokat távolítjuk el Módszerei: • desztillálás • ioncserélők • vízlágyítók: olyan vegyületek, amelyek oldható komplexet képeznek a kalcium és magnézium ionnal. (fürdősó, habfürdő) • olyan vegyületet adnak a vízhez, amely oldhatatlan vegyületet képez a kalcium és magnézium ionnal (trisó, szóda)

Az alkáliföldfémek fontosabb vegyületei Be. Cl 2: lineáris Lewis-komplex Mg. O: magnézium-oxid, égetett magnézia tűzálló anyagok (téglák, kemencék) előállítás: Mg. CO 3(s) = Mg. O(s) + CO 2(g) (hevítés) Mg(OH)2: magnézium-hidroxid vizes szuszpenzióját gyomorsav megkötésére használják Mg. CO 3: magnézium-karbonát: hintőpor Mg(Cl. O 4)2: magnézium-perklorát laboratóriumi szárítószer Ca. O: kalcium-oxid, égetett mészégetés: Ca. CO 3(s) = Ca. O(s) + CO 2(g) (900ºC) mészoltás: Ca. O(s) + H 2 O(l) = Ca(OH)2(s) Ca(OH)2: kalcium-hidroxid, oltott mész építőipar, fertőtlenítés, fémkohászatban salakképző

Az alkáliföldfémek fontosabb vegyületei Ca. SO 4: kalcium-szulfát, Ca. SO 4 2 H 2 O: gipsz, Ca. SO 4 1/2 H 2 O: égetett gipsz építőipar, gyógyászat Ca 5(PO 4)3 (F, OH, Cl): apatit foszfortartamú műtrágya előállítása Ca. C 2: kalcium-karbid előállítása: Ca. O(s) + 3 C(s) = Ca. C 2(s) + CO(g) felhasználása régebben: karbidlámpák Ca. C 2(s) + 2 H 2 O(l) = Ca(OH)2 + C 2 H 2(g) 2 C 2 H 2(g) + 5 O 2(g) = 4 CO 2(g) + 2 H 2 O(g) Ca. CO 3: kalcium-karbonát, mészkő (pát, kalcit, aragonit) korábban néztük: mészkő oldódása (Ca, Mg)CO 3: dolomit aragonit kalcit

Földfémek Al és vegyületei III/A. oszlop • Elektronszerkezet: ns 2 np 1 • Vegyérték általában: 3 ill. 1 (Ga, In, Tl); oxidációs szám: +3, +1 (Ga, In, Tl) • B félfém, a többi fém. • Elektronegativitás: 1. 6 (Al gyakran képez kovalens kötéseket) • Természetes körülmények között szilárd halmazállapotúak Alumínium (alumen = timsó) • • • Felfedezése: 1825 Hans Christian Oersted Ezüstszürke, alacsony olvadáspontú, könnyűfém Könnyen megmunkálható A hőt és az elektromos áramot jól vezeti Szakítószilárdsága kicsi, rosszul önthető Felületét vékony, tömör oxidréteg borítja, ami megvédi a korróziótól – (ha ez megsérül, reakcióba lép a meleg vízzel, ezért az alumíniumedényeknél erre figyelni kell ) Sósavval (tömény savak nem!) és nátrium-hidroxid-oldattal is reakcióba lép, amfoter elem 2 Al + 3 H 2 SO 4 = Al 2(SO 4)3 + 3 H 2 2 Al + 2 Na. OH + 6 H 2 O = 3 H 2 + 2 Na. Al(OH)4 nátrium[tetrahidroxo-aluminát]

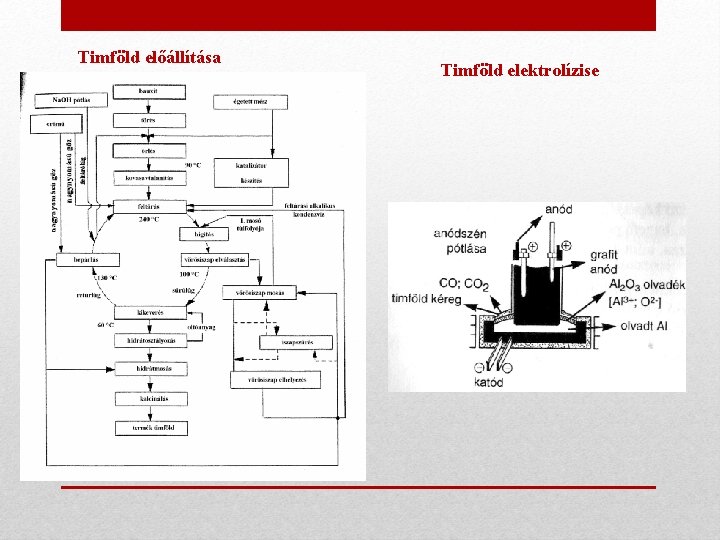
Földfémek Al és vegyületei Előfordulása • Természetben főként bauxitban (Al. O(OH)) ill. agyagásványokban fordul elő, míg a korund tiszta Al 2 O 3 ásvány . • 3. leggyakoribb elem a Föld kérgében Előállítása Érce a bauxit, előállítása ebből két lépésben - lúgos mosással, majd elektrolízissel – történik 1. Bauxitból hidrometallurgiai és pirometallurgiai eljárással timföldet (Al 2 O 3) állítanak elő 2. A timföld elektrolízisével (elektrometallurgiai eljárással) választják le az alumíniumot

Timföld előállítása Timföld elektrolízise

Alumínium Felhasználása: • ötvözetek formájában repülők, autók, vasúti kocsik gyártására • csomagolóanyagként (alufólia, üdítős dobozok) • por alakban redukálószerként fémek előállítására fedőfestékként megfelelő kötőanyaghoz keverve (metál festékek) • elektromos huzalok gyártása • szerkezeti elemek gyártása (állványok stb…) • fémek előállítása (aluminotermikus eljárás) • vegyiparban az ellenállóság kihasználása (pl. : tömény salétromsav tárolása) • timsó • szépségápolás: izzadásgátlókban • Útjelző táblák

Földfémek Al és vegyületei Alumínium ötvözetek • Magnálium, duralumínium (lásd magnéziumnál) • Csoportosítás: - Alakítható (sajtolható) ötvözetek: nagy szilárdság a cél. A keverékek jellege (koncentrációk!) szilárd oldat. Fő ötvözők: Cu, Mn, Mg Duralumínium (4, 5% Cu + 0, 5% Mg + 0, 6% Mn). Cu-ra túltelített, ezért Cu. Al 2 halmazok keletkeznek. Megfelelő kezeléssel ezek finoman eloszolt kis szemcsék formájában válnak ki, → nagy szakítószilárdság. Al-Cu-Ni ötvözetek: magasabb hőmérsékleten nagy szakítószilárdság. A fenti ötvözetek a Cu miatt nem korrózióállóak. Al-Mg-Si ötvözetek (1% Si, 1% Mg, 0. 7%Mn): nagy szilárdságúak, korrózióállóak Al-Mn ötvözetek: kitűnő korrózióállóság, képlékenység, hegeszthetőség. - Önthető ötvözetek: Al öntészeti tulajdonságai nem jók. Eutektikus összetételhez közel álló keverékek, alacsony op. Al-Si ötvözetek (sziluminok, 9 -14% Si): jól önthetők, gyenge szakítószilárdságúak. Al-Si-Cu ötvözetek (4% Cu, 2. 5 %Si): önthetőség mellett nagy szilárdságúak. Al-Cu-Mg ötvözetek (4% Cu, 1. 5 % Mg): önthetők, nagy szilárdságúak, kis Ni-t, hozzáadva magas hőmérsékleten igénybevett alkatrészek (dugattyú).

Földfémek Al és vegyületei Alumínium-oxid (Al 2 O 3) • Természetben: korund, rubin (+Cr 2 O 3), zafír (+Fe. O, Ti 2 O 3) • Al por hevítve: 4 Al + 3 O 2 = 2 Al 2 O 3 (DH=-1687 k. J/mol) • Az oxid nagy képződési entalpiájának köszönhetően az Al gyakran alkalmazott redukálószer (aktivási energiagátat a fejlődő hő leküzdi). Fémek (Cr, Mn) előállítása oxidból: 1. fém-oxid + Al por + gyújtókeverék (Al+Ba. O 2) 2. begyújtva Mg szalaggal: 800 ºC 3. 3 Ba. O 2 + 4 Al = 3 Ba + 2 Al 2 O 3 reakcióból: 2000 ºC 4. pl. Cr 2 O 3 + 2 Al = Al 2 O 3 + 2 Cr • Felhasználás: csiszolópapír - vas-oxiddal szennyezett korund Alkáli-alumínium-szilikátok (Al 2 Si 2 O 7. 2 H 2 O) kaolinit vagy porcelánföld Agyag: Ca. CO 3, Fe 2 O 3 szennyeződésekkel. Mészkővel keverve → portlandcement.

Óncsoport ón és ólom IV/A. oszlop • Elektronszerkezet: ns 2 np 2 • Vegyérték: C, Si, Ge - 4; Sn, Pb – 2 (ritkábban 4) • C nemfém; Si, Ge félfém; Sn, Pb fém. • Elektronegativitás: 2. 5 -1. 8 (C, Si, Ge kovalens kötések, Sn, Pb inkább ionos) Atomszerkezet • Az ón: 50 proton 50 elektron 69 neutron 5 elektronhéj 4 vegyérték elektron • Az ólom 82 proton 82 elektron 125 neutron 6 elektronhéj 4 vegyérték elektron

Óncsoport Az ón (Sn) • • • ón és ólom Az ón régi neve cin -> cintányér (ón tányér) Vegyértéke: +2 – 4 Ezüstfehér színű (szobahőmérsékleten stabil allotróp módosulat (fehér ón)) jól megmunkálható fém olvadáspontja 231, 9°C A fehér ón alacsony hőmérsékleten szürke ónná alakul és eközben szétporlad ->Scott kapitány tragédiája • sűrűsége 7, 3 (1 l tömege 7, 3 kg) • korrózióálló (ezért konzervdobozok, fóliák, dobozok gyártására és fémtárgyak bevonására használják) • Az ón ötvözetei ón + réz => (ón)bronz ón + ólom => lágyforrasz (forrasztóón) ón + ólom + antimon + réz => csapágyfém • Előállítása kohászati eljárással történik.

Óncsoport ón és ólom • Ólom (Pb) • Vegyértéke +2 vagy +4 • Fizikai tulajdonságok: o lágy (papírra lehet vele írni – irón), o olvadáspontja 327, 4 o. C, sűrűsége 11, 4 g/cm 3, o friss vágási felülete ezüstfehér, o felületén oxid és karbonátréteg alakul ki (sötétszürke), ezért korrózióálló • Kémiai tulajdonságok: o Lúgokban nem oldódik, csak híg savakban Oldódása sósavban: Pb + 2 HCl Pb. Cl 2 + H 2 Oldódása kénsavban: Pb + H 2 SO 4 Pb. SO 4 + H 2 o Magasabb hőmérsékleten oxidálódik: 2 Pb + O 2 2 Pb. O • Legfontosabb érce: galenit (Pb. S) • Előállítása kohászati eljárással történik 2 lépésben: 2 Pb. S + 3 O 2 = 2 Pb. O + 2 SO 2 szénnel redukálják az ólomoxidot: 2 Pb. O + C = CO 2+ 2 Pb Az ólom és vegyületei rendkívül mérgezőek (sejtméreg!)

Óncsoport ón és ólom Ólom (Pb) Felhasználás: • csővezetékek, akkumulátor, siklócsapágy (ón és ólom) gyártására használják. • A mínium (Pb 3 O 4) piros színű korrózió gátló olajfesték alapanyaga, • az ólom-tetraetil a motorbenzinek adalékanyaga, kopogásgátló. • Fémólomból föld- és vízalatti kábelek akkumulátorlemezek készülnek • óntárgyakat és forrasztóónt (lágyforrasz) (60%-a ón, 40%-a ólom) készítenek • • belőle Ólomötvözet: sörét, csapágyfém Nehezéknek (tőkesúly) használják vitorláshajók felborulásának megakadályozására Nyomdaiparban betűfémként használták (ónnal, antimonnal ötvözve) Sugárvédelemben védőruházat (ólomkötény)

Átmeneti fémek Vascsoport Általános tulajdonságok • Elektronszerkezet: (n-1)s 2 (n-1)p 6 (n-1)d 1 -10 ns 1 -2 np 0 • Szilárd halmazállapotúak, kivéve Hg • Fémes tulajdonságok: fémrács, áram- és hővezetés, szürkés szín (kivéve Cu, Au) • A nyílt vegyértékhéj miatt (kivétel Zn, Cd) több oxidációs számmal képezhetnek vegyületeket. Vegyületeik általában színesek. Az részben betöltött d-pályák miatt szervetlen ill. szerves ligandumokkal datív kötéssel komplexeket képeznek. vascsoport Vascsoport (triád: Fe, Co, Ni) • Nagyon hasonló tulajdonságokkal rendelkeznek: nagy sűrűség, magas op, mágnesezhetők, legszorosabb illeszkedésű fémrács, könnyen alakíthatók (kis keménység), ötvözhetők, oxidációs szám +2 és +3.

Vascsoport Fizikai tulajdonságok: Vas (Fe) • Olvadáspont: 1538 ºC. Lehűtve térben középpontos kockarács: d-vas (0. 293 nm élhossz. ) 1394 -912 ºC: g-vas – lapon középpontos kockarács (0. 368 nm élhossz) – kisebb sűrűség 912 ºC alatt: a-vas – térben középpontos kockarács (0. 290 nm élhossz) 770 ºC: mágnesezhetőség határa Kémiai tulajdonságok: • Elektronegativitása: 1. 8, általában ionos vegyületeke képez +2 és +3 oxidációs számmal • Fe 2+ vegyületek: zöld szín, többségük nem stabil, levegőn lassan oxidálódnak Fe 3+ formává emiatt redukáló tulajdonságú • Fe 3+ vegyületek: sárga-vörös, természetben ez fordul elő • Oxigénnel reagál: 4 Fe + 3 O 2 = 2 Fe 2 O 3 • Halogénekkel: Fe. F 3, Fe. Cl 3, Fe. Br 3, Fe. I 2 (jód oxidáló hatása a legkisebb, Fe. I 3 instabil) • Kénnel: Fe. S (kén is gyenge oxidálószer) • Vízzel nem reagál, csak ha van benne oldott O 2 → rozsda Fe. O(OH) ill. Fe(OH)3. Fe 2 O 3 • Híg savak H 2 fejlődés közben oldják • Tömény savak (HNO 3, H 2 SO 4, H 3 PO 4) passzív védőréteget képeznek a felületen.

Vascsoport Vas (Fe) Előfordulás • Föld magját alkotja (Ni-el együtt): szilárd belső mag, folyékony külső mag • Vegyületei formájában fordul elő a földkéregben (4. 8 %, 4. leggyakoribb a földkéregben), ill. tiszta állapotban a Földre került meteoritokban. Pirit (Fe. S 2) Kalkopirit (Cu. Fe. S 2) Sziderit (Fe. CO 3) Hematit (Fe 2 O 3) Magnetit (Fe 3 O 4) Limonit (Fe 2 O 3. 1. 5 H 2 O)

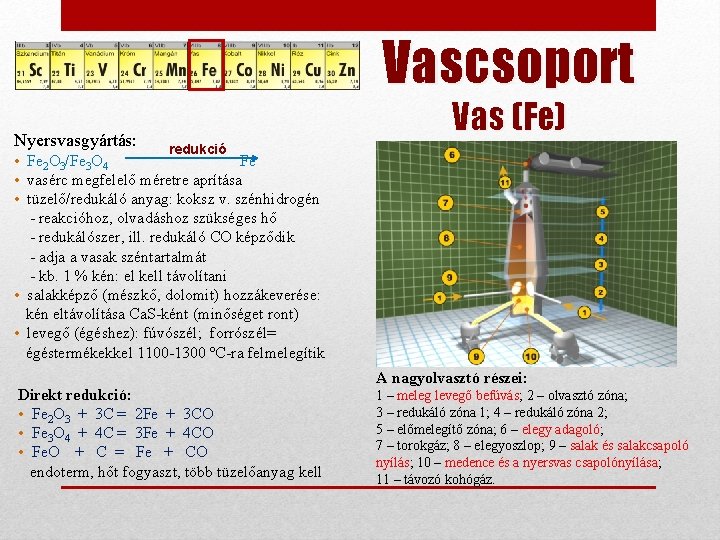
Vascsoport Nyersvasgyártás: Vas (Fe) redukció • Fe 2 O 3/Fe 3 O 4 Fe • vasérc megfelelő méretre aprítása • tüzelő/redukáló anyag: koksz v. szénhidrogén - reakcióhoz, olvadáshoz szükséges hő - redukálószer, ill. redukáló CO képződik - adja a vasak széntartalmát - kb. 1 % kén: el kell távolítani • salakképző (mészkő, dolomit) hozzákeverése: kén eltávolítása Ca. S-ként (minőséget ront) • levegő (égéshez): fúvószél; forrószél= égéstermékekkel 1100 -1300 ºC-ra felmelegítik Direkt redukció: • Fe 2 O 3 + 3 C = 2 Fe + 3 CO • Fe 3 O 4 + 4 C = 3 Fe + 4 CO • Fe. O + C = Fe + CO endoterm, hőt fogyaszt, több tüzelőanyag kell A nagyolvasztó részei: 1 – meleg levegő befúvás; 2 – olvasztó zóna; 3 – redukáló zóna 1; 4 – redukáló zóna 2; 5 – előmelegítő zóna; 6 – elegy adagoló; 7 – torokgáz; 8 – elegyoszlop; 9 – salak és salakcsapoló nyílás; 10 – medence és a nyersvas csapolónyílása; 11 – távozó kohógáz.

Vascsoport Nyersvasgyártás: Indirekt redukció: Vas (Fe) • 3 Fe 2 O 3 + CO = 2 Fe 3 O 4 + CO 2 • Fe 3 O 4 + CO = 3 Fe. O + CO 2 • Fe 3 O 4 + 4 CO = 3 Fe + 4 CO 2 • Fe. O + CO = Fe + CO 2 H 2 is képes redukálni: • C + O 2 = CO 2 • CO 2 + C = 2 CO • C + H 2 O = CO + H 2 • (CO + H 2 O = CO 2 + H 2) magasabb hőmérsékleten redukál mint a CO, de gyorsabban exoterm reakciók, kevesebb tüzelőanyag kell. CO keletkezése: • 3 Fe 2 O 3 + H 2 = 2 Fe 3 O 4 + H 2 O • Fe 2 O 3 + 3 H 2 = 2 Fe + 3 H 2 O • Fe 3 O 4 + H 2 = 3 Fe. O + H 2 O • Fe 3 O 4 + 4 H 2 = 3 Fe + 4 H 2 O • Fe. O + H 2 = Fe + H 2 O Nyersvas tulajdonságai: • 3 -5 % szén + kisebb mennyiségben egyéb elemek (1. 5 -4 % Mn, 0. 5 -1 % Si, kevés P, S • képlékenyen nem alakítható a magas széntartalom miatt Öntöttvas tulajdonságai: • 2 -3. 6 % szén + Si, Mn, P, S • nyersvasból ócskavas hozzáadásával, olvasztással gyártják • könnyen megmunkálható, korrózióálló, rezgéscsill. (szerszámgépállvány) • rideg, könnyen törik, acélnál kisebb szilárdságú C

Acél: Vascsoport Vas (Fe) • Széntartalom max. 2. 11 % • Könnyen megmunkálható (kovácsolás, hengerlés) • Acélgyártás: oxidációval a széntartalom lecsökkentése, ötvözetkészítés: keménység, rugalmasság, hajlékonyság, szilárdság, hőállóság, savállóság, korróziómentesség - olvadt nyersvasba nagy nyomással oxigént fúvatnak (30 perc) régebben Siemens-Martin eljárás: rozsdás ócskavassal olvasztották (O rozsdából – 6 -8 óra) - ötvöző anyag oldása az olvadékban: lehűlve szilárd oldat • Ezután hőkezeléssel mechanikai tulajdonságok módosíthatók - lágyítás: belső feszültség megszüntetése; pár fokkal 727 ºC alá melegítik, lassan lehűtik - edzés: keménység növelése; hevítés kb. 1300 ºC-ra, egy ideig ott tartják, majd gyorsan lehűtik. Ezzel befagyasztják az 1300 ºC-on levő kristályszerkezetet – de belső feszültségek keletkeznek. Megeresztés: ugyanez kb. 100 -700 ºC-on; feszültség csökken, keménység is. - kérgesítés: kemény kopásálló külső réteg; felületi edzéssel vagy ötvözéssel Ötvözetek: • Helyettesítés (szubsztitúció): atomok hasonló méretűek, azonos rácsban kristályosodnak. • Beékelődéses (interszticiós): ötvözőfém atomjai kisebbek helyettesítés beékelődés

Vascsoport Vas (Fe) Vas nem ötvöződik: nemesgázokkal, halogénekkel, s-mező elemeivel, higannyal, kadmiummal, ezüsttel. Nehezen elegyíthető bizmuttal, ólommal, cinkkel. Fontosabb ötvözők: • C 0. 6 % alatt = szerkezeti acélok: szilárdság, szívósság, ellenállás lökésszerű igénybevétellel szemben C 0. 6 % felett = szerszámacélok: keménység, kopásállóság • Ni, Mn: szilárdságot növelik, magas hőmérsékleten is (hőálló acél) • Vanádium (V): keménységet, kifáradással szembeni ellenállást növeli • Cr, Ni: rozsdamentessé, savállóvá teszi • Cr, Al, Si: magas hőmérsékleten is korrózióálló (Fe. Cr 2 O 4 réteg van a felületen) • W: nagyon kemény un. gyorsacélok (forgácsolószerszámokhoz) • Bór (B, ezred %): acél edzhetőségét növeli • Nióbium (Nb, század %): acél rugalmasságát növeli • N, S, P: káros ötvözőanyagok, acélt törékennyé teszik

Átmeneti fémek Rézcsoport A periódusos rendszer I/b csoportjába tartozó fémek: réz, ezüst, arany. Atomjaik jellemző elektronszerkezete (n-1)d 10 ns 2. Réz(Cu): • színesfém, vörös színű (vörösréz) • vegyértékhéj: 4 s 1 3 d 10 • vegyületeiben többnyire +2, esetenként +1 oxidációs számú • Kémiai aktivitása kicsi: híg savakban nem, oxidáló savakban oldódik • Nedves levegőn bázisos réz-karbonát (Cu. CO 3) = patina képződik, mely védi a további korróziótól • Ötvözetek: - sárgaréz (Cu + Zn). Hamis arany 80 % réz. - bronz (Cu + Sn): disztárgyak, szobrok, harang - újezüst=alpakka (Cu + Ni): pénz, evőkészlet Minneapolis városháza (Cu tető) • Felhasználás (fentieken felül): - elektromos vezeték - Cu. SO 4. 5 H 2 O (rézgálic): permetezőszer

Átmeneti fémek Ezüst (Ag): Rézcsoport • Természetben elemi állapotban (ritka) és ércásványokban (többnyire szulfidok) • Vegyértékhéj: 5 s 1 4 d 10 → oxidációs száma +1 • Klasszikus előállítás: Ag 2 S + 2 Na. Cl = 2 Ag. Cl + Na 2 S hevítés 2 Ag. Cl + 2 Hg = 2(Ag. Hg)Cl 2 Ag + Hg 2 Cl 2 • Oxidáló savak (salétromsav, tömény kénsav) oldják • Levegőn oxigénnel nem reagál, csak H 2 S-el → fekete Ag. S a felületen • Hővezető és fényvisszaverő képessége a fémek között a legjobb → tükör • Felhasználás: ékszerek, étkészletek, egészségügyi műszerek, fertőtlenítő hatás gyógyászat elektronikai ipar: nyomtatott áramkörök, kapcsolók, Ag-Zn, Ag-Cd gombelemek

Átmeneti fémek Arany (Au): Rézcsoport • Természetben elemi állapotban és ércásvány formájában is előfordul • Vegyértékhéj: 6 s 1 5 d 10 → oxidációs száma +1 és +3 • Sárga színű, puha, nagyon jól nyújtható • Rendkívül jól vezeti az elektromos áramot és a hőt • Nehézfém (19, 3 g/cm 3), szilárdsága csekély • Kémiailag ellenálló (legtöbb nemfémmel nem reagál) • Lúgok nem támadják meg • Híg/tömény savak nem oldják. Oldja: folyékony Br, Cl, Hg, alkáli-cianid olvadék • Oldódik királyvízben is, amely 3 rész tömény sósav és 1 rész tömény salétromsav elegye: 2 HNO 3 + 2 HCl = Cl 2 + 2 NO 2 + 2 H 2 O 2 Au + 3 Cl 2 = 2 Au. Cl 3 • Előállítás: meddő kőzetekből cianidokkal való kioldással lúgos közegben: 4 Au + 8 Na. CN + O 2 +2 H 2 O = 4 Na[Au(CN)2] + 4 Na. OH 2 Na[Au(CN)2] + Zn = Na 2[Zn(CN)4] + 2 Au • Nem korrodeálódik: ékszer alapanyag és fizetőeszköz (volt) • Ipari felhasználás: elektromos kontaktus, aranyfüsttel bevont egyirányban átlátszó ablakok • Ékszereket (ötvözetek formájában), bevonatokat és dísztárgyakat készítenek belőle.

Átmeneti fémek Cinkcsoport A periódusos rendszer II/b csoportjába tartozó fémek: cink, kadmium, higany. Cink (Zn): • Vegyértékhéj: 4 s 2 3 d 10 → +2 oxidációs szám vegyületeiben • Kissé kékes árnyalatú, szép fémfényű elem. • Közönséges hőmérsékleten rideg, 150– 200 °C közötti hőmérsékleten kovácsolható. • Jó elektromos vezető, szilárdsága csekély. • Magas hőmérsékleten kékeszöld lánggal ég el: 2 Zn + O 2 2 Zn. O • Híg savak oldják: Zn + H 2 SO 4 = H 2 + Zn. SO 4 • oldódik alkálilúgokban is: Zn 2+ + 3 OH– = [Zn(OH)3]– • Legfontosabb ásványai a szfalerit (Zn. S), a wurtzit és a cinkit (Zn. O). • Felhasználás: korrózióvédelem (horganyzott bádog), galvánelem, ötvözetek, gyógyszergyártás, festékek, műanyagok

Átmeneti fémek Cinkcsoport Kadmium (Cd): • A természetben 8 izotópja fordul elő. • Puha, kovácsolható, ezüstfényű fém. • Elektromos áramot kiválóan vezeti • Közepes tisztaságú lemezei hajtogatva az ónhoz hasonló zörejeket adnak. • Levegőn melegebb környezetben sötétebb oxidréteg keletkezik rajta. • Lúgokban az oxidréteg oldhatatlan, • kénsavban és sósavban nehezen, salétromsavban könnyen oldódik. • Vegyületeiben többnyire két vegyértékkel fordul elő. Reakcióiban a cinkhez hasonló, de könnyebben képez komplexeket. • Pirosas-sárgás lánggal égve kadmium-oxid keletkezik (erősen mérgező) • Felhasználják korrózióvédelemre, akkumulátorcellák elektródjának, ötvözetek és festékek készítésére

Átmeneti fémek Cinkcsoport Higany (Hg): • ezüstös, fémszínű • Cseppfolyós, könnyen párolog (mérgező gőzök) – zárva tároljuk! • vezeti a hőt és az elektromos áramot • Csak híg salétromsav, és forró, tömény kénsav támadja meg • más fémekkel alkotott hideg ötvözete az amalgám • Természetben ércásvány formájában fordul elő (Hg. S, vulkáni tevékenység helyein) • Vegyértékhéj: 6 s 2 5 d 10 → oxidációs száma +1 és +2 • Fémeket hidegen oldja: amalgám ötvözetek • Higanyvegyületek mérgezőek! • Felhasználás: hőmérő, barométer, higanygőzlámpa Ag-, Zn-amalgámok: fogtömés • Hg 2 Cl 2: lineáris molekula Cl-Hg-Hg-Cl elektrokémiában referenciaelektród