FIZYKA III MEL Fizyka jdrowa i czstek elementarnych








![liczby magiczne EB/A [Me. V] 2 8 20 28 50 82 126 10 8 liczby magiczne EB/A [Me. V] 2 8 20 28 50 82 126 10 8](https://slidetodoc.com/presentation_image/3b740a3d57a3094b87490bf16a55bd6a/image-13.jpg)




- Slides: 24

FIZYKA III MEL Fizyka jądrowa i cząstek elementarnych Wykład 5 – modele jądrowe cd.

Energia wiązania w modelu kroplowym • energia objętościowa: a. V = const • energia powierzchniowa: a. S = const • energia kulombowska: a. C = const

Energia wiązania • energia asymetrii: a. A = const znika dla N = Z • energia dwójkowania: dla jąder parzysto- parzystych dla A nieparzystych dla jąder nieparzysto- nieparzystych = const

C. F. von Weizsäcker i N. Bohr: półempiryczny wzór na energię wiązania: EB = E V + E S + EC + E A + E P + E M po dopasowaniu do ponad 1200 nuklidów: a. V = 15. 85 Me. V a. S = 18. 34 Me. V a. C = 0. 71 Me. V a. A = 23. 22 Me. V = 11. 46 Me. V

czy to działa?

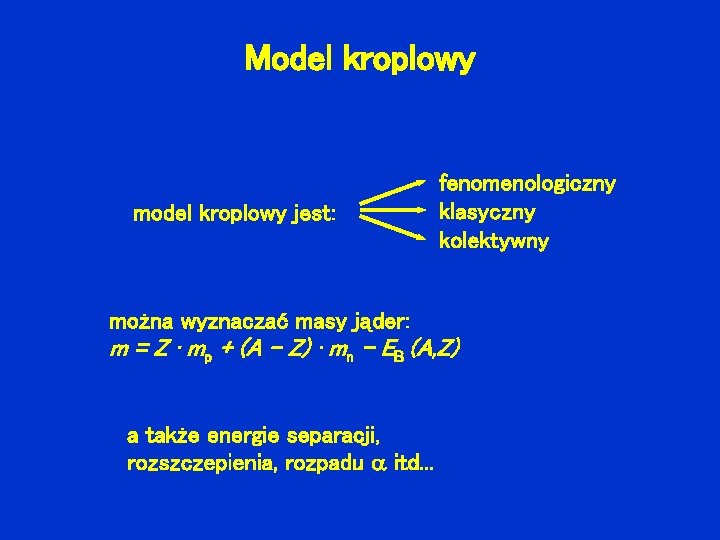
Model kroplowy model kroplowy jest: fenomenologiczny klasyczny kolektywny można wyznaczać masy jąder: m = Z · mp + (A – Z) · mn – EB (A, Z) a także energie separacji, rozszczepienia, rozpadu itd. . .

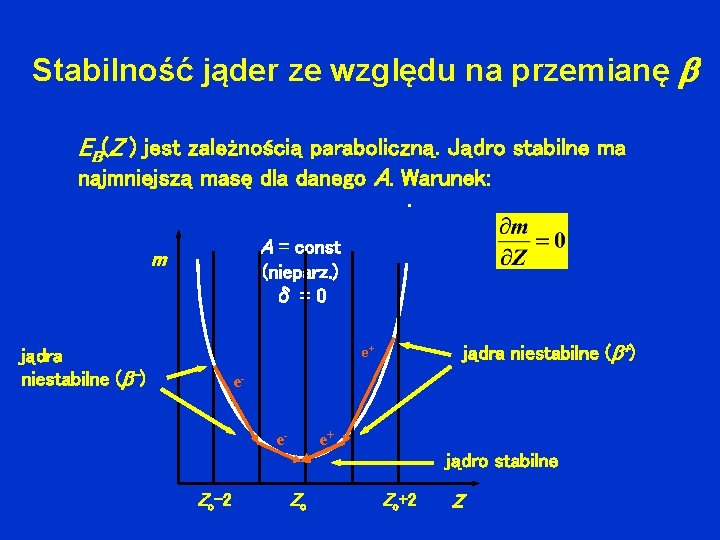
Stabilność jąder ze względu na przemianę EB(Z ) jest zależnością paraboliczną. Jądro stabilne ma najmniejszą masę dla danego A. Warunek: A = const m (nieparz. ) δ=0 jądra niestabilne ( +) e+ jądra niestabilne ( -) ee- e+ jądro stabilne Zo-2 Zo Zo+2 Z

Stabilność jąder ze względu na przemianę jądra nieparz. -nieparz. (mniej stabilne) A = const (parz. ) m δ>0 δ<0 jądra parz. -parz. (bardziej stabilne) e+ e- Zo-3 e+ Zo e- Zo+3 Z nawet trzy stabilne izobary!

Model gazu Fermiego Enrico Fermi (1901 -1954) 1938

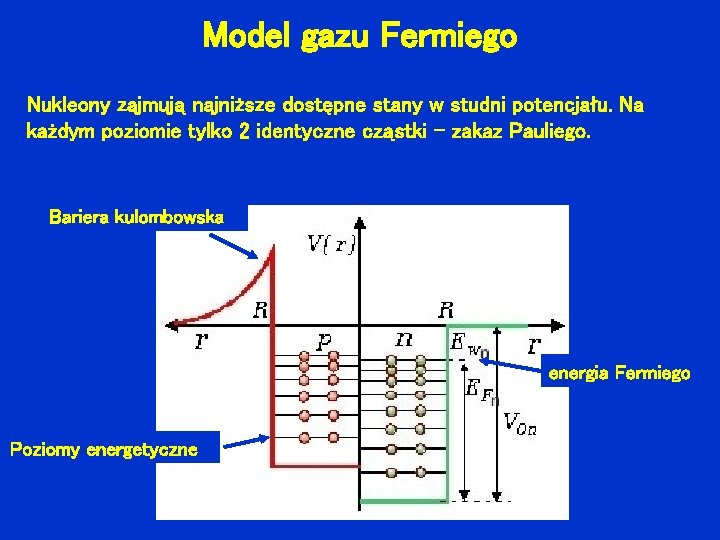
Model gazu Fermiego Nukleony zajmują najniższe dostępne stany w studni potencjału. Na każdym poziomie tylko 2 identyczne cząstki – zakaz Pauliego. Bariera kulombowska energia Fermiego Poziomy energetyczne

Model gazu Fermiego W stanie podstawowym wszystkie dostępne stany kwantowe zajęte. zakaz Pauliego Nukleony nie mogą zmienić stanu swego ruchu bez doprowadzenia energii z zewnątrz – nie zderzają się. Średni pęd nukleonów – pęd Fermiego:

Model gazu Fermiego Przykład: p + p p + n + + m = 140. Me. V energia progowa ELAB = 290. Me. V W zderzeniach protonu z jądrem trzeba uwzględnić pęd Fermiego energia progowa niższa
![liczby magiczne EBA Me V 2 8 20 28 50 82 126 10 8 liczby magiczne EB/A [Me. V] 2 8 20 28 50 82 126 10 8](https://slidetodoc.com/presentation_image/3b740a3d57a3094b87490bf16a55bd6a/image-13.jpg)
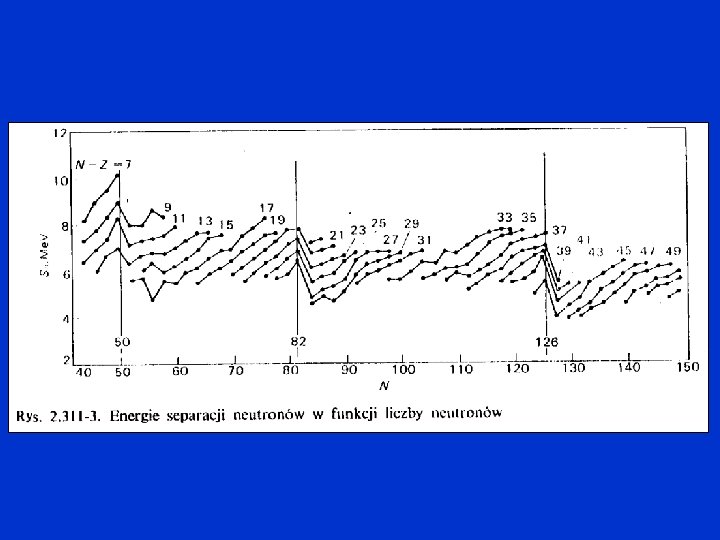
liczby magiczne EB/A [Me. V] 2 8 20 28 50 82 126 10 8 6 4 2 N=28 Z=8 N=8 Z=28 N=50 N=82 Z=50 Z=82 N=126 Z=20 N=20 Z=2 N=2 50 100 150 200 250 A

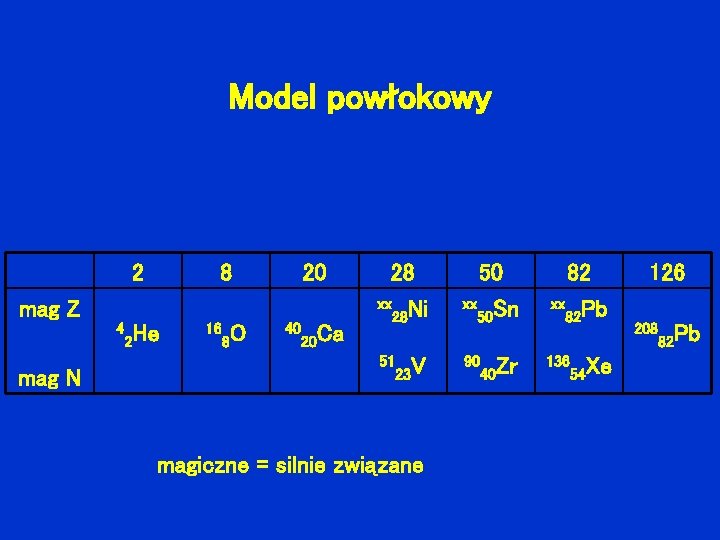
Model powłokowy 2 8 20 mag Z 4 He 2 mag N 16 8 O 40 Ca 20 28 xx Ni 28 50 xx Sn 50 82 xx Pb 82 51 V 23 90 Zr 40 136 Xe 54 magiczne = silnie związane 126 208 Pb 82

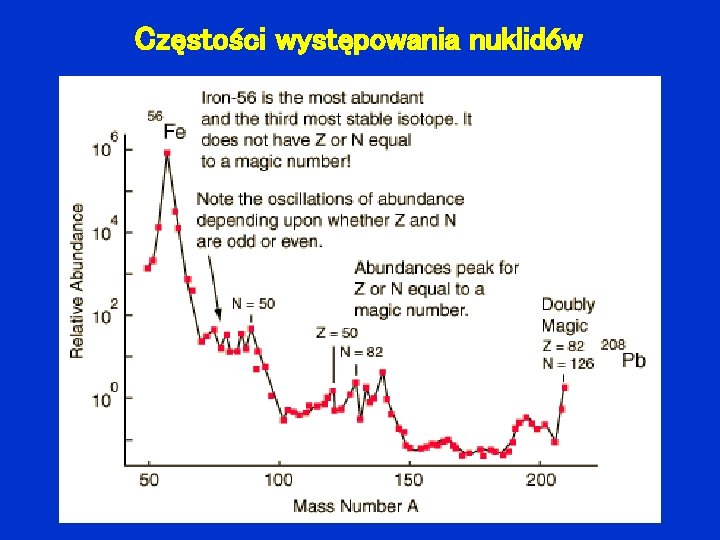
Częstości występowania nuklidów



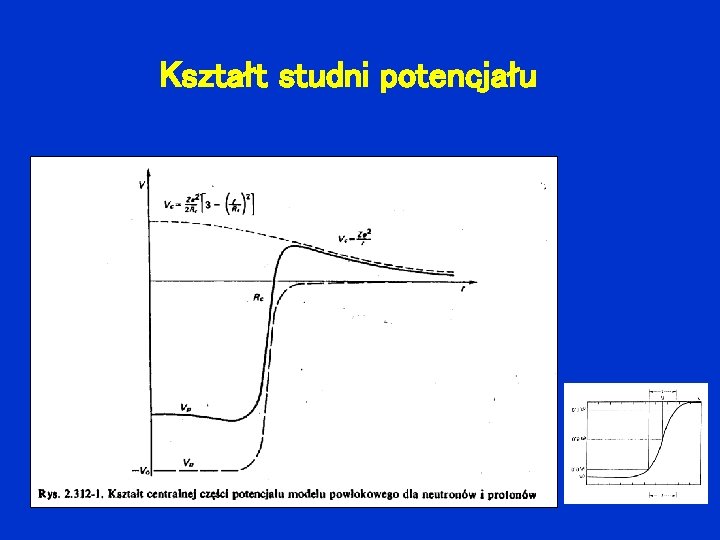
Potencjał w modelu powłokowym Rozważamy nukleon, znajdujący się w polu potencjału pochodzącego od pozostałych nukleonów. potencjał Woodsa - Saxona

dodatkowo dla protonów: potencjał kulombowski

Kształt studni potencjału

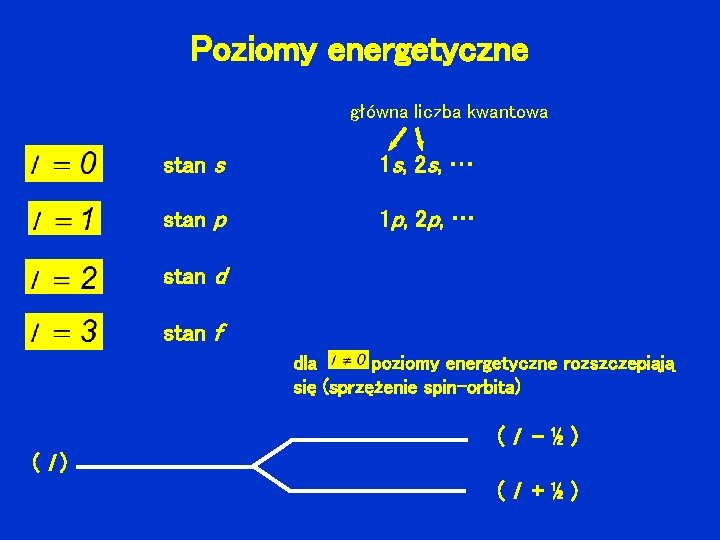
Liczby kwantowe w modelu powłokowym orbitalna liczba kwantowa l - określa orbitalny moment pędu nukleonu: l przybiera wartości całkowite, a liczba możliwych ustawień dla danego l wynosi 2 l + 1 spin s - określa własny moment pędu nukleonu liczba możliwych ustawień spinu (s = ½): 2 s+ 1 = 2 dla danego l : 2(2 l + 1) możliwych stanów

Poziomy energetyczne główna liczba kwantowa stan s 1 s, 2 s, … stan p 1 p, 2 p, … stan d stan f dla poziomy energetyczne rozszczepiają się (sprzężenie spin-orbita) (l -½) (l +½)

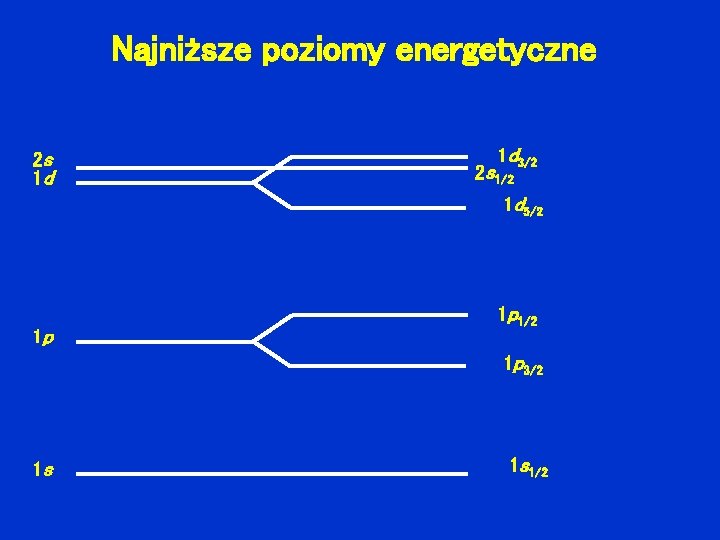
Najniższe poziomy energetyczne 2 s 1 d 1 d 3/2 2 s 1/2 1 d 5/2 1 p 1 p 1/2 1 p 3/2 1 s 1 s 1/2

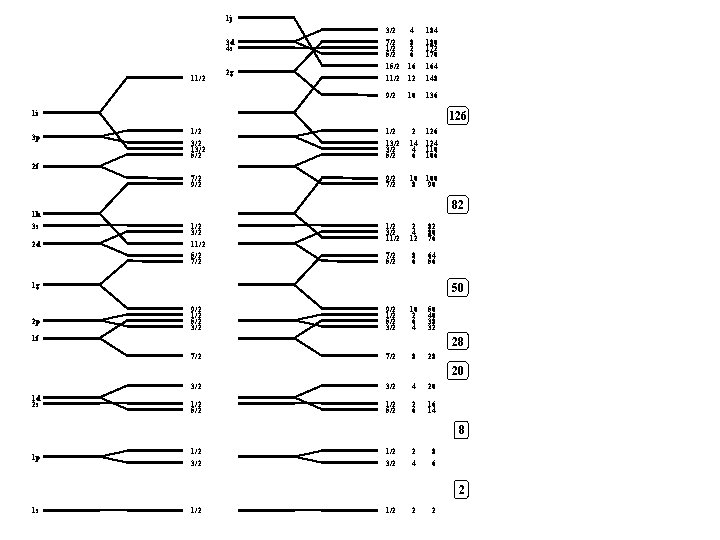
1 j 3/2 7/2 1/2 5/2 11/2 4 8 2 6 16 12 184 180 172 170 164 148 9/2 10 136 1/2 3/2 13/2 5/2 2 14 4 6 124 110 106 7/2 9/2 7/2 10 8 100 90 3 d 4 s 11/2 2 g 1 i 3 p 126 2 f 1 h 3 s 2 d 82 1/2 3/2 11/2 5/2 7/2 1/2 3/2 11/2 2 4 12 82 80 76 7/2 5/2 8 6 64 56 1 g 2 p 50 9/2 1/2 5/2 3/2 10 2 6 4 50 40 38 32 7/2 8 28 1 f 28 20 1 d 2 s 3/2 4 20 1/2 5/2 2 6 16 14 8 1 p 1/2 3/2 2 4 8 6 2 1 s 1/2 2 2
 Wykresy funkcji elementarnych
Wykresy funkcji elementarnych Hamlet act iii scene iii
Hamlet act iii scene iii Fizyka techniczna pk
Fizyka techniczna pk Przedrostki fizyka
Przedrostki fizyka Elektryczny typek
Elektryczny typek Zastosowanie zjawiska fotoelektrycznego
Zastosowanie zjawiska fotoelektrycznego Sylwester kalinowski fizyka
Sylwester kalinowski fizyka Fizyka
Fizyka Fizyka atomowa
Fizyka atomowa Fizyka
Fizyka Moc
Moc Budowa mikrofonu fizyka
Budowa mikrofonu fizyka Umk fizyka
Umk fizyka Fizyka atomowa wzory
Fizyka atomowa wzory Opory ruchu fizyka
Opory ruchu fizyka Moc fizyka
Moc fizyka Sylwester kalinowski fizyka
Sylwester kalinowski fizyka Praca jednostka
Praca jednostka Umk fizyka
Umk fizyka Energia potencjalna
Energia potencjalna Obrazy tworzone przez soczewki
Obrazy tworzone przez soczewki Obraz pozorny
Obraz pozorny Podstawa programowa fizyka
Podstawa programowa fizyka Wielkości fizyczne i ich pomiary
Wielkości fizyczne i ich pomiary Jednostka kąta bryłowego
Jednostka kąta bryłowego















































