FIZIKA HEMIJA Agregatna stanja materije 14 25 Nastavnik













- Slides: 14

FIZIČKA HEMIJA Agregatna stanja materije (14 -25) Nastavnik: Milan Vojinović

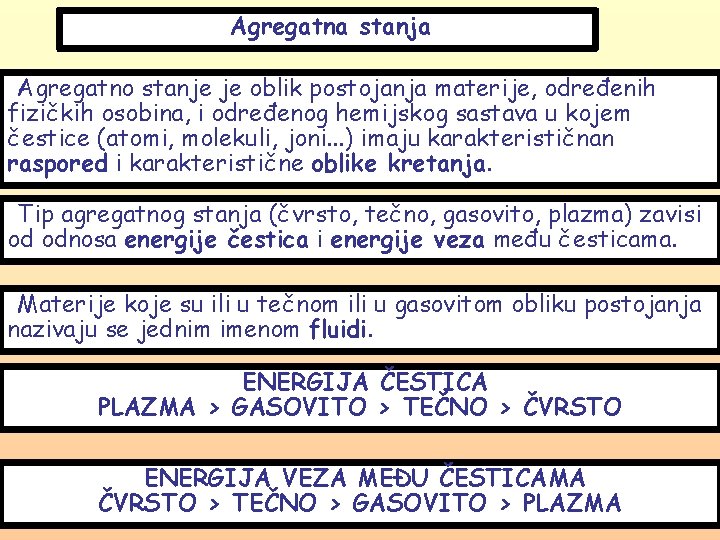
Agregatna stanja Agregatno stanje je oblik postojanja materije, određenih fizičkih osobina, i određenog hemijskog sastava u kojem čestice (atomi, molekuli, joni. . . ) imaju karakterističnan raspored i karakteristične oblike kretanja. Tip agregatnog stanja (čvrsto, tečno, gasovito, plazma) zavisi od odnosa energije čestica i energije veza među česticama. Materije koje su ili u tečnom ili u gasovitom obliku postojanja nazivaju se jednim imenom fluidi. ENERGIJA ČESTICA PLAZMA › GASOVITO › TEČNO › ČVRSTO ENERGIJA VEZA MEĐU ČESTICAMA ČVRSTO › TEČNO › GASOVITO › PLAZMA

Gasovito agregatno stanje U gasovitom stanju molekuli imaju najveću energiju i ispunjavaju čitavu zapreminu suda u kome se nalaze. Prema kinetičkoj teoriji gas se sastoji od čestica zanemarljivo male mase a sile koje deluju između njih su zanemarljive. Čestice gasa se kreću haotično i pri tome se sudaraju međusobno i udaraju u zidove suda. Sudari su elastični pa je ukupna energija gasa ista ali se energija i brzina pojedinačnih čestica pre i posle sudara može promeniti. Ako se energija molekula gasa dovoljno smanji, onda gas prelazi u tečno stanje. Najviša temperatura na kojoj je moguće prevesti gas u tečnost naziva se kritična tempertura a pritisak koji je potreban pri tome naziva se kritičan pritisak a zapremina jednog mola gasa na kritičnom pritisku i kritičnoj temperaturi je kritična zapremina. Ove veličine predstavljaju kritične veličine stanja gasa.

Stanje gasa se definiše pritiskom gasa (p), zapreminom gasa (V) i temperaturom gasa(T). Gas može biti na različitim pritiscima ili temperaturama, tj. pod različitim uslovima. Pod normalnim uslovima gas je na p=101325 Pa i T=273 K. Pod standardnim uslovima gas je na p=101325 Pa i T=293 K. Ako se stanje gasa menja tako da se menjaju pritisak i zapremina gasa a temperatura gasa ostaje nepromenjena (T=const) onda se takav proces naziva izotermski proces. Ako se stanje gasa menja tako da se manjaju zapremina i temperatura gasa a pritisak gasa ostaje nepromenjen (p=const) onda se takav proces naziva izobarski proces. Ako se stanje gasa menja tako da se menjaju temperatura i pritisak a zapremina gasa pri tome ostaje nepromenjena (v=const) onda se takav proces naziva izohorski proces.

Kod idealnih gasova se mogu zanemariti sile koje deluju među molekulima gasa a masa molekula se takođe može zanemariti.

Osim što zavisi od temperature, pritiska i zapremine gasa, stanje gasa zavisi i od količine gasa. Avogadro je postavio hipotezu da jednake zapremine gasova pri istim uslovima imaju isti broj molekula. Po prvi put se u ovoj hipotezi pominje pojam mola. Avogadrov zakon glasi: Iste količine gasa zauzimaju iste zapremine pri istom pritisku i istoj temperaturi. Avzakon Stanje idealnog gasa određjeno je pritiskom, brojem molova i temperaturom. Na osnovu Avogadrovog zakona pod normalnim uslovima molarna zapremina je 22, 414 dm 3. Količina gasa se izražava molom. Vm - molarna zapremina (zapremina koju zauzima jedan mol). osobinegasa

Daltonov zakon - u smeši gasova, svaki gas proizvodi pritisak isti kao kad sam zauzima posudu. U smeši, jedan gas ne oseća prisustvo drugog. Ukupan pritisak je zbir pojedinačnih pritisaka: P = P 1 + P 2 + P 3 + … = P i. P je ukupan pritisak dok su Pi - parcijalni pritisci. Ako se gasovi ponašaju po zakonu idealnog gasnog stanja, ponašaju se i po Daltonovnom zakonu. Molekuli realnog gasa imaju masu i zapreminu koja se može izmeriti a između molekula deluju sile privlačenja ili odbijanja koje se ne mogu zanemariti. Zbog toga se u ovom slučaju ne može primeniti jednačina stanja idealnog gasa pv=n. RT, već jednačina kod koje je izvršena korekcija. Ova jednačina se naziva Van der Valsova i ima sledeći oblik: (p+a/v 2)*(V-b)=RT

Tečno agregatno stanje Najviša temperatura na kojoj je moguće prevesti tečnost u gas naziva se kritična tempertura. Dakle iznad kritične temperature govorimo o gasu koji ne možemo prevesti u tečnost bez obzira koliko pri tom povećavali pritisak. Ispod kritične temperature govorimo o pari koju pod određenim uslovima možemo prevesti u tečno stanje. Napon pare - je pritisak pare iznad tečnosti Napon pare raste sa povećanjem temperature tečnosti. U trenutku kada se izjednači napon pare i pritisak okoline dolazi do ključanja tečnosti. Toplota isparavanja je količina energije koja je potrebna za isparavanje jedinice mase ili jedinice količine date supstance. Može biti izražena u J/kg (Džul po kilogramu) ili J/mol (Džul po molu) date supstance.

Tečnost je supstanca tečnog agregatnog stanja. Takve supstance nemaju stalan oblik ali imaju stalnu zapreminu jer su privlačne sile među njihovim molekulima slabije pa se mogu slobodnije kretati. Tečnosti, prema tome, lako menjaju oblik odnosno zauzimaju oblik posude u kojoj se nalaze. Tečnosti se mogu smatrati nestišljivim - ista količina tečnosti ne menja svoju zapreminu pod uticajem pritiska. Gustina (ρ) definisana je kao masa (m) jedinične zapremine (V). Gustina tečnosti se ne menja. Viskoznost - vodi poreklo od latinske reči viscum, koja znači lepak “lepljiv”, i ima značenje suprotno od "tečljiv". Ulje, med, glicerin itd. su viskoznije, odnosno manje tečljive tečnosti od vode, alkohola, benzina itd. Tečnosti su viskoznije od gasova.

Viskoznost je rezultat unutrašnjeg trenja u fluidu, pa se i meri silom trenja koja se javlja pri kretanju. Ako želimo da izračunamo veličinu sile potrebnu da bi se gornji sloj tečnosti kretao nekom brzinom, ona će pre svega zavisiti od prirode tečnosti u kojoj se ovi slojevi posmatraju. Ukoliko je tečnost viskoznija utoliko će biti potrebna veća sila. Površinski napon je težnja tečnosti da smanje svoju površinu. Molekuli koji se nalaze na površini tečnosti izloženi su dejstvu sila samo sa jedne strane, tako da je rezultanta sila koja teži da molekule sa površine uvuče u unutrašnjost tečnosti. Zbog toga postoji težnja da se površina tečnosti smanji i površina tečnosti se ponaša kao rastegnuta gumena opna. Sila površinskog napona zavisi od dužine granične linije (l) i koeficijenta površinskog napona (y), predstavlja silu na jedinicu dužine granične linije u površinskom sloju tečnosti. F=y*l pnapon

Čvrsto agregatno stanje je najuređenije agregatno stanje materije sa osnovnom osobinom da uvek ima određen oblik i zapreminu. Tela u čvrstom stanju mogu biti kristalna i amorfna. U kristalnim telima atomi su pravilno raspoređeni u prostoru i samo osciluju oko ravnotežnih položaja. kristal Zbog takve strukture kristali su anizotropni, nemaju iste osobine u svim pravcima i imaju određenu tačku topljenja. U amorfnim telima čestice isto osciluju oko ravnotežnih položaja ali je njihov prostorni raspored neuređen. Amorfne supstance su izotropne, osobine su im iste u svim pravcima i nemaju određenu tačku topljenja.

U hemiji i mineralogiji, kristal predstavlja čvrstu materiju čiji su konstutivni elementi atomi, molekuli, ili joni a koji grade pravilnu unutrašnju (prostornu) strukturu. U mineralogiji kristal je telo ograničeno geometrijskim površinama a u svim delovima jednaka hemijska svojstva. Čestice koje grade kristal (molekuli, atomi, joni) su tako gusto i pravilno raspoređene da imaju minimum energije. Jonski kristali se sastoje od nizova pozitivno i negativno naelektrisanih čestica (jona) između kojih deluju jake elektrostatičke sile. jonskav

Kovalentni kristali se sastoje od mreže atoma koji se međusobno drže jakim polarnim i nepolarnim vezama. koveza Metalni kristali se sastoje od atoma koji otpuštaju valentne elektrone, pa su joni okruženi elektronima i između njih deluju jake privlačne sile. Polimorfizam je pojava da se ista supstanca javlja u više kristalnih struktura. polimorfizam Izomorfizam je pojava da više različitih supstanci imaju isti tip kristalne rešetke. izomorfizam

Zeoliti predstavljaju grupu minerala složenih hidratisanih silikata natrijuma, kalijuma i kalcijuma. Zeolit je u prirodi „neaktivan“. Njegove adsorpcione sposobnosti i kapacitet katjonske izmene se aktiviraju mehaničkom obradom. Specifična struktura kristalne rešetke minerala zeolita omogućava njihovu upotrebu kao jonoizmenjivača, pri čemu zeolit jone iz svoje rešetke zamenjuje jonima iz okoline. Njegova efikasnost se ogleda pre svega kod detoksikacije organizma ili pri omekšavanju tvrde vode kada jone kalcijuma zamenjuje jonima natrijuma pri čemu se nerastvorljive soli kalcijuma pretvaraju u natrijumove soli koje su rastvorljive u vodi. Stanje materije
 Kruženje materije u prirodi
Kruženje materije u prirodi Sve materije se dele na sagorive i nesagorive
Sve materije se dele na sagorive i nesagorive Nastavnik predmetne nastave
Nastavnik predmetne nastave Nastavnik za 21 vijek
Nastavnik za 21 vijek Eobrazovanje nastavnik
Eobrazovanje nastavnik Agregatna ponuda
Agregatna ponuda Cvrsta agregatna sostojba
Cvrsta agregatna sostojba Agregatna traznja
Agregatna traznja Tranja
Tranja Agregatna ponuda
Agregatna ponuda Agregatna ponuda
Agregatna ponuda Luisovi simboli i formule
Luisovi simboli i formule Analiticka hemija srednja skola
Analiticka hemija srednja skola Sta je analiza hemija
Sta je analiza hemija Heterociklicna baza nukleinskih kiselina
Heterociklicna baza nukleinskih kiselina
























