FISIOLOGIA GENERAL 2007 Potencial Electroqumico R Constante de




































- Slides: 44

FISIOLOGIA GENERAL 2007



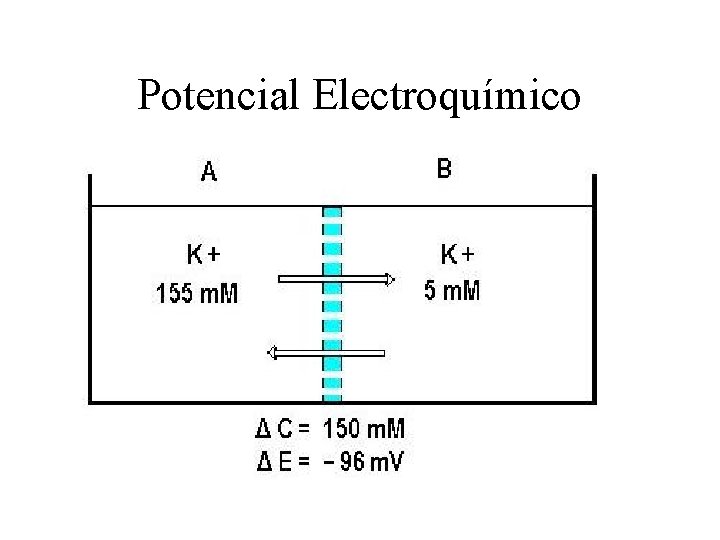
Potencial Electroquímico





R = Constante de los gases = 8. 31 Coul x Volts mol x ºK T = temperatura ºK (273 + 20) F = Constante de Faraday = 96500 Coulomb mol E potasio = 8, 31 x 293 96500 x 2, 303 log K in K ex

CALCULO DEL POTENCIAL DE EQUILIBRIO DEL K E potasio = E Potasio = 8, 31 x 310 96500 x 2, 303 log K ex K in 0, 0267 V x 2, 303 x log K ex K in EK= 61. 5 x log 4. 3 156 EK= 61. 5 x log K ex K in EK= 61. 5 x log 0, 02756 EK = 61, 5 x -1, 559 EK = - 95, 9 m. V


¿QUE SUCEDE CON EL POTENCIAL ELECTRICO DE UNA MEMBRANA CUANDO AUMENTAN LAS PERMEABILIDADES RELATIVAS DE LOS IONES QUE SE ENCUENTRAN A AMBOS LADOS DE ESA MEMBRANA?


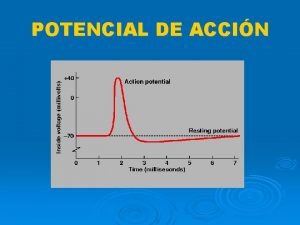
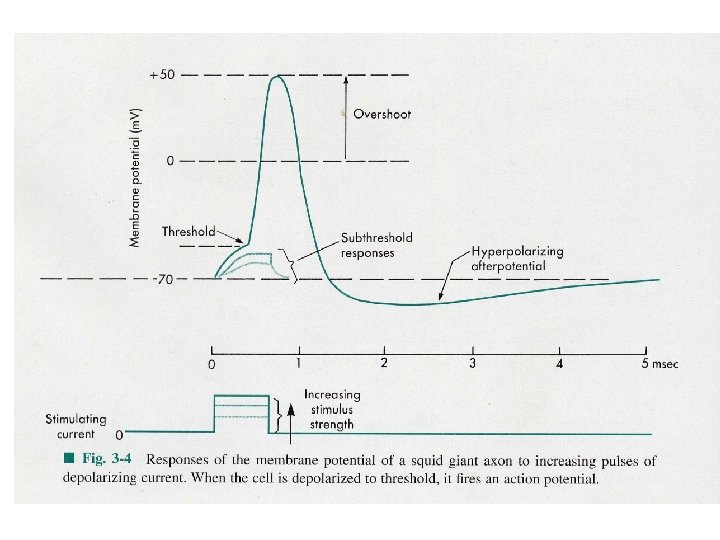
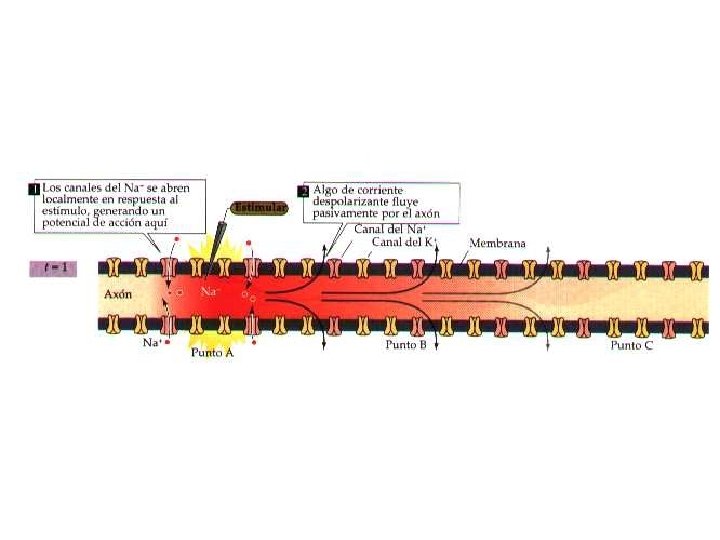
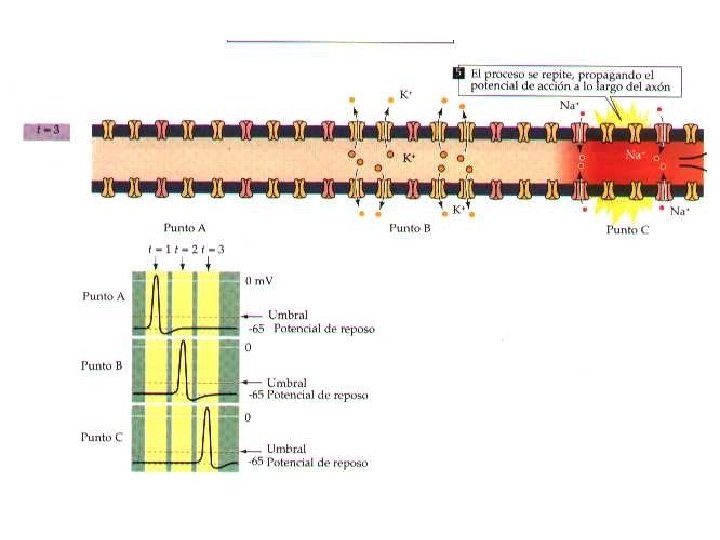
Características de los Potenciales de Acción 1. - Los PA duran aproximadamente 1 ms (Son Breves despolarizaciones transitorias del PM) Se producen a partir del momento en que la despolarización traspasa un voltaje de membrana umbral. La despolarizacion se produce por el aumento de la Permeabilidad al Na, seguido por un aumento de la Permeabilidad del K y como el potencial de la membtrana siempre estara más cerca del potencial de equilibrio del ión más permeable entonces durante la despolarización el potencial ira desde el reposo hacia el VENa (+45 m. V), luego despues desde el VENa hacia el VEK (Repolarización) (-96 m. V)finalmente vuelve al Vm (-85 m. V) después de un tiempo de hiperpolarización




2. - Los PA responden a la Ley del Todo o nada. Poseen un umbral de excitación que se define como la despolarización minima que provocará un PA 3. - Requieren de Potenciales Locales que son: Locales (no son propagados) Amplitud proporcional a la intensidad de la estimulación Son aditivos (se suman) cuando se encuentran dos potenciales locales Son lentos






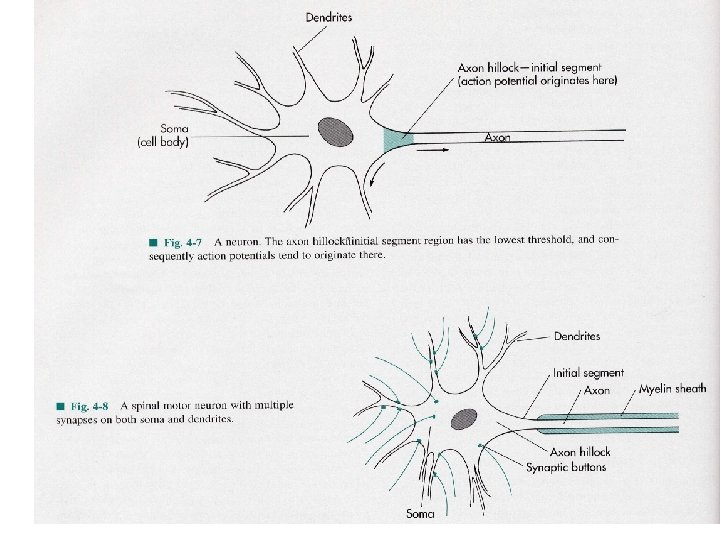
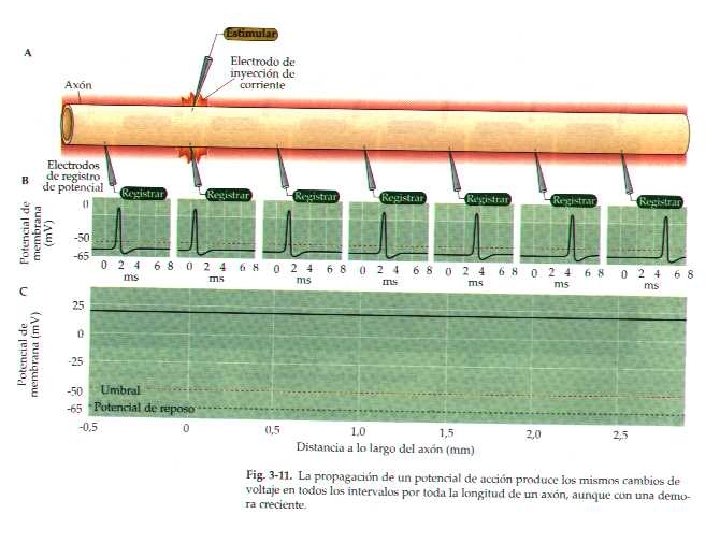
4. - Se propagan a una velocidad y amplitud constantes La velocidad dependerá de: La presencia de mielina diámetro del axoplasma Temperatura estrés metabólico





5. - Los PA no se suman porque poseen periodos refractarios Absolutos lo que las hace absolutamente inexcitables porque no disponen de canales de Na Cerrados Relativos: La membrana en la medida que transcurre el tiempo cada vez un mayor numero de canales de Na dependientes del Voltaje se encontrarán cerrados de modo que ante un 2ª estímulo se abrirán despolarizando de nuevo a la membrana con cada vez mayor amplitud




TEXTOS DE APOYO TEÓRICO

Los liquidos corporales son soluciones El agua en nuestros tejidos la compone el 65% del peso corporal y es el solvente por excelencia y todas nuestras estructuras estan inmersas en una gran solución. Visto así, los liquidos corporales son soluciones compuestas por agua (solvente) y solutos.

Solutos Los solutos pueden ser electrolitos, si tienen carga eléctrica y no-electrolitos si no la tienen. A los electrolitos se les llama también iones y de acuerdo al tipo de carga que poseen son: cationes (+) y aniones (-) ejemplos Na+, K+, Cl-. Existen de acuerdo al numero de cargas libres los iones monovalentes, di, tri a polivalentes como Ca++, PO 4 --- etc y entre los no-electrolitos uno de los que más abunda es Glucosa.

Potencial Químico El Potencial Químico de un soluto esta dado por los gradientes de concentración que posee ese soluto en una solución Si su distribución en la solución No es homogénea es porque tiene zonas con altas concentraciones en contacto con otras de concentraciones más bajas.

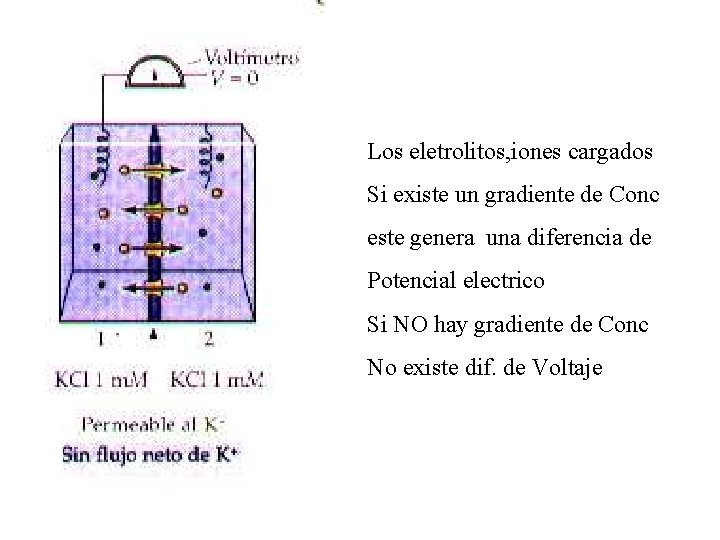
Difusión El gradiente de concentración es la diferencia de concentración que hay en dos puntos de una solución heterogénea, las soluciones tienden a ser homogéneas para lo cual las partículas del soluto difundirán desde las zonas de alta concentración hacia las de más baja concentración (Difusión pasiva) y la fuerza impulsora de los solutos durante la Difusión, es provocada por el Gradiente de Concentración o Potencial Químico del soluto Si dispongo de dos compartimientos separados por una membrana permeable a un soluto que esta disuelto y a concentraciones distintas, dependiendo de que el soluto tenga o no tenga carga eléctrica se generarán fenómenos eléctricos en la membrana que separa ambos compartimientos debido al flujo que se establece,

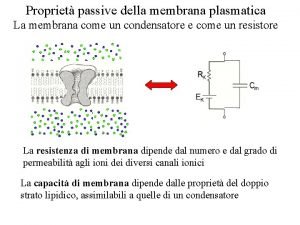
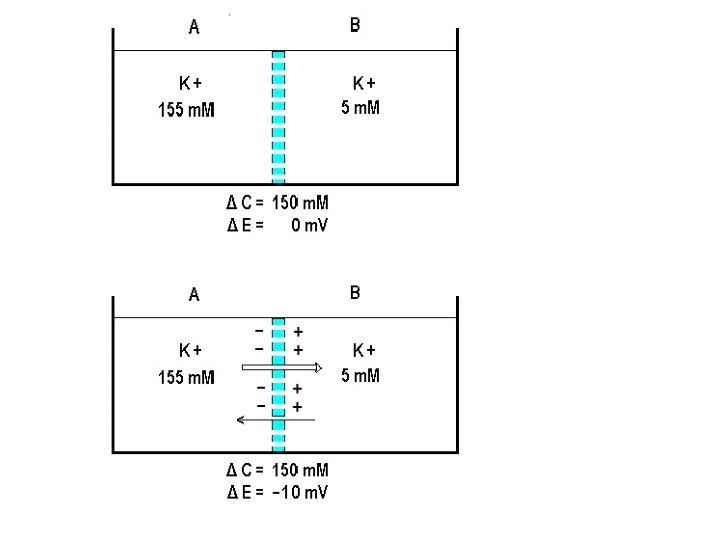
Permeabilidad: Se define como el grado de facilidad o dificultad con que el ión atraviesa una barrera que se le interpone en su trayectoria. Los compartimientos intra y extracelulares estan separados por una barrera semipermeable selectiva (Membrana celular) Cada ión posee un coeficiente de permeabilidad característico La permeabilidad relativa de los iones mas permeables de los compartimientos intra y extracelulares dice que el K es el ion mas permeable en una celula excitable en reposo, le sigue el Cl y Finalmente el Na es el que menos permeabilidad tiene en reposo Si PNa = 1, la PCl = 50 y la PK = 100 Estos valores relativos son aproximados puesto que dependen de las características de las membranas celulares, del ión y de las soluciones en que estos se encuentran que son funcionalmente cambiantes.

ORIGEN DEL POTENCIAL ELECTROQUIMICO Dos iones distintos en carga en una misma solución y movidos por uin potencial químico, lo hacen a velocidades diferentes, en consecuencia al migrar se va produciendo una separación entre ellos (los iones + de los negativos). Esta separación de las cargas creará un campo electrico nuevo con una diferencia de potencial eléctrico denominado Potencial electroquímico, cuyo valor dependerá de la magnitud del Potencial Químico Para que exista un Pot. Electroquímico debe previamente existir un gradiente de concentración (Pot. Químico) que es el que da origen al Pot electroquímico porque fuerza a las cargas a separarse durante la migración.

Los eletrolitos, iones cargados Si existe un gradiente de Conc este genera una diferencia de Potencial electrico Si NO hay gradiente de Conc No existe dif. de Voltaje




 Fisiologia
Fisiologia Tono muscular fisiologia
Tono muscular fisiologia Fisiologia aeronautica
Fisiologia aeronautica Sistema nervoso central
Sistema nervoso central Fisiologia vegetal
Fisiologia vegetal Labios evertidos
Labios evertidos Fisiologia respiratória
Fisiologia respiratória Ganglios basales
Ganglios basales Triada portal del higado
Triada portal del higado Fisiología del sistema venoso
Fisiología del sistema venoso Fisiologia
Fisiologia Genoflexo
Genoflexo Fisiologia
Fisiologia Sistema excretor comparado
Sistema excretor comparado Estomago glandular de las aves
Estomago glandular de las aves Costante di tempo neurone
Costante di tempo neurone Fisiologia de la respuesta sexual
Fisiologia de la respuesta sexual Fisiologia
Fisiologia Fisiologia vegetal
Fisiologia vegetal Pancreas endocrino fisiologia
Pancreas endocrino fisiologia Filtração glomerular fisiologia
Filtração glomerular fisiologia Apparato urinario
Apparato urinario Estomas
Estomas Regulacion hormonal
Regulacion hormonal Fisiologia gastrica
Fisiologia gastrica Inicio del trabajo de parto
Inicio del trabajo de parto Pressão hidrostática capilar
Pressão hidrostática capilar Fisiologia de la glandula pineal
Fisiologia de la glandula pineal Cómo está formada la orina
Cómo está formada la orina Anatomia e fisiologia humana
Anatomia e fisiologia humana Retroalimentacion positiva fisiologia ejemplos
Retroalimentacion positiva fisiologia ejemplos Fragmossomo
Fragmossomo Fisiologia
Fisiologia Mecanismo de cerrojo musculo liso
Mecanismo de cerrojo musculo liso Risposta miogena rene
Risposta miogena rene Onda p
Onda p Fisiologia animal comparada
Fisiologia animal comparada Heces esteatorrea fotos
Heces esteatorrea fotos La fosas nasales
La fosas nasales Anatomia y fisiologia del pancreas
Anatomia y fisiologia del pancreas Fisiología de la placenta
Fisiología de la placenta Fisiologia
Fisiologia Fator atividade harris benedict
Fator atividade harris benedict Tiroide
Tiroide Disinaptico
Disinaptico