FISIKA NUKLIR BASIC NUCLEAR PHYSICS ATOM SIFATSIFAT INTI
FISIKA NUKLIR BASIC NUCLEAR PHYSICS
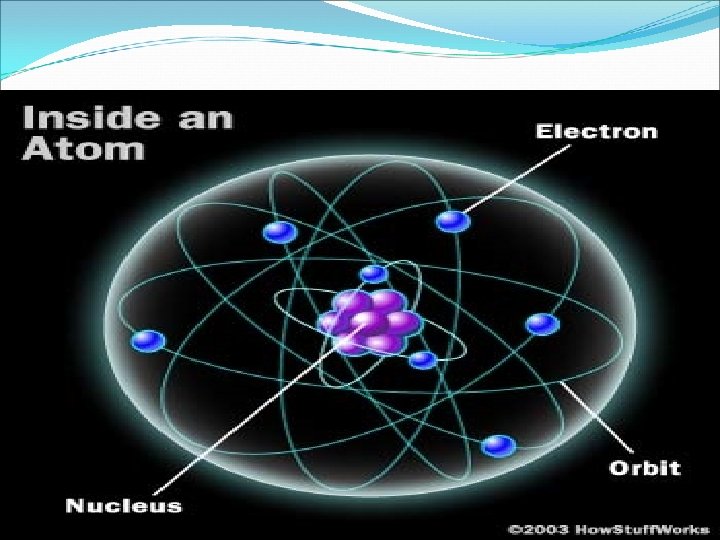
ATOM
SIFAT–SIFAT INTI. ATOM = INTI ATOM + ELEKTRON Bagian terkecil suatu materi yang masih memiliki sifat dasar materi tersebut.

Lambang Inti Atom : A ZX N atau X-A dengan: X = jenis inti Z = nomor proton (Jumlah proton) A = nomor massa (Jumlah nukleon) N = (A-Z) = jumlah neutron Contoh cara menulis: 4 He , 14 N , 16 O atau 4 He, 14 N, 16 O atau He-4, N-14, O-16 2 8 8 2 7 7 isotop → sifat kimia sama (Z sama), sifat nuklir berbeda O-16, O-17, O-18 → isotop, Z sama (8) U-235, U-238 → isotop, Z sama (92) isoton → N sama Isobar → A sama isomer → A, N, Z sama, tenaga beda, misal 14 N dan 14 N*

Muatan Proton mempunyai muatan positif, +e Elektron mempunyai muatan negatif, -e Neutron tidak bermuatan Susah dideteksi Muatan elementer (e )= 1. 602 177 33 x 10 -19 C

Massa Inti(“ 1 + 1 ≠ 2”) Masa inti m ≈ Zmp + Nmn Satuan massa inti: q Karena mudah diperoleh dan dimurnikan sebagai standar, secara internasional disetujui digunakan massa satu atom isotop C-12 (6 proton, 6 neutron, 6 elektron) = 12 u (unified mass unit) q 1 mole atom C-12=12 gr=NA atom C-12 q 1 atom C-12=12/NA gr=12 u q Jadi 1 u = 1/NA=1. 660 559 x 10 -27 kg, Ingat: Bilangan Avogadro NA = 6, 0221367 × 1023 mol-1

Massa Inti u disebut satuan massa atom (sma) Massa proton mp = 1, 0077276470 u Massa neutron mn = 1, 008 665 u Massa elektron me = 0, 00054857 u Dari E = mc 2 me = 0, 51099906 Me. V/c 2 = 9, 1093897× 10 -31 kg. mp = 938, 27231 Me. V/c 2 =1, 672631 1 u = 931, 494 Me. V/c 2 atau Me. V × 10 -27 kg.
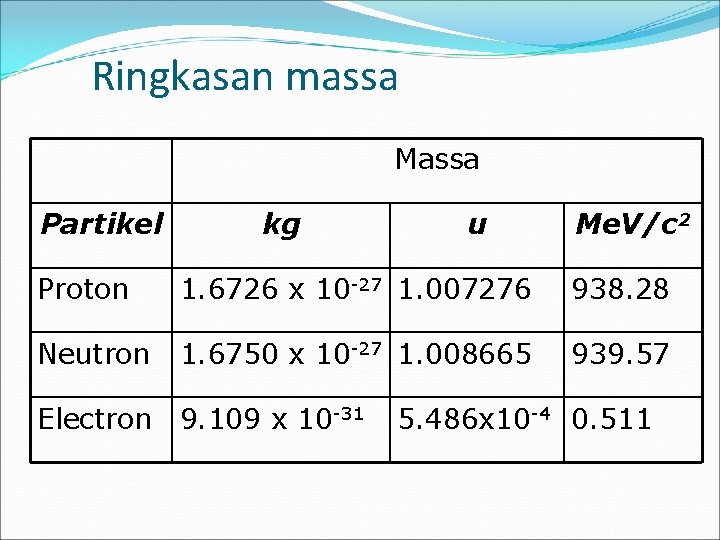
Ringkasan massa Massa Partikel kg u Me. V/c 2 Proton 1. 6726 x 10 -27 1. 007276 938. 28 Neutron 1. 6750 x 10 -27 1. 008665 939. 57 Electron 9. 109 x 10 -31 5. 486 x 10 -4 0. 511

Massa Inti massa neutron mn = 1, 008 665 u, massa proton mp = 1, 007 276 u → mn + mp = 2, 015 941 u, 1 u = 931, 5 Me. V/c 2 Inti-atom deuterium → deuteron, terdiri dari 1 proton dan 1 neutron → md = 2, 013 552 u < mn + mp − md = 0, 002 389 u = 2, 225 Me. V/c 2 ≈ 0, 2% mp → Energi ikat inti deuteron Tenaga ikat elektron dalam atom H 13, 6 e. V ≈ 0, 003 % me Tenaga ikat molekul hidrogen (H 2) 4 e. V ≈ 0, 0000004 % (mp + me)

UKURAN INTI DAN ATOM: Ukuran jerjari inti= 10 -14 - 10 -15 m, femto meter (10 -15 m)=1 Fermi Ukuran jejari atom= 10 -9 - 10 -10 m, nano meter(10 -9 m), Angstrom(10 -10 m) KERAPATAN INTI A/V ~ tetap, A = jumlah nukleon, V = volume inti atom. Jika inti-atom berbentuk bola → V = (4π/3) R 3 → R 3 ~ A → R ~ A 1/3 → ruji inti R = Ro A 1/3 → Ro = 1 - 4, 5 fm (tergantung jenis eksperimen), biasa diambil Ro = 1, 2 × 10 -15 m Ruji 27 Al R = 1, 2 × 10 -15 m × 271/3 = 3, 6 × 10 -15 m Ruji 216 Ra R = 1, 2 × 10 -15 m × 2161/3 = 7, 2 × 10 -15 m → dengan 8× jumlah nukleon ruji 216 Ra 2× ruji 27 Al

Rapat massa materi inti ρm = m/V = (A × 1 u)/(4π/3)R 3 = (A × 1 u)/(4π/3) Ro 3 A = (1 u)/(4π/3)Ro 3 ≈ (1, 6× 10 -27 kg)/{4×(1, 2× 10 -15)3} m 3 = 2× 1017 kg/m 3 Jika volume inti V = 1 cm 3, maka massa inti m = ρm. V = 2 × 1017/ (1 × 106) kg = 2 × 1011 kg = 200 juta ton!!!

Energi Ikat Inti dan Konsep Cacat Massa Mengapa Proton dan Neutron Terikat Membentuk Inti Atom ? Apa yang mengikat proton dan neutron ? Bagaimana dengan gaya Coulomb antar proton? FAKTA : JUMLAH MASSA NUKLEON PADA KEADAAN BEBAS TIDAK SAMA DENGAN MASSA NUKLEON KETIKA MEMBENTUK INTI md < mn + m p

Energi ikat (B=binding energy) Untuk inti-atom massa m dan tenaga ikat B berlaku m = Zmp + Nmn – B/c 2 Dengan massa atom M = Zmp + Nmn + Zme – B/c 2 B = (Zmp + Nmn + Zme – M)c 2 B = {ZM(1 H) + Nmn – M(AZXN)}c 2 Contoh: B(4 He) = 2 M(1 H) + 2 mn – M(4 He) = 28, 30 Me. V Defek massa korelasi dengan energi ikat inti. Perbedaan energi antara energi inti dengan energi penyusun inti (nukleon) disebut energi ikat. Juga bisa dipandang sebagai energi yang diperlukan untuk memisahkan inti menjadi proton dan neutron

PERBEDAAN MASSA PENYUSUN INTI DAN INTI DISEBUT PENYUSUTAN MASSA ATAU CACAT MASSA atau DEFEK MASSA (AX) =(M(AX) – A)c 2 , A=N+Z dalam satuan u: M(AX) = A + Δ(AX) Contoh: M(4 He) = 4 + 2, 424 Me. V / (931, 5 Me. V/u) = 4, 002 602 u B(4 He) = 2 M(1 H) + 2 mn – M(4 He) = 2{AH + Δ(H)} + 2{AH + Δ(n)} – {AHe + Δ(He)} = 2{1 + Δ(H)} + 2{1 + Δ(n)} – {4 + Δ(He)} = 2 Δ(H) + 2 Δ(n) – Δ(He) = 2 × 7, 289 Me. V + 2 × 8, 071 Me. V – 2, 424 Me. V = 28, 30 Me. V

Perbedaan antara energi inti dengan energi penyusun inti (nukleon) disebut energi ikat. Juga bisa dipandang sebagai energi yang diperlukan untuk memisahkan inti menjadi proton dan neutron Tenaga pemisahan (S) untuk melepas satu neutron (neutron separation energy) dari 4 He → 3 He + n S(4 He → 3 He + n) = M(32 He) + mn – M(42 He) = 20, 58 Me. V

Massa inti dapat diperoleh dari massa atom Pada Tabel ada dua penyajian (dalam satuan u=sma): • Massa atom • Cacat massa atom

Spin Inti dan Momen magnet spin Proton atau neutron mempunyai spin intrinsik : 1/2 Momentum angular orbit inti I(I+1) (I=bilangan kuantum spin inti, bulat atau ganjil) p= gp Is N sedangkan n= gn Is N Magneton Inti (satuan momen magnet spin inti) N=(eh)/(4 mp)=5. 05 x 10 -27 J/T analogi dengan elektron B = 9. 274 x 10 -24 J/T Momen Magnetik secara eksperimen proton 2. 7928 n sedangkan neutron -1. 9135 n

Momentum Angular Spin Inti

PR-1 1. Jelaskan bagaimana cara menentukan besarnya massa suatu atom 2. Jelaskan bagaimana cara menentukan besarnya jejari inti atom 3. Jelaskan bagaimana cara menentukan besarnya moment magnet inti atom (proton).
- Slides: 19