Festkrperelektrochemie II 1 Kristalline Elektrolyte 2 Glasartige Elektrolyte


















- Slides: 22

Festkörperelektrochemie II 1. Kristalline Elektrolyte 2. Glasartige Elektrolyte 3. Polymerelektrolyte 4. Interkalationselektroden FU Berlin Constanze Donner / Ludwig Pohlmann 2017 1

Polymerelektrolyte Beispiele: 1. Anorganisch: Silikat- und Borosilikat-Gläser 2. Biopolymere 3. Synthetische Ionenaustauscher Zwei Typen haben besonderes Interesse gefunden: A. Polymer-Salz-Komplexe B. Polyelektolyte A: Polyethylenoxid + Metallsalze: Wright 1975: erhebliche Ionenleitfähigkeit! Andere „Feste Solvents“: Polyethylenimin, Polyethylensuccinate B: Polyelektrolyte: enthalten selbst geladene Gruppen, nur die gegenionen sind mobil FU Berlin Constanze Donner / Ludwig Pohlmann 2017 2

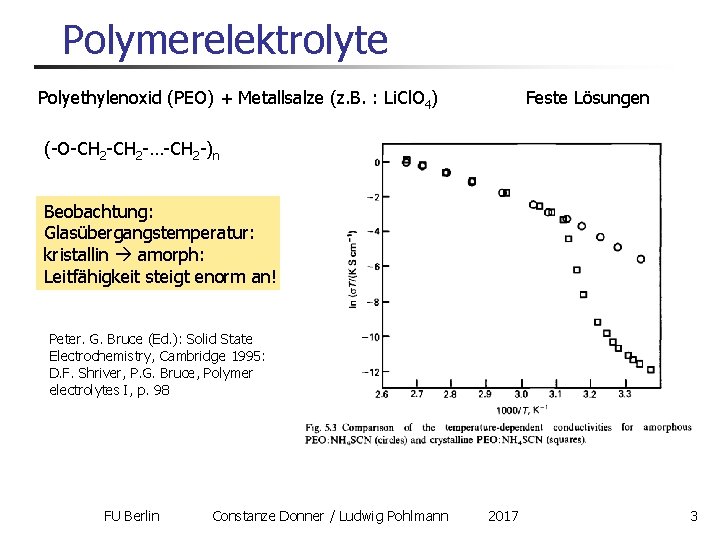
Polymerelektrolyte Polyethylenoxid (PEO) + Metallsalze (z. B. : Li. Cl. O 4) Feste Lösungen (-O-CH 2 -…-CH 2 -)n Beobachtung: Glasübergangstemperatur: kristallin amorph: Leitfähigkeit steigt enorm an! Peter. G. Bruce (Ed. ): Solid State Electrochemistry, Cambridge 1995: D. F. Shriver, P. G. Bruce, Polymer electrolytes I, p. 98 FU Berlin Constanze Donner / Ludwig Pohlmann 2017 3

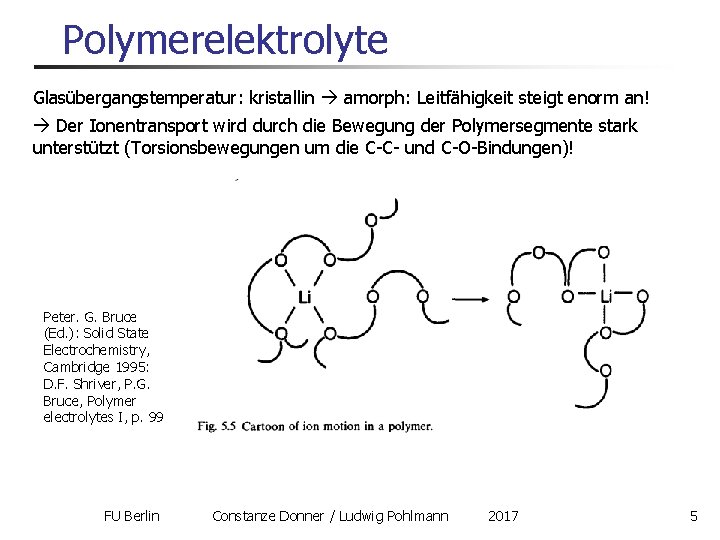
Polymerelektrolyte Glasübergangstemperatur: kristallin amorph: Leitfähigkeit steigt enorm an! Der Ionentransport wird durch die Bewegung der Polymersegmente stark unterstützt (Torsionsbewegungen um die C-C- und C-O-Bindungen)! Die Bewegungen brechen und erzeugen die Koordinationssphären der solvatisierten Ionen und erzeugen temporär freie Plätze, in welche die Ionen diffundieren können. Andere Temperaturabhängigkeit (nicht Arrhenius): = 0 exp(-B/(T – T 0)) (Vogel-Tamman-Fulcher-Gleichung) FU Berlin Constanze Donner / Ludwig Pohlmann 2017 4

Polymerelektrolyte Glasübergangstemperatur: kristallin amorph: Leitfähigkeit steigt enorm an! Der Ionentransport wird durch die Bewegung der Polymersegmente stark unterstützt (Torsionsbewegungen um die C-C- und C-O-Bindungen)! Peter. G. Bruce (Ed. ): Solid State Electrochemistry, Cambridge 1995: D. F. Shriver, P. G. Bruce, Polymer electrolytes I, p. 99 FU Berlin Constanze Donner / Ludwig Pohlmann 2017 5

Interkalationselektroden 1. Schichtgitterkristalle, z. B. Graphit, Mo. S 2, Ti. S 2, Mo. Se 2, Ti. Se 2, 2. Reversible Einlagerung von Ionen/Molekülen in den Zwischenschichten 3. die Konzentration der Interkalate ist veränderbar! Schichtgitterkristall By Ben Mills - Own work, Public Domain, https: //commons. wikimedia. o rg/w/index. php? curid=29764 97 Mo. S 2, the most common metal dichalcogenide, adopts a layered structure. FU Berlin Constanze Donner / Ludwig Pohlmann 2017 6

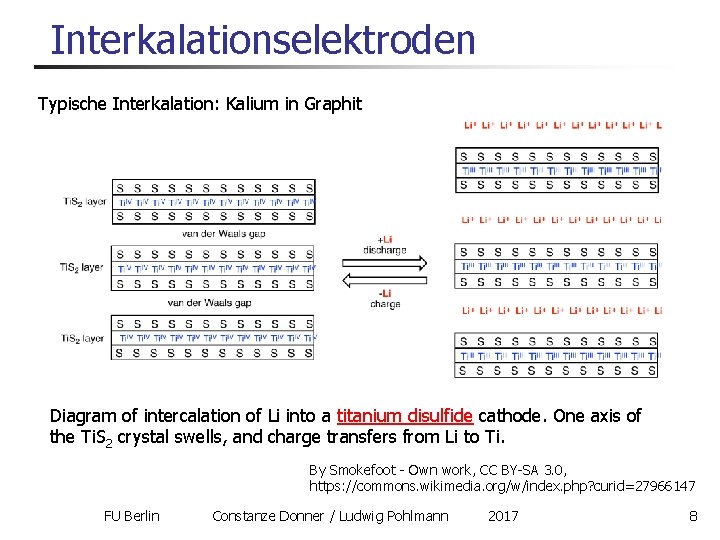
Interkalationselektroden Typische Interkalation: Kalium in Graphit By Ben Mills - Own work, Public Domain, https: //commons. wikimedia. o rg/w/index. php? curid=47193 29 Mo. S 2, the most common metal dichalcogenide, adopts a layered structure. FU Berlin Constanze Donner / Ludwig Pohlmann 2017 7

Interkalationselektroden Typische Interkalation: Kalium in Graphit Diagram of intercalation of Li into a titanium disulfide cathode. One axis of the Ti. S 2 crystal swells, and charge transfers from Li to Ti. By Smokefoot - Own work, CC BY-SA 3. 0, https: //commons. wikimedia. org/w/index. php? curid=27966147 FU Berlin Constanze Donner / Ludwig Pohlmann 2017 8

Transportprozesse Diffusion Migration Konvektion Nernst-Planck-Gleichung Fragen: a) Wie kommt die Ionenbewegung zustande? OK b) Welche Rolle spielt die Migration der Ionen? c) Wie ist die Doppelschicht aufgebaut? FU Berlin Constanze Donner / Ludwig Pohlmann 2017 9

Transportprozesse Nernst-Planck-Gleichung pro Ionensorte i Diffusion Migration Stationärer Zustand: konstanter Strom der Ionen Der Stoffstrom der Ionensorte i muss im stationären Zustand gleich der elektrochemischen Reaktionsrate vi des betreffenden Ions an der Elektrodengrenzfläche sein! Das ist nur möglich, wenn die Elektrodenreaktion hinreichend schnell ist („nicht-polarisierbare Elektrode“), die Transportprozesse also limitierend sind. FU Berlin Constanze Donner / Ludwig Pohlmann 2017 10

Transportprozesse Diffusion Migration Annahmen: 1. Keine Ladungsüberschüsse an der Grenzfläche kein nennenswerter Potentialabfall in der Doppelschicht 2. Transportlimitierung Ci(x=0) = 0 und Ci(x=L) = Csat 3. Konstantes Feld E(x) = const. Dann ist ein Vergleich beider Transportprozesse möglich: Abschätzung FU Berlin Constanze Donner / Ludwig Pohlmann 2017 11

Transportprozesse Vergleich beider Transportprozesse: Potentialdifferenz zwischen den Elektroden RT/F = 0. 025 V 25 °C U = 1 V, zi = 1 : Unter diesen Annahmen gilt also: schon bei moderaten Zellspannungen ist Migration überwiegend! FU Berlin Dann gilt auch das lineare Ohmsche Gesetz: I U ! Constanze Donner / Ludwig Pohlmann 2017 12

Transportprozesse Aber: diese Annahmen sind sehr mutig – sind sie überhaupt realistisch? Viele verschiedene Umstände können die Annahmen zum Wanken bringen: 1. Balance von Reaktionsrate und Stoffstrom: Der Stoffstrom der Ionensorte i muss im stationären Zustand gleich der elektrochemischen Reaktionsrate vi des betreffenden Ions an der Elektrodengrenzfläche sein! Andernfalls: wenn vi Ji , dann reichert sich das Ion an der Grenzfläche an (ab), bis das Potential der entstehenden Überschussladung den Stoffstrom J hinreichend verlangsamt hat, so dass wieder vi Ji‘ ist! Starker Potentialabfall an der (den) Grenzfläche(n) die verbleibende Potentialdifferenz in der Lösung wird verschwindend klein! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 13

Transportprozesse Aber: sind diese Annahmen überhaupt realistisch? 2. Balance von allen Reaktionsraten und Stoffströmen: Dies muss für alle beweglichen Ionensorten im Elektrolyten gelten! Gegenbeispiel: System Kathode Cu | Cu 2+ / SO 42 - | Cu Anode Kupfer-Raffinierung Reaktive Ionen an beiden Elektroden: Cu 2+ Inerte Ionen an beiden Elektroden: SO 42+ FU Berlin Constanze Donner / Ludwig Pohlmann 2017 14

Transportprozesse Aber: sind diese Annahmen überhaupt realistisch? 2. Balance von allen Reaktionsraten und Stoffströmen: Wenn auch nur eine der Ionensorten nicht an den Elektrodenreaktionen teilnimmt, dann stellt sich für diese Ionen das Gouy-Chapman-Gleichgewicht an der Elektrodengrenzfläche ein (diffuse Doppelschicht)! integiert: Starker Potentialabfall an der (den) Grenzfläche(n) die verbleibende Potentialdifferenz in der Lösung wird verschwindend klein! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 15

Transportprozesse Aber: sind diese Annahmen überhaupt realistisch? 3. Gegenwart eines Überschusses von Neutralsalzen: Wenn gelöste Salze im Überschuss vorhanden sind, welche überhaupt nicht an der Reaktion teilnehmen, so stellt sich für Kationen und Anionen dieses Salzes das Gouy-Chapman-Gleichgewicht an der Elektrodengrenzfläche ein (diffuse Doppelschicht)! Starker Potentialabfall an der (den) Grenzfläche(n) die verbleibende Potentialdifferenz in der Lösung wird verschwindend klein! In all diesen Fällen kann man den Anteil der Migration in der Regel vernachlässigen! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 16

Transportprozesse Aber: sind diese Annahmen überhaupt realistisch? 4. Weitere Probleme mit den Annahmen: 1. Anreicherung/Verarmung an der Grenzfläche von Reaktionsprodukten 2. Stationäre Diffusion und konstante Migration im homogenen elektrischen Feld widersprechen sich 3. Unterschiedliche Diffusionsgeschwindigkeiten der verschiedenen Ionensorten FU Berlin Constanze Donner / Ludwig Pohlmann 2017 17

Transportprozesse Wie sieht es nun bei den Festelektrolyten aus? Im Gegensatz zu den flüssigen Elektrolyten stehen hier die Chancen bei einigen Systemen nicht schlecht! Beispiel alpha-Silberjodid: Kathode Ag | Ag+ / I- | Ag Anode 1. Nur eine Ionensorte reagiert an den Elektroden: Ag+ 2. Die nicht reagierenden Anionen sind nicht mobil keine diffuse Doppelschicht 3. Es gibt keine Neutralsalzionen keine diffuse Doppelschicht 4. Durch den konstanten Stoffstrom bleibt die Elektroneutraliät überall gewahrt (x) = 0, E = const. , (x) – lineare Funktion FU Berlin Constanze Donner / Ludwig Pohlmann 2017 18

Transportprozesse Wie sieht es nun bei den Festelektrolyten aus? Aber als Gegenbeispiel ein anderes System: Polyethylenoxid (PEO) + Li. Cl. O 4 1. Nur eine Ionensorte reagiert an den Elektroden: Ag+ 2. Die nicht reagierenden Anionen sind aber mobil diffuse Doppelschicht Abschirmung des Potentials 3. Diffusion dominiert die Leitfähigkeit FU Berlin Constanze Donner / Ludwig Pohlmann 2017 19

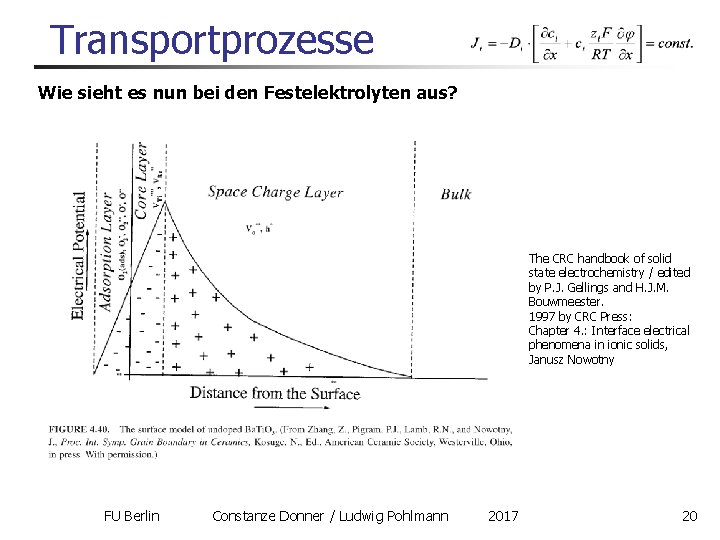
Transportprozesse Wie sieht es nun bei den Festelektrolyten aus? Ein eher typisches Bild der Grenzfläche: The CRC handbook of solid state electrochemistry / edited by P. J. Gellings and H. J. M. Bouwmeester. 1997 by CRC Press: Chapter 4. : Interface electrical phenomena in ionic solids, Janusz Nowotny FU Berlin Constanze Donner / Ludwig Pohlmann 2017 20

Anwendungen 1. 2. 3. 4. Li-Batterien Brennstoffzellen (oxidische Ionenleiter) Gassensoren (Lambda-Sonde) Electrochrome Systeme (Smart Windows) FU Berlin Constanze Donner / Ludwig Pohlmann 2017 21

Aktuelle Forschungen http: //news. mit. edu/2017/toward-solid-lithium-batteries-0202 https: //chargedevs. com/tag/solid-state-batteries/ https: //phys. org/news/2016 -03 -solid-electrolytes-doors-solid-state-batteries. html FU Berlin Constanze Donner / Ludwig Pohlmann 2017 22



