Fenomeni fisici e chimici modello atomico Miscugli e























- Slides: 35

Fenomeni fisici e chimici modello atomico Miscugli e soluzioni Gli elementi e i composti Miscugli e soluzioni I legami chimici e la valenza

Cerchiamo di vincere quella “chemiofobia” … Nei giornali la CHIMICA fa notizia solo quando si parla di disastri ecologici inquinamento e sofisticazioni… …per il prosciutto di Parma “Purezza sì, Chimica no”! (tratto dalla pubblicità del prodotto!)

Fotosintesi CO 2 + 6 H 2 O → C 6 H 12 O 6 + 6 O 2 Materie plastiche

Farmaci Fertilizzanti …. .

Indice I fenomeni fisici Un cubetto di ghiaccio, tolto dal congelatore, fonde. Cambia, da solido a liquido, lo stato di aggregazione della sostanza H 2 O. Però le molecole di H 2 O restano immutate: se alla fine rimettete l’acqua nel freezer, si riformerà il cubetto di ghiaccio iniziale. Questo è un esempio di fenomeno fisico.

Indice I fenomeni chimici Versate qualche cucchiaino di bicarbonato di sodio in un palloncino sgonfio. Poi incappucciate con il palloncino una bottiglietta in cui avete versato un po’ di aceto. Infine sollevate il palloncino, così che il bicarbonato cada nell’aceto. Che cosa succederà?

Indice I fenomeni chimici Si formerà una schiuma ribollente e il palloncino inizierà a gonfiarsi. Sta avvenendo una reazione chimica: l’aceto e il bicarbonato, mescolandosi, si trasformano in sostanze diverse. Il palloncino si gonfia perché dentro la bottiglietta si produce un gas che prima non c’era. dal palloncino si è fatto cadere bicarbonato dentro l’aceto contenuto nella bottiglietta

Indice Fenomeni fisici e fenomeni chimici Se la costituzione della materia non cambia, si parla di fenomeni fisici. Se la costituzione della materia invece cambia, si parla di fenomeni chimici. I fenomeni fisici di solito sono reversibili: dai risultati si può tornare al punto di partenza. I fenomeni chimici di solito sono irreversibili: dai risultati non si può tornare al punto di partenza.

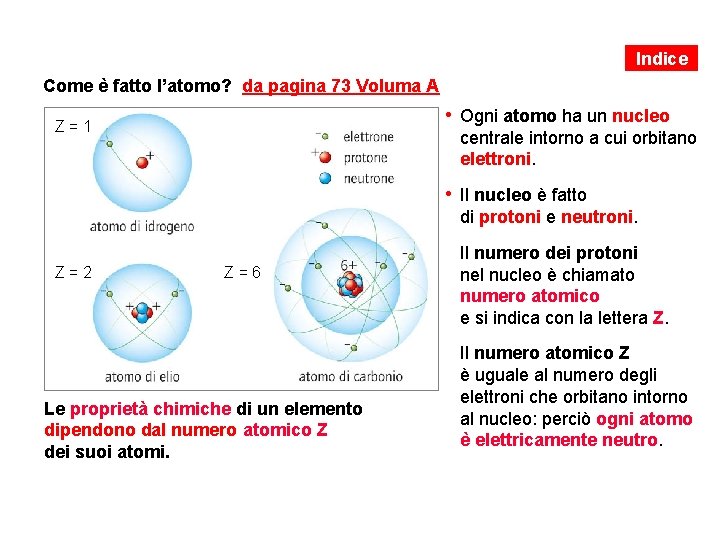
Indice Come è fatto l’atomo? da pagina 73 Voluma A • Ogni atomo ha un nucleo Z=1 centrale intorno a cui orbitano elettroni. • Il nucleo è fatto di protoni e neutroni. • Il numero dei protoni Z=2 Z=6 nel nucleo è chiamato numero atomico e si indica con la lettera Z. • Il numero atomico Z Le proprietà chimiche di un elemento dipendono dal numero atomico Z dei suoi atomi. è uguale al numero degli elettroni che orbitano intorno al nucleo: perciò ogni atomo è elettricamente neutro.

Tavola periodica degli elementi

Indice Come è fatto l’atomo? (2) Gli elettroni negli atomi non possono assumere una posizione qualsiasi: devono muoversi all’interno di una serie di «gusci» concentrici, un po’ come gli strati di una cipolla. Inoltre ogni guscio può ospitare un numero massimo di elettroni: primo guscio: al massimo 2 elettroni; secondo guscio: al massimo 8 elettroni; terzo guscio: al massimo 8 elettroni.

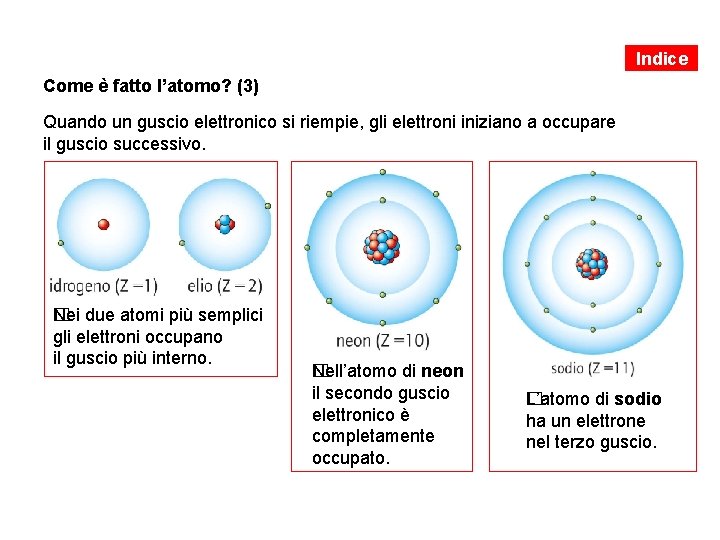
Indice Come è fatto l’atomo? (3) Quando un guscio elettronico si riempie, gli elettroni iniziano a occupare il guscio successivo. �ei due atomi più semplici N gli elettroni occupano il guscio più interno. �ell’atomo di neon N il secondo guscio elettronico è completamente occupato. �’atomo di sodio L ha un elettrone nel terzo guscio.

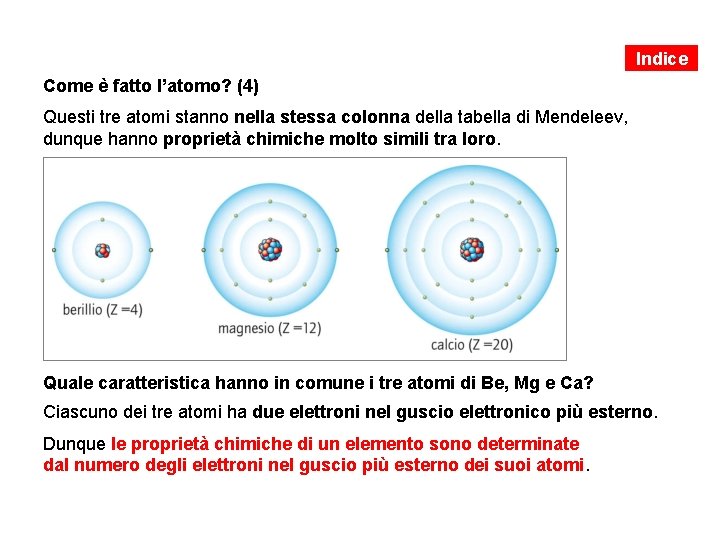
Indice Come è fatto l’atomo? (4) Questi tre atomi stanno nella stessa colonna della tabella di Mendeleev, dunque hanno proprietà chimiche molto simili tra loro. Quale caratteristica hanno in comune i tre atomi di Be, Mg e Ca? Ciascuno dei tre atomi ha due elettroni nel guscio elettronico più esterno. Dunque le proprietà chimiche di un elemento sono determinate dal numero degli elettroni nel guscio più esterno dei suoi atomi.

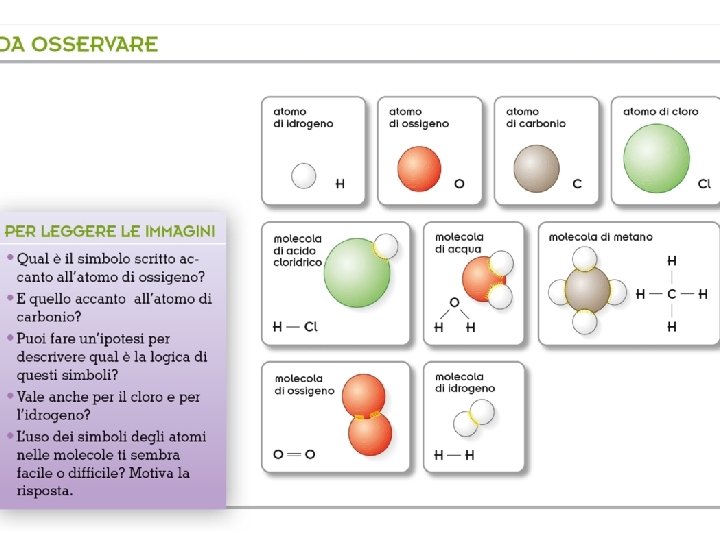
Indice Elementi e composti chimici l’acqua è una sostanza composta H 2 O Fe Esistono tanti tipi diversi di atomi, ciascuno dei quali rappresenta un particolare elemento chimico. • Un elemento è formato da atomi tutti identici tra loro. Fe il ferro è una sostanza semplice • Un composto contiene una particolare combinazione di atomi di tipo diverso.


Indice Le miscele …da pagina 84 volume A La materia è formata da tante sostanze, ciascuna composta da un particolare tipo di atomi o molecole. In natura è raro incontrare una sostanza allo stato puro. Di solito le sostanze sono mescolate tra loro in forma di miscele, che possono essere: • solide (esempio: le rocce); • liquide (esempio: le bibite); • aeriformi (esempio: l’aria).

Indice I miscugli Mescolate in un piatto un po’ di sabbia con un po’ di limatura di ferro. Avrete così un miscuglio, o miscela eterogenea. Le due sostanze si possono di nuovo separare facilmente: basta usare una calamita.

Indice Le soluzioni Se invece mescolate l’acqua e il sale, non riuscirete più a distinguerli. Ora avete una soluzione, o miscela omogenea. Se però riscaldate la soluzione, l’acqua evapora e resta il sale. cristalli di sale acqua e sale Per separare le sostanze che formano una soluzione, bisogna dunque utilizzare i cambiamenti di stato.

Indice Miscugli e soluzioni

Indice Il volume dei miscugli è minore della somma dei volumi di partenza Versate in un contenitore 70 ml d’acqua e in un altro contenitore 30 ml di sabbia. Poi versate l’acqua nel contenitore della sabbia: il miscuglio ha un volume totale di 85 -90 ml. Dove è finito il volume mancante? Il volume mancante è quello che all’inizio era occupato dall’aria tra i granelli della sabbia.

Indice Il volume dei miscugli è minore della somma dei volumi di partenza Ciò che abbiamo visto per la sabbia accade con qualsiasi solido poroso, cioè pieno di «buchi» o pori. Per esempio, se immergiamo questa spugna nel bicchier d’acqua, certamente lo farà traboccare, no? E invece no! Anche qui la ragione è che l’acqua va a occupare tutti i buchi della spugna che prima erano occupati dall’aria.

Indice Solventi e soluti Nelle soluzioni si chiama: • solvente la sostanza che è presente in quantità maggiore; • soluto la sostanza che è presente in quantità minore. Esempio: nell’acqua zuccherata l’acqua è il solvente e lo zucchero è il soluto.

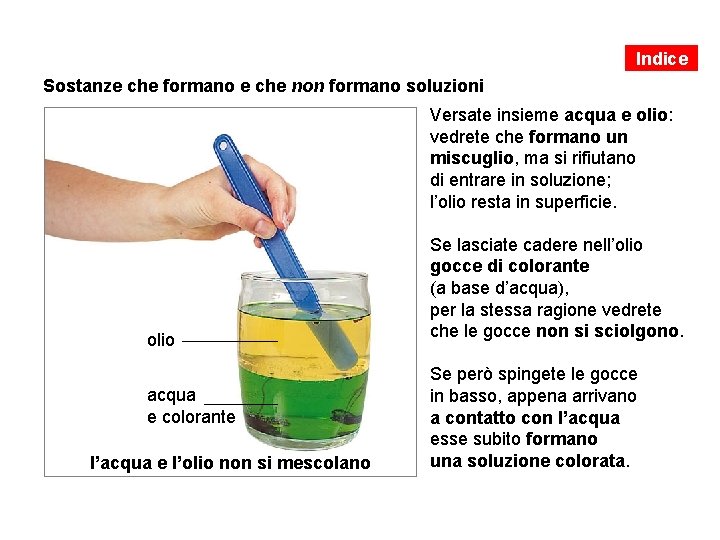
Indice Sostanze che formano e che non formano soluzioni Versate insieme acqua e olio: vedrete che formano un miscuglio, ma si rifiutano di entrare in soluzione; l’olio resta in superficie. olio acqua e colorante l’acqua e l’olio non si mescolano Se lasciate cadere nell’olio gocce di colorante (a base d’acqua), per la stessa ragione vedrete che le gocce non si sciolgono. Se però spingete le gocce in basso, appena arrivano a contatto con l’acqua esse subito formano una soluzione colorata.

Indice Le emulsioni Se agitate con un cucchiaio un miscuglio di acqua e olio, otterrete un’emulsione: tantissime goccioline di olio rimangono sospese nell’acqua e olio latte Anche il latte è un’emulsione. Infatti il latte è formato da piccolissime particelle di grasso sospese in un liquido simile all’acqua.

Indice Esempi di soluzioni allo stato solido, liquido e aeriforme i� l vino è una soluzione tra due liquidi: il solvente è l’acqua mentre l’alcol etilico è il soluto (la concentrazione dell’alcol può variare tra il 10% e il 15%) �na bevanda gassata u è una soluzione tra liquidi e aeriformi: alla bibita è mescolato un po’ di diossido di carbonio (anidride carbonica), il gas che forma le «bollicine» l� ’aria che respiriamo è un esempio di soluzione di gas in gas: l’azoto è il solvente mentre il soluto è l’ossigeno (al 20% circa), con tracce di altri gas l� e leghe metalliche sono soluzioni tra solidi; per esempio nel bronzo delle statue il solvente è il rame e il soluto è un altro metallo, lo stagno (con una concentrazione intorno al 10 -20%)

Indice La concentrazione di una soluzione Si chiama concentrazione di una soluzione il rapporto tra la massa del soluto e la massa totale della soluzione (oppure tra il volume del soluto e il volume totale della soluzione). La concentrazione si esprime in percentuale. Se per esempio sciogliete in acqua 20 ml di sale ottenendo 100 ml di acqua salata, allora la concentrazione della soluzione è pari al 20%.

Indice Le soluzioni sature Se continuate ad aggiungere sale a una soluzione in acqua, vedrete che a un certo punto il sale non si scioglie più. Il sale ora precipita in forma solida al fondo del contenitore. La soluzione è diventata satura.

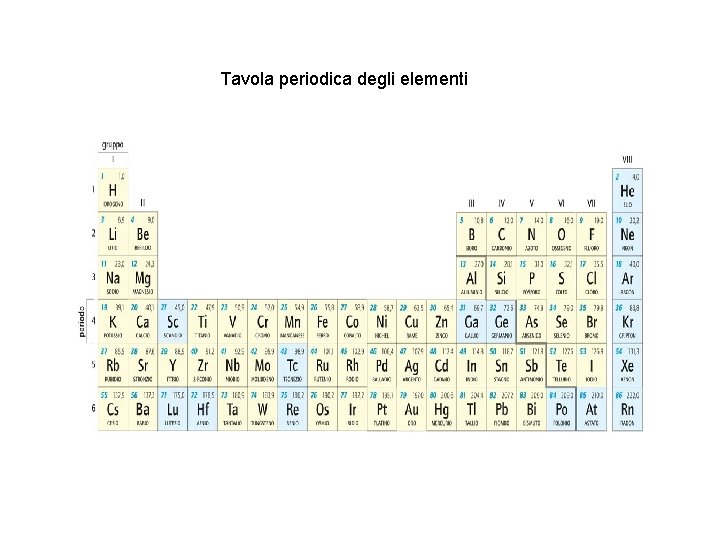
Indice Come si possono classificare gli elementi chimici? Nel 1870 Mendeleev trovò un buon metodo: la tabella (o tavola) periodica. • In ogni riga gli elementi sono ordinati in base alla loro massa atomica. • Ogni colonna (o gruppo) contiene elementi con proprietà chimiche molto simili tra loro. Così in ogni riga si ripete, da sinistra verso destra, la stessa sequenza di proprietà chimiche; perciò le righe della tabella sono chiamate periodi.

Indice La tabella periodica si è rivelata un’ottima classificazione degli elementi. In particolare, Mendeleev aveva lasciato nella tabella alcuni spazi vuoti… … infatti era convinto che le caselle con lo sfondo azzurro dovessero corrispondere a elementi chimici con proprietà ben precise, che non erano ancora stati scoperti. Ebbene, quei nuovi elementi chimici sono stati poi scoperti davvero, e si è trovato che essi hanno proprio le caratteristiche previste da Mendeleev!

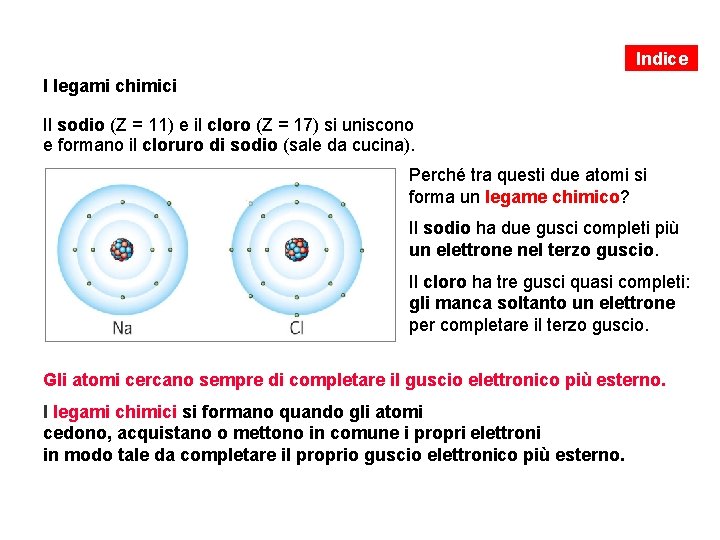
Indice I legami chimici Il sodio (Z = 11) e il cloro (Z = 17) si uniscono e formano il cloruro di sodio (sale da cucina). Perché tra questi due atomi si forma un legame chimico? Il sodio ha due gusci completi più un elettrone nel terzo guscio. Il cloro ha tre gusci quasi completi: gli manca soltanto un elettrone per completare il terzo guscio. Gli atomi cercano sempre di completare il guscio elettronico più esterno. I legami chimici si formano quando gli atomi cedono, acquistano o mettono in comune i propri elettroni in modo tale da completare il proprio guscio elettronico più esterno.

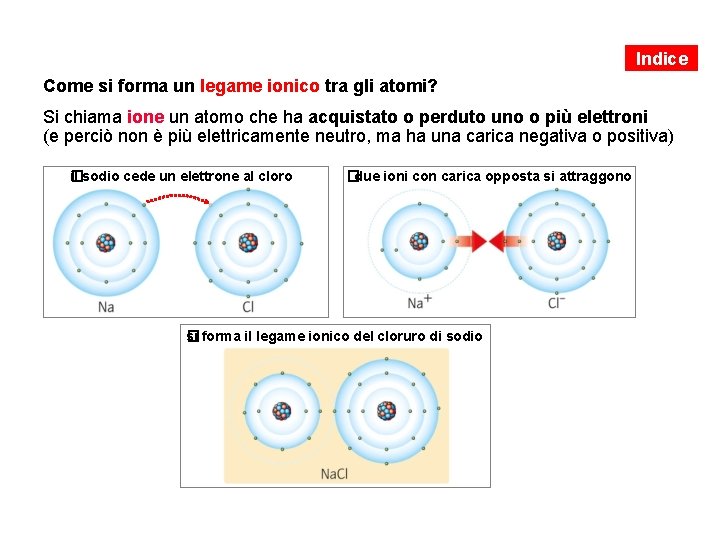
Indice Come si forma un legame ionico tra gli atomi? Si chiama ione un atomo che ha acquistato o perduto uno o più elettroni (e perciò non è più elettricamente neutro, ma ha una carica negativa o positiva) il sodio cede un elettrone al cloro � i due ioni con carica opposta si attraggono � si forma il legame ionico del cloruro di sodio �

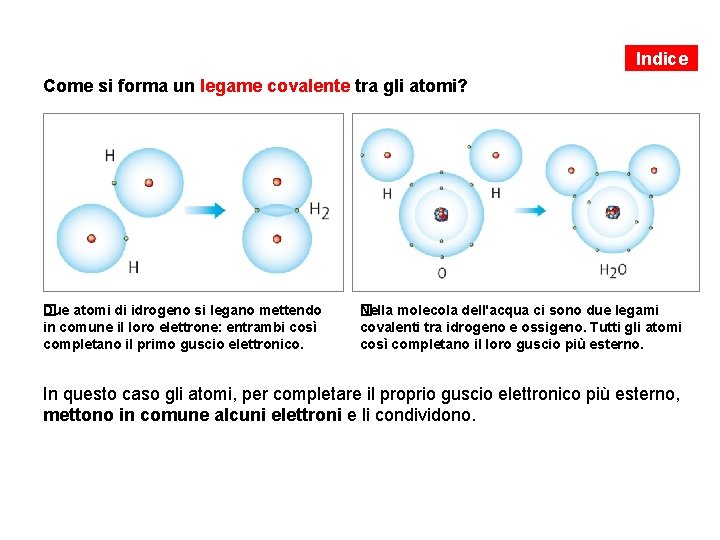
Indice Come si forma un legame covalente tra gli atomi? �ue atomi di idrogeno si legano mettendo D in comune il loro elettrone: entrambi così completano il primo guscio elettronico. �ella molecola dell'acqua ci sono due legami N covalenti tra idrogeno e ossigeno. Tutti gli atomi così completano il loro guscio più esterno. In questo caso gli atomi, per completare il proprio guscio elettronico più esterno, mettono in comune alcuni elettroni e li condividono.

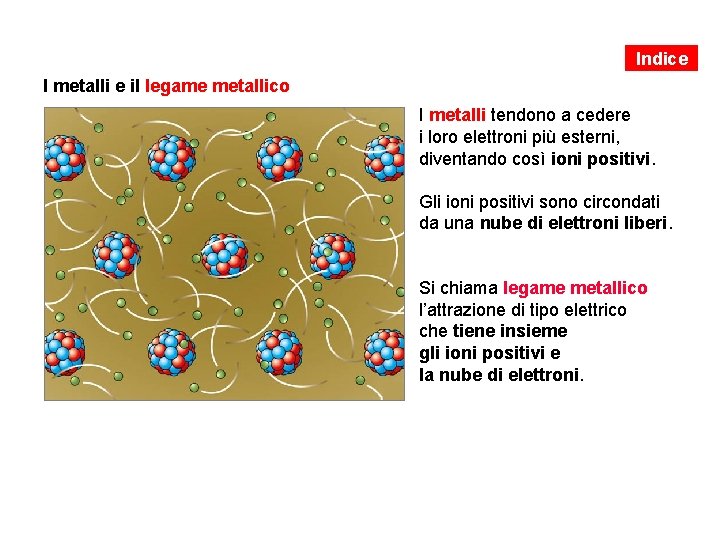
Indice I metalli e il legame metallico I metalli tendono a cedere i loro elettroni più esterni, diventando così ioni positivi. Gli ioni positivi sono circondati da una nube di elettroni liberi. Si chiama legame metallico l’attrazione di tipo elettrico che tiene insieme gli ioni positivi e la nube di elettroni.

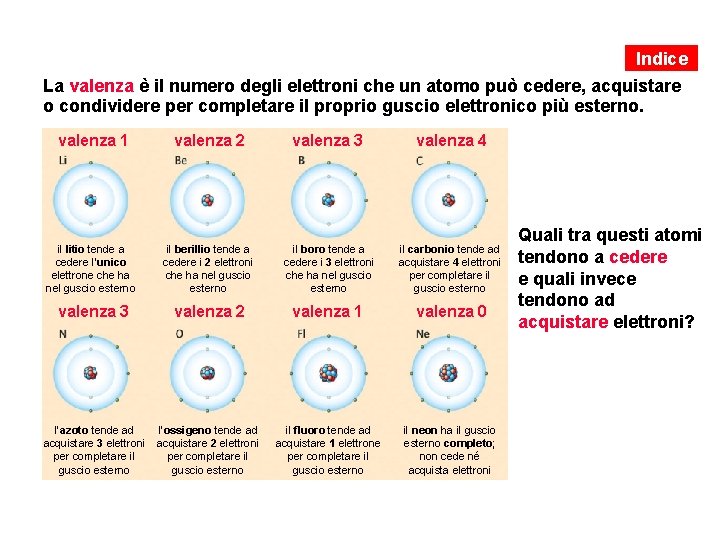
Indice La valenza è il numero degli elettroni che un atomo può cedere, acquistare o condividere per completare il proprio guscio elettronico più esterno. valenza 1 valenza 2 valenza 3 valenza 4 il litio tende a cedere l’unico elettrone che ha nel guscio esterno il berillio tende a cedere i 2 elettroni che ha nel guscio esterno il boro tende a cedere i 3 elettroni che ha nel guscio esterno il carbonio tende ad acquistare 4 elettroni per completare il guscio esterno valenza 3 valenza 2 valenza 1 valenza 0 l’azoto tende ad acquistare 3 elettroni per completare il guscio esterno l’ossigeno tende ad acquistare 2 elettroni per completare il guscio esterno il fluoro tende ad acquistare 1 elettrone per completare il guscio esterno il neon ha il guscio esterno completo; non cede né acquista elettroni Quali tra questi atomi tendono a cedere e quali invece tendono ad acquistare elettroni?

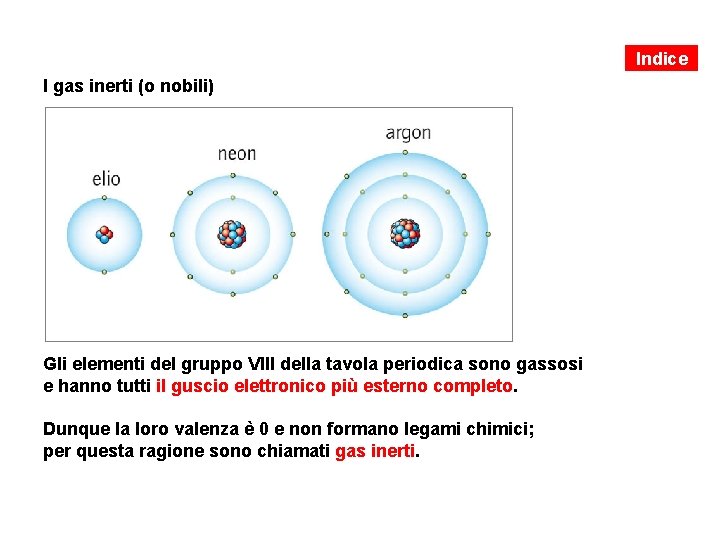
Indice I gas inerti (o nobili) Gli elementi del gruppo VIII della tavola periodica sono gassosi e hanno tutti il guscio elettronico più esterno completo. Dunque la loro valenza è 0 e non formano legami chimici; per questa ragione sono chiamati gas inerti.