FAZNI DIJAGRAMI I dio SKRUIVANJE METALA I LEGURA



























- Slides: 32

FAZNI DIJAGRAMI I. dio

SKRUĆIVANJE METALA I LEGURA Ø Skrućivanje - proces pretvorbe metala i legura iz tekućeg u kruto stanje Ø Skrućivanje - proces nastanka i rasta kristala (kristalizacija) Ø Prekristalizacija – pretvorba skrućenog metala iz jednog kristalnog oblika u drugi (npr. alotropske modifikacije) Ø Skrućivanje metala – važan proces za industrijsku proizvodnju (ljevarstvo – lijevanje metala i legura u

Da bi došlo do skrućivanja metala i legura potrebno je ispuniti slijedeće uvjete: Ø pothlađenost taljevine Ø prisutnost klica Ø odvođenje topline iz sustava Razlikujemo dva načina nastajanja klica (nukleacije): Ø homogenu nukleaciju Ø heterogenu nukleaciju Ø Klica kritične veličine nastaje na onom mjestu u taljevini gdje u tom trenutku ima dovoljan broj atoma koji imaju fluktuaciju energije veću ili jednaku energijskoj barijeri Ø Energija potrebna skupini atoma za svladavanje energijske barijere pri nastajanju klice potječe od toplinskih fluktuacija energije

Taljevina Kristali koji Granice zrna Zrna rastu iz klica Klice a) b) c) Slika 1. Shematski prikaz nekoliko faza skrućivanaja: a) Pothlađena taljevina s klicama, b) Rast kristala iz klica, c) Skrućivanje je završeno – kristali su u međusobnom kontaktu preko kristalnih granica

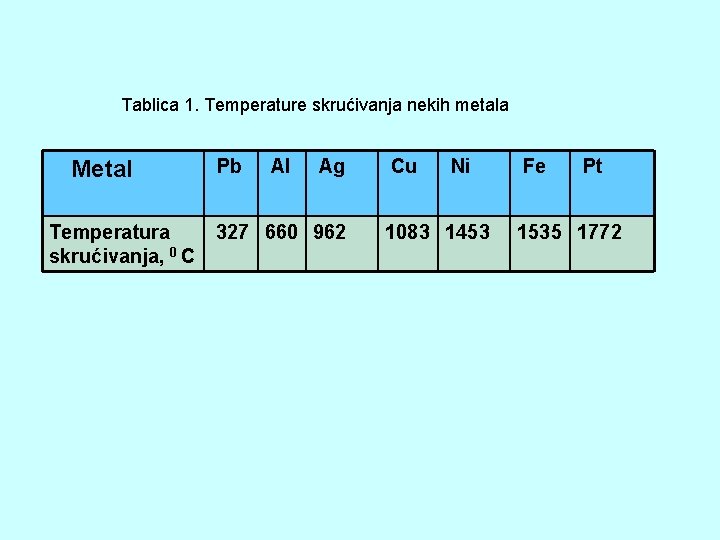
Tablica 1. Temperature skrućivanja nekih metala Metal Temperatura skrućivanja, 0 C Pb Al Ag 327 660 962 Cu Ni 1083 1453 Fe Pt 1535 1772

Heterogena nukleacija Ø Heterogena nukleacija se odvija kada je u taljevini prisutna strana čestica ili površina (supstrat), kao na primjer površina posude u kojoj je taljevina Ø Heterogena nukleacija se odvija na nekoj već postojećoj površini koja smanjuje barijeru površinske energije, smanjuje slobodnu energiju potrebnu za nastajanje stabilne klice Ø Uvjet za heterogenu nukleaciju je da površina supstrata mora biti namočena taljevinom Ø Površinska energija potrebna za heterogenu nukleaciju je manja od one za homogenu nukleaciju – ukupna promjena slobodne energije za nastajanje stabilne klice je manja, a također je manji i kritični polumjer klice Ø Za heterogenu nukleaciju je potebno znatno pothlađivanje taljevine nego kod homogene nukleacije manje Ø U industrijskoj praksi (oblikovanje proizvoda lijevanjem taljevine u kalupe) heterogena nukleacija omogućava skrućivanje 0

Slika 2. Lijevanje rastaljenog metala u kalup

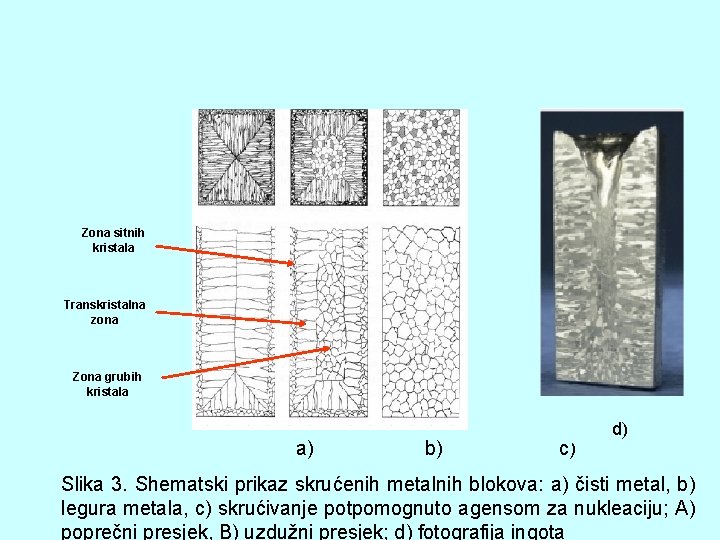
A) Zona sitnih kristala B) Transkristalna zona Zona grubih kristala a) b) c) d) Slika 3. Shematski prikaz skrućenih metalnih blokova: a) čisti metal, b) legura metala, c) skrućivanje potpomognuto agensom za nukleaciju; A) poprečni presjek, B) uzdužni presjek; d) fotografija ingota

Opis slike 3. Ø metali i legure su izgrađeni od velikog broja kristalnih zrna polikristaliničnost Ø sitna kristalna zrna nastaju uz površinu kalupa zbog velikog pothlađenja taljevine i s time i velikog broja klica Ø transkristalna zona – štapičasta kristalna zrna nastaju zbog velikog temperaturnog gradijenta od površine ka unutrašnjosti Øzona grubih zrna nastaje zbog sporog ohlađivanja taljevine – mali broj kristalnih klica Ø skrućivanje monokristala (jednog kristala) odvija se posebnim tehnikama na jednoj klici (upotreba u elktrotehnici)

Neki primjerci odljevaka legura visokog tališta

Ravnotežni dijagrami

Kada se voda dovoljno ohladi i zaledi ona mijenja stanje iz tekućeg u kruto -led. Taj se proces naziva promjena faza Ø Ø Vrlo je važno proučavanje mogućih načina na koje različiti materijali mogu postojati sami ili u dodiru s drugima u odnosu na temperaturu, tlak i vrijeme Ø Razlog je tih proučavanja spoznati kakva će biti stabilnost materijala u svim vrstama okolina jer o tome vrlo mnogo ovise mehanička svojstva tih materijala Ø Očiti primjer toga je da konstrukcijske materijale ne možemo koristiti na temperaturi koja je blizu njihova tališta Ø Manje očite promjene mogu se događati unutar samog materijala koje mogu biti vrlo važne za čvrstoću materijala Ø Te promjene faza mogu se prikazati pomoću tzv. faznih dijagrama koji nam omogučavaju predviđanje onog što će se dogoditi ako promjenimo temperaturu ili sastav ( overall composition) materijala

DEFINICIJE SUSTAV – sadrži samo materijale koje ispitujemo (zatvoren je jer se radi samo o određenim materijalima (npr. Cu i Zn) i njihovim kombinacijama (legura Cu – Zn). Jednofazni sustav je homogen, a dvo- i višefazni sustav je heterogen Ø Obrađivati ćemo samo sustave koji su u ravnoteži. Neravnotežni fazni odnosi mogu bitno različiti od ravnotežnih za isti sustav FAZA – dio sustava s homogenim fizičkim i kemijskim svojstvima mehanički odvojiv. Faza može sadržavati jednu ili više komponenti. Faza mora biti: 1) homogena u odnosu na kristalnu strukturu sređenost atoma, 2) Mora biti fizički odvojeno područje od drugoga faznom granicom, 2) mora biti mikroskopski homogena, tj. mora imati posebnu strukturu, 3) svojstva faze moraju se mijenjati kontinuirano s promjenom temperature, tlaka i sastava (mnoge mješavine zadržavaju istu strukturu s različitim omjerima komponenti; u tom slučaju one su još u istoj fazi). KOMPONENTA – prepoznatljive tvari iz kojih je sastavljen sustav – koje su na početku pomiješane (npr. Fe i C u čeliku; H 2 O i Na. Cl u slanoj vodi). Broj komponenti sustava je najmanji broj nezavisnih tvari iz kojih može biti sastavljen 13 sustav sa svim svojim fazama. Razlikujemo jedno-, dvo-, tro- komponentne sustave

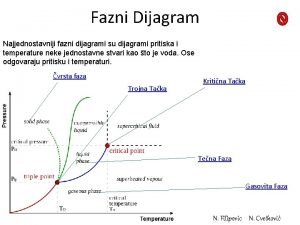
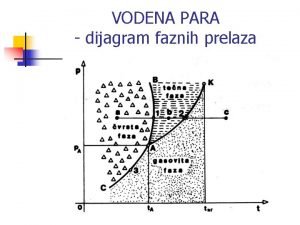
Jednokomponentni sustav Trojna točka – sve su tri faze u ravnoteži Logaritam tlaka H 2 O, atm 1. Komponenta: H 2 O 2. Faze: para, tekućina i krutina (led) - različita agregatna stanja H 2 O Tekućina Krutina (led) Pin (para) Teamperatura H 2 O, 0 C Slika 1. Fazni dijagram za vodu, H 2 O

Temperatura Plin Tekućina d Fe (BCC) g Fe (FCC) Krutina Fe (BCC) Logaritam tlaka Slika 2. a) Ravnotežni dijagram za željezo, b) Temperature promjene faza tekuće kruto, Fe (BCC) i kruto ( Fe (BCC) )

Opis određivanja krivulje ohlađivanja 1) Nakon određivanja sastava legure metal A i metal B rastalimo (dovođenjem topline uništavamo njihove kristalne rešetke) 2) Tijekom ohlađivanja, za određene vremenske termine očitavamo temperaturu na termometru i zapisujemo ( , 0 C i t, h) 3) Iz tih podataka konstruiramo krivulju ohlađivanja za svaki metal i leguru posebno

KRIVULJE OHLAĐIVANJA KRIVULJA OHLAĐIVANJA ZA ČISTI METAL Temperatura Eksperimentalni podaci Ohlađivanje taljevine (Termometar) Taljevina metala A Temperatura, Taljevina (T) K , 0 C t, h Taljevina(T) + krutina L L+ S S Lonac za taljenje metala Krutina Vrijeme (Sat) t Vrijeme, t a) b) Slika 3: a) Krivulja ohlađivanja za čisti metal, b) Dobivanje podataka za krivulju ohlađivanja

Krivulja ohlađivanja za čisti metal (opis Slike 3) Ø- vrijeme apscisa , t (h), ordinata - temperatura (theta), 0 C Tijekom ohlađivanja taljevine, T čistog metala temperatura pada do vrijednosti k - temperatura kristalizacije (koja je također i temperatura tališta metala), tj. do točke L, koja pokazuje početak skrućivanja (kristalizacije) metala. Na temperaturi k istovremeno postoje dvije faze i taljevina i skrućeni metal sve do točke S, koja označava završetak kristalizacije metala. Iako se metal i nadalje ohlađuje, krivulja ne pokazuje pad temperature između točki L i S (dio krivulje paralelan s apscisom) – zašto? Krivulja ne pokazuje pad temperature iako se i nadalje metal ohlađuje, jer se oslobađa latentna toplina kristalizacije koja nadoknađuje hlađenjem odvedenu toplinu. Ødalnjim ohlađivanjem metala, nakon točke S temperatura kristaliziranog metala ponovno pada sve do sobne temperature Promjena faza iz tekućeg čistog metala (taljevina) u kruti, kristalizirani metal je izotermalna promjena faza na temperaturi k u vremenu t.

Krivulja ohlađivanja za čisto željezo T Temperatura, , 0 C 1538 1394 T+ L S + Fe (BCC) 910 Fe (FCC) + Fe (BCC) Vrijeme, t Slika 4. Shematski prikaz krivulje ohlađivanja za čisto Fe. Samo je jedna temperatura prijelaza iz taljevine u krutinu T + , a ostale temperature su temperature promjene u krutome (alotropske modifikacije Fe). Te su promjene također izotermalne.

KRIVULJA OHLAĐIVANJA ZA LEGURU Eksperimentalni podaci Temperatura Ohlađivanje taljevine (Termometar) Taljevina metala A i B Temperatura, Taljevina (T) metala A i B L Taljevina(T) + krutina, Lonac za taljenje metala , 0 C t, h L+ S S Krutina legure, Vrijeme (Sat) t Vrijeme, t a) b) Slika 5: a) Krivulja ohlađivanja za leguru, b) Dobivanje podataka za krivulju ohlađivanja

Opis krivulje ohlađivanja za leguru (Slika 5) Øvrijeme apscisa , t (h), ordinata - temperatura (theta), 0 C Ø točka L – početak kristalitzacije legure Øtočka S – završetak kristalizacije legure Krivulja ohlađivanja za legure pokazuje temperaturni pad u vremenu t kada istovremeno postoje dvije faze: taljevina legure i kristali legure (između točki L i S). Nakon točke S legura je kristalizirana i temperatura brže pada sve do sobne temperature.

RAVNOTEŽNI DVOKOMPONENTNI DIJAGRAMI Ø Ravnoteža: minimum energije stanja za dane T (temperaturu), P (tlak), i kemijski sastav legure. Postiže se nakon dovoljno vremena koje može biti jako dugo. Stanje koje nije na minimumu energije može dugotrajno izgledati stabilno. To stanje se naziva metastablino statanje. Ø Faza će u ravnoteži ostati konstantana u odnosu na vrijeme Ø Ravnotežni dvokomponentni dijagrami daju odnos kemijskog sastava legure kao funkciju temperature i količinu faza u dijagramu. ØTi dijagrami ne daju dinamiku kada će se jedna faza pretvoriti u drugu. ØPonekad se dijagrami daju uz tlak kao varijablu. Ø U faznim dijagramima koje ćemo opisivati pretpostavljamo da je tlak konstantan i jednak atmosferskom

KONSTRUKCIJA RAVNOTEŽNOG DVOKOMPONENTNOG DIJAGRAMA Ø Mješavinu od dva metala nazivamo binarna ili dvokomponentna legura, a sustav dvokomponentni sustav Ø Ravnotežni dvokomponentni fazni dijagrami konstruiraju se iz krivulja ohlađivanja koje dobivamo posebno za svaki čisti metal i svaku njihovu leguru (njihovu kombinaciju sastava) Ø Nacrtamo dijagram s krivuljama ohlađivanja i do tog dijagrama nacrtamo “okvir” za ravnotežni dvokomponentni dijagram: apscisa: maseni postotni sastav legura, ordinata : temperatura Ø Iz dijagrama krivulja ohlađivanja iz točaka L i S (za svaku leguru i čisti metal) povučemo paralelu s apscisom do vertikale na dvokomponentnom ravnotežnom dijagramu koja predatavlja ili čisti metal ili leguru. Ø Presjecišta na vertikali (koja predstavlja leguru) označavaju: presjecišta iz točke L – likvidus liniju, a iz točke S - solidus liniju ravnotežnog dijagrama. Ø Nakon ucrtavanja svih presjecišta iz točaka L – njhovim spajanjem dobijemo LIKVIDUS LINIJU Ø Nakon ucrtavanja svih presjecišta iz točkaka S – njhovim spajanjem dobijemo SOLIDUS LINIJU

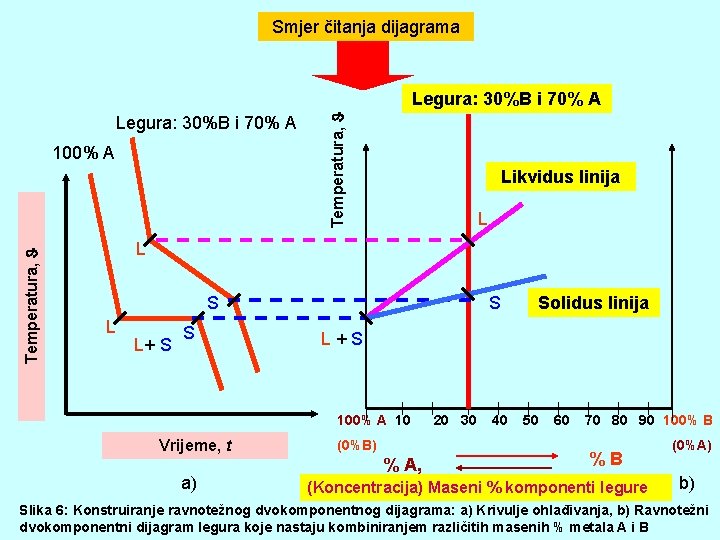
Smjer čitanja dijagrama Legura: 30%B i 70% A Temperatura, 100% A Temperatura, Legura: 30%B i 70% A Likvidus linija L L S L L+ S S S L+S 100% A 10 Vrijeme, t a) Solidus linija (0%B) % A, 20 30 40 50 60 70 80 90 100% B %B (Koncentracija) Maseni % komponenti legure (0%A) b) Slika 6: Konstruiranje ravnotežnog dvokomponentnog dijagrama: a) Krivulje ohlađivanja, b) Ravnotežni dvokomponentni dijagram legura koje nastaju kombiniranjem različitih masenih % metala A i B

Linije binarnog, dvokomponentnog ravnotežnog dijagrama Likvidus linija Solidus linija Ø crta koja pokazuje temperaturu na kojoj ohlađivanjem počinje skrućivanje legura uvjetima ili taljenje zagrijavanjem legura pod ravnotežnim Ø Crta binarnog dijagrama koja pokazuje temperaturu na kojoj sustav legura ohlađivanjem postaje potpuno skrućen ili na kojoj zagrijavanjem počinje taljenje legure pod ravnotežnim uvjetima Ø Iznad likvidus linije su sve legure rastaljene (taljevina) Ø Ispod solidus linije su sve legure u krutom stanju Solvus linija Ø Crte binarnog dijagrama koje pokazuju granicu topivosti pod ravnotežnim uvjetima Ø Granica maksimalne topivosti legirajuće komponente u osnovnom metalu na određenoj temperaturi

DVOKOMPONENTNI IZOMORFNI RAVNOTEŽNI DIJAGRAM Ø Izomorfni – potpuna topivost metala A i metala B u krutome i tekućem (rastaljenom) stanju Likvidus linija Solidus linija Shema nastajanja legure: Taljevina, T Temperatura, Legura T+ b Taljenje Metal A Krutina c 20 30 40 Maseni % A 50 Ohlađivanje + (kristali mješanci) 100% A 10 Zagrijavanje a 60 Metal B 70% Kristalizacija Taljevina 30% Zajednička Kristal mješanac 70 80 90 100% B rešetka legure A - B Atom metala A Maseni % B Atom metala B Koncentracija komponenti A i B Slika 7: Ravnotežni dvokomponentni dijagram (izomorfni) potpune topivosti u krutome

Tumačenje dijagrama potpune topivosti u krutome za leguru koja sadrži 70% A i 30% B (Slika 7) Točka a ØNa temperaturi a legura je rastaljena Ø faza je samo jedna – taljevina, T ØKoličinski udjel T = 100% Ø Koncentracija legure: 70% metala A i 30% metala B Točka b Ø Na temperaturi b egzistiraju dvije faze: T + Ø Količinski udio T = ? ; Količinski udio = ? Ø Koncentracija B u T = ? % B; Koncentracija B u = ? Točka c ØLegura je skrućena – postoji samo jedna faza: (kristali mješanci) Ø Količinski udio = 100% Ø Koncentracija B u = 30%B Vidimo da nam je za jednofazno područje sve poznato (faza, koncentracija B i količinski udio. Za određivanje koncentracije B i količinskog udjela faza u dvofaznom području služimo se tzv. pravilom poluge

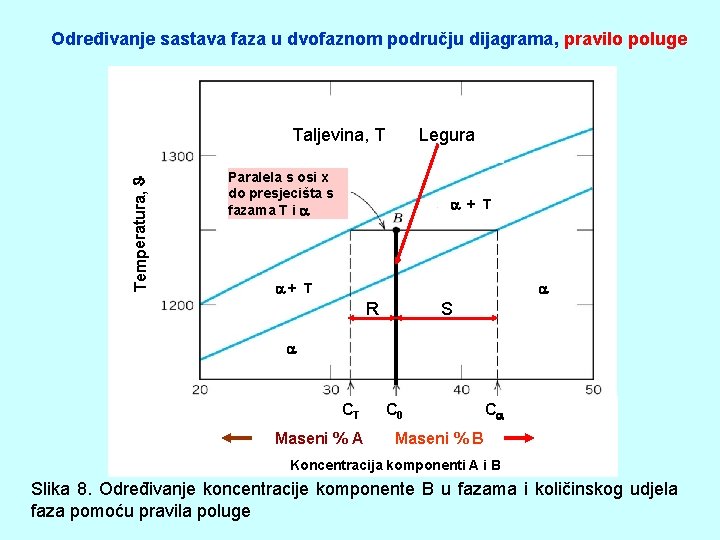
Određivanje sastava faza u dvofaznom području dijagrama, pravilo poluge Temperatura, Taljevina, T Legura Paralela s osi x do presjecišta s fazama T i + T R S CT Maseni % A C 0 C Maseni % B Koncentracija komponenti A i B Slika 8. Određivanje koncentracije komponente B u fazama i količinskog udjela faza pomoću pravila poluge

Određivanje koncentracije komponente B u fazama T i : a) odredi leguru ( koncentracije komponenti) u dijagramu i na njoj temperaturu u dvofaznom području a) na određenoj temperaturi, u dvofaznom području, povuci izotermalu (paralelu s osi x) do presjecišta s granicama prisutnih faza b) Iz tih presjecišta spusti okomicu na os x i očitaj koncentraciju komponente B (%B). Do 100% je koncentracija komponente A. Ø CT – koncentracija komponente B u taljevini, T Ø C 0 – koncentracija komponente B u cijeloj leguri (zadana, početna koncentracija) Ø C - koncentracija komponente B u

PRAVILO POLUGE Ø Odredi udaljenost točke B (na leguri) od presjecišta s granicama faza: R = C 0 – C T S = C - C 0 Količinski maseni udjeli faza su: (MT) Taljevina (T) M S C - C 0 = ————— C - CT R +S R C 0 - CT = ————— R +S C - CT Zapamti: udaljenosti od točke na leguri do presjecišta s fazama su obrnuto proporcionalne. U brojnik ide ona udaljenost koja ne graniči s fazom čiji količinski udio određujemo.

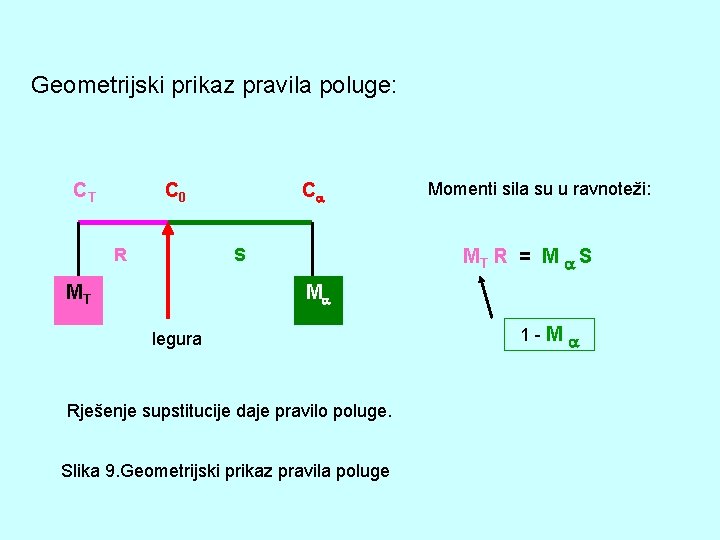
Izvod za pravilo poluge Pošto imamo samo dvije faze, tada je zbroj njihovih masa: MT + M = 1 (1) Prema zakonu o očuvanju masa: Količina komponente B u - fazi + količina B u taljevini = ukupna količina komponente B ili MT C T + M C = C 0 Iz prvog uvjeta imamo: M (2) = 1 - MT Supstitucijom (3) u (2): (1 - MT ) C + MT C T = C 0 Rješenja za MT (taljevinu) i M (kristale mješance) daju : C - C 0 MT = ———— C - CT C 0 - CT M = ———— C - CT (3) (4)

Geometrijski prikaz pravila poluge: CT C 0 R C S MT Momenti sila su u ravnoteži: MT R = M S M legura Rješenje supstitucije daje pravilo poluge. Slika 9. Geometrijski prikaz pravila poluge 1 -M
 Fazni dijagram
Fazni dijagram Legure bakra
Legure bakra Ciscenje aluminijuma
Ciscenje aluminijuma Io sono il signore dio tuo non avrai altro dio
Io sono il signore dio tuo non avrai altro dio P v dijagram
P v dijagram Snaga u trofaznom sustavu
Snaga u trofaznom sustavu Ternarna veza
Ternarna veza Fatima kadri
Fatima kadri Vennovi dijagrami
Vennovi dijagrami Er dijagram
Er dijagram Dijagrami interakcije
Dijagrami interakcije Grafikoni i dijagrami
Grafikoni i dijagrami Učenje matematike kroz igru
Učenje matematike kroz igru Er model baze podataka
Er model baze podataka Mehanika
Mehanika Otto hofmann
Otto hofmann E-r dijagram
E-r dijagram Prosta greda mehanika
Prosta greda mehanika Reciklaza slike
Reciklaza slike Mašinstvo i obrada metala
Mašinstvo i obrada metala Kiseline hemija
Kiseline hemija Naponski niz
Naponski niz Kalijum superoksid i ugljen dioksid
Kalijum superoksid i ugljen dioksid Podela metala
Podela metala Galvanski spreg
Galvanski spreg Oksidacija metala
Oksidacija metala Cementacija metala
Cementacija metala Svojstva metala
Svojstva metala Zemnoalkalni metali
Zemnoalkalni metali Kodel salta ziemos diena zvirbliai yra papure
Kodel salta ziemos diena zvirbliai yra papure Naponski niz elemenata
Naponski niz elemenata Kodel medis atrodo siltesnis uz metala
Kodel medis atrodo siltesnis uz metala Nitriranje metala
Nitriranje metala