Farmacogenmica de las dianas farmacolgicas y sus implicaciones

















- Slides: 22

Farmacogenómica de las dianas farmacológicas y sus implicaciones clínicas Abril 2006

Indice Introducción Metabolismo/dianas Estrategias descubrimiento Validación dianas La genómica en el desarrollo y utilización clínica de medicamentos Imatinib Cetuximab

Introducción Dianas terapéuticas: moléculas localizadas en cualquier parte de la célula, capaces de reconocer un fármaco y producir una respuesta celular que modifique el curso de una enfermedad. Evaluación de dianas terapéuticas: identificación, caracterización y validación de dianas. La secuenciación del genoma humano: gran nº de potenciales dianas terapéuticas, sin embargo, la mayoría de estas dianas no han sido completamente caracterizadas ni se ha establecido su asociación con una enfermedad concreta. Se ha estimado que el número de dianas potenciales terapéuticas se encuentra entorno a 600 y 1. 500, fármacos en el mercado actúan sobre alrededor de 500 dianas diferentes.

Metabolismo / Dianas n n n Experiencia Tipo de polimorfismo u Inactivador / Reguladores Nº proteínas implicadas: efectos variabilidad u Estrategia estudio u Fenotipo Genotipo

Estrategias descubrimiento I n Gen candidato Mono o poligénica u Esquizofrenia / Clozapina: 10 genes 6/19 polimorfismos asociación máxima VPP: 0, 76 VPN: 0, 82 Sens: 96% Esp: 38% u n Escaneado o barrido del genoma No relación con mecanismo: fármacos nuevos o con mec. De acción amplio u Limitación tecnológica. Coste u

Estrategias descubrimiento II n Diana directa Receptores beta: betabloqueantes u -13, 3% vs – 4, 5% (p<0, 002) u n Proteína de transducción/distales u n Receptores B 2 bradikinina: IECA Proteínas patogenia u Apolipoproteína E: estatinas Placebo >tasa eventos CV o muerte Tratamiento >riesgo = > beneficio <riesgo = < beneficio o nada

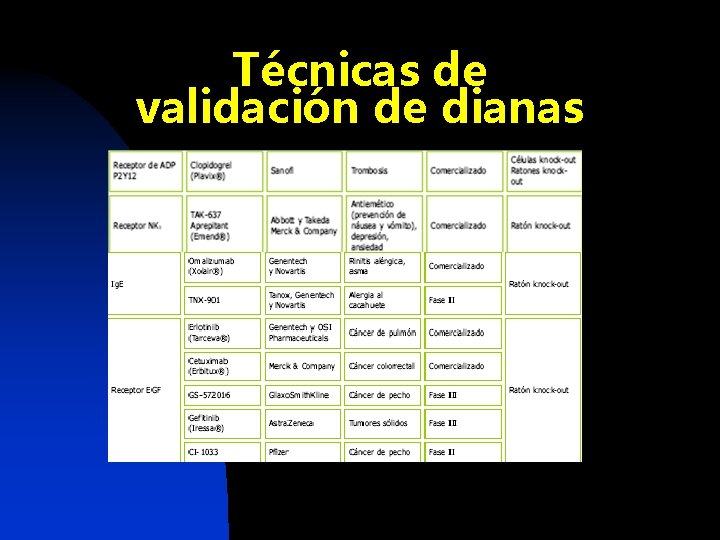
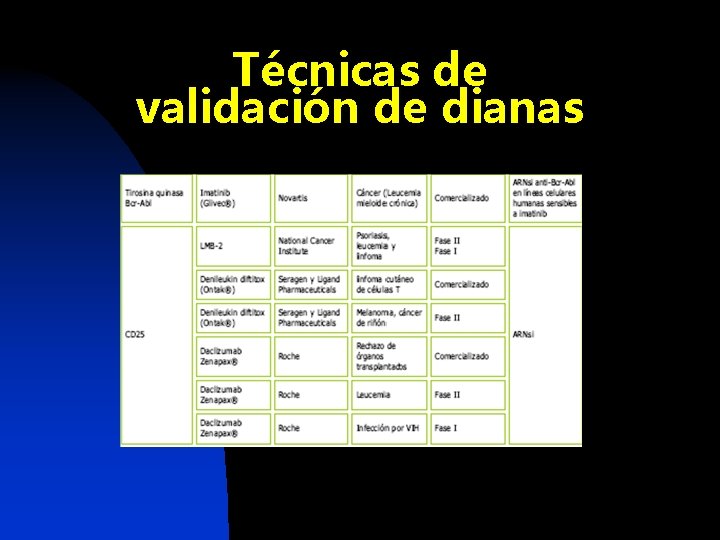
Técnicas de validación de dianas n Oligonucleótidos antisentido n Ratones Knock-out

Técnicas de validación de dianas

Técnicas de validación de dianas

Técnicas de validación de dianas

Aplicaciones de la FG Investigación y desarrollo de medicamentos Ø Selección de posibles candidatos Ø Mejorar criterios de inclusión / exclusión Ø Mejorar la eficiencia de los ensayos clínicos Ø Evergreening Utilización clínica Ø Identificar grupos de riesgo y/o de eficacia Ø Terapéutica más efectiva e individualizada

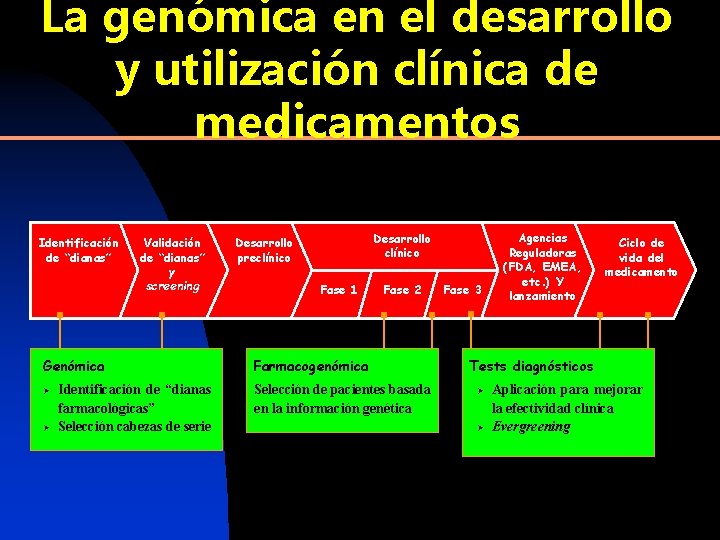
La genómica en el desarrollo y utilización clínica de medicamentos Identificación de “dianas” Validación de “dianas” y screening Genómica Ø Ø Identificación de “dianas farmacológicas” Selección cabezas de serie Desarrollo clínico Desarrollo preclínico Fase 1 Fase 2 Farmacogenómica Selección de pacientes basada en la información genética Fase 3 Agencias Reguladoras (FDA, EMEA, etc. ) Y lanzamiento Ciclo de vida del medicamento Tests diagnósticos Ø Ø Aplicación para mejorar la efectividad clínica Evergreening

La genómica en el desarrollo y utilización clínica de medicamentos Fase I/II: - poca aplicación (mejora eficiencia = discriminación) - evaluación inicial seguridad/eficacia Fase III: - aplicación mayoritaria - recogida sistemática de muestras - valor estudios retrospectivos? ? ? “Post-hoc” Selección de pacientes basada Fase IV: - alta utilidad potencial RA en la información genética Ø Aplicación para mejorar la efectividad clínica - Abacavir: cohorte 200 pacientes. 18 Hipersens. 14 (78%) polimorfismo HLA 4 (22%) no polimorfismo HLA

La genómica en el desarrollo y utilización clínica de medicamentos Importancia de los test genéticos – Seguridad: �� TPMT (6 -MP, azathioprina) �� UGT 1 A 1 (irinotecan) �� CYP 2 C 9/VKORC 1 (warfarina) – Eficacia: �� EGFR status (Erbitux, Tarceva) Selección de pacientes basada Ø en la información genética �� Her 2/neu status (Herceptin) �� Philadelphia chromosome ~ Bcr-abl (Gleevec) Aplicación para mejorar la efectividad clínica

“Evergreening”: extensión de la patente “If the drug company is able to include the use of the test on the label for therapy then it has achieved a powerful tool in its ability to extend the patent life of the drug. As long as the test is kept proprietary it will be impossible for a generic manufacturar to launch a drug into the market”

La genómica en el desarrollo y utilización clínica de medicamentos Selección de pacientes basada en la información genética Ø Aplicación para mejorar la efectividad clínica

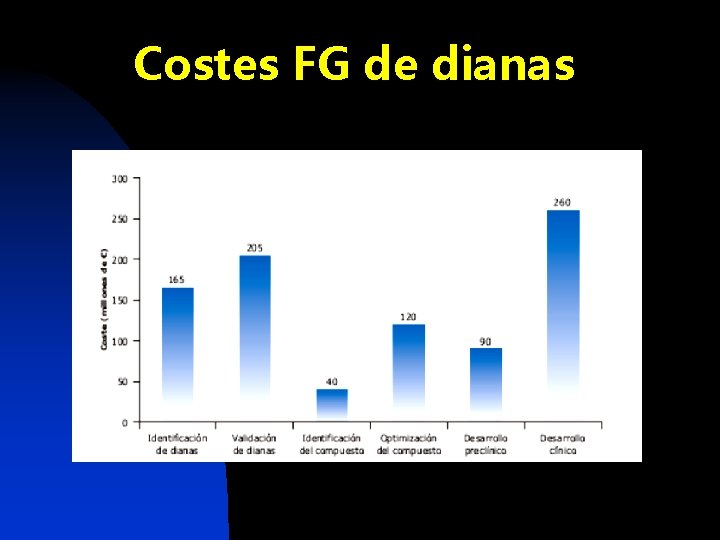
Costes FG de dianas

Imatinib n n LMC: translocación Cr 9/22 1ª evidencia mutación específica asociada a cáncer: Ph+ = bcr-ABL n Tirosinkinasa oncogénica n Imatinib inhibe TK Inhibe proliferación celular u Induce apoptosis u

Imatinib n n Ensayo IRIS: ECA fase III. 19 meses 1106 pacientes LMC Ph+ Tto 1ª línea Imatinib vs IFN alfa + citarabina Respuesta citogenética: 85, 2 vs 22, 1% u Respuesta hematológica: 95, 1 vs 55, 5 % u % Pacientes LP 18 m: 92, 1 vs 73, 5% u Efectos adversos: mejor tolerancia u Supervivencia estimada: n. s. u 30. 000 -60. 000 eu/año/paciente. Indefinido u

Cetuximab n n El receptor del factor de crecimiento epidérmico (EGFR) pertenece a la familia de receptores de superficie celular HER (Erb. B) con actividad de tipo tirosina cinasa, disregulados en muchos tipos de tumores. La vía de señalización del EGFR regula la diferenciación celular, proliferación, migración, angiogénesis y apoptosis, todas las cuales se encuentran alteradas en las células neoplásicas. La expresión de EGFR o la suprarregulación del gen EGFR se produce en un 60% a 80% de los casos de cáncer colorrectal, y puede detectarse de forma sencilla mediante inmunohistoquímica Asociado con un pronóstico desfavorable en estos pacientes.

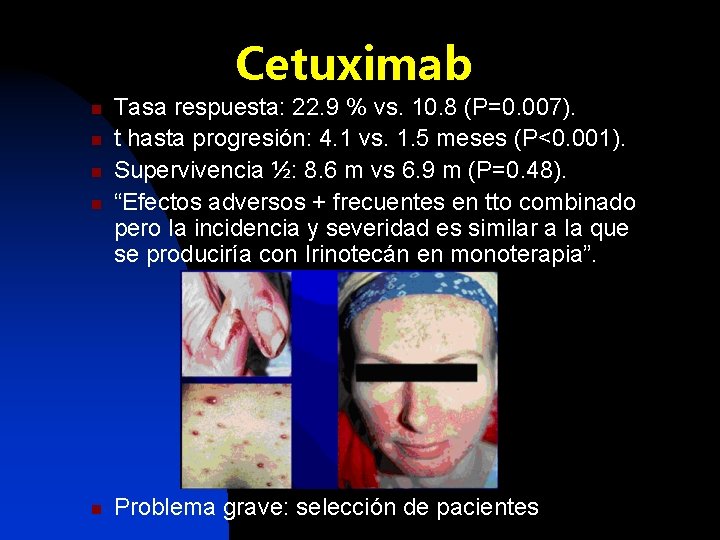
Cetuximab n n n Tasa respuesta: 22. 9 % vs. 10. 8 (P=0. 007). t hasta progresión: 4. 1 vs. 1. 5 meses (P<0. 001). Supervivencia ½: 8. 6 m vs 6. 9 m (P=0. 48). “Efectos adversos + frecuentes en tto combinado pero la incidencia y severidad es similar a la que se produciría con Irinotecán en monoterapia”. Problema grave: selección de pacientes

Cetuximab n El desarrollo clínico realizado hasta el momento muestra una muy discreta actividad de los fármacos anti-EGFR y, en ocasiones, resultados desalentadores. Nos encontramos, pues, ante una vía de acción antitumoral desarrollada y activa in vitro, así como en modelos de xenotrasplante tumoral, que sin embargo, no ha alcanzado su manejo óptimo en la clínica.
 Silogismo disyuntivo ejemplos
Silogismo disyuntivo ejemplos Implicaciones significado
Implicaciones significado Mai sus mai sus m-as ridica
Mai sus mai sus m-as ridica El misterioso balsamo curo sus heridas y le infundio animo
El misterioso balsamo curo sus heridas y le infundio animo Sobre la mesa de mármol había un hermoso joyero de nácar
Sobre la mesa de mármol había un hermoso joyero de nácar Proposición adjetiva ejemplos
Proposición adjetiva ejemplos La verdad de las personas no esta en sus palabras
La verdad de las personas no esta en sus palabras Dibujos las fuerzas y sus efectos
Dibujos las fuerzas y sus efectos Secante tangente
Secante tangente Las proteinas y sus funciones
Las proteinas y sus funciones Dibujo aparato respiratorio
Dibujo aparato respiratorio Dibujos de la célula vegetal
Dibujos de la célula vegetal Como se separa en silabas la palabra examen
Como se separa en silabas la palabra examen Cuadro comparativo nic y niif para pymes
Cuadro comparativo nic y niif para pymes Gemacion
Gemacion Línea del tiempo de las generaciones de las computadoras
Línea del tiempo de las generaciones de las computadoras Dicen que las palabras se las lleva el viento
Dicen que las palabras se las lleva el viento Misiones se hace con las manos de los que dan
Misiones se hace con las manos de los que dan Introduccion de las generaciones de las computadoras
Introduccion de las generaciones de las computadoras Edad de la historia
Edad de la historia Las obligaciones mercantiles
Las obligaciones mercantiles Metales definicion
Metales definicion Asitilen
Asitilen