Faktory ovlivujc inek liv Nedouc inky liv Interakce
































































- Slides: 80

Faktory ovlivňující účinek léčiv. Nežádoucí účinky léčiv. Interakce léčiv. Výzkum a vývoj nových léčiv. Lenka Součková Farmakologický ústav 1

Faktory ovlivňující účinek léčiv I. ve vztahu k LP II. ve vztahu k pacientovi III. ve vztahu k LP i pacientovi

I. Faktory vztahující se k LP § fyz. -chem. vlastnosti léčiva § velikost molekuly, chemická konfigurace – optická izomerie § léková forma § farmaceutická dostupnost – podíl z podané dávky dostupný pro absorpci § strava § § tuky zpomalují absorpci ze střeva díky zpomalení vyprazdňování žaludku tvorba komplexů s ionty ovlivnění renální clearance změnou p. H změna FD – agonistický či antagonistický úč.

II. Faktory vztahující se k pacientovi 1. 2. 3. 4. 5. 6. věk tělesná hmotnost patologický stav genetické faktory cirkadiální rytmy pohlaví

II. Faktory vztahující se k pacientovi 1. věk § děti § korelace dle hmotnosti/povrchu těla § novorozenci – nezralost fce ledvin a jaterního metabolismu, prostup HEB § vyšší věk § polymorbidita, polypragmazie § T 1/2 eliminace § FD – změna citlivosti cílových struktur – paradoxní a hyperergní reakce dávek o 1/4 - 1/3

II. Faktory vztahující se k pacientovi 2. tělesná hmotnost § dávka obvykle na 70 kg t. hm. § lépe dávka/kg t. hm. § tělesná konstituce

II. Faktory vztahující se k pacientovi 3. patologický stav § poškození orgánů biotransformace / eliminace léčiv úprava dávkování či KI u neselektivních látek § podmínka účinku § antipyretika, digoxin, kortikoidy u A. B.

II. Faktory vztahující se k pacientovi 4. genetické faktory § farmakogenetika § genetické polymorfismy CYP 450 § rychlí x pomalí metabolizátoři § genotypizace x fenotypizace

Genetické faktory - FK § Genový polymorfizmus enzymů metabolizujících léčiva a transportérů pro léčiva: v populaci existuje několik odlišných fenotypů (pomalý, střední, rychlý event. ultrarychlý metabolizátor) s frekvencí výskytu vyšší než 1%, které jsou způsobeny mutací jednoho genu (monogenní závislost) § Genetické testy na odchylky v metabolizmu a transportu léčiv nejsou v praxi běžně prováděny, i když existují poznatky o velkém vlivu na farmakokinetiku některých léčiv a jsou dostupné rychlé (ale drahé) metody na vyšetření polymorfizmu.


II. Faktory vztahující se k pacientovi 5. cirkadiální rytmy § biologické rytmy fyziologických fcí během denní, sezónní, roční doby § chronofarmakologie, chronoterapie

Cirkadiální rytmy • Biorytmy v tělesných funkcích v závislosti na denní, sezónní nebo roční době - předmětem studia chronofarmakologie a chronoterapie. • Příklad: incidence astmatických atak je nejvyšší v časných ranních hodinách, kdy je nízký tonus sympatiku a nízká hladina endogenních glukokortikoidů • Cisplatina – nižší toxicita při velkém objemu močového měchýře – cirkadiánní rytmy • Melatonergní antidepresiva

II. Faktory vztahující se k pacientovi 6. pohlaví § silnější reakce u žen § citlivost na LP v CNS během menstruace a klimakteria § těhotenství + kojení!

Pohlavní rozdíly v absorpci § Pomalejší vyprazdňování žaludku a tranzitní čas u žen, přetrvává i po menopauze, rozdíl zvýšen substitucí estrogenů (kontracepce, HRT) § Delší čas pro absorpci § Nižší exprese střevního CYP u žen § vyšší biologická dostupnost a plazmatické hladiny některých léčiv u žen § Pg. P (MDR 1) – vyšší jaterní exprese u mužů § Aktivita Pg. P (fenotyp) shodná – Pg. P patrně není ovlivněn pohlavím

Těhotenství § § zpomalená žaludeční a střevní motilita zvýšený objem plazmy, tělesná voda zvýšena až o 8 litrů hypoalbuminémie, obsazení plazm. proteinů hormony zvýšený průtok ledvinami a vzestup GFR § ovlivnění mikrosomálních enzymů (stimulace progesteronem, kompetetivní inhibice progesteronem a estradiolem)

III. Faktory vztahující se k LP i pacientovi 1. 2. 3. 4. dávka opakované podávání LP kombinace LP pozdní účinky

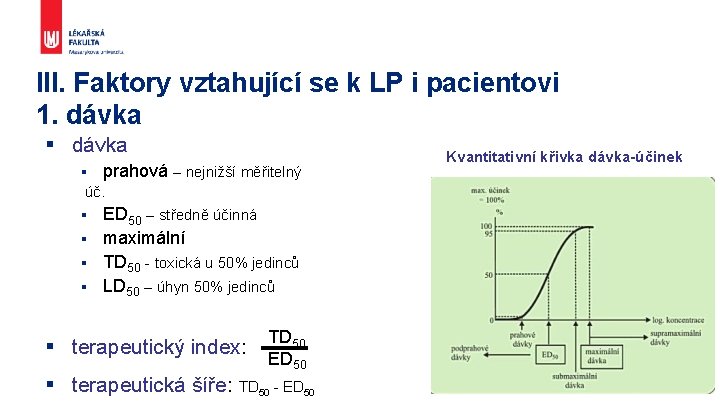
III. Faktory vztahující se k LP i pacientovi 1. dávka § prahová – nejnižší měřitelný úč. ED 50 – středně účinná § maximální § TD 50 - toxická u 50% jedinců § LD 50 – úhyn 50% jedinců § TD § terapeutický index: ED 50 50 § terapeutická šíře: TD 50 - ED 50 Kvantitativní křivka dávka-účinek

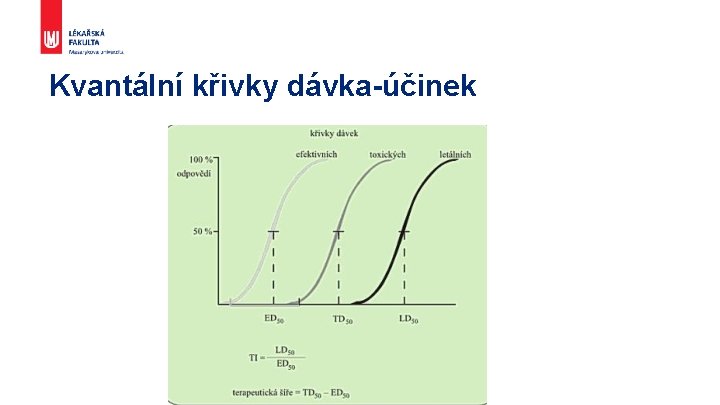
Kvantální křivky dávka-účinek

III. Faktory vztahující se k LP i pacientovi 1. dávka § dosis singula (dosis pro dosi) § DTS - dosis therapeutica singula § dosis maxima § dosis pro die

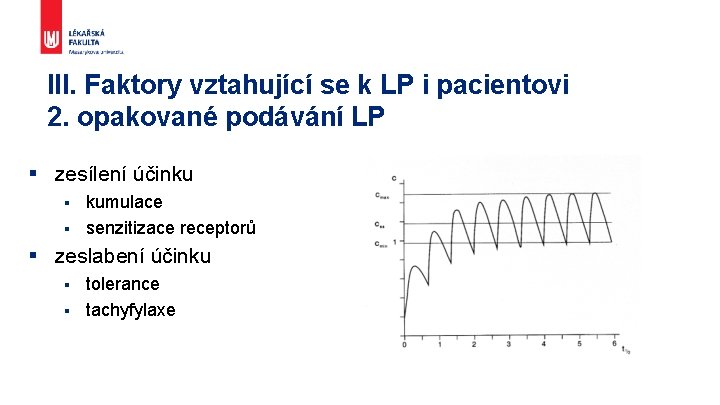
III. Faktory vztahující se k LP i pacientovi 2. opakované podávání LP § zesílení účinku kumulace § senzitizace receptorů § § zeslabení účinku tolerance § tachyfylaxe §

III. Faktory vztahující se k LP i pacientovi 3. kombinace LP Snížení účinku A n t a g o n i z m u s § farmakologický (ACH + atropin) § fyziologický (ACH + adrenalin) § chemický (heparin + protamin sulfát; kovy + dimerkaprol, EDTA) Zvýšení účinku S y n e r g i z m u s § Sumace: obě léčiva mají stejný (podobný) účinek a při kombinovaném podávání je výsledný účinek součtem účinků, které by součtem léčiva měla při podávání v monoterapii jednostranná : analgetika anodyna + narkotika oboustranná : kombinace cytostatik § Potenciace jednostranná : Ca 2+ + digoxin oboustranná : digoxin + thiazidová diuretika

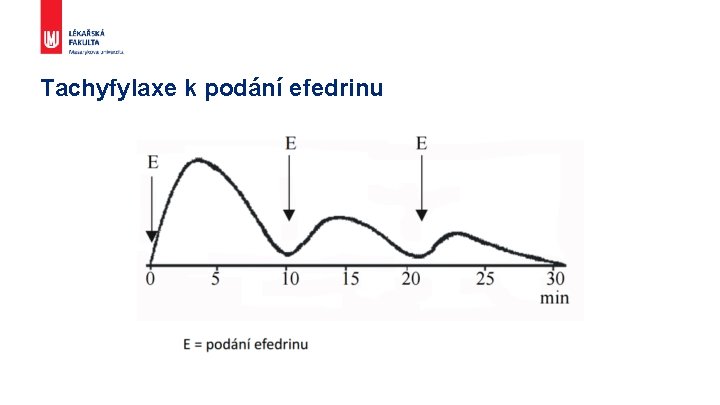
Opakované podání § Zesílení účinku – kumulace – dávka nasycovací, senzitizace § Zeslabení účinku – tolerance, tachyfylaxe § Léková závislost Definujte zápatí - název prezentace / pracoviště 22

Tachyfylaxe k podání efedrinu

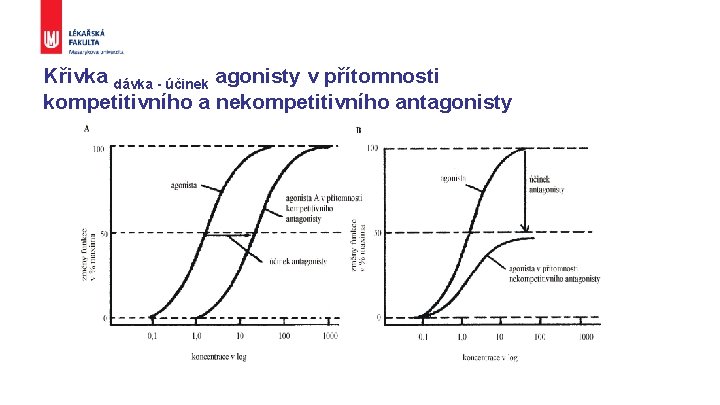
Křivka dávka - účinek agonisty v přítomnosti kompetitivního a nekompetitivního antagonisty

III. Faktory vztahující se k LP i pacientovi 4. pozdní účinky § dlouhý interval mezi expozicí a účinkem § teratogenní § mutagenní § kancerogenní

Nežádoucí účinky léčiv

Nežádoucí účinky léčiv = nepříznivá nezamýšlená odpověď na podání jakékoliv dávky LP § nadměrně silný hlavní účinek § NÚ závislý na hlavním účinku § incidence 1 – 30 % léčených pacientů § 0, 5 – 0, 9% - letální NÚ

Intenzita NÚ § mírné § nevyžadují přerušení terapie § středně závažné § změna terapie nebo dávkování § závažné § potenciální ohrožení pacienta § vysazení + léčba příznaků § letální

Legislativní rozdělení NÚ Zákon o léčivech (378/2007 Sb. ) § závažný § § neočekávaný § § USAR – unexpected serious adverse reaction podezření na závažný neočekávaný § § UADR – unexpected adverse drug reaction závažný neočekávaný § § SADR – serious adverse reaction SUSAR - suspected unexpected serious adverse reaction nežádoucí příhoda

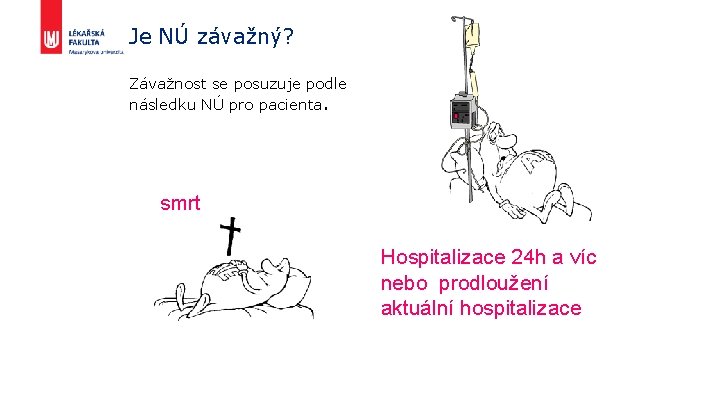
Je NÚ závažný? Závažnost se posuzuje podle následku NÚ pro pacienta. smrt Hospitalizace 24 h a víc nebo prodloužení aktuální hospitalizace

Vrozené anomálie a vady trvalé či významné poškození zdraví nebo omezení schopností Nebo pokud je NÚ život ohrožující nebo považován za medicínsky významný

Co musíme SÚKLu hlásit a jak? § Jakéholiv podezření na závažný nebo neočekávaný nežádoucí účinek LP. + SÚKL prosí hlásit i zneužití nebo nesprávné použití LP, předávkování, podezření na lékovou interakci, teratogenní efekt nebo neúčinnost přípravku. § Formulář je na webu SÚKL k dispozici v pdf i elektronický http: //www. sukl. cz/modules/undesired/report. php § Více info o NÚ: http: //www. sukl. cz/nahlasit-nezadouci-ucinek 32

Formulář pro hlášení NÚ • U pacienta v zájmu ochrany osobních dat nevyplňujeme celé jméno, ale pouze iniciály např. Dorota Plchová – vyplníme pouze „DP“

Nežádoucí účinky Typ A (Adverse) – 95% - závislé na dávce - farmaceutické, farmakokinetické Typ B (Bizzare) – 5% - na dávce nezávislé - idiosynkrazie, alergie, pyrogenní reakce Typ C (Continous) - při delším podávání Typ D (Delayed) - opožděné reakce Typ E (End of use) - po vysazení

Nežádoucí účinky – typ A § stejný mechanismus jako hlavní účinek –) předvídatelný a závislý na dávce § předávkování antidiabetiky → hypoglykémie § farmaceutická varianta § nedostatečně čisté přípravky – příměsi pyrogenů, bakterií apod. § exspirované LP § farmakokinetická varianta § choroby jater nebo ledvin § choroby srdeční ( prokrvení jater a ledvin, zhoršená absorpce z GIT prokrvení a edém střevní sliznice) § nebo mtb. při hypertyreóze nebo hypotyreóze § interakce léčiv

Nežádoucí účinky – typ B § genetické polymorfismy (idiosynkrazie) nebo alergie § pyrogenní rekce § pseudoalergické reakce klinické projevy jako u hypersenzitivit, ale imunologicky nelze nic prokázat § při příští aplikaci se reakce na stejné léčivo nemusí opakovat §

B - Alergické reakce § nežádoucí reakce organismu na opakované podání léku - senzibilizace § předchozí expozice cca 7 -14 dnů § interakce antigen-protilátka § přítomnost protilátek v plazmě

Typy alergických reakcí I. časná (anafylaktická) reakce § II. Ig. E: rce antigen-protilátka cytotoxický typ § Ig. E a Ig. M – vyvolají lýzu bb (anémie, trombocytopenie, leukopenie) III. podmíněná imunokomplexy § rce antigen-protilátka a tvorba imunokomplexů (sérová nemoc, glomerulonefritida) IV. reakce pozdní přecitlivělosti § senzibilizované T-lymf, zánět → po opakovaném podání: kožní rash, kontaktní dermatitida http: //www. angisrevue. cz/revue/archiv/cislo/detail/35/ http: //zdravi. e 15. cz/clanek/priloha-lekarske-listy/beta-laktamova-antibiotika-142697

Nežádoucí účinky – typ C § tolerance § závislost § specifické pro různé látky § kortikosteroidy – atrofie kůry nadledvin § fenacetin – zánět ledvin http: //medlibes. com/entry/cushings-syndrome

Nežádoucí účinky – typ D § teratogeneze, mutageneze, kancerogenita § hormonální zásahy v graviditě § § § snížení fertility výojová toxicita = teratogenní účinky kumulace léčiv v mléce kojící matky imunosuprese § imunosupresiva → ca jater, žlučových cest genová toxicita (vazba na DNA)

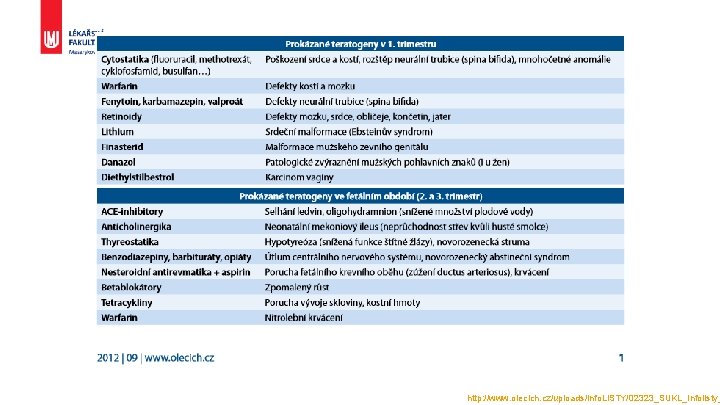
http: //www. olecich. cz/uploads/info. LISTY/02323_SUKL_Infolisty_

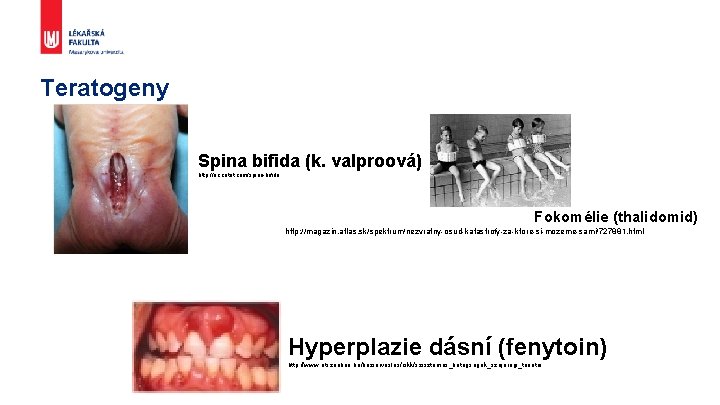
Teratogeny Spina bifida (k. valproová) http: //ec. cotot. com/spina-bifida Fokomélie (thalidomid) http: //magazin. atlas. sk/spektrum/nezvratny-osud-katastrofy-za-ktore-si-mozeme-sami/727881. html Hyperplazie dásní (fenytoin) http: //www. otszonline. hu/haziorvoslas/cikk/szisztemas_betegsegek_szajuregi_tunetei

Nežádoucí účinky – typ E § „rebound“ fenomén § po ukončení aplikace dojde k zhoršení původních obtíží § anxiolytika → úzkost § antihypertenziva → hypertenze § abstinenční syndrom u látek vyvolávajících závislost

Toxické účinky léčiv —> po podání nepřiměřeně vysoké dávky § zvýšená kvantita účinku – heparin – krvácivost § změněná kvalita účinku – fenacetin - nefropatie Toxické reakce: I. farmakologické - zmírní se po poklesu plazmatických hladin (hypnotika) II. patologické - vedou k poškození tkání I. genotoxické - poškození DNA

Toxické účinky látek Příznaky toxicity mohou vznikat jako: § časné – akutní toxicita § během opakované aplikace – subakutní toxicita § pozdní – chronická toxicita: místní x systémová akutní x chronická § místní (poleptání) § systémové § § nespecifické – toxické vůči kterékoliv buňce specifické – selektivní toxicita v urč. tkáních nebo orgánech

Toxické účinky léčiv § nejčastěji se vyskytují po látkách s nízkým terapeutickým indexem § Antihypertenziva § Srdeční glykosidy § Antiarytmika § Antikoagulancia § Cytostatika, imunosupresiva § Aminoglykosidová antibiotika

Ostatní nežádoucí účinky § CNS § ospalost, závratě, bolesti hlavy, deprese § GIT § dyspepsie, plynatost, peptidické vředy, průjem, zácpa, zvracení, anorexie § UGT § poruchy erekce, změny poševní sekrece § RT § dyspnoe, bronchokonstrikce § KVS § arytmie, hypotenze, hypertenze, palpitace

Interakce léčiv

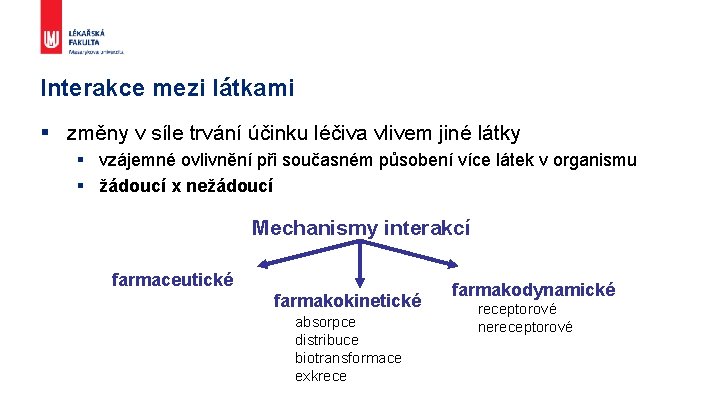
Interakce mezi látkami § změny v síle trvání účinku léčiva vlivem jiné látky § vzájemné ovlivnění při současném působení více látek v organismu § žádoucí x nežádoucí Mechanismy interakcí farmaceutické farmakokinetické absorpce distribuce biotransformace exkrece farmakodynamické receptorové nereceptorové

Interakce CYP INDUKTORY CYP 450 INHIBITORY CYP 450 § § § § dexametazon fenobarbital rifampicin fenytoin třezalka tečkovaná (Hypericum perforatum) jinan dvoulaločný (Ginkgo biloba) § § antidepresiva (fluoxetin, fluvoxamin, paroxetin) chinin, chinidin chloramfenikol, erytromycin ketokonazol, itrakonazol grapefruitová šťáva

Interakce léčiv § § aditivní - součet synergické - než součet potenciační – zesílení jedné látky druhou antagonistické § fyziologický, funkční (H a A v bronších) § kompetitivní ( -mimetika a -blokátory) § nekompetitivní

Výzkum a vývoj nových léčiv http: //portal. med. muni. cz/clanek-367 -vyzkum-novych-leciv-od-zrodu-k-registraci. html

VÝVOJ NOVÉHO LÉČIVA § výzkum i vývoj finančně náročné (800 milionů dolarů/1 lék) § z 10 000 syntetizovaných látek jen 1 na trh § vývoj cca 10 let § nutná přísné normy a vodítka pro kontrolu nových léčiv – výstrahou je thalidomidová aféra

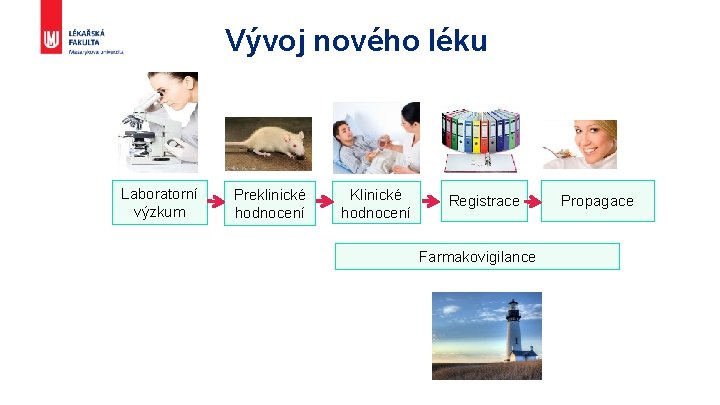
Vývoj nového léku Laboratorní výzkum Preklinické hodnocení Klinické hodnocení Registrace Farmakovigilance Propagace

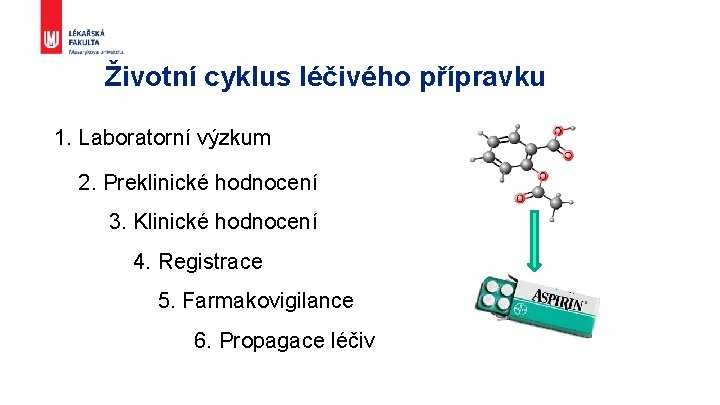
Životní cyklus léčivého přípravku 1. Laboratorní výzkum 2. Preklinické hodnocení 3. Klinické hodnocení 4. Registrace 5. Farmakovigilance 6. Propagace léčiv

1. Laboratorní výzkum § modifikace chemické struktury už známého léčiva § vyhledávání přírodních látek § § rostliny (srdeční glykosidy) § živočišné tkáně (heparin) § mikroorganizmy (penicilin) § lidské buňky § biotechnologie (inzulín) lékový design = cílená syntéza látek se strukturou navrženou počítačovým modelováním

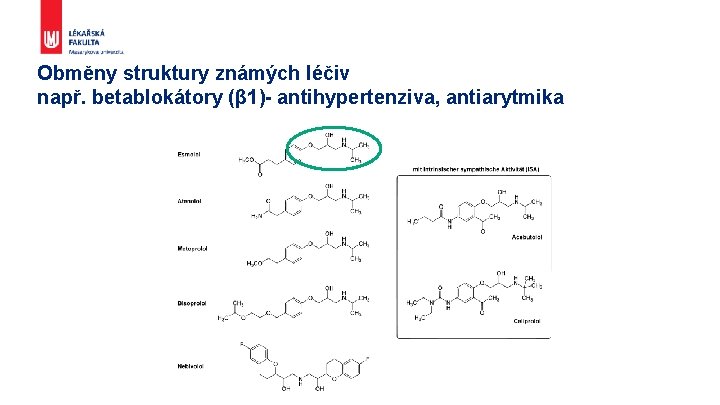
Obměny struktury známých léčiv např. betablokátory (β 1)- antihypertenziva, antiarytmika

Farmaceutický výzkum a vývoj nových léčiv § Na počátku je nutno vybrat vhodnou látku a připravit vhodnou lékovou formu. § Klíčové je odhadnout účinky dané látky a její případnou toxicitu § K tomu používáme odborné databáze, literaturu, „in silico“ testování´- testování v PC, kdy počítač je např. schopen testovat interakce různých molekul § Všechny nadějné molekuly procházejí screeningovými testy, kterými se dá zjistit např. , na který systém v organismu látka působí, jakou bude mít vazbu na různé receptory…

2. Preklinické hodnocení = testování léčiv in vitro a na zvířatech s cílem předpovědět terapeutický účinek a toxicitu potenciálního léčiva pro použití u člověka. § Je nezbytné je provést, než je léčivo poprvé podáno člověku. Nejprve musíme v preklinice vyzkoušet : § Jaké má látka farmakokinetické a farmakodynamické vlastnosti § Jak je (ne)bezpečná § Jak je účinná na onemocnění, na které ji potřebujeme § Jakou má jakost a fyzikální vlastnosti …… 59

Jaké testy se provádí v preklinice? 1. Stanovení farmakokinetiky 2. Stanovení farmakodynamiky 3. Toxikologické testy § Akutní toxicita-po jednorázovém podání § Chronická toxicita –po opakovaném podání § Toxikokinetika-osud toxinu v organismu § Bezpečnostní farmakologie – popis nežádoucích účinků (NÚ)na jednotlivé orgánové systémy, odhad možných NÚ u člověka § Specifické toxikologické testy: karcinogenita, genotoxicita, reprodukční toxicita, lokální toxicita, fototoxicita… 60

Typy a pravidla preklinických testů 1) In vitro testy – např. na buněčných a tkáňových kulturách, izolovaných orgánech. Nahrazují některé testy na zvířatech 2)Testy na zvířatech - musí se dodržovat Správná laboratorní praxe, což jsou pravidla pro správné testování na zvířatech – pro jejich správný chov, zacházení, metodiku testů, kvalifikaci pracovníků…. - Používá se pravidlo 3 R 61

Pravidlo 3 R 1. 2. 3. Reduction- redukce počtu testů a počtu pokusných zvířat. Replacement- Nahrazení zvířat testy in vitro. Vhodný výběr zvířecího modelu dle citlivosti. Omezení studií na zárodcích a mláďatech. Refinement- Odklon od testování dávek letálních, testuje se pak pouze dávka toxická. Letální dávka = dávka, která zvíře usmrtí ( např. LD 50 = dávka usmrcující 50% aplikovaných zvířat ) Toxická dávka –dávka vyvolávající již zřetelné příznaky otravy Modely laboratorních zvířat Laboratorní myš, potkan, králík, morče, křeček Prase domácí, kočka, pes, opice Fyziologické/patofyziologické modely 62

3. Klinické hodnocení = systematické testování 1 nebo několika hodnocených léčivých přípravků s cílem ověřit bezpečnost nebo účinnost léčivého přípravku. Je prováděno na subjektech hodnocení za účelem: 1. zjistit nebo ověřit klinické, farmakologické nebo jiné farmakodynamické účinky, 2. stanovit nežádoucí účinky, 3. studovat absorpci, distribuci, metabolismus nebo vylučování (Zákon o léčivech 378/2008 – novela 70/2013) 63

Na kom je prováděno? § Subjekt hodnocení - zdravý dobrovolník - pacient Kdo ho zadává a provádí? § Zadavatel (sponsor) -fyzická nebo právnická osoba, která odpovídá za zahájení, řízení, popřípadě financování klinického hodnocení § Zkoušející- lékař, který odpovídá za průběh klinického hodnocení v daném místě 64

Informovaný souhlas pacienta Já, níže podepsaný/á dobrovolně a svobodně souhlasím s účastí v klinickém hodnocení „………. . “. Povaha, cíl, rozsah a doba trvání této klinické studie mi byly řádně a srozumitelně vyšetřujícím lékařem vysvětleny. Moje účast v této studii nebude nijak ovlivňovat moji další léčbu či pobyt ve zdravotnickém zařízení. Měl/a jsem možnost zeptat se na všechny nevyjasněné otázky. Obdržel/a jsem uspokojivou odpověď a plně rozumím všem informacím, kterých se mi dostalo. S výsledky provedeného vyšetření bude zacházeno jako s citlivými údaji, na něž se vztahuje povinnost mlčenlivosti a ochrany dle příslušných právních předpisů. V případě, že jich bude použito pro publikační účely, budou zveřejněny anonymně. Jsem si vědom/a, že z projektu mohu kdykoliv odstoupit, aniž to bude mít jakýkoliv vliv na moji další léčbu. Jméno pacienta: ……………Datum: …………Podpis pacienta: ……………… Jméno lékaře zodpovědného za provádění studie: ……… Datum: ………. Podpis lékaře: ……….

Co je hodnoceno? § Hodnocený léčivý přípravek = léková forma léčivé látky nebo přípravek získaný technologickým zpracováním pouze pomocných látek (placebo), které se testují nebo používají pro srovnání v klinickém hodnocení; hodnoceným léčivým přípravkem může být i již registrovaný léčivý přípravek, pokud se používá nebo zhotovuje (včetně změn složení lékové formy nebo obalu) způsobem, který se liší od registrované podoby léčivého přípravku, nebo pokud se používá pro neregistrovanou indikaci nebo za účelem získání dalších informací o registrované variantě léčivého přípravku

Jak hodnocení probíhá (1)? § Zadavatel si vybere centrum podle toho: - jestli jsou v dané nemocnici či klinice pacienti s požadovanou diagnózou a kolik jich je - jaké má centrum vybavení - jak jsou specializovaní lékaři…. . § Pokud KH probíhá ve více centrech v ČR nebo i mimo ČR = multicentrické 67

Jak hodnocení probíhá (2)? § + Zadavatel nebo jím pověřená osoba zpracují příslušné dokumenty: § Protokol- popisuje cíl, uspořádání, metodiku, statistiku a organizaci KH § Soubor informací pro pacienty + informovaný souhlas - projev vůle k účasti v KH § CRF (case report form) – záznamové listy pacienta § Soubor informací pro zkoušejícího (IMPD)- soubor klinických a neklinických údajů o hodnoceném léčivém přípravku § Vyplní žádost o povolení KH a pošle ji na SÚKL a etickou komici a čeká, až ji KH schválí. Teprve potom může KH začnout. 68

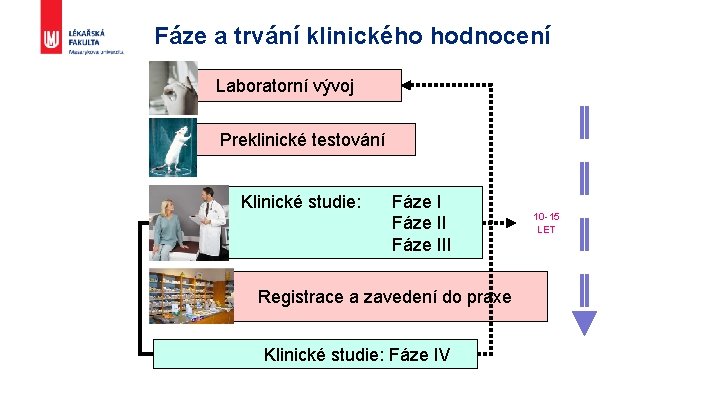
Fáze a trvání klinického hodnocení Laboratorní vývoj Preklinické testování Klinické studie: Fáze III Registrace a zavedení do praxe Klinické studie: Fáze IV 10 -15 LET

KHL 1. fáze – Zdraví dobrovolníci § účinek na tělesné funkce ČLOVĚKA + bezpečnost použití § § § určení dávky - farmakokinetika (c v plazmě, eliminace) farmakodynamika – ovlivnění vitálních fcí podání jednorázové nebo jen krátkodobé informovaný souhlas finanční odměna desítky osob

KHL 2. fáze - Pilotní studie § 1. podání pacientům v předpokládané indikaci § § § sleduje se ovlivnění nemoci, NÚ, farmakokinetika u patolog stavu a po opakovaném podání indikace x KI informovaný souhlas 100 a více pacientů bez finanční odměny

KHL 3. fáze - Rozšířená klinická studie § § sta - tisíce pacientů srovnání terapeutické účinnosti a bezpečnosti vůči standardní terapii (nebo placebu) = kontrolovaná klinická studie § randomizovaná klinická studie § často s tzv. zaslepením – single x double blind nebo open label (otevřená) multicentrická sestavení SPC § předkládáno společně s výsledky fáze I a II a dokumentací KH k registraci (SÚKL)

KHL 4. fáze - Postmarketingové (postregistrační) hodnocení § po uvedení léčiva na trh - min 5 let od reg. § § ověření účinku v široké klinické praxi údaje o výskytu NÚ, interakcích, rozdíly ve věkových skupinách. . . porovnání se standardní terapií možnost stažení z oběhu

Příklady stažení z trhu z poslední doby rofecoxib (HVLP Vioxx) - KV a CV NÚ, AIM klobutinol (HVLP Silomat) - srdeční arytmie rosiglitazon (HVLP Avandia, Avandamet) - KV rizika: ICHS

Registrace léčiv

Registrace LP § HVLP podléhají před uvedením na trh v ČR registraci: Vyhl. č. 228/2008 Sb. o registraci LP § schvalovací řízení = povolení k uvedení na trh § § § minimalizace předvídatelných rizik spojených s uvedením LP na trh Státní ústav pro kontrolu léčiv (SÚKL) v ČR Evropská léková agentura (EMA) pro EU § hodnotí doložení účinnosti, jakosti a bezpečnosti § soulad předložené dokumentace s požadavky právních předpisů a nejaktuálnějších vědeckých poznatků § výstupem je hodnotící zpráva a příslušné regulační/správní rozhodnutí - Rozhodnutí o registraci

Registrace LP § posuzují se: § § § indikace KI dávkování způsob výdeje PI pro pacienta návrh textů na obal § součástí rozhodnutí o registraci je SPC § následuje žádost o přidělení maximální ceny a o stanovení výše a podmínek úhrady z veřejného zdravotního pojištění

Typy registračních procedur v ČR § Národní § § Vzájemného uznávání § § § uznání existující registrace v 1 členském státě v ostatních státech EU stát s "národní reg. " se stane referenčním, ostatní státy EU vybrané žadatelem jsou členské Decentralizovaná § § registrace v 1 státě - pouze v případě, že LP není registrován v jiné zemi EU nebo neprobíhá registrace v jiném členském státě EU LP není registrován v žádném členském státě 1 ze států je zvolen jako referenční, ostatní vybrané státy EU jsou členské zainteresované státy žádost posoudí a rozhodnou o kladném nebo záporném stanovisku ve své zemi Centralizovaná § hodnocení EMA - registrace platí ve všech členských státech EU § povinné pro biotechnologicky připravené přípravky, nové léčivé látky pro indikace AIDS, onkologická onemocnění, neurodegenerativní onemocnění, diabetes a pro přípravky určené k léčbě velmi vzácných onemocnění

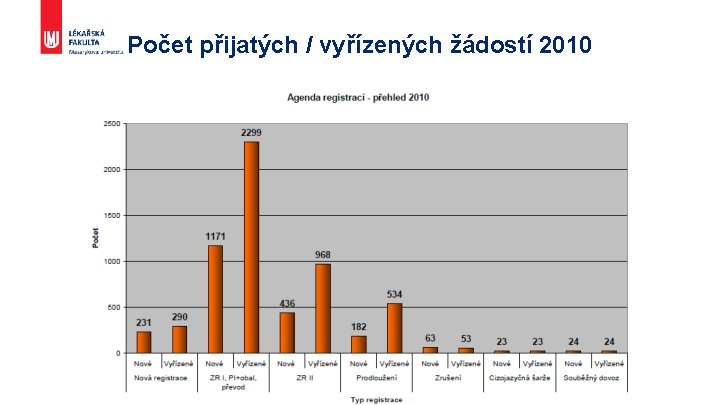
Počet přijatých / vyřízených žádostí 2010

Děkuji za pozornost! 80
 Recesivní epistáze
Recesivní epistáze Slabé vazebné interakce
Slabé vazebné interakce Danimarka rize inek sorusu
Danimarka rize inek sorusu Okey masasına inek düştü
Okey masasına inek düştü Inek vücut kondisyon skoru
Inek vücut kondisyon skoru Polygynandrie
Polygynandrie Faktory ovplyvňujúce rýchlosť chemických reakcií
Faktory ovplyvňujúce rýchlosť chemických reakcií Sanguitest
Sanguitest Faktory ovplyvňujúce životné prostredie
Faktory ovplyvňujúce životné prostredie Společenské lokalizační faktory
Společenské lokalizační faktory Abiotické faktory pracovní list řešení
Abiotické faktory pracovní list řešení Mzdotvorné faktory
Mzdotvorné faktory Protektivní faktory etopedie
Protektivní faktory etopedie Abiotické faktory pracovní list řešení
Abiotické faktory pracovní list řešení Inky tadpoles
Inky tadpoles Inky tadpoles
Inky tadpoles Uv inky
Uv inky Farar inky
Farar inky Liv garrett
Liv garrett Liv tyler face shape
Liv tyler face shape Liv mjelde
Liv mjelde Skolerejse til stockholm
Skolerejse til stockholm Liv otto hassert
Liv otto hassert Jeg-støttende principper
Jeg-støttende principper Liv-kaappi
Liv-kaappi Jeg støttende sygepleje liv strand
Jeg støttende sygepleje liv strand Liv tan
Liv tan