Examentraining Havo 5 Programma Algemene kennis Zuren en
















- Slides: 23

Examentraining Havo 5

Programma • • Algemene kennis Zuren en basen Redox Bio-organisch

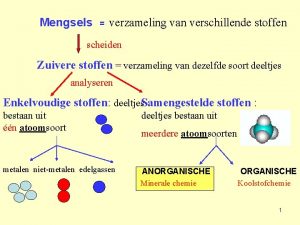
Mengsels • Een vloeistof en een vaste stof: – Oplossing: helder mengsel, vaste stof lost op in de vloeistof – Suspensie: troebel mengsel, vaste stof lost niet op in de vloeistof • Twee vloeistoffen samen: – Oplossing: helder mengsel, ene vloeistof lost op in de andere – Emulsie: troebel mengsel, vloeistoffen lossen niet in elkaar op.

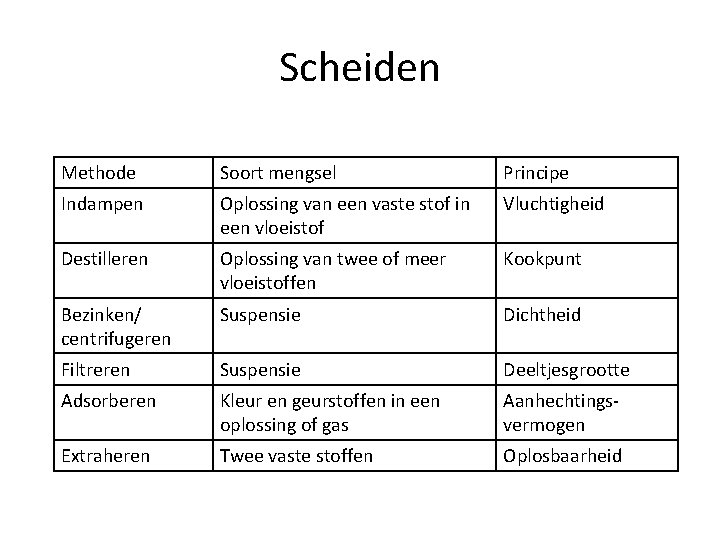
Scheiden Methode Soort mengsel Principe Indampen Oplossing van een vaste stof in een vloeistof Vluchtigheid Destilleren Oplossing van twee of meer vloeistoffen Kookpunt Bezinken/ centrifugeren Suspensie Dichtheid Filtreren Suspensie Deeltjesgrootte Adsorberen Kleur en geurstoffen in een oplossing of gas Aanhechtingsvermogen Extraheren Twee vaste stoffen Oplosbaarheid

Bouw van een atoom • Atoomnummer = aantal protonen • Massagetal = aantal protonen + neutronen = het aantal deeltjes in de kern • Aantal elektronen = protonen + of – de lading. • Isotoop = hetzelfde atoomnummer, ander massagetal

Periodiek Systeem • Groep 1: Alkalimetalen – Zeer onedel, reageren dus met alles – Lading 1+ • Groep 2: Aardalkalimetalen – Behoorlijk onedel, reageren met bijna alles – Lading 2+ • Groep 17: Halogenen – Komen nooit alleen voor (Cl 2 Br 2 I 2 F 2) – Lading 1 - • Groep 18: Edelgassen – Zeer edel, reageren nergens mee – Geen ionlading, want komen niet als ion voor

Bindingen • Metaal – Metaalbinding: Binding waarbij de positieve metaalionen bij elkaar gehouden worden door de vrije, negatieve, elektronen • Niet metaal (moleculaire stof) – Vanderwaals kracht en waterstofbruggen tussen de moleculen – Atoombinding in de molecluen • Zout (metaal + niet metaal) – Ionbinding: + en – trekken elkaar aan.

Zouten • Metaalion (positief) met niet metaal ion (negatief) • Verhoudingsformule= positieve en negatieve lading moet gelijk zijn • Oplosvergelijking: van (s) naar (aq – KI (s) K+ (aq) + I- (aq) • Indamp/neerslagvergelijking: van (aq) naar (s) – 3 Na+ (aq) + PO 43 - (aq) Na 3 PO 4 (s)

De Mol

Zuren & Basen • Zuur staat H+ af – Sterke zuren staan alle H+ af alles boven H 3 O+ – Zwakke zuren staan een deel van de H+ af • Base neemt H+ op – Sterke base neemt allemaal een H+ op – Zwakke base een deel neemt een H+ op

p. H • Zuurgraad – 0 -7 = Zuur – 7 = neutraal – 7 -14 = Basisch • • • p. H = -log [H+] = 10 -p. H p. OH = -log [OH-] = 10 -p. OH p. H + p. OH = 14

Reacties • Reactie waarbij een H+ overgedragen wordt • Sterkste zuur reageert met sterkste base • Hierbij ontstaat de “overkant” van Tabel 49 – Zwakke zuren/basen worden niet gesplitst en schrijf je dus aan elkaar (Bv HAc ipv H+ en Ac-) – Sterke zuren/basen worden volledig gesplitst en schrijf je dus als ionen: H+ en Cl– Onoplosbare zouten zijn niet geïoniseerd, schrijf ze dus aan elkaar, bv Ag. Cl

Redox • Reactie met elektronen overdracht. • Reductor: staat elektronen af, produceert dus elektronen • Oxidator: neemt elektronen op, consumeert dus elektronen • Halfreacties in Binas 48

Reacties • Sterkste reductor reageert met de sterkste oxidator. • Inventariseren m. b. v. BINAS – Halfreactie oxidator overnemen – Halfreactie reductor omdraaien • Elektronen gelijk maken • Optellen • Wegstrepen

Elektrochemische cel/batterij • Elektrochemische cel bestaat uit: – Twee elektroden, elk in een eigen ruimte (halfcellen), met daarin een oplossing met vrije ionen (elektrolyt) • Aan de minpool reageert de reductor • Aan de pluspool reageert de oxidator • Elektroden gaan door de stroomdraad van de minpool naar de pluspool • Een zoutbrug maakt de stroomkring gesloten

Elektrolyse • Gedwongen redoxreactie, omgekeerde van een elektrochemische cel • Reductor: reageert aan de pluspool. Let op! Positieve ionen komen niet bij de pluspool! • Oxidator: reageert aan de minpool. Let op! Negatieve ionen komen niet bij de minpool

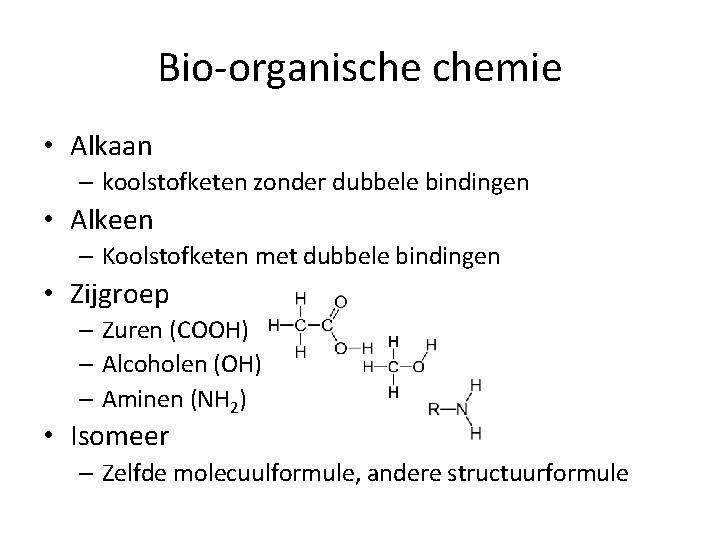
Bio-organische chemie • Alkaan – koolstofketen zonder dubbele bindingen • Alkeen – Koolstofketen met dubbele bindingen • Zijgroep – Zuren (COOH) – Alcoholen (OH) – Aminen (NH 2) • Isomeer – Zelfde molecuulformule, andere structuurformule

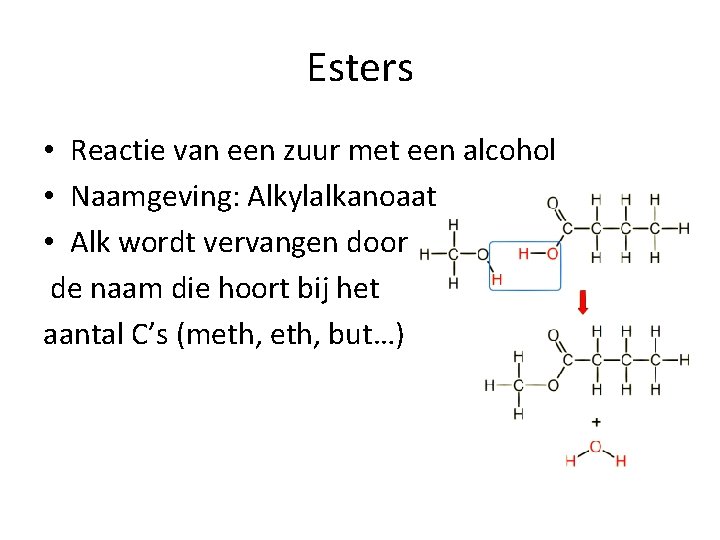
Esters • Reactie van een zuur met een alcohol • Naamgeving: Alkylalkanoaat • Alk wordt vervangen door de naam die hoort bij het aantal C’s (meth, but…)

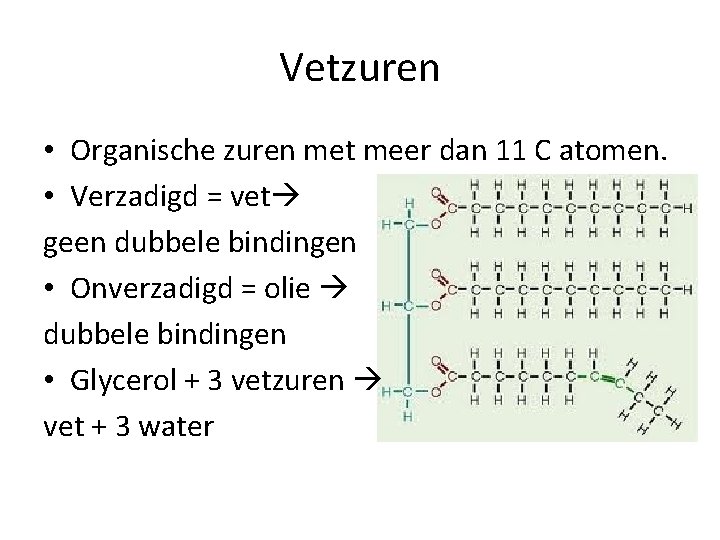
Vetzuren • Organische zuren met meer dan 11 C atomen. • Verzadigd = vet geen dubbele bindingen • Onverzadigd = olie dubbele bindingen • Glycerol + 3 vetzuren vet + 3 water

Polymerisatie • Veel monomeren aan elkaar zodat lange ketens ontstaan • Additiepolymerisatie: monomeer heeft áltijd een dubbele binding die open klapt • Condensatiepolymerisatie: H 2 O wordt afgesplitst: COOH, OH en/of NH 2 nodig • Naamgeving: kleinste originele eenheid met poly er voor, bv polyetheen.

Thermo • Thermoharder = stof die bij warmte niet vervormd – Polymeerketens zijn onderling verbonden) • Thermoplast = stof die bij warmte wel vervormd – Polymeerketens zijn los

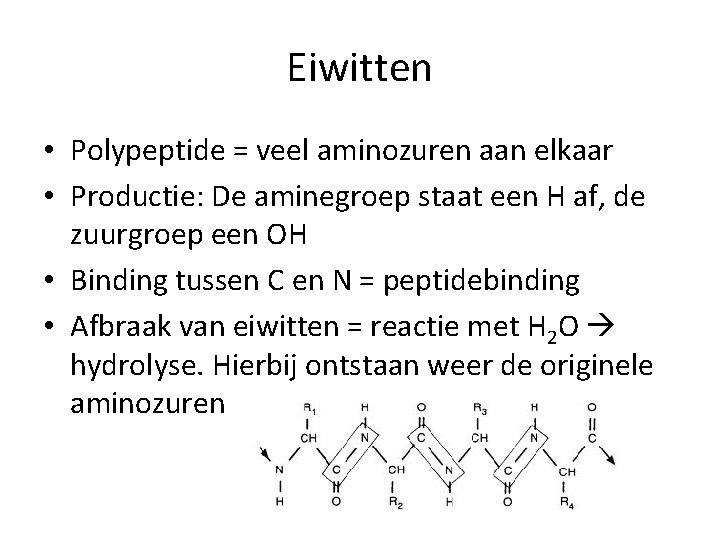
Eiwitten • Polypeptide = veel aminozuren aan elkaar • Productie: De aminegroep staat een H af, de zuurgroep een OH • Binding tussen C en N = peptidebinding • Afbraak van eiwitten = reactie met H 2 O hydrolyse. Hierbij ontstaan weer de originele aminozuren

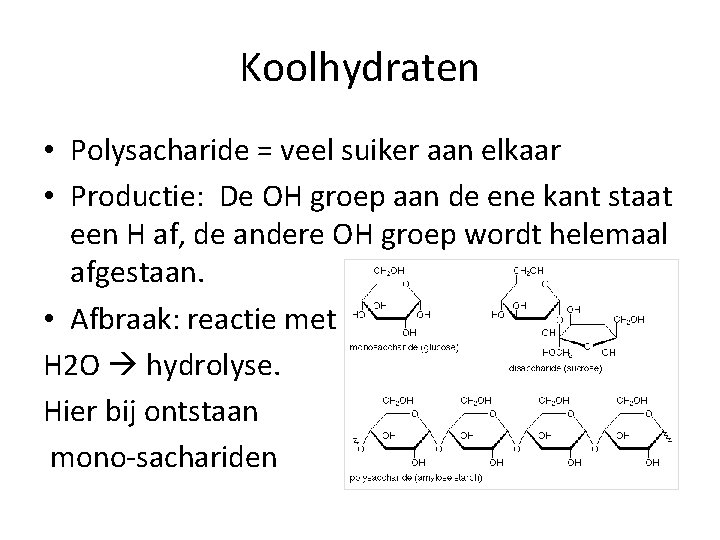
Koolhydraten • Polysacharide = veel suiker aan elkaar • Productie: De OH groep aan de ene kant staat een H af, de andere OH groep wordt helemaal afgestaan. • Afbraak: reactie met H 2 O hydrolyse. Hier bij ontstaan mono-sachariden
 Binair zout
Binair zout Zure stoffen
Zure stoffen Zoutzuur notatie
Zoutzuur notatie Kennis is macht
Kennis is macht Communicatiedoelstelling voorbeeld
Communicatiedoelstelling voorbeeld Kennis dc logistiek
Kennis dc logistiek Parate kennis
Parate kennis Boeken over chromatografie
Boeken over chromatografie Biomedische kennis
Biomedische kennis Kennis learning routes llp
Kennis learning routes llp Angstfragebogen für schüler download
Angstfragebogen für schüler download Algemene ledenvergadering vng
Algemene ledenvergadering vng Klankgrepe en lettergrepe
Klankgrepe en lettergrepe Marketingplan inhoud
Marketingplan inhoud Algemene modelovereenkomst tussenkomst
Algemene modelovereenkomst tussenkomst Algemene vergadering artinya
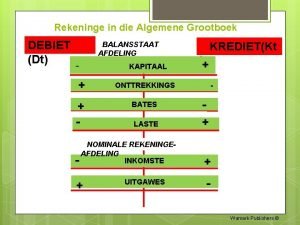
Algemene vergadering artinya Algemene grootboek graad 8
Algemene grootboek graad 8 Vergelijking van de cirkel
Vergelijking van de cirkel Structuur isomeren
Structuur isomeren Stelsin examples
Stelsin examples Algemene preventie
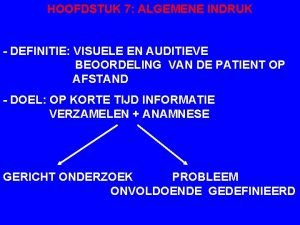
Algemene preventie Algemene indruk voorbeelden
Algemene indruk voorbeelden Bhv alarmeren
Bhv alarmeren Algemene anamnese
Algemene anamnese