EVOLUCIN MODELO ATMICO INTRODUCCIN Los filsofos griegos se










- Slides: 17

EVOLUCIÓN MODELO ATÓMICO

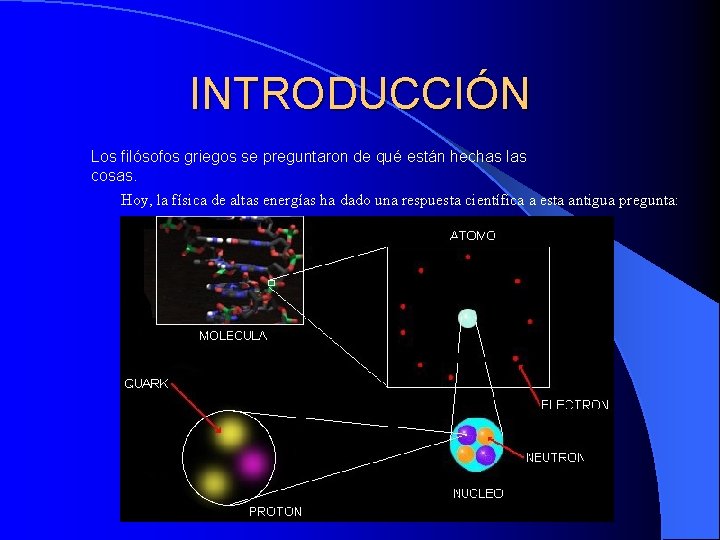
INTRODUCCIÓN Los filósofos griegos se preguntaron de qué están hechas las cosas. Hoy, la física de altas energías ha dado una respuesta científica a esta antigua pregunta:

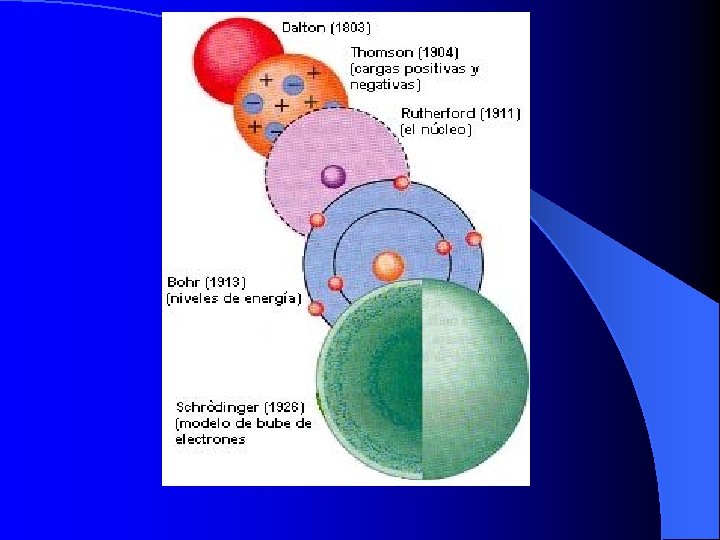
Historia del átomo Modelo Demócrito 460 AC y Dalton 1803 Thomson Rutherford Bohr Nube electrónica 1897 1912 1913 1930

Como consecuencia de todos los estudios que se han realizado para comprender mejor la naturaleza de la materia hoy el hombre cuenta con gran cantidad de conocimientos que le permiten desarrollar la ciencia en forma increible. La concepción de los átomos surge como idea filosófica en Grecia aproximadamente entre el siglo IV y V antes de Cristo. En esta presentación, les mostraré la concepción atómica y los distintos Modelos Atómicos. El modelo actual que tenemos del átomo ha sido consecuencia de las investigaciones y experimentaciones de una diversidad de científicos a través del tiempo; estudiaremos los principales modelos que se propusieron y que pretendieron establecer la forma del ÁTOMO.

LOS ATOMISTAS GRIEGOS La palabra “átomo" viene del griego "a-tomos“ y significa "indivisible". Demócrito (alrededor de 460 -370 AC. ), Explicó que la materia esta compuesta de partículas en perpetuo movimiento con cualidades ideales: Ø muy pequeñas para lograr verlas. Ø Son indivisibles como lo indicaba su nombre. • Eran sólidas y vacías en su interior • Eran eternas ya que eran perfectas • Estaban rodeadas por espacio vacío ( para explicar sus movimientos y cambios en la densidad) • Tienen un número infinito de formas (para explicar su diversidad observada en la naturaleza)

Intentó calcular el peso del átomo, basándose en observaciones y experimentos, Dalton propuso el primer modelo atómico estableciendo los siguientes postulados: 1. -Los elementos están constituidos por átomos. 2. -Los átomos de un mismo elemento son iguales en todas sus propiedades. DALTON 3. -Los átomos son indivisibles. 4. -Los compuestos contienen átomos combinados. Actualmente han sido modificados el 2 do. y 3 er. postulado.

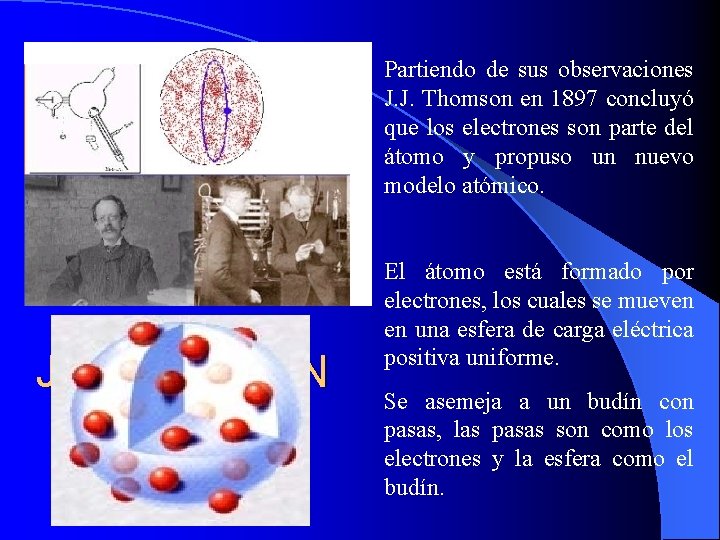
Partiendo de sus observaciones J. J. Thomson en 1897 concluyó que los electrones son parte del átomo y propuso un nuevo modelo atómico. J. J. THOMSON El átomo está formado por electrones, los cuales se mueven en una esfera de carga eléctrica positiva uniforme. Se asemeja a un budín con pasas, las pasas son como los electrones y la esfera como el budín.

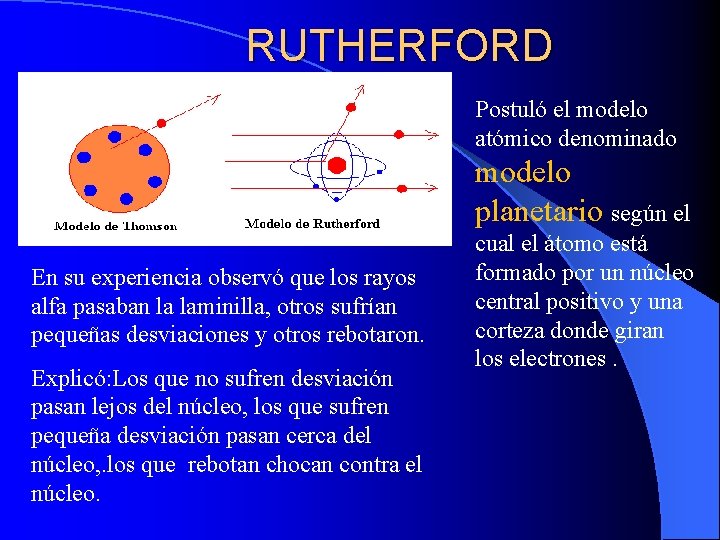
RUTHERFORD Postuló el modelo atómico denominado modelo planetario según el En su experiencia observó que los rayos alfa pasaban la laminilla, otros sufrían pequeñas desviaciones y otros rebotaron. Explicó: Los que no sufren desviación pasan lejos del núcleo, los que sufren pequeña desviación pasan cerca del núcleo, . los que rebotan chocan contra el núcleo. cual el átomo está formado por un núcleo central positivo y una corteza donde giran los electrones.

NIELS BOHR Bohr aplica la teoría cuántica creada por Max Planck y fundamenta su modelo con los siguientes postulados: La distancia entre el electrón y el núcleo es constante. Los electrones se encuentran girando alrededor del núcleo en forma circular y en niveles de energía. Un electrón gana o pierde energía cuando pasa de un nivel a otro nivel estacionario.

SOMMERFELD Supuso que los electrones por tener el mismo tipo de carga eléctrica, forman campos magnéticos iguales por lo que se repelen, no pueden tener órbitas circulares, sino elípticas resultando de esta manera el desdoblamiento de cada nivel de energía en subniveles de energía.

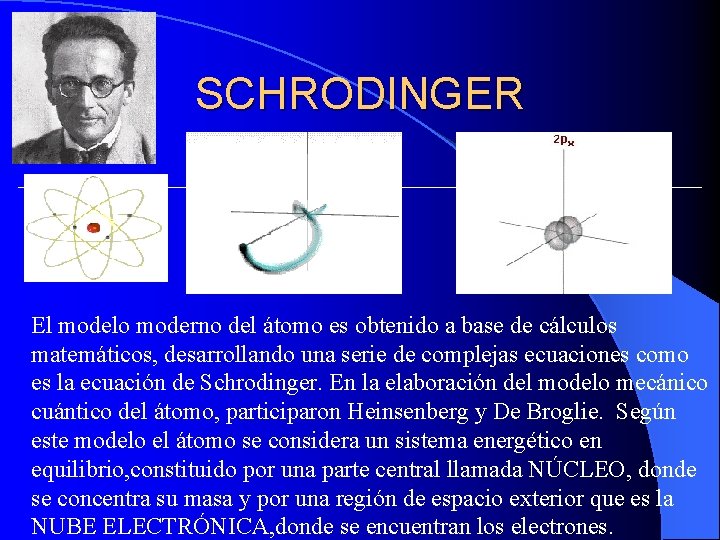
SCHRODINGER El modelo moderno del átomo es obtenido a base de cálculos matemáticos, desarrollando una serie de complejas ecuaciones como es la ecuación de Schrodinger. En la elaboración del modelo mecánico cuántico del átomo, participaron Heinsenberg y De Broglie. Según este modelo el átomo se considera un sistema energético en equilibrio, constituido por una parte central llamada NÚCLEO, donde se concentra su masa y por una región de espacio exterior que es la NUBE ELECTRÓNICA, donde se encuentran los electrones.

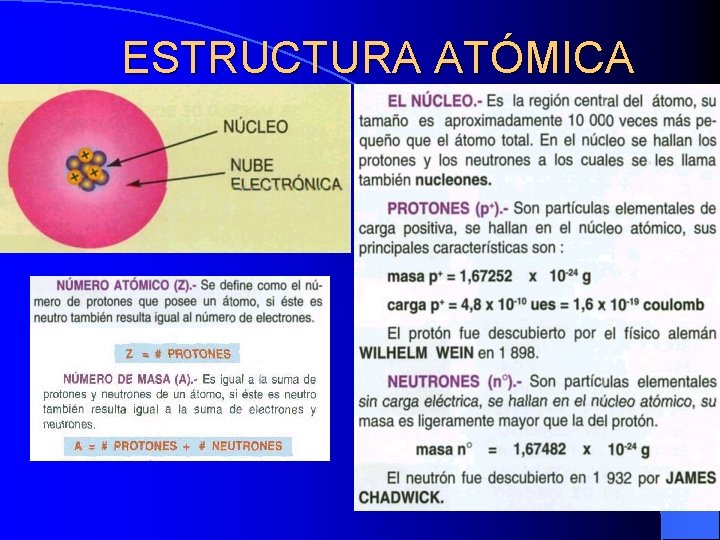
ESTRUCTURA ATÓMICA

NUBE ELECTRÓNICA


Modelos atómicos

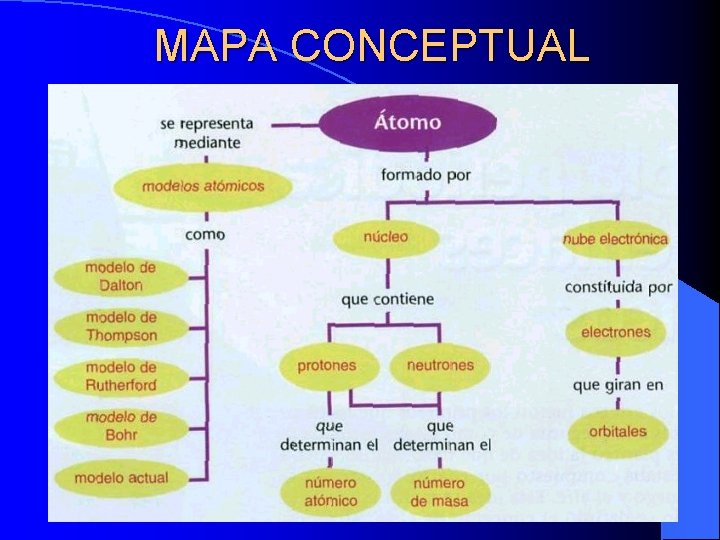
MAPA CONCEPTUAL

CONCLUSIONES • El átomo es la mínima cantidad de materia QUE SE OBTIENE MEDIANTE PROCEDIMIENTOS QUÍMICOS. • Por las observaciones que se han realizado bombardeando átomos con partículas elementales, un átomo se puede explicar así: • Un núcleo de carga positiva donde se concentra la mayoría de su masa, y varios electrones alrededor del núcleo como un enjambre de abejas. El núcleo está compuesto de protones (con carga positiva) y neutrones (sin carga), a estos llamaremos nucleones. • Cuando el átomo está al estado fundamental su carga es 0 • La diferencia entre los elementos químicos que se encuentran en la naturaleza no es más que el número de protones y de neutrones en sus átomos.