Europische Patientenakademie zu Therapeutischen Innovationen Ethische und praktische
















- Slides: 20

Europäische Patientenakademie zu Therapeutischen Innovationen Ethische und praktische Herausforderungen bei der Organisation von klinischen Prüfungen an kleinen Populationen

Kleine Populationen in klinischen Prüfungen Europäische Patientenakademie zu Therapeutischen Innovationen § Eine allgemeingültige Definition für „kleine Populationen“ gibt es nicht. Der Begriff „kleine Population” wird allgemein verwendet, wenn es nur eine beschränkte Gesamtzahl von Patienten mit der untersuchten Erkrankung gibt. § Es besteht eine gewisse Überlappung zwischen kleinen und speziellen Populationen. Zu kleinen Populationen kann Folgendes gehören: Ø seltene Erkrankungen einschließlich spezifischer Subtypen häufiger Erkrankungen Ø Kinder (pädiatrische Patienten) Ø Ältere Menschen (geriatrische Patienten) 2

Seltene und extrem seltene Erkrankungen Europäische Patientenakademie zu Therapeutischen Innovationen § 30 Millionen Menschen in der EU sind von seltenen Erkrankungen betroffen. § Als „selten“ bezeichnet man eine Erkrankung, wenn diese bei weniger als einem von 2000 Menschen auftritt. § „Extrem seltene“ Erkrankungen treten bei weniger als einem von 2. 000 Menschen (angenommene Prävalenz 1) auf. § Es gibt nur begrenzte Kenntnisse über seltene Krankheiten, aufgrund von wenig Forschung (Forschungsinteresse und verfügbare Finanzierung begrenzt) § Bei seltenen Erkrankungen gibt es eine große Variabilität der Ausprägung und der Stadien der Erkrankung. 1 Hennekam RC. (2011). Care for patients with ultra-rare disorders. European Journal of Medical Genetics. 54(3), 220 -4. doi: 10. 1016/j. ejmg. 2010. 12. 001 3

Standardlösungen und Non-Standard-Lösungen Europäische Patientenakademie zu Therapeutischen Innovationen § Grundsätzlich wird die Entwicklung von medizinischen Produkten für seltene Erkrankungen sowie von Arzneimitteln für Kinder als Standardsituation angesehen; mit anderen Worten, es existieren entsprechende Leitlinien, um sie zu regeln. § In diesen Situationen folgt die Arzneimittelentwicklung den Prinzipien der evidenzbasierten Medizin, wie dies auch bei häufigen Erkrankungen der Fall ist. § Die Entwicklung von Arzneimitteln für seltene Erkrankungen sowie von Arzneimitteln für Kinder kann Beschränkungen hinsichtlich dessen, was möglich und sinnvoll ist, auferlegen. § Die Entwicklung erfordert daher möglicherweise nicht dem Standard entsprechende Lösungen 4

Evidenzstufen Europäische Patientenakademie zu Therapeutischen Innovationen § Der Aussagewert der Ergebnisse klinischer Prüfungen sollte in Bezug auf die Evidenzstufe berücksichtigt werden, zumal die Ergebnisse einiger Arten von Studien signifikanter sind, als andere: 5

Welchen Evidenzgrad kann man in Studien an kleinen Populationen und Kindern erreichen? Europäische Patientenakademie zu Therapeutischen Innovationen § Schlüsselfragen: Ø Kann eine randomisierte kontrollierte Studie durchgeführt werden? Ø Ist eine kleine randomisierte kontrollierte Studie besser als eine große Beobachtungsstudie? Ø Besteht die Gefahr von Verzerrungen? Ø Wie genau wird das Ergebnis sein? Ø Welcher Evidenzgrad ist für die initiale Marktzulassung erforderlich? Ø Welcher Evidenzgrad ist für die Marktüberwachung nach Zulassung erforderlich? 6

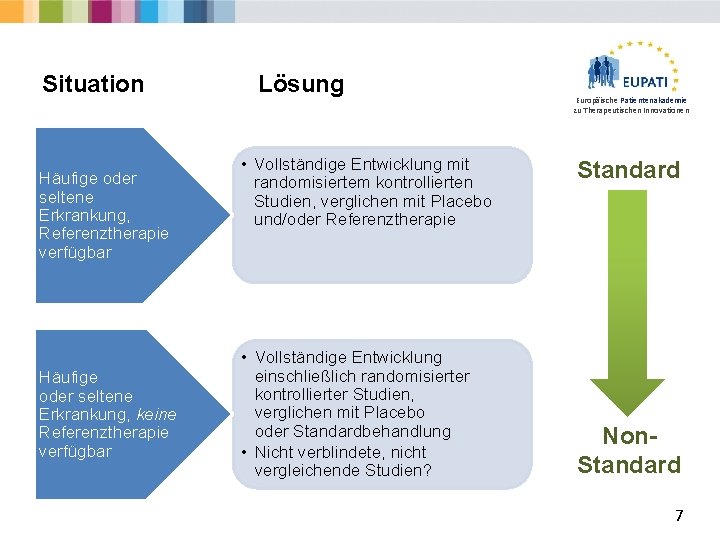
Situation Häufige oder seltene Erkrankung, Referenztherapie verfügbar Häufige oder seltene Erkrankung, keine Referenztherapie verfügbar Lösung • Vollständige Entwicklung mit randomisiertem kontrollierten Studien, verglichen mit Placebo und/oder Referenztherapie • Vollständige Entwicklung einschließlich randomisierter kontrollierter Studien, verglichen mit Placebo oder Standardbehandlung • Nicht verblindete, nicht vergleichende Studien? Europäische Patientenakademie zu Therapeutischen Innovationen Standard Non. Standard 7

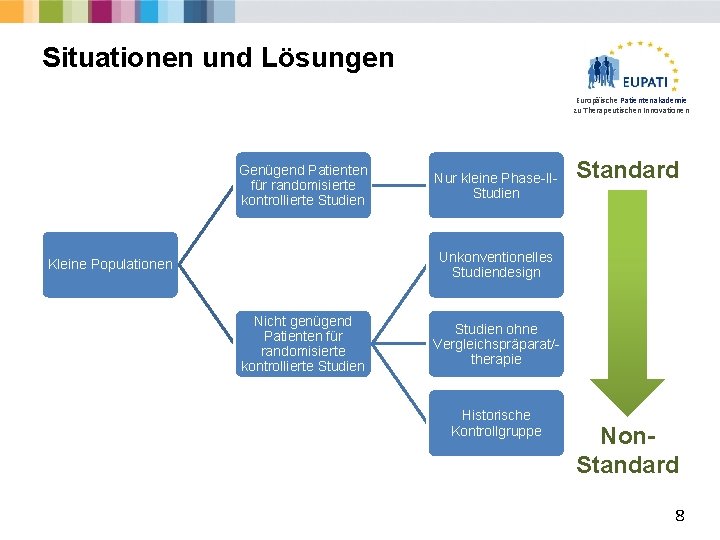
Situationen und Lösungen Europäische Patientenakademie zu Therapeutischen Innovationen Genügend Patienten für randomisierte kontrollierte Studien Nur kleine Phase-IIStudien Standard Unkonventionelles Studiendesign Kleine Populationen Nicht genügend Patienten für randomisierte kontrollierte Studien ohne Vergleichspräparat/therapie Historische Kontrollgruppe Non. Standard 8

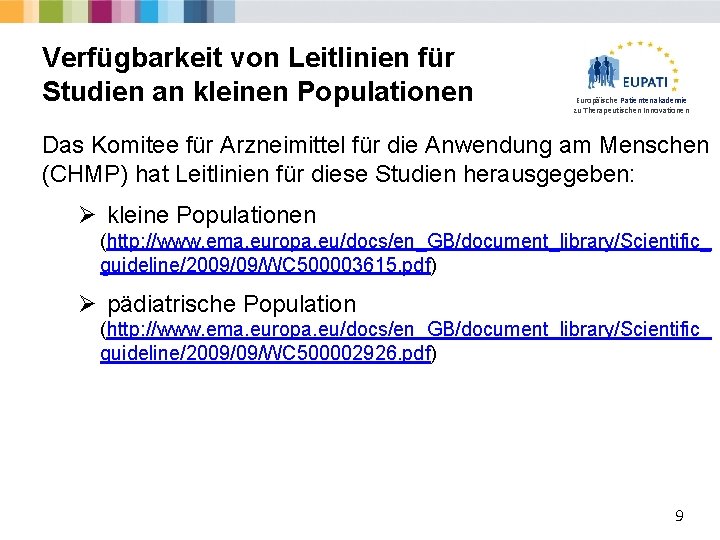
Verfügbarkeit von Leitlinien für Studien an kleinen Populationen Europäische Patientenakademie zu Therapeutischen Innovationen Das Komitee für Arzneimittel für die Anwendung am Menschen (CHMP) hat Leitlinien für diese Studien herausgegeben: Ø kleine Populationen (http: //www. ema. europa. eu/docs/en_GB/document_library/Scientific_ guideline/2009/09/WC 500003615. pdf) Ø pädiatrische Population (http: //www. ema. europa. eu/docs/en_GB/document_library/Scientific_ guideline/2009/09/WC 500002926. pdf) 9

Studien in kleinen Populationen: Schlüsselfaktoren (1) Europäische Patientenakademie zu Therapeutischen Innovationen § Standardisierte Datenerfassung – vorab geplant (prospektiv), dokumentiert im Protokoll und beachtet mit der folgenden Intention: Ø Maximierung der Erfassung wichtiger Informationen Ø Minimierung der Belastung durch die Teilnahme an der Studie Ø Vermeidung von „Loss to follow-up“ (Ausscheiden von Studienteilnehmern vor Abschluss der Verlaufskontrolle) § Tiermodelle der Erkrankung müssen optimal genutzt werden. 10

Studien in kleinen Populationen: Schlüsselfaktoren (2) Europäische Patientenakademie zu Therapeutischen Innovationen Schlüsselfaktoren: § Verständnis des natürlichen Verlaufs der Erkrankung, wie sich diese also im Lauf der Zeit ändern kann § Verständnis der Quellen möglicher Fehlinterpretationen von Daten (Störfaktoren) § Verständnis der Quellen variablen Ansprechens auf die Therapie. 11

Studien in kleinen Populationen: Beurteilung der Wirksamkeit (1) Europäische Patientenakademie zu Therapeutischen Innovationen § Typischerweise erfolgt die Beurteilung der Wirksamkeit auf Grundlage der folgenden Parameter: Ø Heilung Ø Überleben Ø Zeit bis zur Progression der Erkrankung Ø Progressionsfreies Überleben Ø Umkehr des Organversagens Ø Stabilisierung der Erkrankung § Die Auswahl des am besten geeigneten Endpunkts ist von entscheidender Bedeutung. 12

Studien in kleinen Populationen: Beurteilung der Wirksamkeit (2) Europäische Patientenakademie zu Therapeutischen Innovationen § Wie wird Wirksamkeit gemessen? Ø Harte Endpunkte (z. B. Überlebensraten) Ø Surrogat-Endpunkte (klinische Verbesserung) Ø Symptomlinderung Ø Lebensqualität Ø Biomarker, Surrogatwert unbekannt Oftmals ist es notwendig, eine logische Kombination von Maßnahmen in Betracht zu ziehen, die auf die selbe Schlussfolgerung deuten. 13

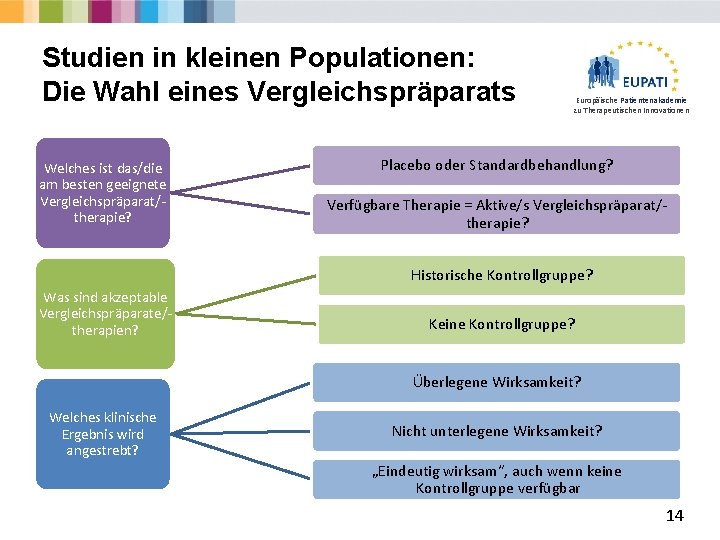
Studien in kleinen Populationen: Die Wahl eines Vergleichspräparats Welches ist das/die am besten geeignete Vergleichspräparat/therapie? Europäische Patientenakademie zu Therapeutischen Innovationen Placebo oder Standardbehandlung? Verfügbare Therapie = Aktive/s Vergleichspräparat/therapie? Historische Kontrollgruppe? Was sind akzeptable Vergleichspräparate/therapien? Keine Kontrollgruppe? Überlegene Wirksamkeit? Welches klinische Ergebnis wird angestrebt? Nicht unterlegene Wirksamkeit? „Eindeutig wirksam“, auch wenn keine Kontrollgruppe verfügbar 14

Beispiele für Studiendesigns Europäische Patientenakademie zu Therapeutischen Innovationen § Nahtlos adaptives Design: Ø Phase II und Phase III werden zu einer Studie zusammengefasst Ø das Studiendesign wird im Verlauf der Studie adaptiert Ø nach der Interimsanalyse werden die besten Dosierungsstufen weiter verfolgt § Sequenzielle Studien: Ø Nimmt Patienten auf und führt Analysen durch, bis eine zuverlässige Schlussfolgerung gezogen werden Ø die Wirkung bzw. das klinische Ergebnis stellt sich schnell heraus § Modellierung: Ø Auswirkung von Parametern Ø Beziehung zwischen Wirksamkeit und Wirkungen 15

Praktische Probleme für Patienten bei der Teilnahme an einer Studie zu einer seltenen Erkrankung Europäische Patientenakademie zu Therapeutischen Innovationen § Es kann aufwändig sein, relevante Studien zu finden § Möglicherweise erfordert das Aufsuchen des Prüfzentrums eine lange Anreise § Möglicherweise ist eine Verlegung bzw. ein Umzug des Patienten erforderlich § Möglicherweise ist eine finanzielle Unterstützung und/oder die Aufnahme in das Gesundheitssystem erforderlich § Möglicherweise muss ein Dolmetscher hinzugezogen werden § Kindern muss die Möglichkeit zum Schulbesuch gegeben werden § Möglicherweise ist die Umstellung des gesamten Familienlebens erforderlich 16

Datenschutz und Transparenz Europäische Patientenakademie zu Therapeutischen Innovationen § Es werden alle Maßnahmen ergriffen, um die Privatsphäre bzw. die personenbezogenen Daten während der klinischen Prüfungen zu schützen. Bei seltenen oder extrem seltenen Erkrankungen ist dies jedoch aus den folgenden Gründen möglicherweise problematisch: Ø kleinere oder nicht vorhandene Patientenregister Ø Risiko der Identifizierung in einer klinischen Studie 17

Ethische Aspekte bei klinischen Prüfungen zu seltenen Erkrankungen Europäische Patientenakademie zu Therapeutischen Innovationen § Nutzen/Risiken-Bewertung aufgrund eines lebensbedrohlichen Erkrankungsstadiums § Oftmals ist kein(e) bekannte(s) wirksame(s) Vergleichspräparat/-therapie verfügbar § Die neue Behandlung ist nach Abschluss der Studie möglicherweise nicht verfügbar § Es besteht kein etablierter Prozess, die Patienten über die Ergebnisse der Studie zu unterrichten 18

Das Verfahren der „Einwilligung nach Aufklärung“ Europäische Patientenakademie zu Therapeutischen Innovationen § Patienten sind möglicherweise nicht in der Lage, selbst eine Einwilligung nach Aufklärung zu geben und verlassen sich möglicherweise auf die Entscheidung des gesetzlichen Vertreters, dessen Ansichten möglicherweise in mancherlei Hinsicht von denen des Patienten abweichen. § Die Entscheidung zur Teilnahme an der Studie erfolgt oftmals nicht wirklich freiwillig, sondern weil es eventuell keine Behandlungsalternative gibt. § Der Schweregrad der Erkrankung macht die Placebokontrolle zu einem besonderen Problem, da diese erfordert, dass die Teilnehmer einwilligen, in der ersten Studienphase möglicherweise überhaupt keine Behandlung zu erhalten. 19

Schlussfolgerung Europäische Patientenakademie zu Therapeutischen Innovationen § Es muss ein Gleichgewicht zwischen dem, was notwendig ist und was möglich ist, gefunden werden. § Es stehen Methoden zur Verfügung, um in klinischen Prüfungen an kleinen Populationen Wirksamkeit zu belegen § Die Entwicklungsstrategie für Behandlungsformen für kleine Populationen sollte vorab mit den Zulassungsbehörden besprochen, und sie sollten um wissenschaftliche Beratung sowie Unterstützung bei der Erstellung des Prüfplans gebeten werden. § klinische Prüfungen zu seltenen oder extrem seltenen Erkrankungen sind mit einer Anzahl ethischer und organisatorischer Herausforderungen verbunden. 20