ESTUDOS EPIDEMIOLGICOS DE INTERVENO Hermano Alexandre Lima Rocha




































- Slides: 43

ESTUDOS EPIDEMIOLÓGICOS DE INTERVENÇÃO Hermano Alexandre Lima Rocha Mestre em Saúde Pública UFC – Faculdade de Medicina

Tópicos O Tipos de estudos O Estudos de intervenção O Ensaios cínicos O Exercícios

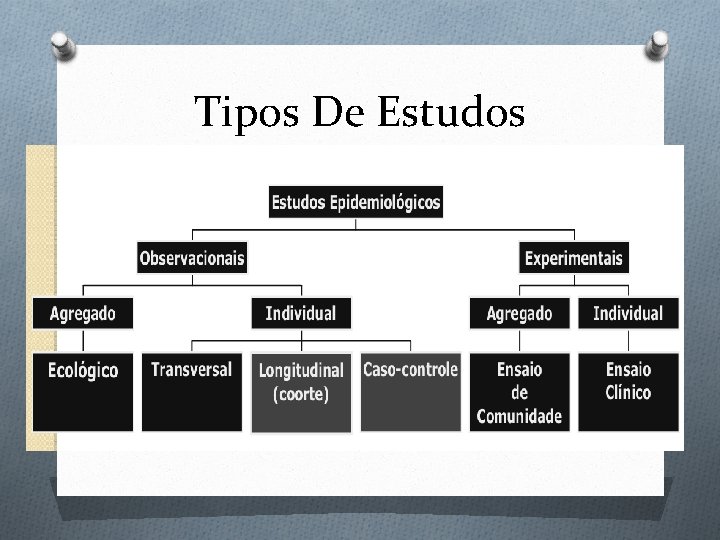
Tipos De Estudos �CLASSIFICAÇÃO: • Estudos Observacionais • Estudos Experimentais(de intervenção)

Tipos De Estudos

Estudos Epidemiológicos De Intervenção CARACTERÍSTICAS: v O investigador manipula o fator de exposição (a intervenção) v A intervenção pode ser uma atitude profilática ou terapêutica v O objetivo é investigar os efeitos dessa ação v São também denominados ESTUDOS EXPERIMENTAIS, v O termo “experimento verdadeiro” é designado para os ensaios clínicos randomizados controlados / quasi

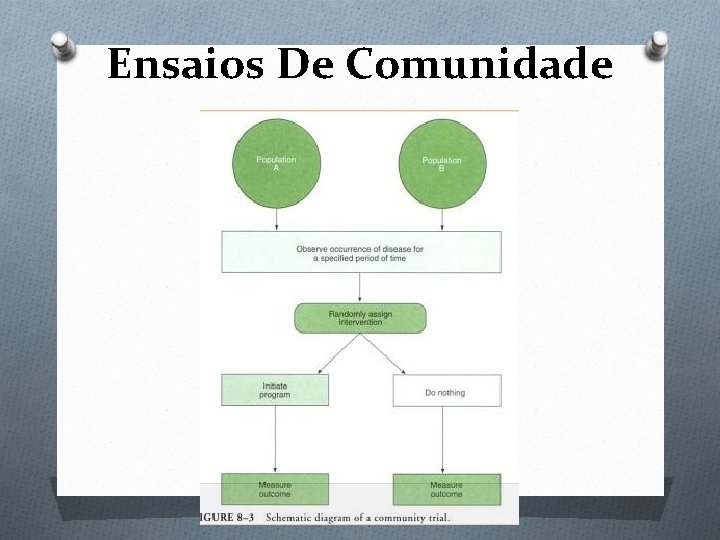
Tipos De Estudos De Intervenção: O ENSAIOS CLÍNICOS (“clinical trials”) - Têm como a unidade de análise os indivíduos doentes. - Principalmente terapêuticos (ex. : avaliação da eficácia do uso da dexametasona em meningites bacterianas; avaliação do uso de vitamina D na prevenção de hipocalcemia neonatal. ) O ENSAIOS DE COMUNIDADE (“community trials”) - Têm como unidade de análise, uma comunidade inteira - Predominantemente profiláticos (ex. : avaliação dos efeitos da fluoretação da água na redução da incidência de cáries)

Ensaios De Comunidade

Ensaios Clínicos O Relatos desde a Grécia antiga; O Primeiro ensaio clínico de 1700.

11 Então disse Daniel ao despenseiro a quem o chefe dos eunucos : 12 Experimenta, peço-te, os teus servos dez dias, e que se nos dêem legumes a comer, e água a beber. 13 Então se examine diante de ti a nossa aparência, e a aparência dos jovens que comem a porção das iguarias do rei; e, conforme vires, procederás para com os teus servos. 14 E ele consentiu isto, e os experimentou dez dias. 15 E, ao fim dos dez dias, apareceram os seus semblantes melhores, e eles estavam mais gordos de carne do que todos os jovens que comiam das iguarias do rei. James Lind (1746) conduziu o primeiro ensaio clínico registado na história da Medicina. A bordo do Salisbury, dividiu um grupo de doze marinheiros afetados pelo escorbuto em diferentes grupos com diferentes formas de terapia. O grupo com acesso a laranjas e limões se recuperou da doença Benjamin Waterhouse (1800) foi designado pelo Conselho de Boston da Saúde em que de 19 rapazes vacinados e 2 não vacinados foram expostos ao vírus da varíola. Os dois meninos não vacinados sucumbiu à doença No Guy's Hospital em Londres, William Withey Gull chegou à conclusão que doenças poderiam ter um progresso favorável mediante tratamento com placebo, após tratar 21 pacientes com febre reumática "em grande parte com água de hortelã" 9

Fisher e Mac. Kenzie (1923) usam a randomização na experimentação na agricultura Criação do Comitê Especial de Estudos Experimentais pelo Conselho de Pesquisa Médica da Grâ-Bretanha (1931) Amberson (1931) fez a alocação randomizada do tratamento 24 pacientes com Tb pulmonar (2 grupos) – através de moeda – quem tomaria medicação (sanocrysin) e quem receberia água destilada Usou princípios dos estudos cegos Promulgação do Código de Nuremberg que estabeleceu que nenhum ser humano poderia ser submetido a qualquer pesquisa sem consentimento explícito (1946) Declaração de Helsinque (1964); revisão em Tóquio (1975) e Resolução 196/96 do CNS no Brasil 1998 mais de 9. 000 ensaios em revistas médicas e a Biblioteca Cochrane registrava mais de 150. 000 10

Ensaios Clínicos O PLANEJADOS (objetivos definidos, hipótese considerando os O O O resultados desejados, tempo, custos e possíveis dificuldades) PROSPECTIVOS (equivalente a estudos de coorte) Envolvem pacientes com uma condição de interesse (DOENTES), Subdivididos em dois ou mais grupos: a) submetidos a um determinado tipo de intervenção (drogas novas, outras modalidade terapêuticas, técnicas cirúrgicas, etc) b) um grupo controle (placebo ou intervenção clássica ou nenhuma intervenção) Avalia-se o DESFECHO da doença, elucidando-se qual modalidade de tratamento é mais eficaz. Utilidade do estudo: benefício para futuros pacientes com uma mesma condição de saúde.

Controles

Estudos de controles concorrentes não randomizados O Controles são participantes tratados sem a intervenção ao mesmo tempo do grupo de intervenção e alocados, por definição, sem processo aleatório (randomizado) O Ex: Participantes da clínica A sofrerão a nova intervenção; participantes da clínica B não sofrerão

Controles históricos O A nova intervenção é aplicada em um grupo de participantes e os resultados comparados a resultados de participantes anteriores O Por definição são não randomizados e não concorrentes O Argumento para o uso deste tipo de controle O Nenhum paciente deveria ser privado do novo tratamento (aspectos éticos)

Controles históricos O Limitações: O Particularmente vulneráveis a “bias” (viés) O Mudanças ocorridas no diagnóstico ou manejo do paciente O Vantagem: O Custos e tempo O Tipicamente são obtidos de 2 fontes: O Na literatura: difícil saber se são compatíveis O Bancos de dados ou registros hospitalares

Estudos com retirada (withdrawl) O No tratamento de uma doença crônica o medicamento é retirado ou reduzido O O objetivo é avaliar a resposta à interrupção ou redução O Pode ser válido para avaliar a duração do benefício de uma intervenção que já se sabe útil O Também pode ser utilizada para avaliar tratamentos cujos benefícios nunca foram conclusivamente comprovados O Limitações: O O grupo estudado é muito selecionado

Ensaios Clínicos �P = População �I = Intervenção �C = Controle �O = Outcomes = Desfecho

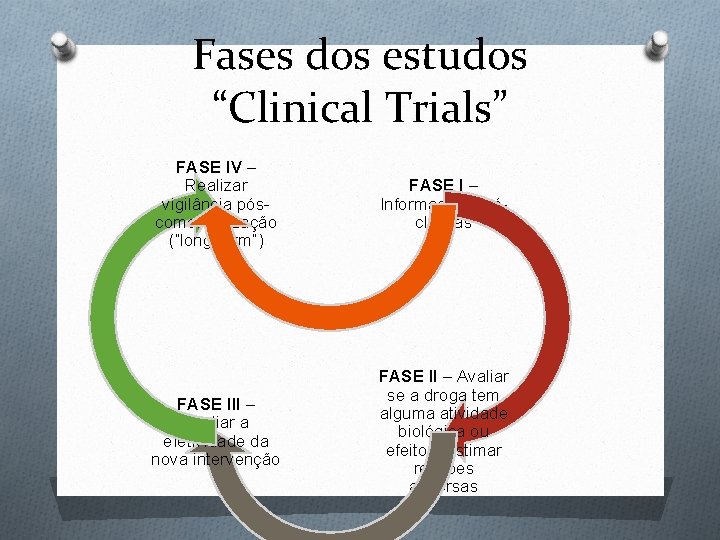
Fases dos estudos “Clinical Trials” FASE IV – Realizar vigilância póscomercialização (“long-term”) FASE I – Informações préclínicas FASE III – Avaliar a efetividade da nova intervenção FASE II – Avaliar se a droga tem alguma atividade biológica ou efeito e estimar reações adversas

Fases I e FASE II – Avaliar II Fase I: Informações pré-clínicas O Ensaios de farmacologia clínica (metabolismo, biodisponibilidade) e toxicidade no homem O Qual é a máxima dose tolerada sem causar efeitos secundários em um pequeno número de voluntários saudáveis? O Avalia segurança e não eficácia O Pacientes com doença sem cura conhecida (aids, câncer) podem participar atividade biológica ou efeito e estimar reações adversas O Investigação clínica da eficácia e segurança do tratamento, em pequena escala O Raramente ultrapassa 200 pacientes O Com frequência não randomizados

Fases III e IV FASE III - Avaliar a efetividade da nova intervenção O Comparação em larga escala com tratamentos padrões disponíveis O Clinical trial propriamente dito para alguns autores O Maioria randomizado FASE IV – Realizar vigilância póscomercialização O No Brasil, conduzida pelo O O MS (ANVISA) e nos EUA pelo FDA Ainda existem questões de monitoramento de efeitos adversos, incluindo morbidade e mortalidade Não incluem grupos controles e não são randomizados Procedimentos ou equipamentos podem falhar, depois de alguns anos Rede de farmacovigilânia

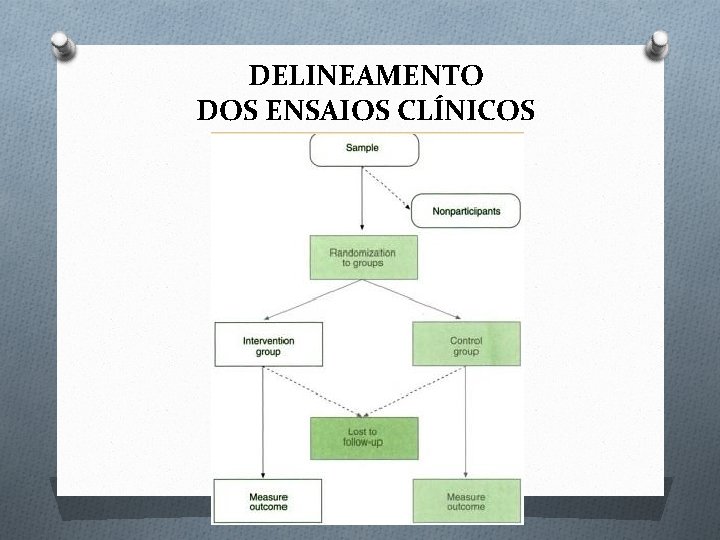
DELINEAMENTO DOS ENSAIOS CLÍNICOS

Seleção Da População De Estudo População de estudo: O Indivíduos doentes(confirmação da presença do diagnóstico) O Definição da fase da evolução da doença. Tamanho da amostra depende: O Do objetivo do estudo O Desfecho (tipo de resultado e qual a freqüência) O Dos resultados esperados (diferença nos resultados em relação ao tto. padrão) O Parâmetro utilizado para minimizar o erro tipo I (ou alfa)= probabilidade de detectar uma diferença que na realidade não existe (utiliza-se em geral o nível de significância de 0, 05) O Parâmetro para minimizar o erro tipo II (ou beta) = probabilidade de não detectar uma diferença quando ela realmente existe (utiliza-se em geral o poder do estudo de 80%)

Desenvolvimento do estudo Alocação ao tratamento: O Randomização(Aleatoriamente): objetivo de reduzir o viés de seleção e redução de confundimento. (tipos: simples, em bloco, pareada, estratificada) O Cego ou duplo-cego (até triplo-cego): objetivo de reduzir viés de aferição. O Uso de placebo: também reduzir o viés de aferição. O Ensaios tipo cruzados (“crossover trials”: o mesmo indivíduo participa do grupo de intervenção e do grupo controle em momentos diferentes)

�O cegamento é difícil ou mesmo impossível algumas vezes: Ø Medicação com efeito colateral importante Ø Cirurgia Ø Psicoterapia

Desenvolvimento do estudo Acompanhamento: O Critérios de avaliação precisos e reprodutíveis devem ser aplicados a todos os grupos do tratamento. O Aderência ao tratamento e perdas de seguimento podem introduzir viés se diferentemente distribuídas entre o grupo tratado e controle.

Questões éticas: O Protocolos científicos não sejam conflitantes aos interesses dos pacientes. O Todos os tratamentos devem ser igualmente aceitáveis, considerando-se o conhecimento atual. O Nenhum indivíduo possa ser restringido ao acesso de qualquer outro tratamento. O Erros na aplicação do protocolo. O Planejamento da análise estatística. O Responsabilidades administrativas.

Resultados esperados: Grupos Tratad o Contro le Evento de interesse Presen Ausente te Incidência do evento A B R 1=a/(a+b) C D R 2=c/(c+d)

Análise 28

Medidas do tamanho do efeito RAR RR • Redução absoluta do risco • RC - RT • Risco relativo • RT/RC RRR • Redução relativa do risco • [(RC – RT)/RC] X 100 NNT • Número necessário para tratar • 1/RAR OR • Odds ratio • (a/b) / (c/d) = ad/bc RT= risco no grupo tratado RC= risco no grupo controle

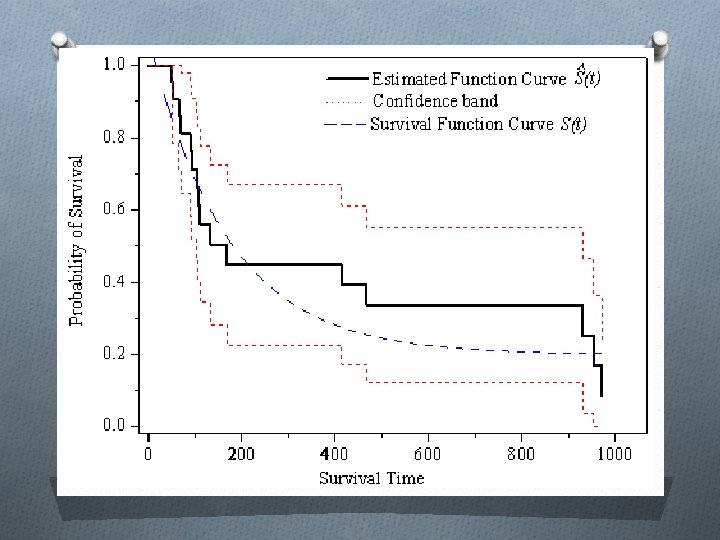
Análise de sobrevivência

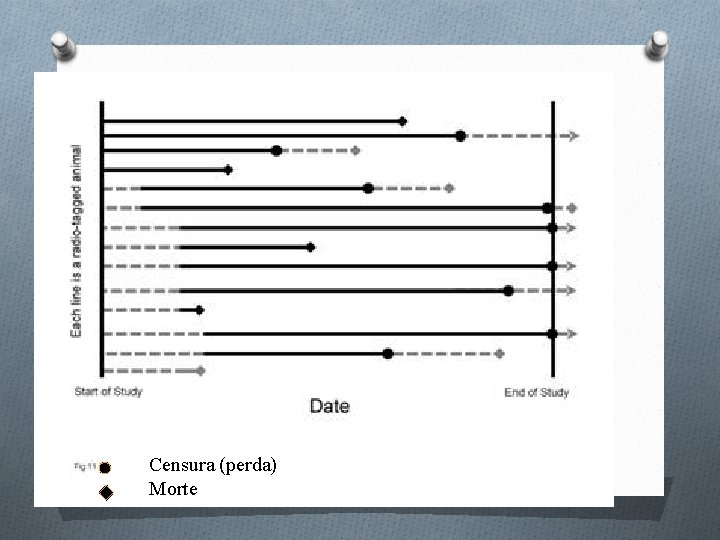
Análise de sobrevida O Dados necessários para calcular uma tabela de sobrevida: 1. intervalo de tempo; 2. início (o número em cada intervalo de tempo) 3. mortos (o número de mortos em cada intervalo de tempo) 4. perdidos (o número de perdidos em cada intervalo de tempo). O O restante da tabela aparece por cálculo. O O ponto exato no tempo de perda de seguimento ou de morte é desconhecido --- a morte ou perda é assumida como ocorrida no fim do intervalo

32 Censura (perda) Morte

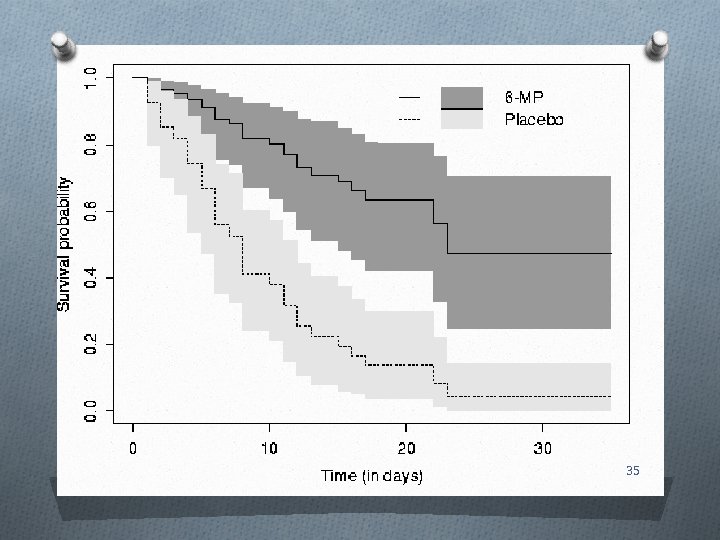
Teste logrank O são duas (ou mais) curvas de sobrevida diferentes? O usa estatística de qui quadrado baseado na diferença entre a sobrevida observada e a sobrevida esperada se as curvas não fossem diferentes

34

35

EXEMPLO: O Efeito do tratamento por trombólise em pacientes com arritmias cardíacas até seis horas após o início dos sintomas de IAM. Morreu Tratado Controle 1352 1773 Não morreu 13086 12613 Total 14438 14386 Incidênci a 9, 4% 12, 3% Resultados obtidos: 1. Risco relativo (RR =9, 4/12, 3 = 0, 76 ) 2. Redução relativa do risco (RRR = 1 – 0, 76 = 0, 24 ou 24%) 3. Redução absoluta do risco (RAR = 12, 3 -9, 4 = 2, 9%) 4. Número de pacientes tratados (NNT = 1/0, 029 = 34)

Dimensões Dos Desfechos �Eficácia: Ø Como a intervenção funciona nas condições artificiais em que se desenvolve o estudo (administração da intervenção, aderência, características dos sujeitos incluídos)

Dimensões Dos Desfechos Ø Efetividade: Ø Como a intervenção funciona “no mundo real” – sem as condições de controle dos estudos experimentais.

Dimensões Dos Desfechos § Eficiência: § Avalia se a intervenção, além de efetiva, é vantajosa sob o ponto de vista econômico

Hierarquia Das Evidência Estudos Intervenções

Vantagens e desvantagens Vantagens Desvantagens Permite que a efetividade de Caro e complicado um novo tratamento seja testada Fornece o mais forte nível de evidência Pacientes podem se recusar ao tratamento Uma grande amostra é necessária Problemas éticos

Exercício Uma vacina contra a gripe foi testada em um grupo de voluntários. Dos 100 individuos que receberam a vacina, 4 tiveram a doença e dos 50 que receberam o placebo, 8 tiveram gripe durante o período de seguimento. Qual é a eficácia da vacina?

Obrigado! Dúvidas? hermanoalexandre@gmail. com hermano@ufc. br
 Tipos de estudos epidemiológicos
Tipos de estudos epidemiológicos Tipos de estudos epidemiológicos
Tipos de estudos epidemiológicos Cancion tu eres mi hermano del alma realmente el amigo
Cancion tu eres mi hermano del alma realmente el amigo Interveno
Interveno Autobrocantes
Autobrocantes Jika diketahui data
Jika diketahui data Estudos europeus
Estudos europeus Semana de estudos intensivos
Semana de estudos intensivos Estudo longitudinal
Estudo longitudinal Discutimos sobre assuntos pendentes e sugerimos melhorias
Discutimos sobre assuntos pendentes e sugerimos melhorias Mites
Mites Ipeak roteiro de estudos
Ipeak roteiro de estudos O que são estudos de coorte
O que são estudos de coorte Mestrado em economia internacional
Mestrado em economia internacional Estudo transversais
Estudo transversais Estudo transversal
Estudo transversal Apazdosenhor estudos
Apazdosenhor estudos Jamais considere seus estudos
Jamais considere seus estudos Jus puniendi
Jus puniendi Pablo da rocha
Pablo da rocha Aleluia tu és pedro
Aleluia tu és pedro Tipos de rochas
Tipos de rochas Jesus of nazareth hymn
Jesus of nazareth hymn Rosmiro fuentes
Rosmiro fuentes Nbrega
Nbrega Leonardo sampaio e gustavo rocha
Leonardo sampaio e gustavo rocha Pasaje dardo rocha planos
Pasaje dardo rocha planos Gustavo rocha edad
Gustavo rocha edad Gabriel gomes da rocha
Gabriel gomes da rocha A rocha internacional
A rocha internacional Pera rocha portuguesa
Pera rocha portuguesa O xisto faz efervescência
O xisto faz efervescência Present continuous frasi
Present continuous frasi Prof. larissa rocha
Prof. larissa rocha Rorschach testi yorumlama
Rorschach testi yorumlama Ivan antonio peña rocha
Ivan antonio peña rocha Amparo rocha alonso
Amparo rocha alonso Mariel rocha-narvaez
Mariel rocha-narvaez Raimundo rocha dos santos
Raimundo rocha dos santos Tipos de rochas
Tipos de rochas Lousa rocha
Lousa rocha Guilherme rocha pardi
Guilherme rocha pardi Cmffra
Cmffra Obras de ruth rocha
Obras de ruth rocha
































































