ESTUDO DOS GASES Gs e Vapor A diferena






- Slides: 7

ESTUDO DOS GASES

Gás e Vapor A diferença entre gás e vapor é dada a partir da temperatura crítica. O vapor é a matéria no estado gasoso, estado esse que pode ser liquefeito com o aumento da pressão. Com o gás não ocorre o mesmo. Ele é um fluido impossível de ser liquefeito com um simples aumento de pressão. Isso faz com o gás seja diferente do vapor. Uma determinada substância no estado gasoso é um gás se a sua temperatura for superior à temperatura crítica, se a temperatura for igual ou inferior à temperatura crítica a substância é vapor. A teoria cinética dos gases considera que os gases ideais possuem as seguintes características principais: � � � Massa: todos os gases possuem massa; Volume: o volume dos gases não é fixo porque é sempre igual ao volume do recipiente que os contém; O volume dos gases é variável, adaptando-se ao volume do recipiente Dilatação e compressão: Com o aumento da temperatura e/ou diminuição da pressão, o gás dilata-se (expande-se). Por outro lado, com um abaixamento da temperatura e/ou aumento da pressão, ele sofre contração (é comprimido);

Transformações Gasosas Primeiramente vamos definir o que significa o “Estado de um Gás”: “O Estado de um Gás fica completamente caracterizado através dos valores assumidos pelas suas grandezas físicas: Volume (V), Temperatura (T) e Pressão (p), que são denominadas: Variáveis de Estado. ” Para caracterizar uma mudança de Estado do gás, são necessárias pelo menos duas variações das três possíveis. Vamos estudar a seguir os três tipos de transformações de Estado onde uma das grandezas sempre permanece constante, caracterizando uma transformação: Isobárica: pressão constante � Isotérmica: temperatura constante � Isocórica ou Isométrica, isovolumétrica: volume constante �

Lei geral dos gases perfeitos A expressão que determina a lei geral para os gases perfeitos pode ser vista da seguinte forma: Onde po, Vo e To são respectivamente a pressão inicial, volume inicial e temperatura inicial. Essa é uma expressão que é utilizada para quando as variáveis de um gás apresentarem variações. No estudo dos gases utiliza-se a escala Kelvin (K), cuja fórmula de conversão em relação à temperatura em graus Celsius (C) é: TK = TC+273

Lei de Boyle Segundo a lei, quando um gás sofre uma transformação isotérmica ( temperatura constante ), a pressão dele é inversamente proporcional ao volume ocupado. Dessa lei obtemos que como To = T temos que: � � po. Vo = p. V EX: Certo gás contido em um recipiente de 1 m³ com êmbolo exerce uma pressão de 250 Pa. Ao ser comprimido isotérmicamente a um volume de 0, 6 m³ qual será a pressão exercida pelo gás?

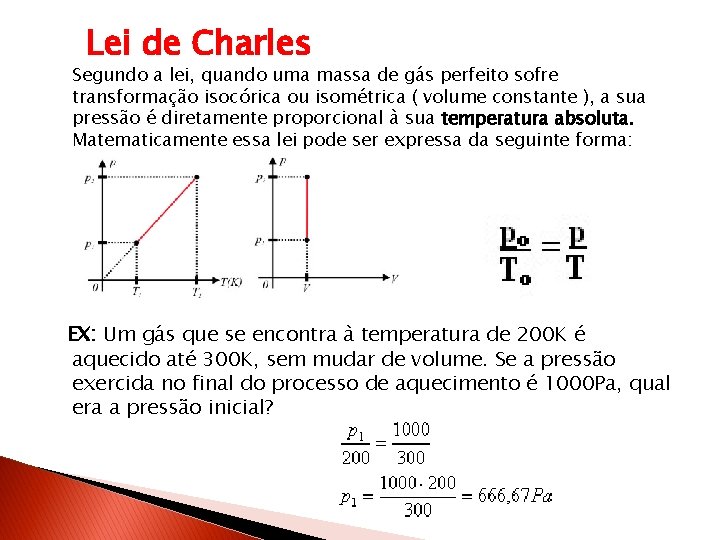
Lei de Charles Segundo a lei, quando uma massa de gás perfeito sofre transformação isocórica ou isométrica ( volume constante ), a sua pressão é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma: EX: Um gás que se encontra à temperatura de 200 K é aquecido até 300 K, sem mudar de volume. Se a pressão exercida no final do processo de aquecimento é 1000 Pa, qual era a pressão inicial?

Lei de Gay- Lussac Segundo a lei, quando um gás sofre uma transformação isobárica ( pressão constante ) o volume do gás é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma: EX: Um gás de volume 0, 5 m³ à temperatura de 20ºC é aquecido até a temperatura de 70ºC. Qual será o volume ocupado por ele, se esta transformação acontecer sob pressão constante?