ESTRUTURA ATMICA Profa Karen ATIVIDADE VDEO ELETROSFERA DO



















































- Slides: 58

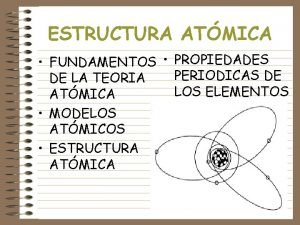
ESTRUTURA ATÔMICA Profa. Karen





















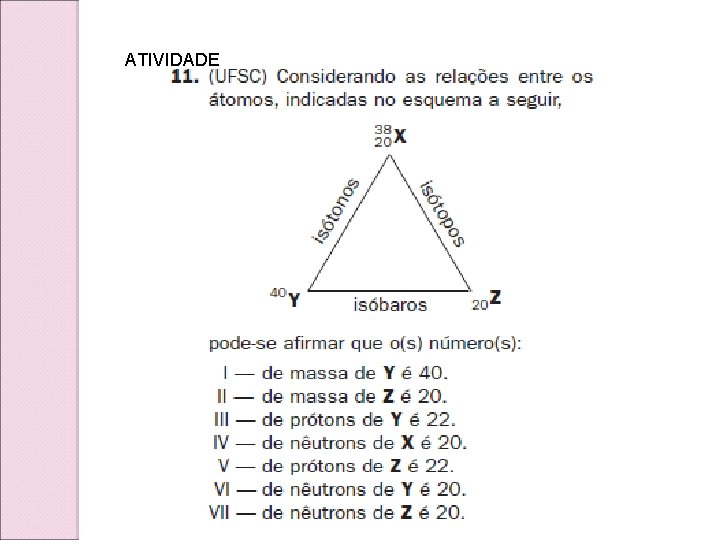
ATIVIDADE






VÍDEO


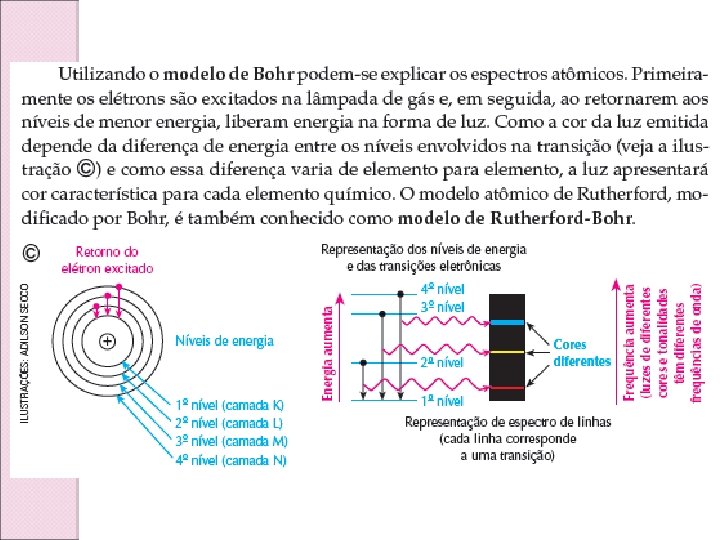
ELETROSFERA DO ÁTOMO Em torno do núcleo do átomo temos uma região denominada de eletrosfera que é dividida em 7 partes chamada camadas eletrônicas ou níveis de energia. Do núcleo para fora estas camadas são representadas pelas letras K, L, M, N, O, P e Q. Em cada camada poderemos encontrar um número máximo de elétrons, que são:



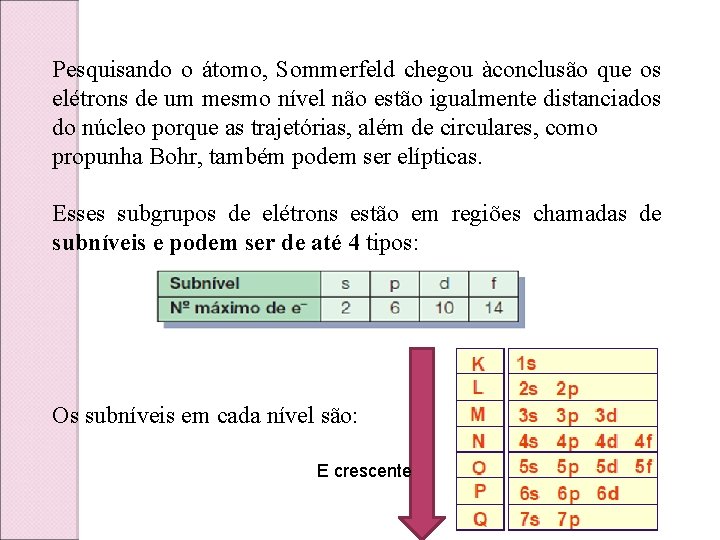
Pesquisando o átomo, Sommerfeld chegou àconclusão que os elétrons de um mesmo nível não estão igualmente distanciados do núcleo porque as trajetórias, além de circulares, como propunha Bohr, também podem ser elípticas. Esses subgrupos de elétrons estão em regiões chamadas de subníveis e podem ser de até 4 tipos: Os subníveis em cada nível são: E crescente


DISTRIBUIÇÃO ELETRÔNICA O átomo de cálcio possui número atômico 20, sua distribuição eletrônica, nos subníveis será: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 O átomo de cobalto tem número atômico 27, sua distribuição eletrônica, nos subníveis será: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 7

DISTRIBUIÇÃO ELETRÔNICA DE ÍONS Para os cátions devemos distribuir os elétrons como se eles fossem neutros e, em seguida, da última camada retirar os elétrons perdidos. Fe 2+ (Z = 26) Configuração normal: 1 s 2, 2 p 6, 3 s 2, 3 p 6, 4 s 2, 3 d 6. Retirando 2 elétrons do último nível (nível 4) Configuração do cátion: (1 s 2, 2 p 6, 3 s 2, 3 p 6, 3 d 6) 2+ Para os ânions devemos adicionar os elétrons ganhos aos já existentes no átomo e, em seguida distribuir o total. S 2 - (Z = 16): 16 + 2 = 18 elétrons. Configuração do íon: (1 s 2, 2 p 6, 3 s 2, 3 p 6) 2 –





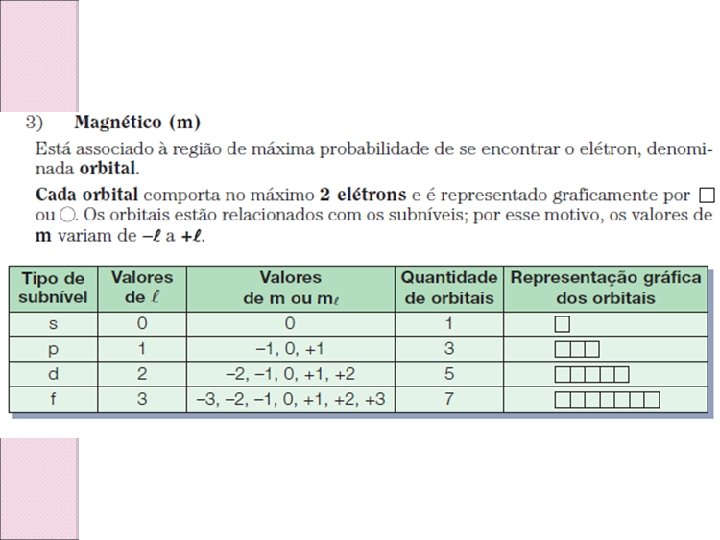
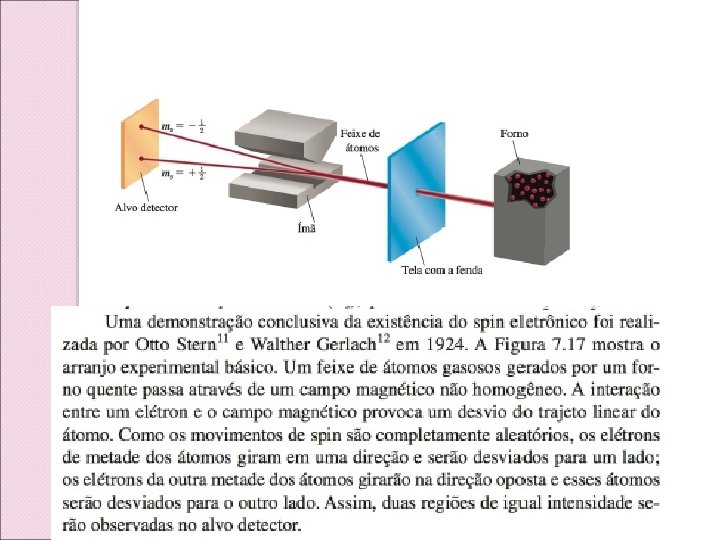
Caracterização do elétron: Números quânticos





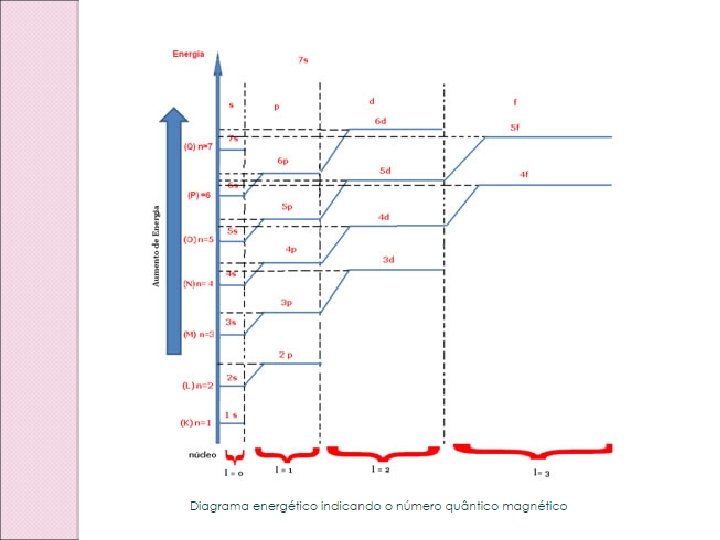
Subnivel mais energético: Números quânticos principal e azimutal. A energia potencial está relacionada ao número quântico principal, que fornece a distância do elétron ao núcleo. A energia cinética está relacionada ao número quântico secundário (azimutal), que fornece a forma do orbital, o que caracteriza o movimento do elétron. Então, teremos a relação: 1 - Quanto maior a soma (n + l), mais energético é o conjunto. 2 - Quando a soma (n + l) é igual para conjuntos de subníveis e níveis diferentes, terá maior energia o conjunto que apresentar maior valor de n.

Os subníveis são preenchidos em ordem crescente de energia (ordem energética). Linus Pauling descobriu que a energia dos subníveis cresce na ordem: 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d. . .


EXEMPLO:









 Para levantar 500kg emprega-se uma alavanca
Para levantar 500kg emprega-se uma alavanca Ordem energetica
Ordem energetica Poema x
Poema x Diagrama de linnus pauling
Diagrama de linnus pauling Eletrosfera
Eletrosfera Eletrosfera
Eletrosfera Internet profa
Internet profa Profa ma
Profa ma Internet profa
Internet profa Multiplicaciones con decimales
Multiplicaciones con decimales Www.profa
Www.profa Profa campis
Profa campis Comisin
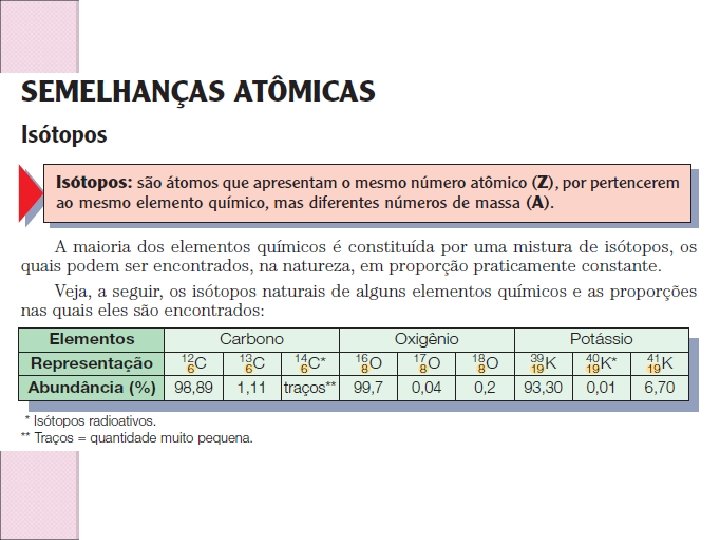
Comisin Masa atmica
Masa atmica Atmica
Atmica Atmica
Atmica Joseph thomson
Joseph thomson Atmica
Atmica Atmica
Atmica Atomizadores continuos
Atomizadores continuos Atmica
Atmica Masa atmica
Masa atmica Foto do 8 ano
Foto do 8 ano Texto sobre a arte rupestre com atividade
Texto sobre a arte rupestre com atividade Os fluxos financeiros descrevem a atividade economica
Os fluxos financeiros descrevem a atividade economica Atividade
Atividade Atividade orientadora de ensino
Atividade orientadora de ensino Vamos fazer
Vamos fazer Inovação no uso dos recursos naturais e matérias-primas
Inovação no uso dos recursos naturais e matérias-primas Sitio ativo
Sitio ativo Atividade de projeto de vida 7 ano
Atividade de projeto de vida 7 ano O q é geografia
O q é geografia Atividades relative pronouns
Atividades relative pronouns Atividade
Atividade O que é modo verbal
O que é modo verbal Sopro no coração
Sopro no coração Atividade adaptada de porcentagem
Atividade adaptada de porcentagem Quantas calorias gasta estudar
Quantas calorias gasta estudar Quem 1
Quem 1 Sonhar com onça pintada
Sonhar com onça pintada Texto sobre dança com atividades
Texto sobre dança com atividades Formula harris benedict fator atividade
Formula harris benedict fator atividade Exercícios sequência recursiva
Exercícios sequência recursiva Soap exemplo
Soap exemplo Efeitos cromáticos
Efeitos cromáticos Ler texto abaixo
Ler texto abaixo Texto dramático 3 ano fundamental
Texto dramático 3 ano fundamental De acordo com a atividade anterior responda
De acordo com a atividade anterior responda Actividade laboratorial osmose relatório
Actividade laboratorial osmose relatório Atividade
Atividade Horizontal resposta
Horizontal resposta Leia as frases
Leia as frases Superpoderes projeto de vida
Superpoderes projeto de vida Potenciação 6 ano
Potenciação 6 ano Atividade renascimento 7 ano
Atividade renascimento 7 ano Mais de 25 séculos após
Mais de 25 séculos após Atividade sobre a luz e os corpos 3 ano
Atividade sobre a luz e os corpos 3 ano Noite estrelada
Noite estrelada Poluio
Poluio