Estructura de Lewis Profesor Richard Salazar Qumica Unidad






- Slides: 10

Estructura de Lewis Profesor Richard Salazar Química Unidad: Estudio y organización de la materia. Objetivo: OA 14: Usar la tabla perio dica como un modelo para predecir las propiedades relativas de los elementos qui micos basa ndose en los patrones de sus a tomos, considerando: ∙ El nu mero ato mico. ∙ La masa ato mica. ∙ La conductividad ele ctrica. ∙ La conductividad te rmica. ∙ El brillo.

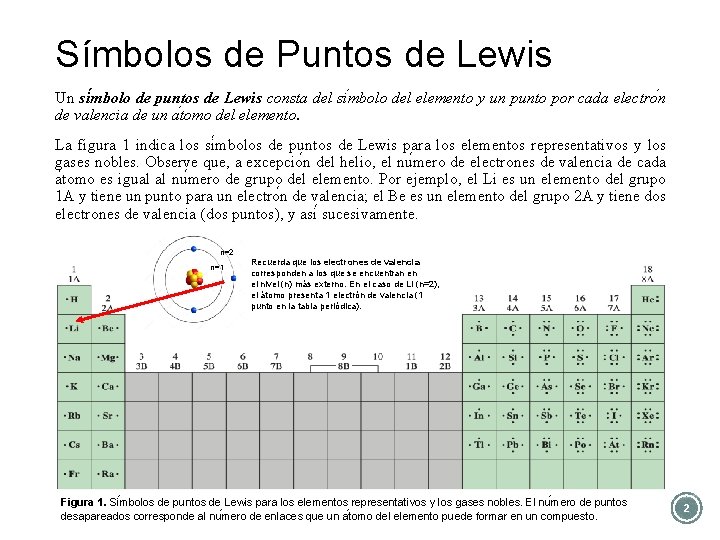
Símbolos de Puntos de Lewis Un si mbolo de puntos de Lewis consta del si mbolo del elemento y un punto por cada electro n de valencia de un a tomo del elemento. La figura 1 indica los si mbolos de puntos de Lewis para los elementos representativos y los gases nobles. Observe que, a excepcio n del helio, el nu mero de electrones de valencia de cada a tomo es igual al nu mero de grupo del elemento. Por ejemplo, el Li es un elemento del grupo 1 A y tiene un punto para un electro n de valencia; el Be es un elemento del grupo 2 A y tiene dos electrones de valencia (dos puntos), y asi sucesivamente. n=2 n=1 Recuerda que los electrones de valencia corresponden a los que se encuentran en el nivel (n) más externo. En el caso de Li (n=2), el átomo presenta 1 electrón de valencia (1 punto en la tabla periódica). Figura 1. Si mbolos de puntos de Lewis para los elementos representativos y los gases nobles. El nu mero de puntos desapareados corresponde al nu mero de enlaces que un a tomo del elemento puede formar en un compuesto. 2

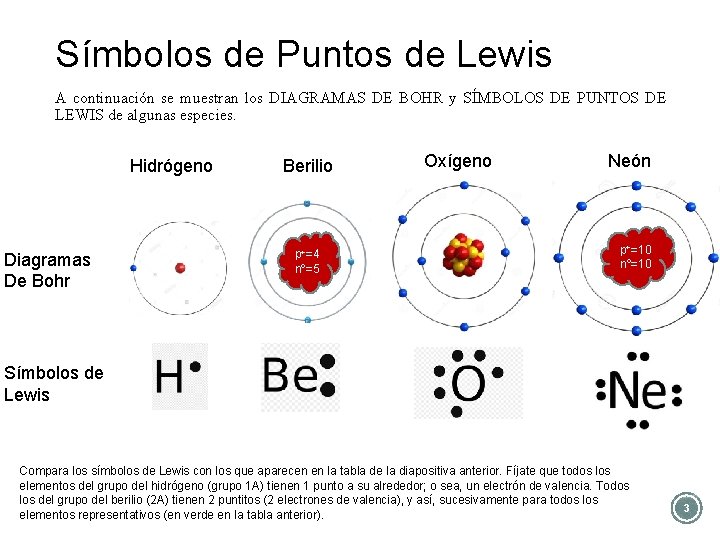
Símbolos de Puntos de Lewis A continuación se muestran los DIAGRAMAS DE BOHR y SÍMBOLOS DE PUNTOS DE LEWIS de algunas especies. Hidrógeno Diagramas De Bohr Berilio p+=4 nº=5 Oxígeno Neón p+=10 nº=10 Símbolos de Lewis Compara los símbolos de Lewis con los que aparecen en la tabla de la diapositiva anterior. Fíjate que todos los elementos del grupo del hidrógeno (grupo 1 A) tienen 1 punto a su alrededor; o sea, un electrón de valencia. Todos los del grupo del berilio (2 A) tienen 2 puntitos (2 electrones de valencia), y así, sucesivamente para todos los elementos representativos (en verde en la tabla anterior). 3

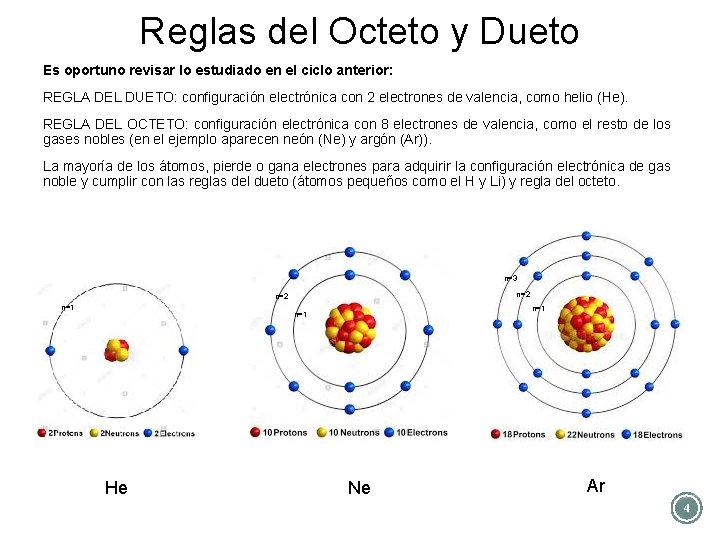
Reglas del Octeto y Dueto Es oportuno revisar lo estudiado en el ciclo anterior: REGLA DEL DUETO: configuración electrónica con 2 electrones de valencia, como helio (He). REGLA DEL OCTETO: configuración electrónica con 8 electrones de valencia, como el resto de los gases nobles (en el ejemplo aparecen neón (Ne) y argón (Ar)). La mayoría de los átomos, pierde o gana electrones para adquirir la configuración electrónica de gas noble y cumplir con las reglas del dueto (átomos pequeños como el H y Li) y regla del octeto. n=3 n=2 n=1 n=1 He Ne Ar 4

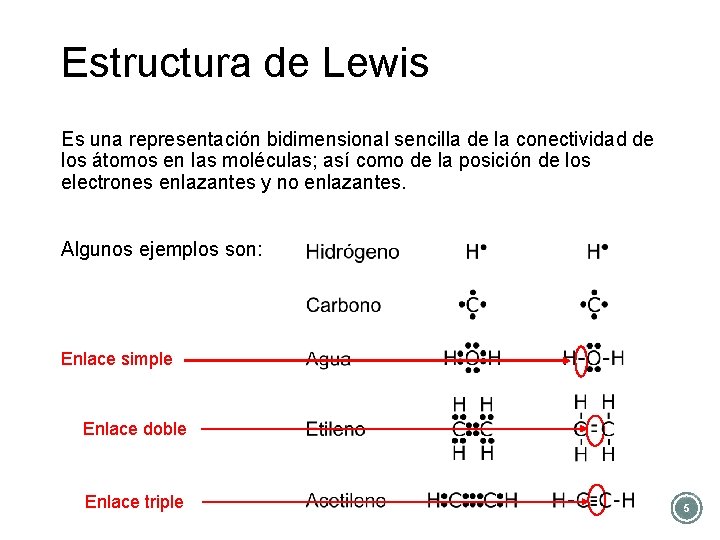
Estructura de Lewis Es una representación bidimensional sencilla de la conectividad de los átomos en las moléculas; así como de la posición de los electrones enlazantes y no enlazantes. Algunos ejemplos son: Enlace simple Enlace doble Enlace triple 5

Estructuras de Lewis Figura 1 6

Ejemplo 1 7

Ejemplo 2 Enlace doble 8

Te toca Mira todo el video ▪ 9

Good Job, Congratulations 10