ESTRATEGIA DE PROPAGACIN in vitro DE Aechmea fasciata


















- Slides: 38

ESTRATEGIA DE PROPAGACIÓN in vitro DE Aechmea fasciata PARA LA REGENERACIÓN DE PLANTAS COMPLETAS. Previa a la obtención de Grado Académico o Título de: INGENIERA EN BIOTECNOLOGÍA R. Valeria Vallejo T. Directora: M. Sc. Mónica Jadán Codirector: Ing. Pedro Romero

Introducción BROMELIAS Plantas monocotiledóneas originarias del continente americano. Incluye 56 géneros, 3. 143 especies y subespecies, más de la mitad son epífitas. Proveen de un sitio para vivir a insectos, ácaros, crustáceos, moluscos e incluso pequeños anfibios. • En Ecuador, la única cultivada es la piña, con aproximadamente 600 Ha. • Tillandsia dyeriana se encuentra en los manglares • Llamadas también huaicundos

Formulación del problema • Tala indiscriminada Justificación de bosques. • Propagación in vitro: • Mayor número de plantas en menor tiempo. • Pérdida de endémicas. • Crecimiento lento especies • Plantaciones uniformes. • Plantas sin microorganismos. • Interés económico

Objetivos • General Establecer una estrategia de propagación in vitro de Aechmea fasciata para la regeneración de plantas completas. Específicos Determinar el protocolo de desinfección más adecuado para la introducción de explantes de Aechmea fasciata. • Establecer la dosis óptima de reguladores de crecimiento en la fase de introducción que permita la adaptación de los explantes. Determinar la dosis óptima de BAP, corte del explante y consistencia del medio en la fase de multiplicación que permitan obtener el mayor número de brotes. Estudiar el efecto de dos auxinas en la fase de enraizamiento, que permitan la obtención del mayor número de plantas enraizadas. Determinar la estrategia más económica para la regeneración de Aechmea fasciata in vitro.

Marco teórico Aechmea fasciata Morfologías: • Plantas terrestres (Ananas, Pitcairnia) • Plantas epifitas con reserva de agua (Neoregelia, Aechmea) • Plantas epifitas sin tanque (Tillansia recurvata, T. circinata) • 140 especies distribuidas desde México hacia Sudamérica. • Se presenta como roseta de largas hojas, márgenes aserrados, inflorescencia en espiga. • Planta ornamental. • Las hojas están cubiertas de tricomas. • En Ecuador existen 447 especies, incluyendo 152 especies endémicas, agrupadas en 13 géneros (Manzanares 2000, Valencia & León Yánez 2002). • Muestran gran adaptabilidad y resistencia a condiciones ambientales extremas (Miranda et al. 2007). • El ciclo de vida abarca de 2 a 30 años.

Cultivo in vitro de tejidos vegetales • Cultivar plantas dentro de un frasco de vidrio en un ambiente artificial. • Características fundamentales: la asepsia y el control de los factores que afectan el crecimiento. Medio de cultivo 1. Macroelementos y microelementos C, H, P, K, S, Ca, Mg – B, Zn, Mn, Fe, Cl 2. Reguladores de crecimiento. - Auxinas Agrandamiento y alargamiento celular, formación de raíces laterales y adventicias, retardo en la abscisión de hojas y frutos, entre otros efectos. - Citoquinas El proceso de división celular, la diferenciación en tejidos vegetales, la modificación de la dominancia apical y diferenciación de tallos. 3. Agentes gelatinizadores Agarosa y agaropectina. 4. Fuente de carbono Sacarosa 5. Vitaminas Tiamina, piridoxina, ác. nicotínico, mioinositol 6. Factores físicos Temperatura, luz, p. H

Propagación in vitro de Aechmea fasciata Etapa 0: Selección de la planta donadora y preparación. Etapa 1: Establecimiento del medio de cultivo in vitro. Etapa 2: Multiplicación. Etapa 3: Enraizamiento. Etapa 4: Aclimatación de las plántulas.

Materiales y métodos La investigación se realizó en los Laboratorios de Servicios Agrobiotecnológicos “AGROBIOTECH”, ubicados en la Provincia de Pichincha, Cantón Rumiñahui. El material vegetal utilizado fueron hijuelos de Aechmea fasciata proporcionado en el laboratorio.

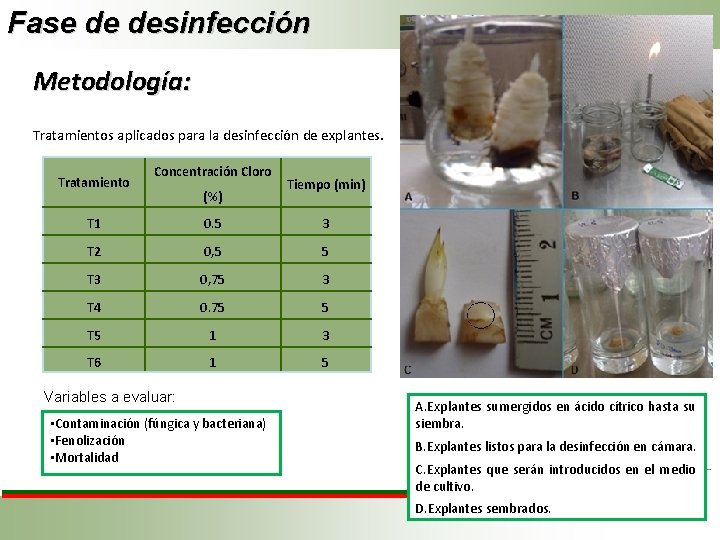
Fase de desinfección Metodología: Tratamientos aplicados para la desinfección de explantes. Tratamiento Concentración Cloro (%) Tiempo (min) T 1 0. 5 3 T 2 0, 5 5 T 3 0, 75 3 T 4 0. 75 5 T 5 1 3 T 6 1 5 Variables a evaluar: • Contaminación (fúngica y bacteriana) • Fenolización • Mortalidad A. Explantes sumergidos en ácido cítrico hasta su siembra. B. Explantes listos para la desinfección en cámara. C. Explantes que serán introducidos en el medio de cultivo. D. Explantes sembrados.

Fase de introducción Tratamientos aplicados para la fase de introducción de explantes. Tratamiento ANA (mg/L) AIB (mg/L) 1 0 0 0 2 0 0 0, 1 3 0 0, 1 0 4 0 0, 1 5 0, 1 0 0 6 0, 1 0 0, 1 7 0, 1 0 8 0, 1 Metodología: Variables a evaluar: • Adaptabilidad. • Contaminación (fúngica y bacteriana). • Longitud del explante. A)Brote de A. fasciata a los empezando la fase. B)Brote de A. fasciata a los 20 días de la fase. C)Brote de A. fasciata lista para la siguiente fase.

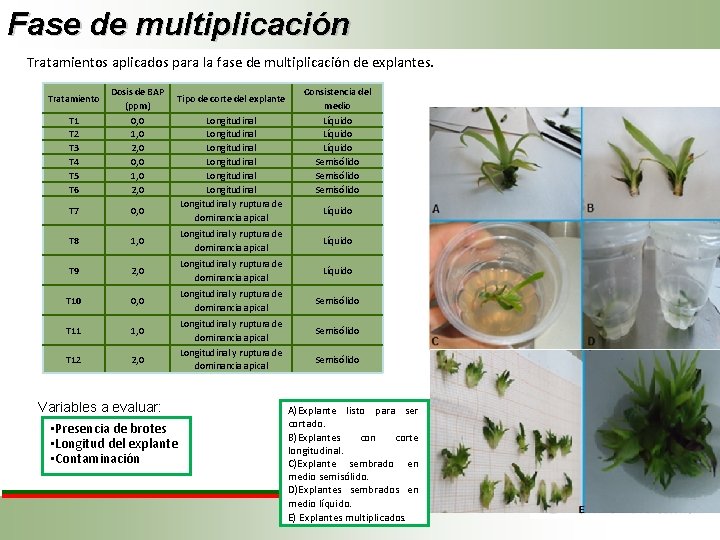
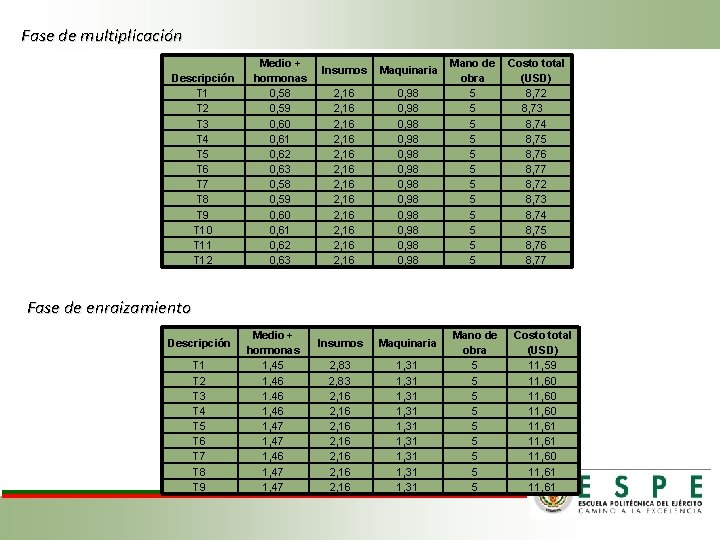
Fase de multiplicación Tratamientos aplicados para la fase de multiplicación de explantes. T 1 T 2 T 3 T 4 T 5 T 6 Dosis de BAP (ppm) 0, 0 1, 0 2, 0 T 7 0, 0 T 8 1, 0 Longitudinal y ruptura de dominancia apical Líquido T 9 2, 0 Longitudinal y ruptura de dominancia apical Líquido T 10 0, 0 Longitudinal y ruptura de dominancia apical Semisólido T 11 1, 0 T 12 2, 0 Tratamiento Tipo de corte del explante Variables a evaluar: • Presencia de brotes • Longitud del explante • Contaminación Longitudinal Longitudinal y ruptura de dominancia apical Longitudinal y ruptura de dominancia apical Consistencia del medio Líquido Semisólido Líquido Semisólido A)Explante listo para ser cortado. B)Explantes con corte longitudinal. C)Explante sembrado en medio semisólido. D)Explantes sembrados en medio líquido. E) Explantes multiplicados.

Fase de enraizamiento Tratamientos aplicados para la fase de enraizamiento de explantes. Tratamiento T 1 T 2 T 3 T 4 T 5 T 6 T 7 T 8 T 9 Dosis de AIB Dosis de AIA (ppm) 0, 0 0, 5 1, 0 0, 0 0, 5 1, 0 Variables a evaluar: • Longitud de la raíz. • Altura del explante. • Color del explante. A)Explante con nuevos brotes. B)Brotes separados del explante principal. C)Explantes sembrados en el medio de enraizamiento. D)Explantes sembrados en los 9 tratamientos. E)Explantes con raíces.

RESULTADOS Y DISCUSIÓN

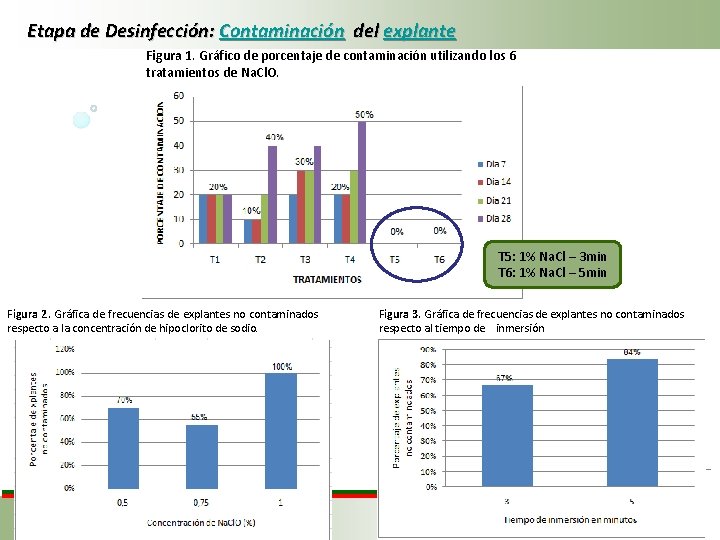
Etapa de Desinfección: Contaminación del explante Figura 1. Gráfico de porcentaje de contaminación utilizando los 6 tratamientos de Na. Cl. O. T 5: 1% Na. Cl – 3 min T 6: 1% Na. Cl – 5 min Figura 2. Gráfica de frecuencias de explantes no contaminados respecto a la concentración de hipoclorito de sodio. Figura 3. Gráfica de frecuencias de explantes no contaminados respecto al tiempo de inmersión

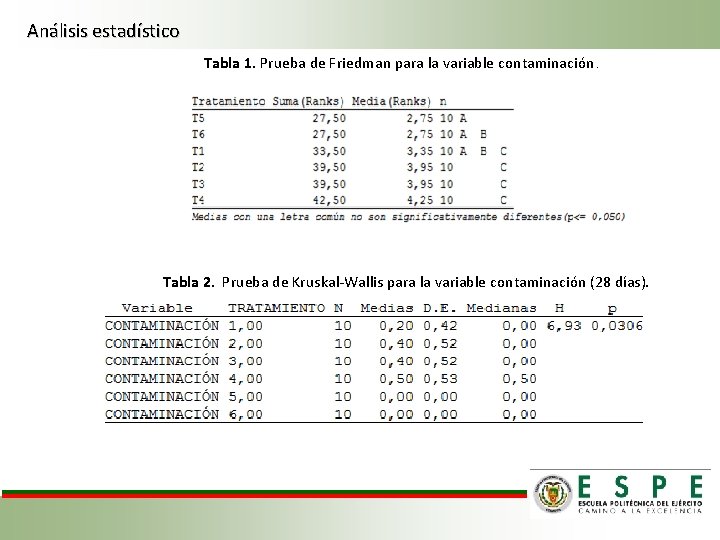
Análisis estadístico Tabla 1. Prueba de Friedman para la variable contaminación. Tabla 2. Prueba de Kruskal-Wallis para la variable contaminación (28 días).

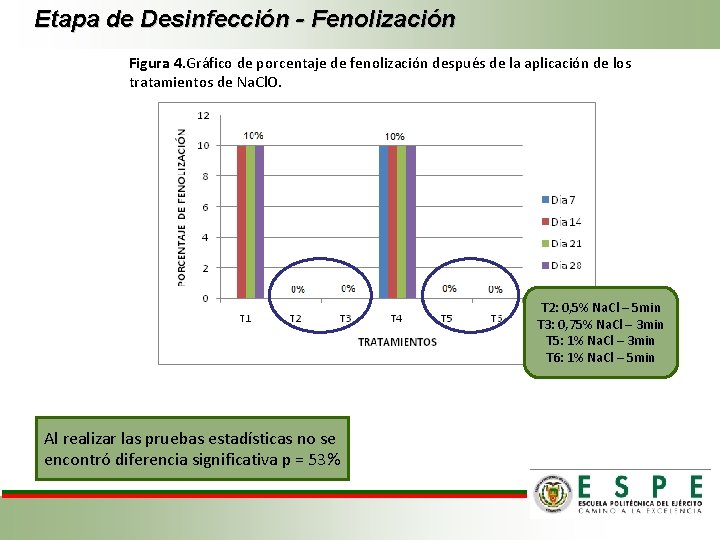
Etapa de Desinfección - Fenolización Figura 4. Gráfico de porcentaje de fenolización después de la aplicación de los tratamientos de Na. Cl. O. T 2: 0, 5% Na. Cl – 5 min T 3: 0, 75% Na. Cl – 3 min T 5: 1% Na. Cl – 3 min T 6: 1% Na. Cl – 5 min Al realizar las pruebas estadísticas no se encontró diferencia significativa p = 53%

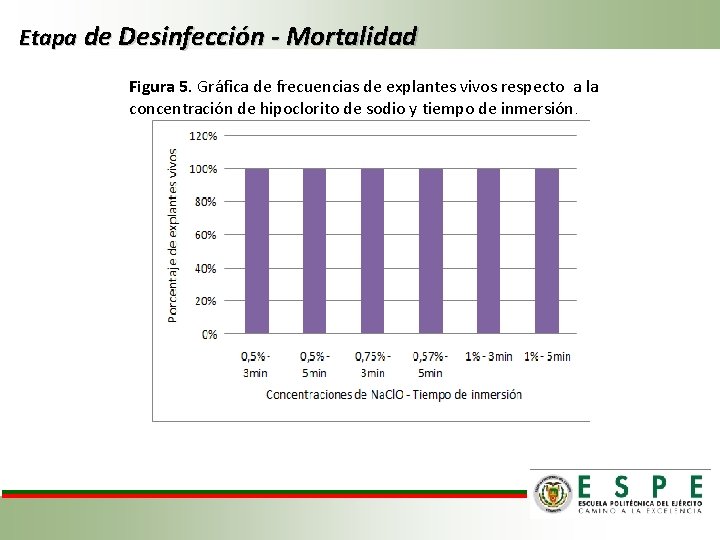
Etapa de Desinfección - Mortalidad Figura 5. Gráfica de frecuencias de explantes vivos respecto a la concentración de hipoclorito de sodio y tiempo de inmersión.

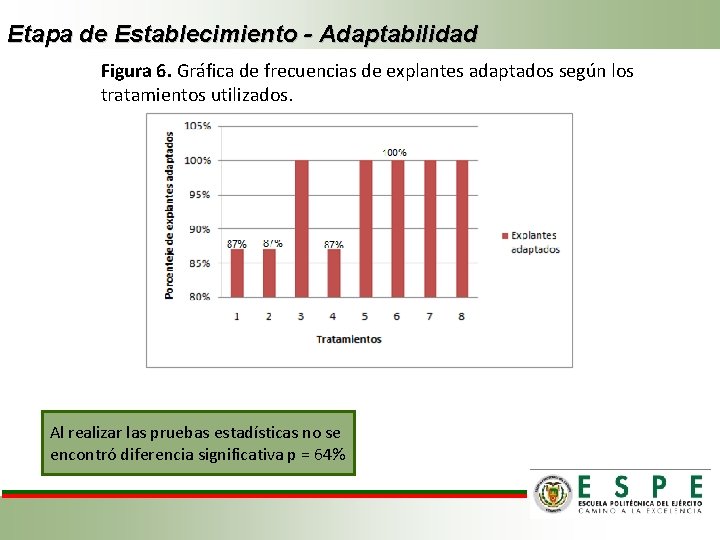
Etapa de Establecimiento - Adaptabilidad Figura 6. Gráfica de frecuencias de explantes adaptados según los tratamientos utilizados. Al realizar las pruebas estadísticas no se encontró diferencia significativa p = 64%

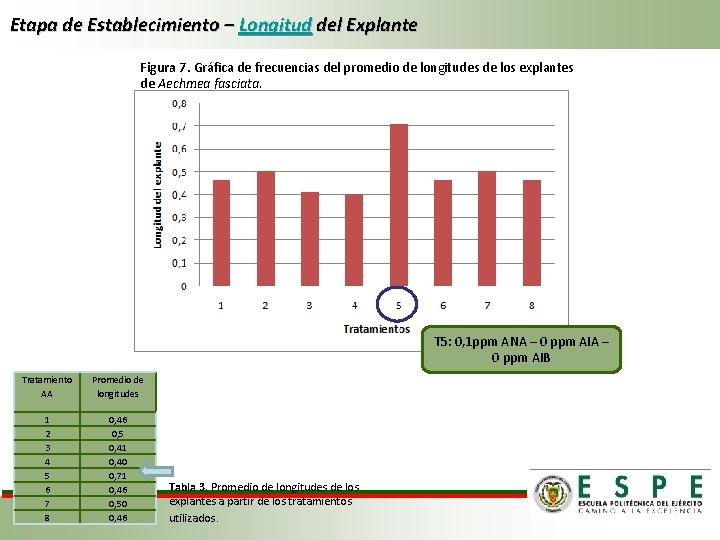
Etapa de Establecimiento – Longitud del Explante Figura 7. Gráfica de frecuencias del promedio de longitudes de los explantes de Aechmea fasciata. T 5: 0, 1 ppm ANA – 0 ppm AIB Tratamiento AA Promedio de longitudes 1 2 3 4 5 6 7 8 0, 46 0, 5 0, 41 0, 40 0, 71 0, 46 0, 50 0, 46 Tabla 3. Promedio de longitudes de los explantes a partir de los tratamientos utilizados.

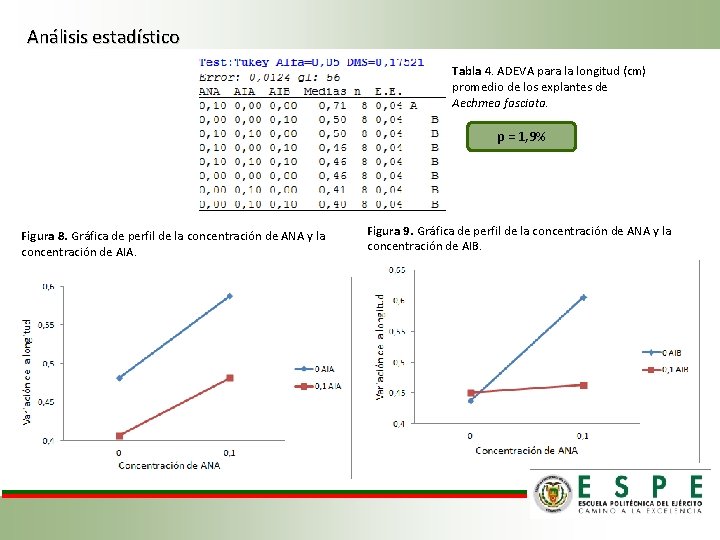
Análisis estadístico Tabla 4. ADEVA para la longitud (cm) promedio de los explantes de Aechmea fasciata. p = 1, 9% Figura 8. Gráfica de perfil de la concentración de ANA y la concentración de AIA. Figura 9. Gráfica de perfil de la concentración de ANA y la concentración de AIB.

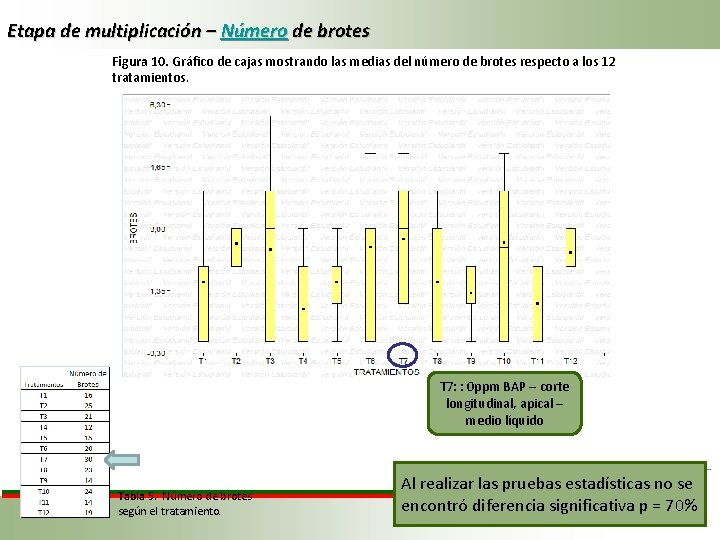
Etapa de multiplicación – Número de brotes Figura 10. Gráfico de cajas mostrando las medias del número de brotes respecto a los 12 tratamientos. T 7: : 0 ppm BAP – corte longitudinal, apical – medio líquido Tabla 5. Número de brotes según el tratamiento. Al realizar las pruebas estadísticas no se encontró diferencia significativa p = 70%

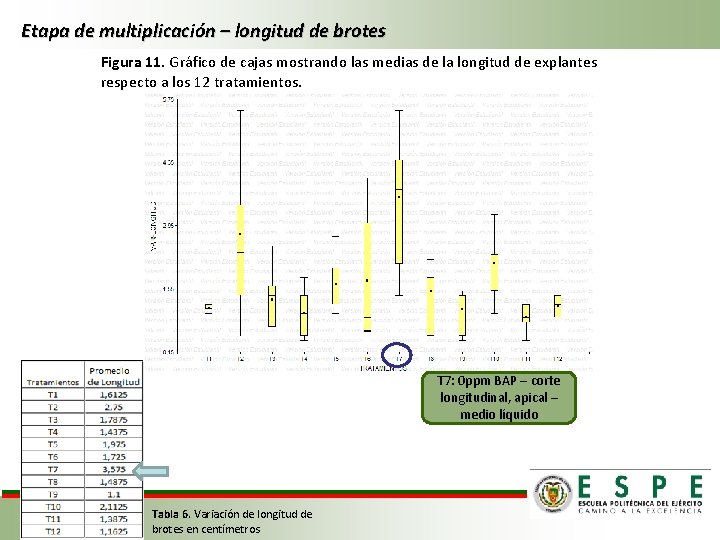
Etapa de multiplicación – longitud de brotes Figura 11. Gráfico de cajas mostrando las medias de la longitud de explantes respecto a los 12 tratamientos. T 7: 0 ppm BAP – corte longitudinal, apical – medio líquido Tabla 6. Variación de longitud de brotes en centímetros

Etapa de multiplicación – longitud de brotes Análisis estadístico Tabla 7. Prueba LSD de Fisher para la interacción de BAP, tipo de corte y consistencia del medio, respecto a la longitud del explante.

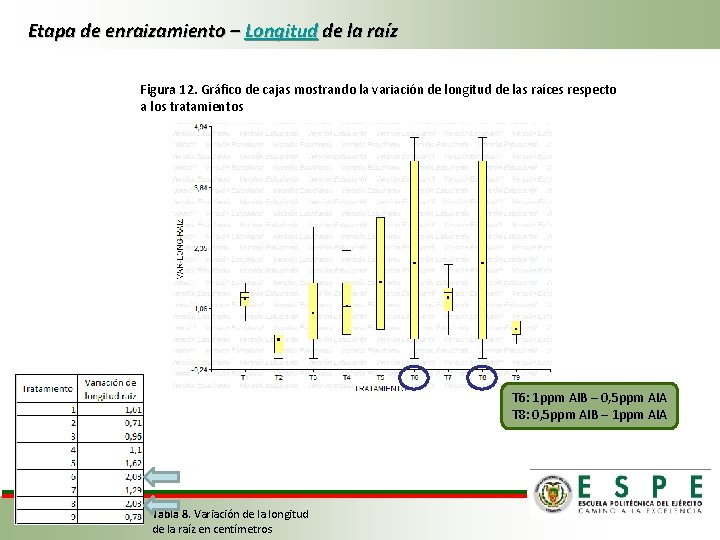
Etapa de enraizamiento – Longitud de la raíz Figura 12. Gráfico de cajas mostrando la variación de longitud de las raíces respecto a los tratamientos T 6: 1 ppm AIB – 0, 5 ppm AIA T 8: 0, 5 ppm AIB – 1 ppm AIA Tabla 8. Variación de la longitud de la raíz en centímetros

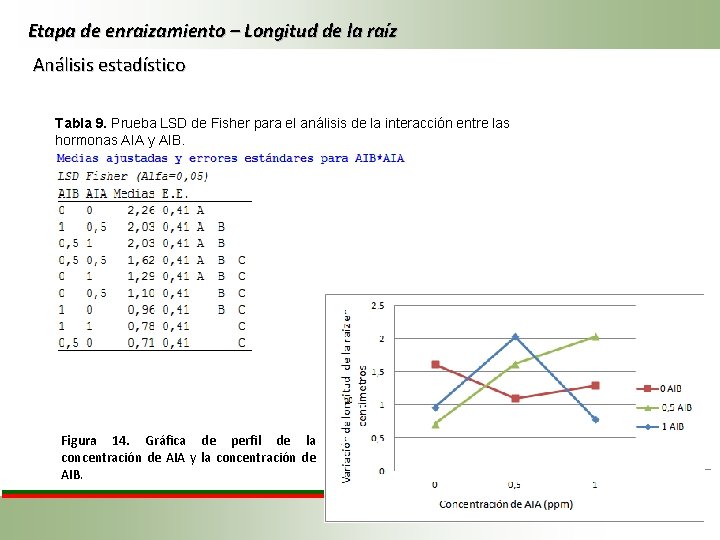
Etapa de enraizamiento – Longitud de la raíz Análisis estadístico Tabla 9. Prueba LSD de Fisher para el análisis de la interacción entre las hormonas AIA y AIB. Figura 14. Gráfica de perfil de la concentración de AIA y la concentración de AIB.

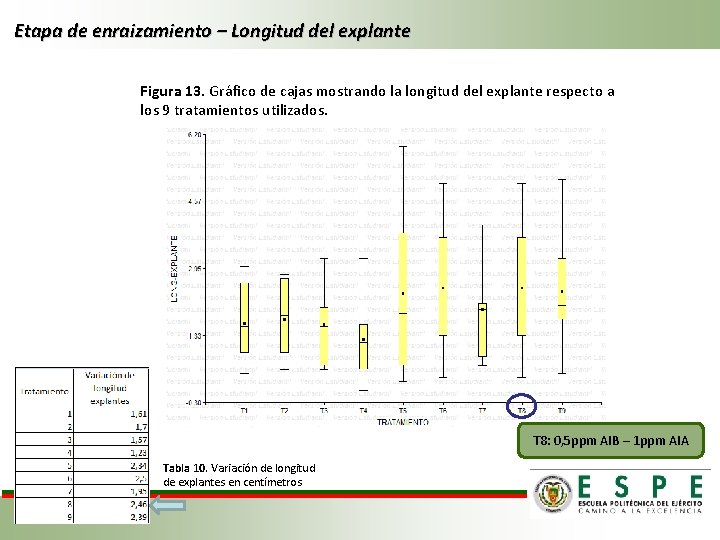
Etapa de enraizamiento – Longitud del explante Figura 13. Gráfico de cajas mostrando la longitud del explante respecto a los 9 tratamientos utilizados. T 8: 0, 5 ppm AIB – 1 ppm AIA Tabla 10. Variación de longitud de explantes en centímetros

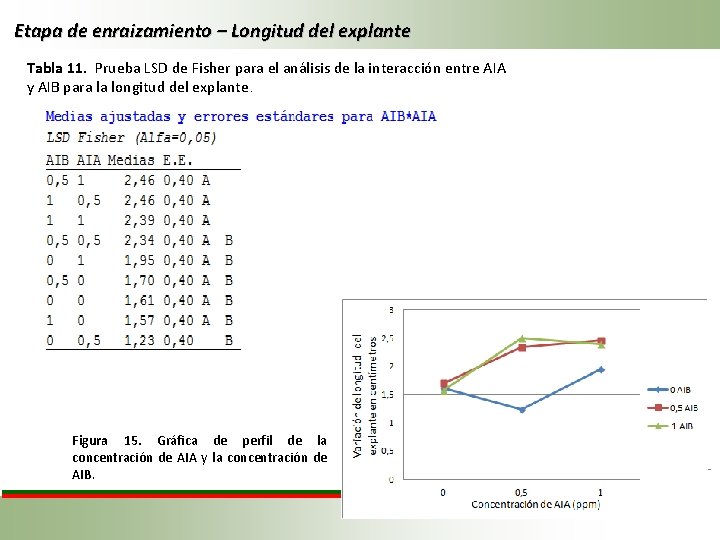
Etapa de enraizamiento – Longitud del explante Tabla 11. Prueba LSD de Fisher para el análisis de la interacción entre AIA y AIB para la longitud del explante. Figura 15. Gráfica de perfil de la concentración de AIA y la concentración de AIB.

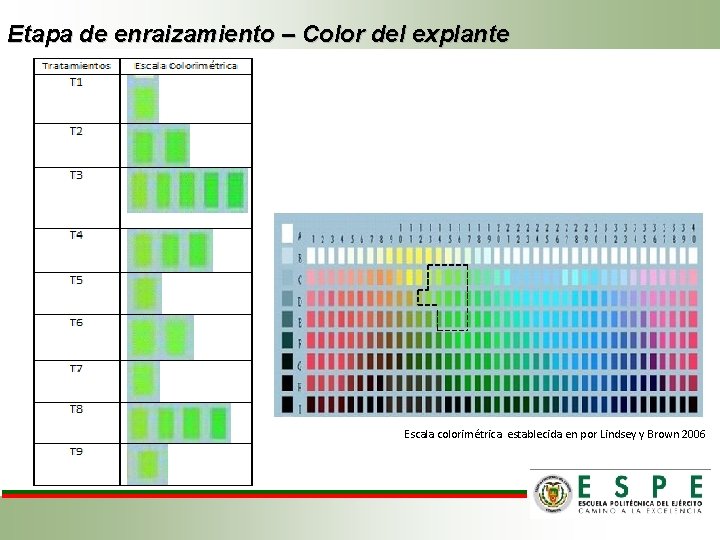
Etapa de enraizamiento – Color del explante Escala colorimétrica establecida en por Lindsey y Brown 2006

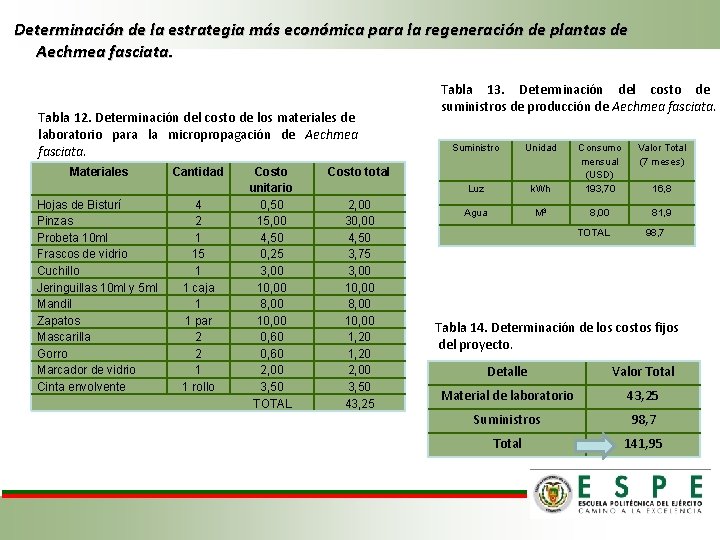
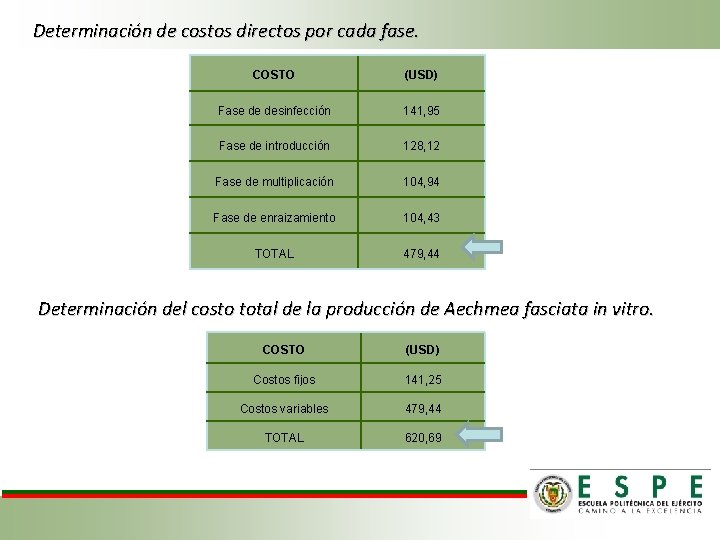
Determinación de la estrategia más económica para la regeneración de plantas de Aechmea fasciata. Tabla 12. Determinación del costo de los materiales de laboratorio para la micropropagación de Aechmea fasciata. Materiales Hojas de Bisturí Pinzas Probeta 10 ml Frascos de vidrio Cuchillo Jeringuillas 10 ml y 5 ml Mandil Zapatos Mascarilla Gorro Marcador de vidrio Cinta envolvente Cantidad 4 2 1 15 1 1 caja 1 1 par 2 2 1 1 rollo Costo unitario 0, 50 15, 00 4, 50 0, 25 3, 00 10, 00 8, 00 10, 00 0, 60 2, 00 3, 50 TOTAL Tabla 13. Determinación del costo de suministros de producción de Aechmea fasciata. Suministro Unidad Valor Total (7 meses) k. Wh Consumo mensual (USD) 193, 70 Luz Agua M 3 8, 00 81, 9 Costo total 2, 00 30, 00 4, 50 3, 75 3, 00 10, 00 8, 00 10, 00 1, 20 2, 00 3, 50 43, 25 TOTAL 16, 8 98, 7 Tabla 14. Determinación de los costos fijos del proyecto. Detalle Valor Total Material de laboratorio 43, 25 Suministros 98, 7 Total 141, 95

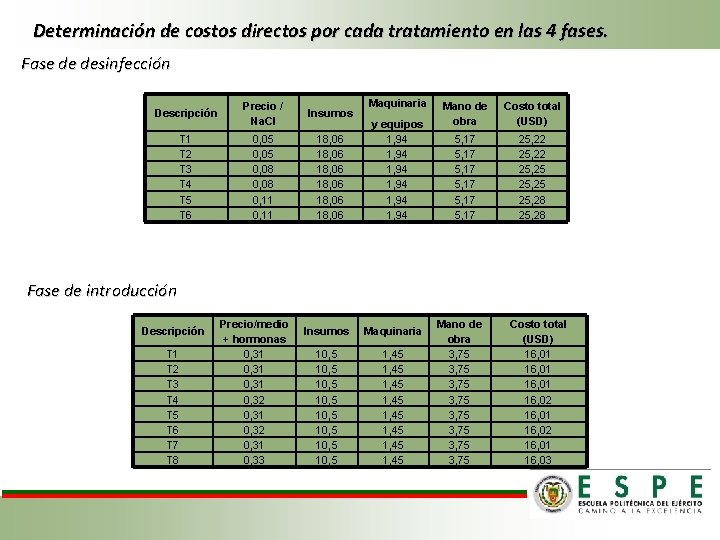
Determinación de costos directos por cada tratamiento en las 4 fases. Fase de desinfección Descripción Precio / Na. Cl Insumos T 1 T 2 T 3 T 4 T 5 T 6 0, 05 0, 08 0, 11 18, 06 18, 06 Maquinaria y equipos 1, 94 1, 94 Mano de obra Costo total (USD) 5, 17 5, 17 25, 22 25, 25 25, 28 Fase de introducción Descripción T 1 T 2 T 3 T 4 T 5 T 6 T 7 T 8 Precio/medio + hormonas 0, 31 0, 32 0, 31 0, 33 Insumos Maquinaria 10, 5 10, 5 1, 45 1, 45 Mano de obra 3, 75 3, 75 Costo total (USD) 16, 01 16, 02 16, 01 16, 03

Fase de multiplicación Descripción T 1 T 2 T 3 T 4 T 5 T 6 T 7 T 8 T 9 T 10 T 11 T 12 Medio + hormonas 0, 58 0, 59 0, 60 0, 61 0, 62 0, 63 Insumos Maquinaria 2, 16 2, 16 2, 16 0, 98 0, 98 0, 98 Mano de obra 5 5 5 Costo total (USD) 8, 72 8, 73 8, 74 8, 75 8, 76 8, 77 Fase de enraizamiento Descripción T 1 T 2 T 3 T 4 T 5 T 6 T 7 T 8 T 9 Medio + hormonas 1, 45 1, 46 1, 47 Insumos Maquinaria 2, 83 2, 16 2, 16 1, 31 1, 31 1, 31 Mano de obra 5 5 5 5 5 Costo total (USD) 11, 59 11, 60 11, 61

Determinación de costos directos por cada fase. COSTO (USD) Fase de desinfección 141, 95 Fase de introducción 128, 12 Fase de multiplicación 104, 94 Fase de enraizamiento 104, 43 TOTAL 479, 44 Determinación del costo total de la producción de Aechmea fasciata in vitro. COSTO (USD) Costos fijos 141, 25 Costos variables 479, 44 TOTAL 620, 69

CONCLUSIONES

• Una concentración de 1% de hipoclorito de sodio por un tiempo de cinco minutos de inmersión permite obtener explantes viables y libres de contaminación en el proceso de desinfección de Aechmea fasciata; es necesaria la aplicación de un antioxidante en el medio de cultivo para ayudar a que el explante no elimine fenoles de manera inmediata y pueda empezar a adaptarse al medio. • Los explantes adaptados al medio de cultivo empiezan a cambiar su color, de blanco a verde conforme avance su desarrollo. • La longitud del explante permitió establecer estadísticamente el mejor tratamiento de introducción debido a la diferencia significativa obtenida, donde el tratamiento adecuado fue T 5 (0, 1 mg. L-1 de ANA, 0 mg. L-1 de AIA y 0 mg. L-1 de AIB) alcanzando la mayor longitud. • El mayor número de brotes en la fase de multiplicación estuvo favorecido por el tratamiento que contenía el medio con sales M&S, suplementado con 0 mg. L-1 de la hormona BAP.

• La longitud del explante y el crecimiento de brotes presentan un mejor desarrollo en un medio M&S sin la adición de agar. • Las concentraciones de 0, 5 y 1 mg. L de AIA y AIB son las que favorecieron en un mayor tamaño tanto en la longitud de la raíz como en la longitud del tamaño del explante durante la fase de enraizamiento. • El color de los explantes se mantuvo en el mismo tono verde, indicando el avance de su desarrollo. • El uso de carbón activado provee un ambiente de oscuridad al medio de cultivo, aumentado en gran manera la generación de raíces. • El método de multiplicación para Aechmea fasciata presenta un costo para el mercado de 0, 76 centavos de dólar.

RECOMENDACIONES

• Es importante realizar ensayos previos para encontrar el tratamiento adecuado para la desinfección de las bromelias, sin olvidar que se debe eliminar toda la humedad que puede tener la planta. • Se debe tener mucho cuidado en el manejo de los explantes para no contaminarlos, así como se debe esterilizar bien los materiales, es importante cambiar las pinzas cada vez que se realice el trabajo en cámara. • Es necesario para un buen desarrollo del explante mantener controladas las condiciones ambientales a las que se encuentra la planta, ya un exceso de humedad o rayos solares puede dañar el explante. • Con el fin de disminuir el coeficiente de variación, se debería homogenizar el material vegetal, para que los explantes de A. fasciata que serán utilizados estén en igual condiciones. • Se recomienda realizar ensayos adicionales para la conservación de este material vegetal, ya que es una especie que se encuentra en peligro de extinción.

GRACIAS!
 Ukupni ige referentne vrednosti
Ukupni ige referentne vrednosti Procedure for isolation of cells for in vitro culture
Procedure for isolation of cells for in vitro culture Sap netweaver portal vitro
Sap netweaver portal vitro University of pittsburgh
University of pittsburgh Felice shieh
Felice shieh Wetboek familierecht
Wetboek familierecht Molécule simple
Molécule simple Dimensiones de estrategias
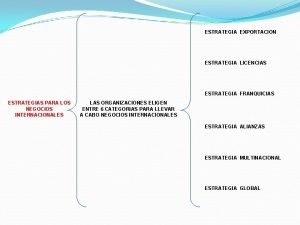
Dimensiones de estrategias Estrategia de diferenciacion
Estrategia de diferenciacion Que es coinstruccionales
Que es coinstruccionales Matriz de atractividad
Matriz de atractividad Estrategia de aprendizaje auditivo
Estrategia de aprendizaje auditivo Estrategia sanitaria de salud bucal
Estrategia sanitaria de salud bucal Hipermarcas
Hipermarcas Estrategia pni
Estrategia pni Estrategia de producto
Estrategia de producto Chandler alfred (1962). estructura y estrategia
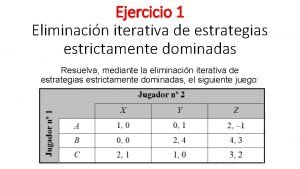
Chandler alfred (1962). estructura y estrategia Estrategias dominadas
Estrategias dominadas Participación estudiantil: somos pares
Participación estudiantil: somos pares Maxi maxi mini mini
Maxi maxi mini mini Estrategia sanitaria nacional de salud bucal
Estrategia sanitaria nacional de salud bucal Estrategia del especialista
Estrategia del especialista Champion challenger estrategia
Champion challenger estrategia Matriz de kraljic
Matriz de kraljic Estrategia intentada
Estrategia intentada Rayo es una palabra aguda grave o esdrujula
Rayo es una palabra aguda grave o esdrujula Plantilla propuesta redes sociales
Plantilla propuesta redes sociales Atributos de los productos
Atributos de los productos Que veo, que no veo, que infiero ejemplos
Que veo, que no veo, que infiero ejemplos Que es una estrategia metacognitiva
Que es una estrategia metacognitiva Ejemplo de análisis foda de una institución pública
Ejemplo de análisis foda de una institución pública Actividad curricular ejemplo
Actividad curricular ejemplo Pregunta pico ejemplos
Pregunta pico ejemplos Estrategia multidomestica
Estrategia multidomestica Estrategias de vida r y k
Estrategias de vida r y k Estrategia del talento humano
Estrategia del talento humano Estrategia fa (maxi-mini)
Estrategia fa (maxi-mini) Integracion vertical hacia atras
Integracion vertical hacia atras A estratégia do oceano azul
A estratégia do oceano azul