Estado Slido GA O L NO C E

















- Slides: 27

Estado Sólido GÍA O L NO C E T IA, TE C N E N I E CI AMB Y Por: Raquel Lópe Page 1

¿Cómo son los sólidos? v. Son cuerpos cuyas moléculas se encuentran unidas rígidamente entre sí, debido a que sus fuerzas de adhesión son mucho mayores que las de cohesión Page 2

Tipos de sólidos • Cristalinos: las partículas que los forman se encuentran en una disposición ordenada, fija y regular. Ej. Cuarzo y Diamante • Amorfos: las partículas no ocupan posiciones regulares. Ej. : hule y vidrio. Page 3

Por ejemplo: Figura N° 2: Pirita, Fluorita y Amatista, ejemplos de sólidos cristalinos. Page 4

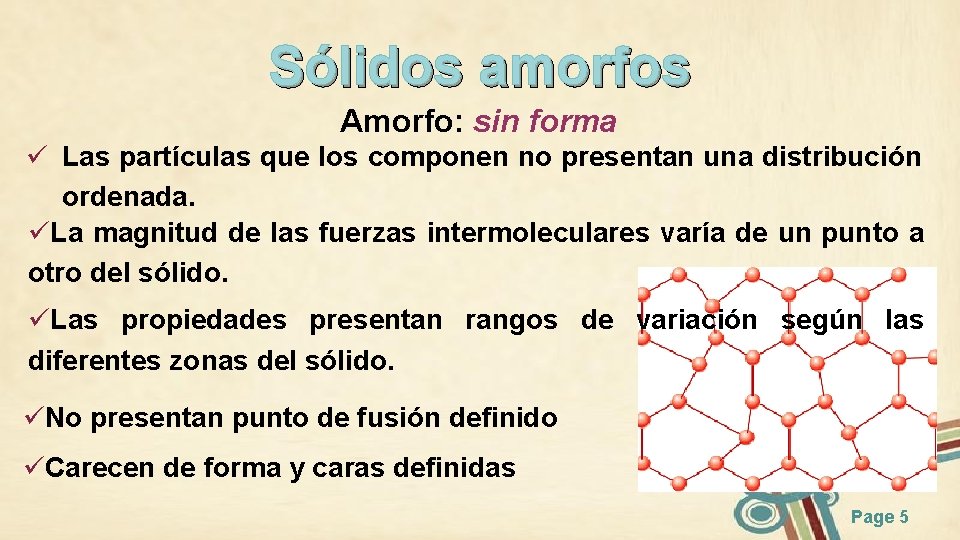
Sólidos amorfos Amorfo: sin forma ü Las partículas que los componen no presentan una distribución ordenada. üLa magnitud de las fuerzas intermoleculares varía de un punto a otro del sólido. üLas propiedades presentan rangos de variación según las diferentes zonas del sólido. üNo presentan punto de fusión definido üCarecen de forma y caras definidas Page 5

Sólido cristalino Cuarzo (Si. O 2) Sólido amorfo Vidrio Page 6

Las propiedades de un sólido dependerán de: üEl tipo de partículas que lo formen. üEl ordenamiento de las partículas. üLa naturaleza y magnitud de las fuerzas intermoleculares que existan entre ellas. Iónicos Covalentes Tipos de sólidos cristalinos Moleculares Metálicos Page 7

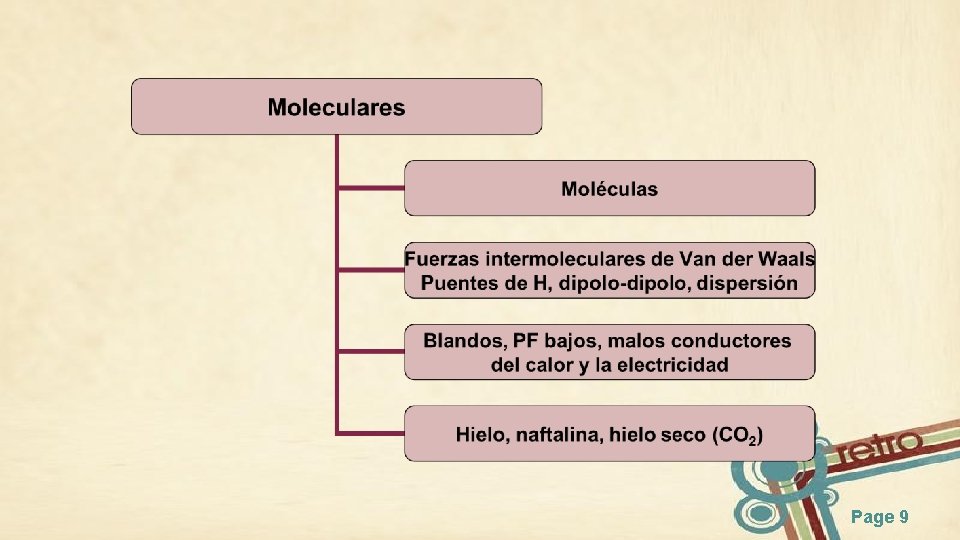
Sólidos Cristalinos Dependiendo del tipo de unión entre las partículas se pueden clasificar en: • • Moleculares (fuerzas intermoleculares) Iónicos (enlace iónico) Covalentes (enlace covalente) Metálicos (enlace metálico) Page 8

Page 9

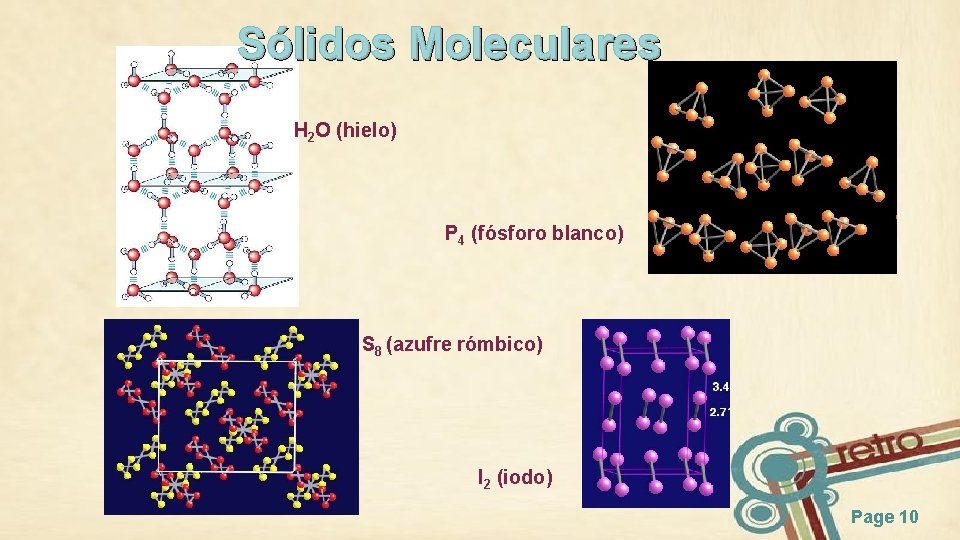
Sólidos Moleculares H 2 O (hielo) P 4 (fósforo blanco) S 8 (azufre rómbico) I 2 (iodo) Page 10

Page 11

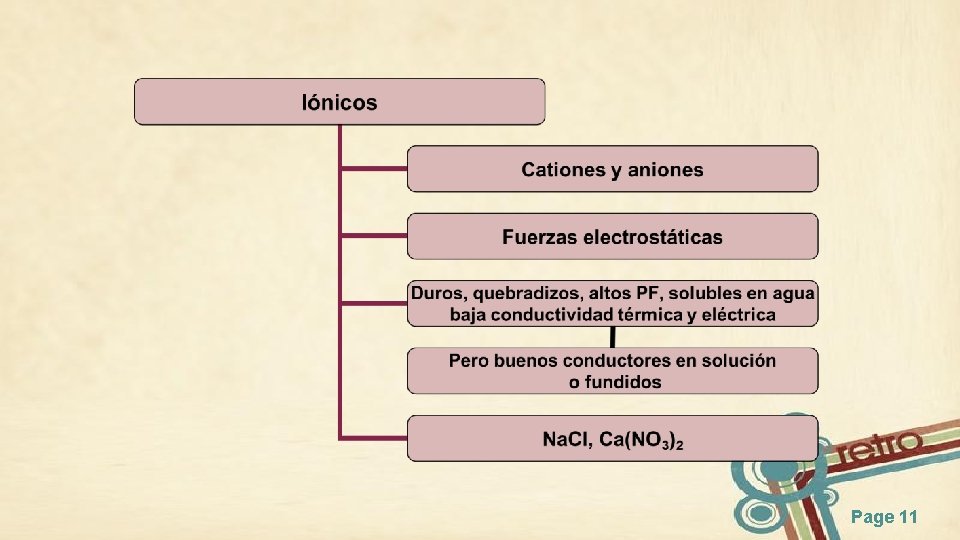
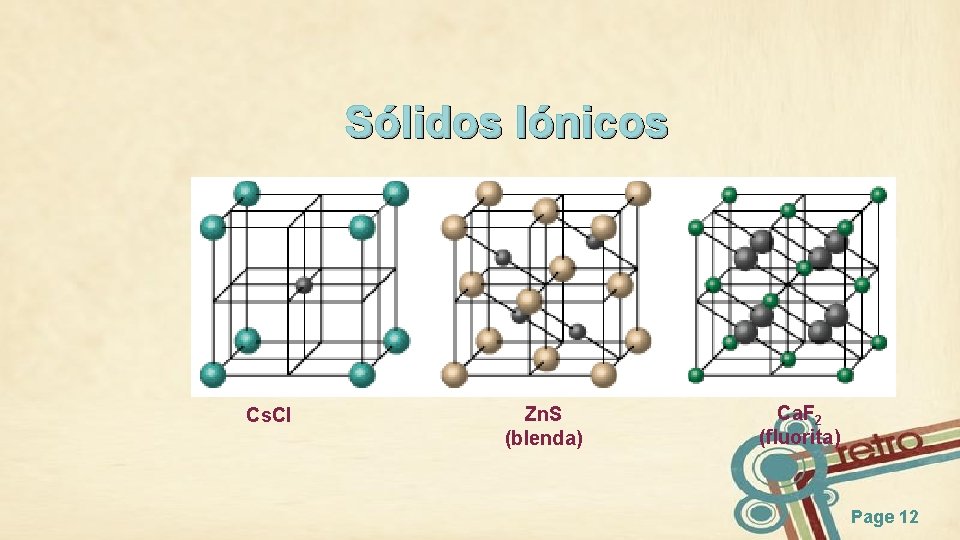
Sólidos Iónicos Cs. Cl Zn. S (blenda) Ca. F 2 (fluorita) Page 12

Por ejemplo: Na. Cl Page 13

Page 14

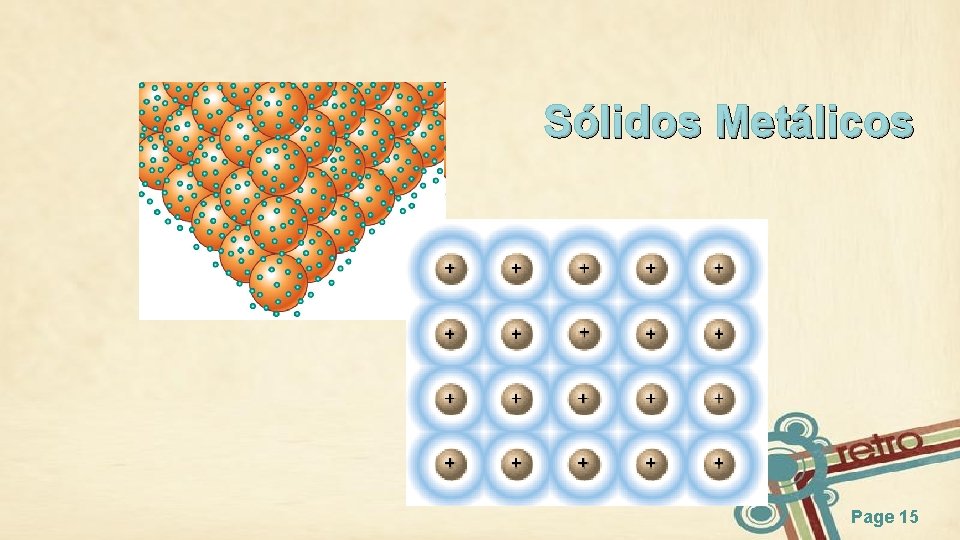
Sólidos Metálicos Page 15

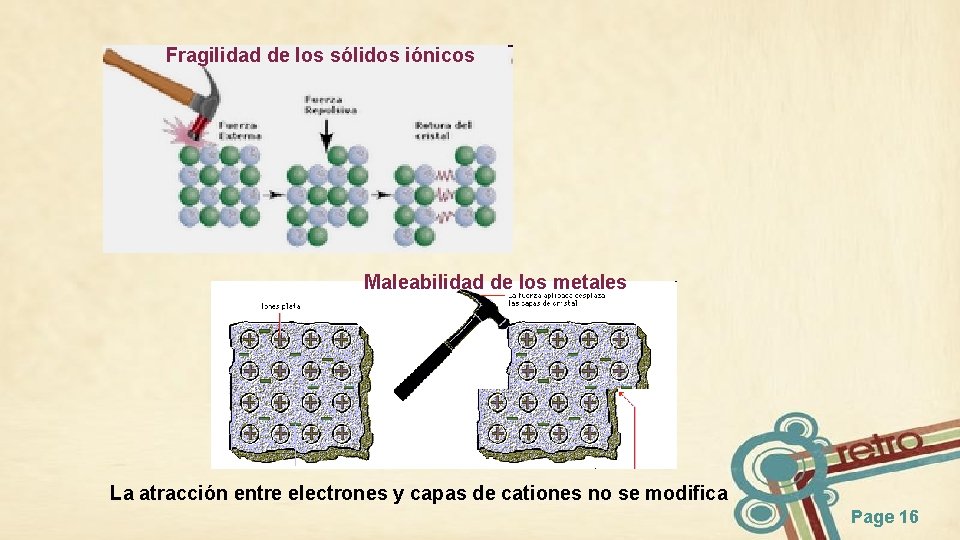
Fragilidad de los sólidos iónicos Maleabilidad de los metales La atracción entre electrones y capas de cationes no se modifica Page 16

Page 17

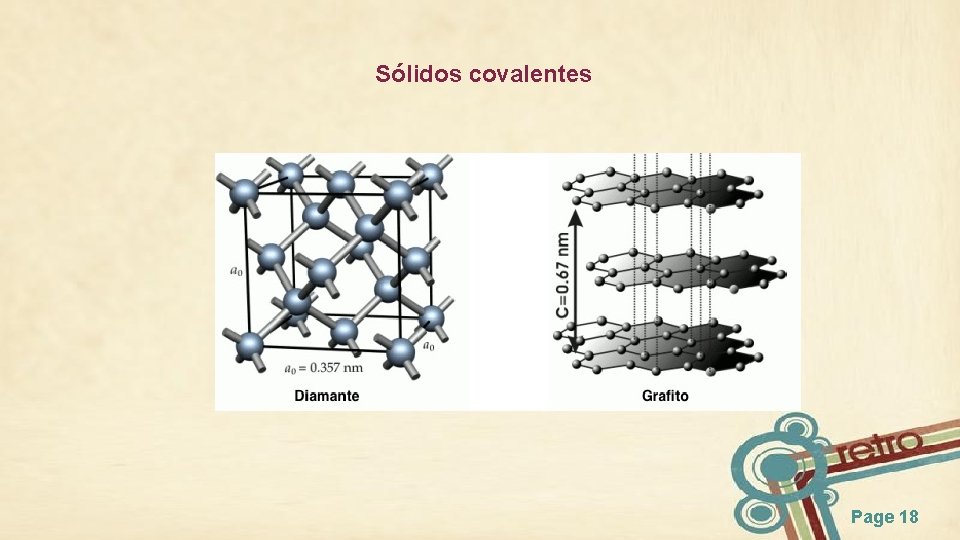
Sólidos covalentes Page 18

Para los siguientes sólidos: cuarzo (Si. O 2), hielo seco (CO 2), bromuro de litio (Li. Br). Identificar al sólido más blando. ¿Será también el de menor punto de fusión? Page 19

Al colocar los tres sólidos en un horno a 500°C, sólo uno de ellos se funde, pero los otros dos permanecen intactos. Identificar qué sólidos no funden a esa temperatura. Page 20

• Para el sólido blando, se conocen los siguientes datos: - El sólido sublima a – 78, 5°C y 1 atm. - El punto triple se presenta a – 56, 4°C y 5, 11 atm. - El punto crítico se presenta a 31, 1°C y 73 atm. - La pendiente de la recta de puntos de fusión del sólido es positiva. Construir el diagrama de fases del sólido en mención. 7. . Page 21

Práctica Dirigida 1. ¿Cuál de los siguientes tipos de sólidos tienen generalmente los puntos de fusión más bajos? A) Aquellos que están compuestos por moléculas simétricas pequeñas. B) Aquellos que están compuestos por iones positivos y negativos pequeños. C) Aquellos que están compuestos por moléculas polares. D) Aquellos en los cuales los átomos están ligados con enlaces covalentes y forman así una red. E) Aquellos que están formados por iones positivos y electrones móviles. Page 22

2. Indique con verdadero (V) o falso (F) a las proposiciones siguientes: I. Los sólidos pueden ser cristalinos o amorfos. II. Los sólidos cristalinos se caracterizan por poseer un punto de fusión definido. III. El punto de fusión nos ayuda como criterio de pureza de un material. A) VVV D) FFV B) E) VVF C) VFV FVV Page 23

3. • Clasifique las proposiciones como verdaderas (V) o falsas (F) según corresponda: I. El Mg. O, Ca. S y son ejemplos de sólidos iónicos. II. Los sólidos covalentes como el diamante y el cuarzo son buenos conductores de la electricidad. III. Las partículas de un sólido molecular, se hallan enlazadas por medio de enlaces covalentes. A) VVV D) VFF B) E) VFV C) FFF FVV Page 24

4. • Respecto a los sólido señale lo correcto: I. Los sólidos amorfos se caracterizan porque muchos de ellos tienen pequeñas regiones cristalinas conectadas con grandes regiones no cristalinas. II. El es un sólido cristalino, por lo tanto debe fundir en un rango de temperatura. III. Los sólidos cristalinos tienen una forma geométrica definida. A) Solo I B) D) I y II E) Solo II I y III C) Solo III Page 25

5. A escala atómica, los sólidos cristalinos son: A) Compresibles y desordenados. B) Compresibles y ordenados. C) Incompresibles y ordenados. D) Incompresibles y desordenados. E) Incomprimibles. Page 26

Tipo de sólido atómico Partículas átomos molecular moléculas iónico iones positivos (cationes) e iones negativos (aniones) metálico red covalente átomos Tipo de sólidos Fuerzas intermoleculares Propiedades Ejemplos dispersión de London suaves puntos de fusión muy bajos malos conductores del calor y la electricidad gases nobles del grupo 8 A dispersión de London bastante blandos dipolo - dipolo puntos de fusión de bajo a moderado enlace de hidrógeno pobres conductores de calor y electricidad atracciones electrostáticas ion-ion enlaces metálicos enlaces covalentes CH 4, I 2, H 2 O, CO 2, C 12 H 22 O 11 duros y frágiles puntos de fusión alto Na. Cl, Ca(NO 3)2, Ca. O malos conductores térmicos y eléctricos en estado sólido de blandos a duros puntos de fusión de bajos a altos excelentes conductores térmicos y eléctricos, maleables y dúctiles muy duro puntos de fusión muy altos pobres conductores térmicos y eléctricos Na, Fe, W, Cu diamante (C), Si. O 2 (cuarzo), Si. C (carborundo) Page 27