ESCUELA POLITCNICA DEL EJRCITO DEPARTAMENTO DE CIENCIAS DE










- Slides: 26

ESCUELA POLITÉCNICA DEL EJÉRCITO DEPARTAMENTO DE CIENCIAS DE LA VIDA INGENIERÍA EN BIOTECNOLOGÍA ESPE-HOLDINGDINE Previo a la obtención del título de: INGENIERA EN BIOTECNOLOGÍA Tania Carina Villarreal “INOCULACIÓN COMBINADA DE HONGOS MICORRÍCICO-ARBUSCULARES Y Azospirillum spp. EN PLÁNTULAS DE BANANO (Musa paradisiaca) MICROPROPAGADAS: EFECTOS SOBRE EL DESARROLLO Y CRECIMIENTO DURANTE LA FASE DE ACLIMATACIÓN”

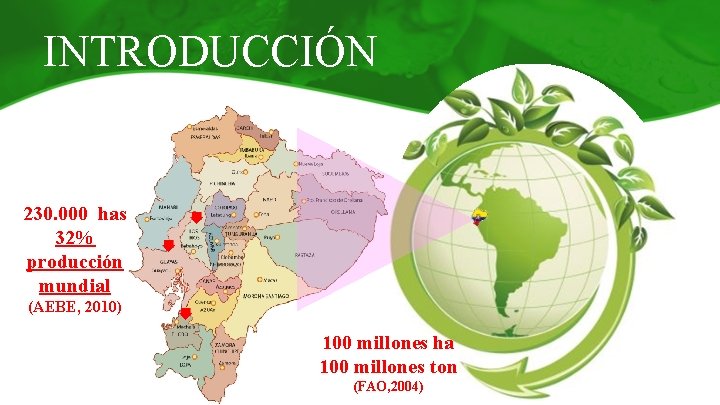
INTRODUCCIÓN 230. 000 has 32% producción mundial (AEBE, 2010) 100 millones ha 100 millones ton (FAO, 2004)

INTRODUCCIÓN Pérdida de fertilidad = baja producción Mejorar manejo agrícola . Monocultivo (WRM, 2004) (AEBE , 2010) 40% del Costo de producción es para INSUMOS QUÍMICOS Incremento de la producción Agricultura sostenible

BIOTECNOLOGÍA Plantas micropropagadas Hongos micorrícicos arbusculares (HMA) Bacterias promotoras del crecimiento vegetal

OBJETIVOS Objetivo General Analizar el efecto de la inoculación combinada de Hongos micorrícicos arbusculares (HMA) y Azospirillum sp, sobre el desarrollo y crecimiento de plántulas de banano (Musa paradisiaca) micropropagadas durante la fase de aclimatación. Objetivos Específicos - Aislar y propagar Azospirillum sp. y esporas de HMA nativas del cultivo de banano. Inocular y determinar el efecto de diferentes dosis de HMA y Azospirillum sp. así como su interacción, sobre las variables de crecimiento de la planta y el contenido de macro y micronutrientes en el tejido foliar y suelo Evaluar el % colonización y la población final de esporas en plántulas de banano micropropagadas durante la fase de aclimatación. Determinar la población final de Azospirillum sp. presente en el sustrato y en raíces de las plantas de banano. Determinar la dosis de HMA y de Azospirillum sp. que permitan obtener los mejores resultados respecto a las variables evaluadas.

HIPÓTESIS La co-inoculación de HMA y Azospirillum sp. mejoran el crecimiento (altura, perímetro del pseudotallo, área foliar, biomasa aérea, biomasa radical y contenido de nutrientes) de las plántulas de banano micropropagadas durante la fase de aclimatación

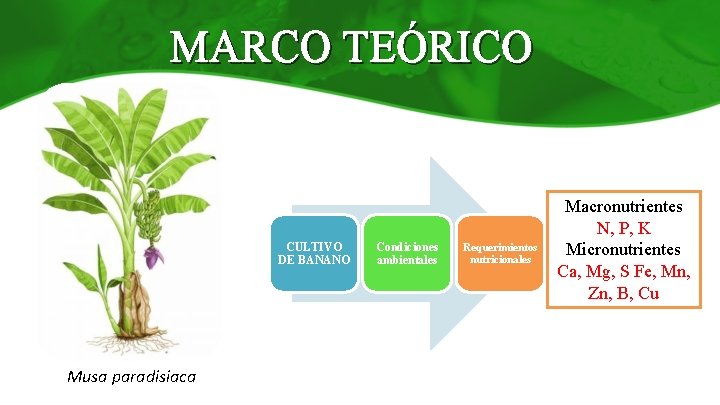
MARCO TEÓRICO CULTIVO DE BANANO Musa paradisiaca Condiciones ambientales Requerimientos nutricionales Macronutrientes N, P, K T= 25°C Micronutrientes Riego=160 -180 Ca, Mg, S Fe, Mn, mm/mes Zn, B, Cu

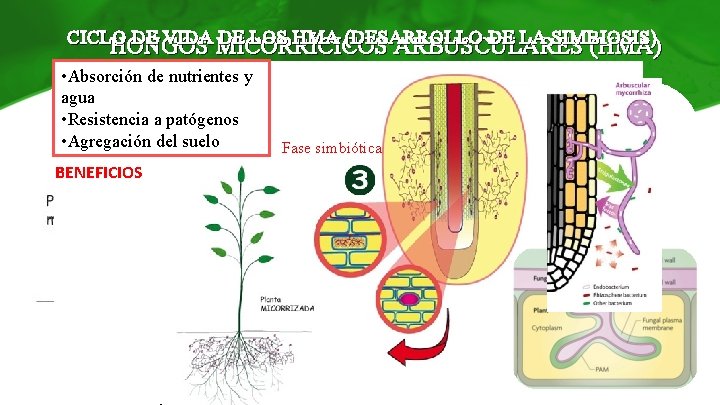
CICLO DE VIDA MICORRÍCICOS DE LOS HMA (DESARROLLO DE LA SIMBIOSIS) HONGOS ARBUSCULARES (HMA) • Absorción de nutrientes y agua • Resistencia a patógenos • Agregación del suelo Fase asimbiótica BENEFICIOS Asociación mutualista Fase simbiótica HONGOPLANTA 85 -95% especies vegetales Fase presimbiótica Fase asimbiótica Coadyuvante microbiano Fase simbiótica HONGOS MICORRÍCICOS presimbiótica (Bonfante & Anca, 2009) ARBUSCULARES

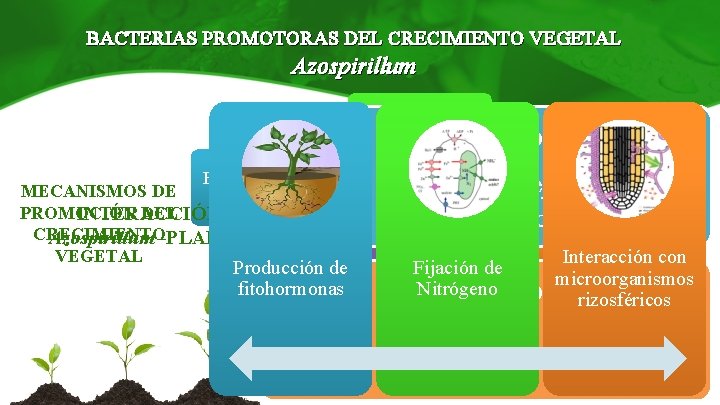
BACTERIAS PROMOTORAS DEL CRECIMIENTO VEGETAL Azospirillum p. H 6 a 7 T°= 30°C Colonización interna Bacilos Gram (-) Diazótrofa MECANISMOS DE PROMOCIÓN DEL INTERACCIÓN CRECIMIENTO Azospirillum -PLANTA VEGETAL Producción de fitohormonas • Ingreso por tejido destruido Familia Rhodospirillaceae • Acción de pectinasas Fijación de Nitrógeno Interacción con microorganismos rizosféricos Colonización externa Azospirillum • Adsorción • Anclaje

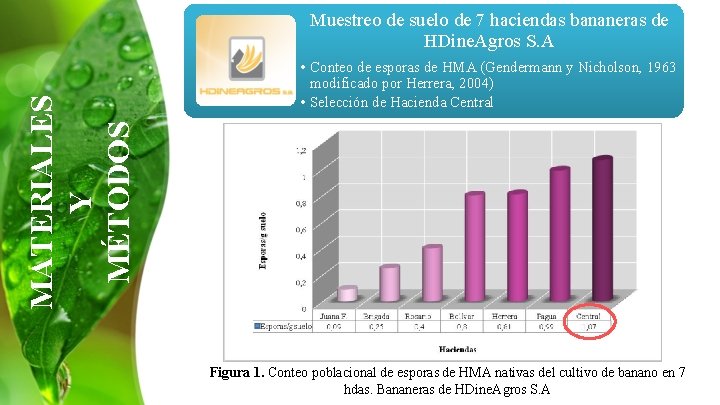
MATERIALES Y MÉTODOS Muestreo de suelo de 7 haciendas bananeras de HDine. Agros S. A • Conteo de esporas de HMA (Gendermann y Nicholson, 1963 modificado por Herrera, 2004) • Selección de Hacienda Central Figura 1. Conteo poblacional de esporas de HMA nativas del cultivo de banano en 7 hdas. Bananeras de HDine. Agros S. A

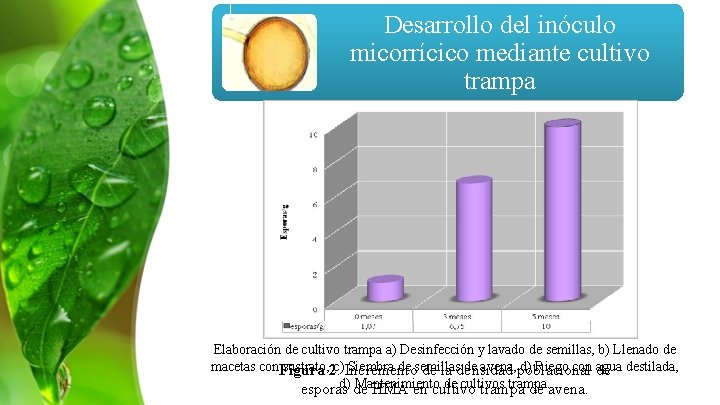
Desarrollo del inóculo micorrícico mediante cultivo trampa 30% arena 10% turba negra 60% suelo negro Elaboración de cultivo trampa a) Desinfección y lavado de semillas, b) Llenado de macetas con. Figura sustrato, 2. c) Incremento Siembra de semillas de avena, poblacional d) Riego con de agua destilada, de la densidad d) de Mantenimiento de cultivos trampa. esporas HMA en cultivo trampa de avena.

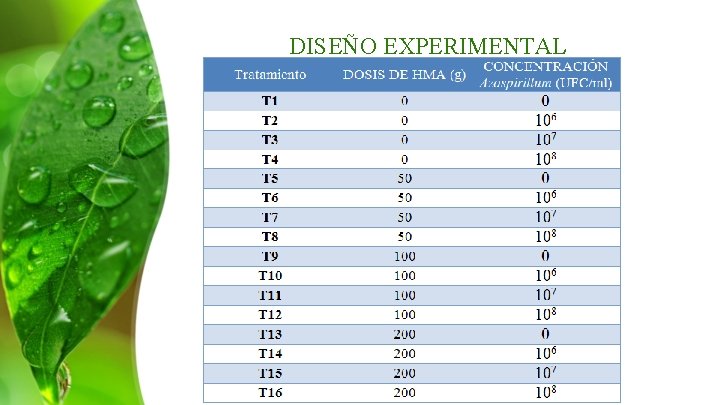
DISEÑO EXPERIMENTAL Diseño completamente al azar Repeticiones: 9 UE: 1 planta Total: 144 plantas

Transplante e inoculación de plántulas de banano con HMA • Adecuación de cámara de crecimiento • Inoculación con HMA a) Fraccionamiento de inóculo por tratamiento, b) Llenado de macetas con sustrato, c) Aplicación de tratamientos, d) Trasplante de plántulas de banano, e) Riego con solución nutritiva, f) Ubicación de macetas en cámara de crecimiento

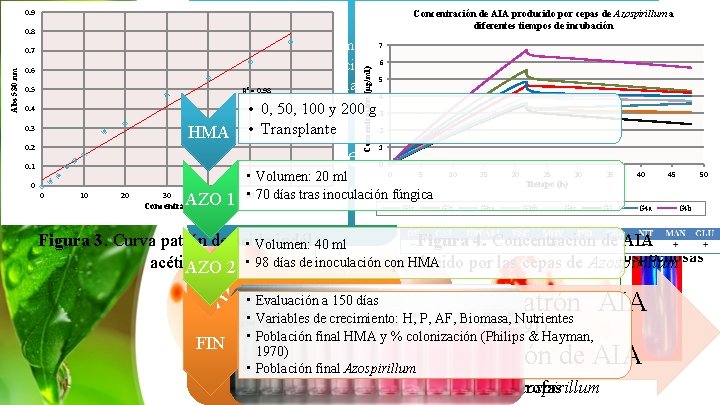
Concentración de AIA producido por cepas de Azospirillum a Inoculación de Azospirillum diferentes tiempos de incubación 0. 9 0. 8 Abs 530 nm 0. 6 0. 5 Concentración (μg/ml) 7 e identificación • Aislamiento 6 • Selección de la cepa inóculo 5 • Inoculación R = 0. 98 4 • 0, 50, 100 y 200 g 3 2 HMA • Transplante 0. 7 2 0. 4 0. 3 0. 2 • Pruebas fenotípicas Pruebas de • Volumen: 20 ml • Pruebas bioquímica identificación AZO 1 • 70 días tras inoculación fúngica 1 0 0. 1 0 5 10 15 20 25 30 35 40 45 50 Tiempo (h) 0 0 10 20 30 40 Concentración (μg/ml) 50 60 70 G 1 r G 2 r G 3 ra G 3 rb G 4 r G 2 G 4 a G 4 b Selección cepas Figura 3. Curva patrón de ácido indól 40 ml Figura 4. Concentración dede AIA • Volumen: “sospechosas” HMA acético producido por las. Azospirillum cepas de Azospirillum AZO 2 • 98 días de inoculación con • Evaluación a 150 días Selección de • Curva patrón AIA • Variables de crecimiento: H, P, AF, Biomasa, Nutrientes (Bric et al. 1991). Incubació • la Población final HMA y % colonización (Philips & Hayman, cepa n 30°C / FIN 1970) 14 d AIA • Producción de • inóculo Población final Azospirillum Aislamientodey bacterias seleccióndiazótrofas de Azospirillum

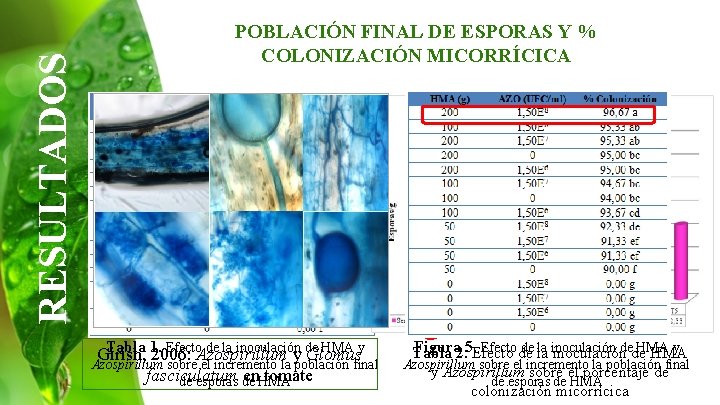
RESULTADOS POBLACIÓN FINAL DE ESPORAS Y % COLONIZACIÓN MICORRÍCICA Tabla 1. Efecto de la inoculación de HMA y Girish, 2006: Azospirillum y Glomus Azospirillum sobre el incremento la población final fasciculatum en. HMA tomate de esporas de Figura 2. 5. Efecto de de la la inoculación HMA y Tabla inoculacióndede HMA Azospirillum sobre el incremento la población final y Azospirillum sobre el porcentaje de de esporas de HMA colonización micorrícica

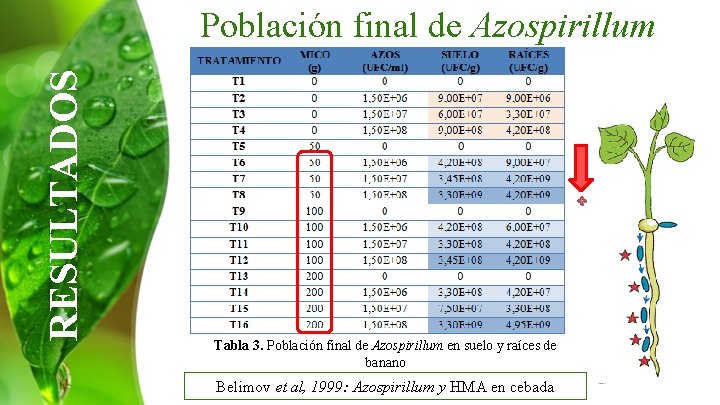
RESULTADOS Población final de Azospirillum + Tabla 3. Población final de Azospirillum en suelo y raíces de banano Belimov et al, 1999: Azospirillum y HMA en cebada

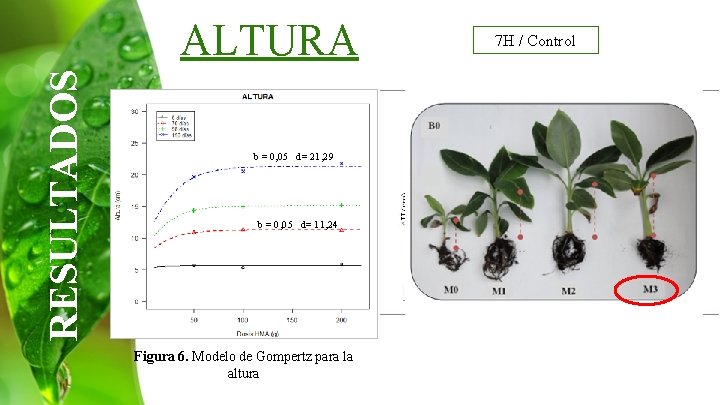
RESULTADOS ALTURA 7 H / Control b = 0, 05 d= 21, 29 b = 0, 05 d= 11, 24 Figura 6. Modelo de Gompertz para la altura Figura 7. Efecto de la inoculación de HMA y Azospirillum sobre Tabla 4. Efecto deellaincremento inoculacióndedealtura HMApara y el días de altura Azospirillumperíodo sobre el 70 -150 incremento para el período 70 -150 días

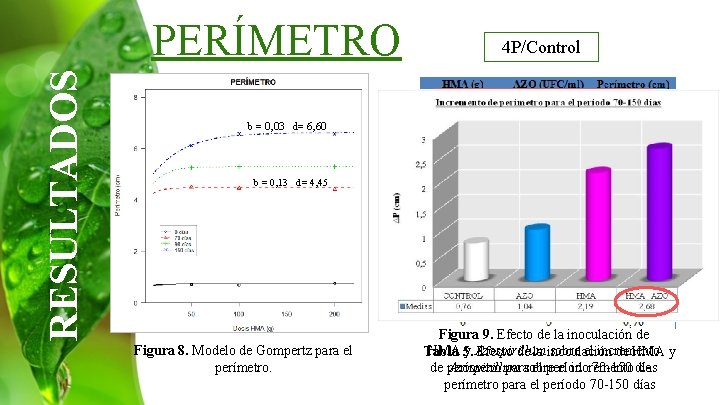
RESULTADOS PERÍMETRO 4 P/Control b = 0, 03 d= 6, 60 b = 0, 13 d= 4, 45 Figura 8. Modelo de Gompertz para el perímetro. Figura 9. Efecto de la inoculación de HMA 5. y Azospirillum sobre el incremento Tabla Efecto de la inoculación de HMA y de perímetro parasobre el período 70 -150 días Azospirillum el incremento de perímetro para el período 70 -150 días

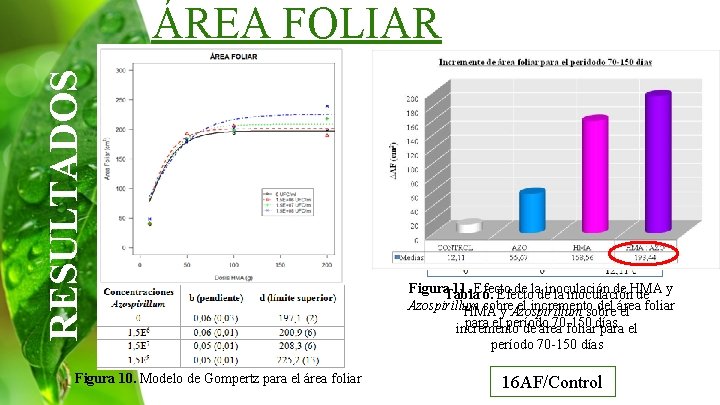
RESULTADOS ÁREA FOLIAR Figura 10. Modelo de Gompertz para el área foliar Figura. Tabla 11. Efecto de ladeinoculación de HMA 6. Efecto la inoculación de y Azospirillum sobre el incremento del área HMA y Azospirillum sobre el foliar para el período 70 -150 incremento de área foliardías para el período 70 -150 días 16 AF/Control

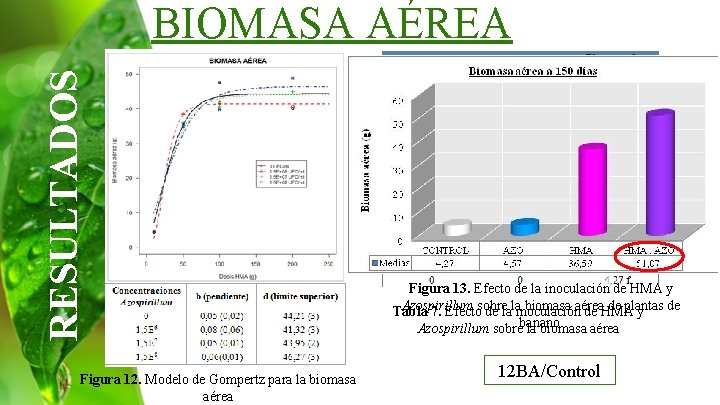
RESULTADOS BIOMASA AÉREA Figura 12. Modelo de Gompertz para la biomasa aérea Figura 13. Efecto de la inoculación de HMA y Azospirillum biomasa aérea de plantas de Tabla 7. Efectosobre de lalainoculación de HMA y Azospirillum sobrebanano. la biomasa aérea 12 BA/Control

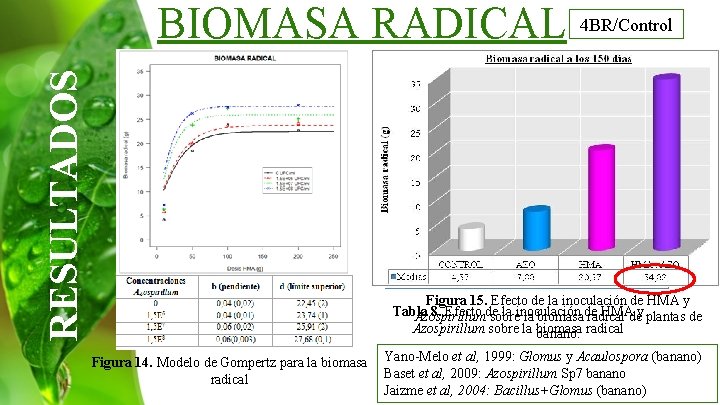
RESULTADOS BIOMASA RADICAL 4 BR/Control Figura 15. Efecto de la inoculación de HMA y Tabla 8. Efecto de la inoculación HMAdey plantas de Azospirillum sobre la biomasa de radical Azospirillum sobre la biomasa banano. radical Figura 14. Modelo de Gompertz para la biomasa radical Yano-Melo et al, 1999: Glomus y Acaulospora (banano) Baset et al, 2009: Azospirillum Sp 7 banano Jaizme et al, 2004: Bacillus+Glomus (banano)

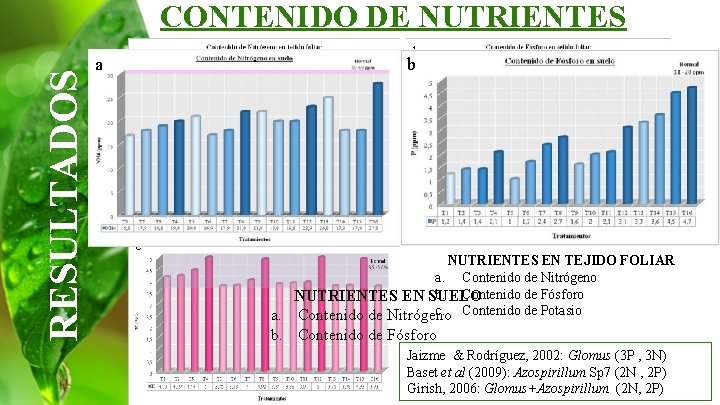
RESULTADOS CONTENIDO DE NUTRIENTES a a c b b NUTRIENTES EN TEJIDO FOLIAR a. Contenido de Nitrógeno b. Contenido de Fósforo NUTRIENTES EN SUELO c. Contenido de Potasio a. Contenido de Nitrógeno b. Contenido de Fósforo Jaizme & Rodríguez, 2002: Glomus (3 P , 3 N) Baset et al (2009): Azospirillum Sp 7 (2 N , 2 P) Girish, 2006: Glomus+Azospirillum (2 N, 2 P)

CONCLUSIONES 1. La Hacienda Central poseía la mayor densidad poblacional de propágulos de HMA entre las 7 hdas. bananeras evaluadas. 2. Utilizando 30% de suelo de la Hacienda Central, un sustrato de suelo - arena (1: 1) y plantas de avena como hospederas, se obtuvo (tras cinco meses de propagación) un inóculo micorrícico que contenía 10 esporas/g de suelo. 3. La cepa G 4 b de Azospirillum fue la que produjo mayor cantidad de AIA (6, 33 μg/ml) en relación a las cepas restantes y fue seleccionada como cepa inóculo. 4. La co-inoculación de 200 g de HMA y 1, 5 E 8 UFC/ml de Azospirillum favorece el crecimiento de las plántulas de banano, permitiendo incrementar 7 veces la altura, 4 veces el perímetro, 16 veces el área foliar, 12 veces la biomasa aérea y 8 veces la biomasa radical, en relación a las plantas control.

CONCLUSIONES 5. La co-inoculación de 200 g de HMA y 1, 5 E 8 UFC/ml de Azospirillum promueve una mejor absorción de fósforo y nitrógeno. 6. La población final de esporas de HMA y el porcentaje de colonización, son favorecidos por la co-inoculación de Azospirillum, alcanzando los mayores valores (62, 67 esporas/g y 96, 67%) para la interacción de HMA- Azospirillum en sus mayores dosis 7. La población final de Azospirillum incrementa cuando se co-inoculan con HMA.

RECOMENDACIONES • Realizar un ensayo similar utilizando menor número de tratamientos y más repeticiones para lograr obtener resultados que permitan determinar en forma concreta el efecto de cada uno de los microorganismos y de su interacción sobre el desarrollo y nutrición de banano. • Evaluar el efecto de mayores concentraciones de Azospirillum sobre el desarrollo de plántulas de banano, a fin de determinar la concentración máxima que beneficia a la planta y la dosis a la que se registran perjuicios sobre su desarrollo. • Incrementar el porcentaje de turba en el sustrato para el crecimiento de las plantas o aumentar el tiempo de aplicación de solución nutritiva, a fin de alcanza niveles óptimos de fósforo en el suelo que no perjudiquen a los HMA pero que permitan una adecuada nutrición de las plantas. • Evaluar la productividad de las plantas de banano co-inoculadas con HMA y Azospirillum en campo.

GRACIAS