Equipo 6 Transferencia de material gentico II Transformacin












- Slides: 14

Equipo 6. Transferencia de material genético II: Transformación.

Objetivos: �Conocer el fundamento para transformar células bacterianas. �Realizar la técnica de transformación bacteriana. �Aprender a identificar células transformantes mediante su fenotipo. �Conocer la definición de organismo transgénico. �Conocer las aplicaciones de la transformación bacteriana: beneficios y riesgos.

Ingeniería Genética �Herramienta que permite técnicas de manipulación y selección de material genético.

Organismos transgénicos Es aquél que ha sufrido la alteración de su material hereditario (genoma) por la introducción artificial (manipulación genética) de un gene exógeno, esto es, proveniente de otro organismo completamente diferente.

Vectores de clonación � Es un sistema que permite introducir en una célula hospedera un fragmento de DNA que se pretende clonar. �En esta célula hospedera el vector se replica y se expresa.

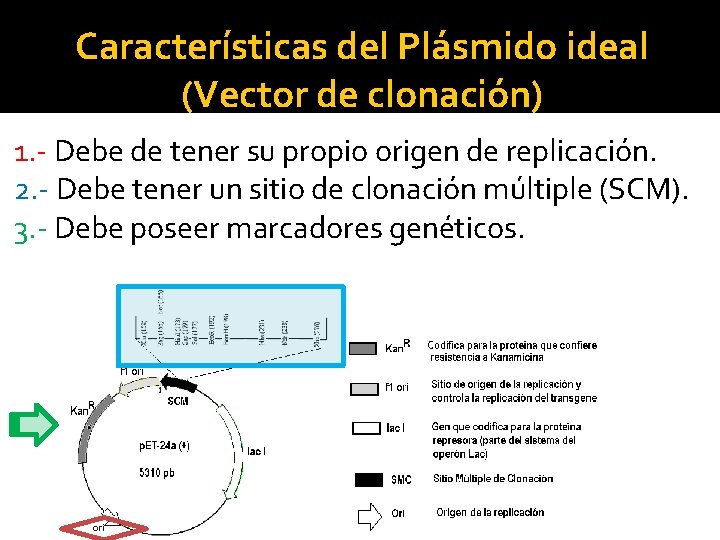
Características del Plásmido ideal (Vector de clonación) 1. - Debe de tener su propio origen de replicación. 2. - Debe tener un sitio de clonación múltiple (SCM). 3. - Debe poseer marcadores genéticos.

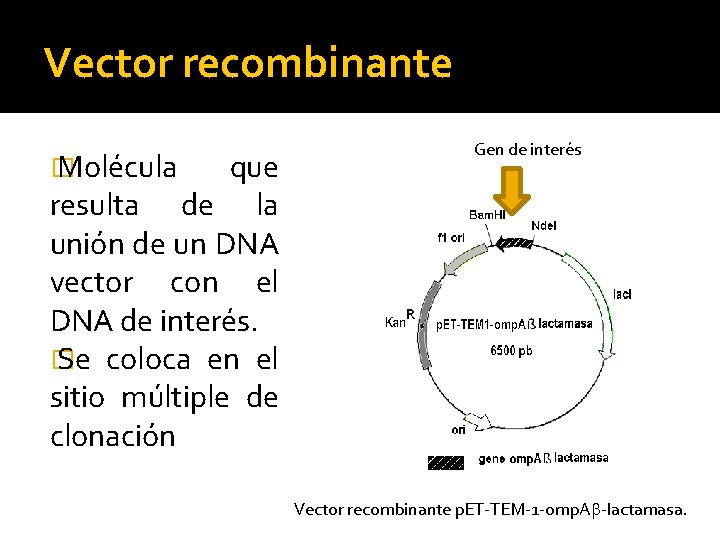
Vector recombinante � Molécula que resulta de la unión de un DNA vector con el DNA de interés. � Se coloca en el sitio múltiple de clonación Gen de interés Vector recombinante p. ET-TEM-1 -omp. A -lactamasa.

Transformación Para la introducción del DNA existen diferentes técnicas: �Choque Térmico �Microelectroporación

Choque térmico (el usado en la práctica) �Las bacterias hospederas son pre-tratadas con agentes que aumentan su permeabilidad membranal, como es el aumento de la temperatura �Los iones como el Ca 2+, disminuyen la repulsión de cargas eléctricas entre los nucleótidos y la membrana, facilitando la entrada del plásmido al interior de la célula.

Células competentes y células transformantes �Células competentes: Células que han recibido un tratamiento apropiado para llevar a cabo la introducción del material genético. �Células transformantes: Células que contiene el material genético foráneo, a las cuales se les restauro su permeabilidad de la membrana y se encuentran en condiciones óptimas de crecimiento.

Material: � Células competentes: E. coli DH 5 � Vector recombinante: Plásmido p. ET-TEM-1 omp. Aβ-lactamasa. Medio para restaurar crecimiento de células transformantes: SOC. Medio Luria con 20 m. M Glucosa. � Medio de selección: Cajas Petri con medio LB/Kanamicina (30 µg/m. L). �

Procedimiento Experimental: Primera parte choque térmico � 1. 2. 3. 4. 5. Transformación de células competentes con el vector PET-TEM-1 por el método de choque térmico. Tomar un tubo de células competentes del congelador y colocarlas en hielo Añadir 1 a 5 µL del plásmido a un microtubo que contiene 100 µL de células de E. coli competentes. Mezclar. Dejar en hielo por 30 minutos. Dar choque térmico a 42ºC durante 45 segundos (NO AGITAR).

Segunda parte: Restaurar células para óptimo crecimiento 6. 7. 8. 9. 10. Agregar 450 µL de medio SOC e incubar por 60 minutos a 37ºC con agitación 225 a 250 rpm. Concentrar las células por centrifugación. Eliminar el sobrenadante y resuspender el paquete celular en 100 µL de medio SOC. Esparcir los 100 µL de bacterias transformadas, en las cajas con medio de selección (Agar -LBKanamicina). Incubar a 37ºC por 24 h. Observar crecimiento y guardar la caja a 4ºC.

Controles 11. Como control negativo incubar 100 µL de células competentes en medio de selección a 37ºC por 24 h. 12. Calcular la eficiencia de la transformación.