EQUIPO 5 PREPARACIN DE ACETATO DE ISOAMILO PREPRACIN



















- Slides: 26

EQUIPO 5 PREPARACIÓN DE ACETATO DE ISOAMILO

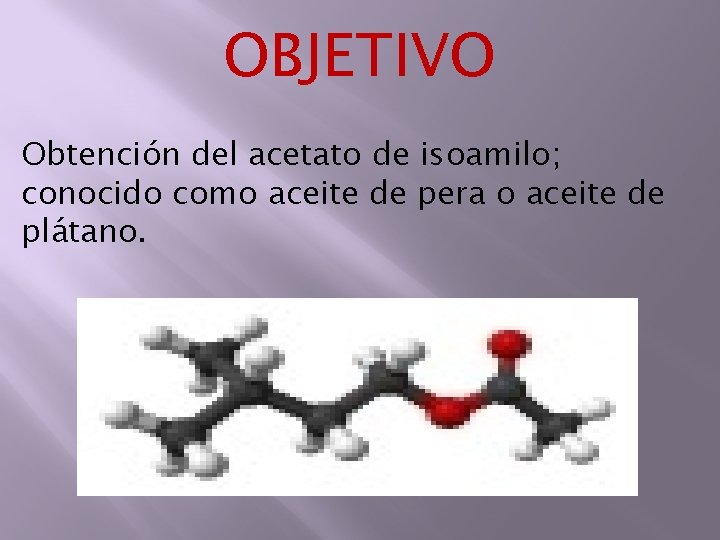
PREPRACIÓN DE ACETATO DE ISOAMILO El acetato de isoamilo (denominado también aceite de banana o aceite de plátano) es un compuesto orgánico de fórmula CH 3 COOCH 2 CH(CH 3)2 que es un éster del alcohol isoamil y el ácido acético. Es un líquido incoloro con aroma a bananas (y ligeramente a pera) y por eso algunas industrias alimentarias lo emplean como aromatizante. La denominación aceite de banana o aceite de plátano se aplica tanto al acetato de isoamilo empleado como aromatizante, o a las mezclas de acetato de isoamilo, acetato de amilo y otros compuestos.

SÍNTESIS El acetato de isoamilo se obtiene de forma natural de algunas frutas como el plátano (banana) y las peras. A pesar de ello se sintetiza también artificialmente, mediante una reacción catalizada en medio ácido (por esterificación Fischer) entre el alcohol isoamílico y el ácido acético glacial tal y como se muestra: Generalmente se suele emplear ácido sulfúrico como catalizador de la reacción de síntesis. El intercambio de iones del ácido de algunas resinas permite emplearlas también como catalizador.

OBJETIVO Obtención del acetato de isoamilo; conocido como aceite de pera o aceite de plátano.

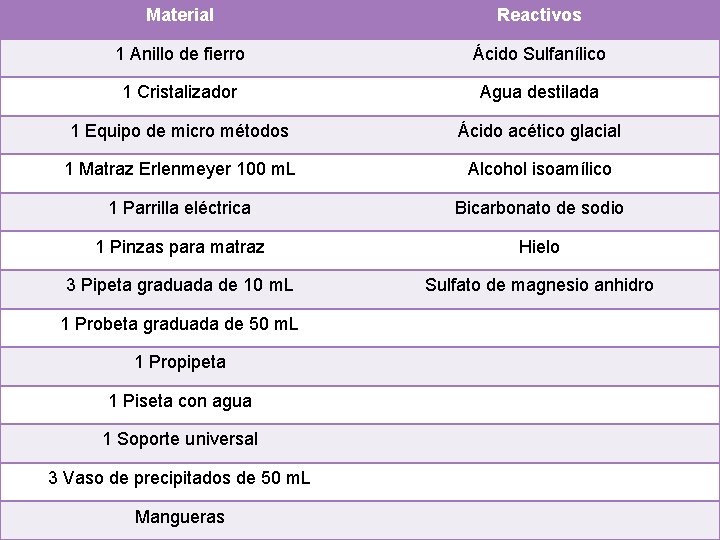
Material Reactivos 1 Anillo de fierro Ácido Sulfanílico 1 Cristalizador Agua destilada 1 Equipo de micro métodos Ácido acético glacial 1 Matraz Erlenmeyer 100 m. L Alcohol isoamílico 1 Parrilla eléctrica Bicarbonato de sodio 1 Pinzas para matraz Hielo 3 Pipeta graduada de 10 m. L Sulfato de magnesio anhidro 1 Probeta graduada de 50 m. L 1 Propipeta 1 Piseta con agua 1 Soporte universal 3 Vaso de precipitados de 50 m. L Mangueras


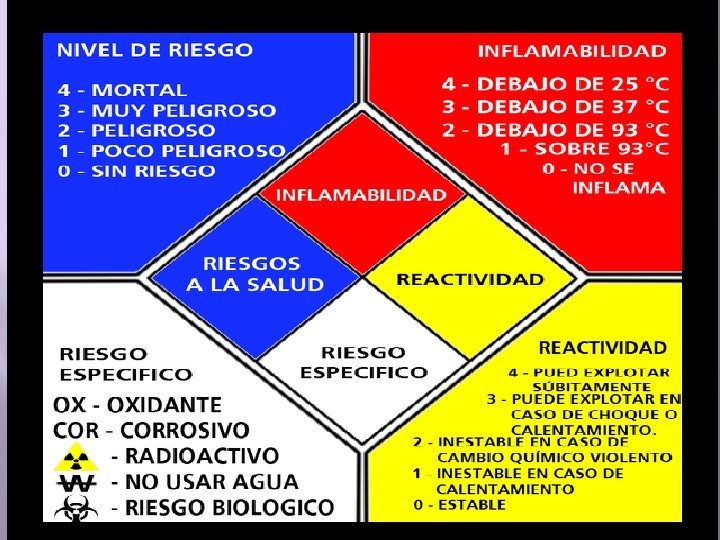
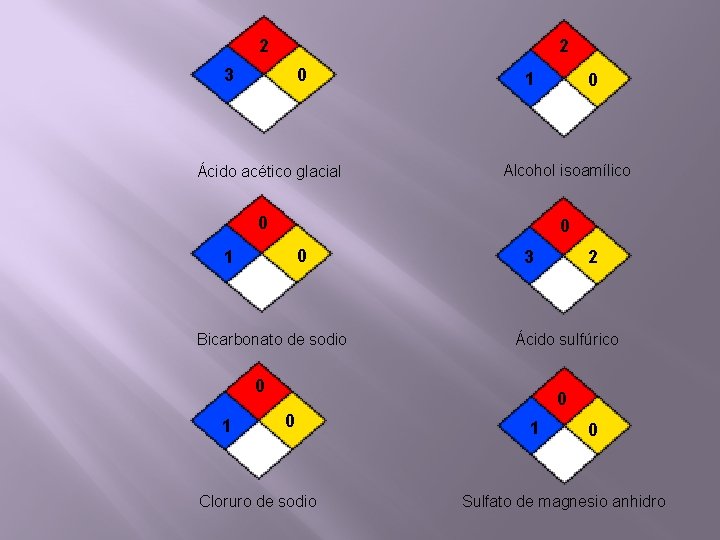
2 2 0 3 Ácido acético glacial 1 Alcohol isoamílico 0 0 0 1 3 2 1 OX Bicarbonato de sodio Ácido sulfúrico 0 1 0 0 0 Cloruro de sodio 1 0 Sulfato de magnesio anhidro

Desarrollo: Observaciones acerca de la preparación de las soluciones estándar. Se sugiere asignar a dos equipos la preparación de las soluciones de Na. HCO₃ al 5% y de Na. Cl saturada desde la práctica pidan los reactivos y preparen las soluciones. A los equipos que se les asigne preparar las soluciones deben de pedir un matraz aforado de 100 m. L para la solución de Na. HCO₃ al 5% y un matraz Erlenmeyer de 100 m. L para la solución de Na. Cl saturada y pesar los reactivos necesarios para realizar la solución asignada.

ETAPA 1: Preparación de soluciones. Equipo 1: Na. OH₃ 5% 100 m. L Equipo 2: Na. Cl solución saturada 100 m. L

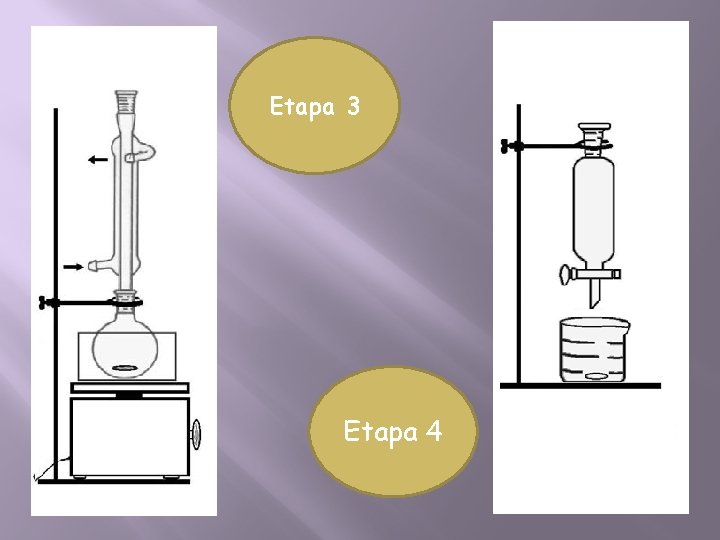
ETAPA 3: REFLUJO. ETAPA 2: ESTERIFICACIÓN. � En un matraz bola de 25 m. L coloque 3. 6 m. L de alcohol isoamílico y 4. 8 m. L de ácido acético glacial. Cuidadosamente agregue 0. 8 m. L de ácido sulfúrico concentrado, agite ligeramente el matraz manualmente y luego agregue la barra magnética. � Coloque un refrigerante con mangueras al matraz en forma vertical y caliente la mezcla de reacción en baño María (utilizando agua en vez del baño de arena ya que el calentamiento sería más severo) y mantenga el reflujo durante 1 h con agitación.

ETAPA 4: EXTRACCIÓN. � Después de este tiempo, el matraz se enfría al chorro de agua y se transvasa la mezcla de reacción a un embudo de separación junto con 10 m. L de agua fría. Se enjuaga el matraz de reacción con 5 m. L de agua fría y esta se adiciona al embudo de separación, agitando varias veces el embudo. Se separa la capa acuosa de la orgánica. Descarte la capa acuosa (capa inferior). ETAPA 5: NEUTRALIZACIÓN Y LAVADO. � El ácido acético que no reaccionó se elimina al agitar la fase orgánica con una solución al 5% de bicarbonato de sodio (5 m. L aprox), repita la operación 1 veces, verificando si las aguas extraídas con el bicarbonato son básicas. Agregue a la fase orgánica 5 m. L de agua y añadir 2 m. L de una solución acuosa saturada de cloruro de sodio, no agite la mezcla. Cuidadosamente separe la capa acuosa y descártela.

ETAPA 6: Secado. � � Vierta la fase orgánica en un vaso de precipitados seco de 50 m. L, agregar 0. 2 g de sulfato de magnesio anhidro para secar el éster. Agitarlo suavemente, dejar reposar hasta que el éster esté completamente claro y separar por decantación. Mida el volumen del éster* obtenido para calcular el rendimiento.

Etapa 3 Etapa 4

CUESTIONARIO

1. Escriba el mecanismo de la reacción de obtención del éster 2. Además de la esterificación de Fischer entre un ácido carboxílico y un alcohol en medio ácido, hay otras rutas para la obtención de un éster. ¿Cuál sería otra vía de síntesis del acetato de isoamilo?

Existen 3 vías principales para la síntesis de ésteres que de manera general se obtienen por la reacción de alcoholes y fenoles con ácidos y sus derivados. Las principales rutas son las siguientes: - Obtención con ácidos. -Obtención con cloruros o anhídros de ácido. -Obtención con ésteres (transesterificación). PARA MÁS INFORMACIÓN CONSULTAR EL CAPITULO 24, SECCIÓN 24. 15 DEL LIBRO QUÍMICA ORGÁNICA DE MORRISON Y BOYD.

3. La obtención de un éster a partir de un ácido carboxílico y un alcohol es una reacción reversible. Cuando se esterifica un ácido carboxílico, se emplea un exceso de alcohol. ¿Que condiciones son necesarias para invertir la reacción? Las condiciones que se requieren para lograr que la reacción sea reversible están dadas por la reacción de conversión de ésteres a ácidos por medio de la hidrólisis de los mismos, es decir, se requiere tratar al éster con un exceso de agua en un medio ácido para que se obtener como productos un ácido carboxílico y un alcohol. CONSULTAR LA SECCIÓN 24. 16 DEL LIBRO QUÍMICA ORGÁNICA DE MORRISON Y BOYD.

4. ¿Cuales son los usos y aplicaciones del producto obtenido? Propiedades: Se presenta como un líquido incoloro y un característico aroma a plátano (fruta). Es un líquido altamente inflamable. Dependiendo de la concentración con la que se presente posee un ligero aroma a pera. La denominación aceite de pera se refiere por regla general a una solución de acetato de isoamilo en etanol y se emplea como un sabor artificial en lácteos. Usos: El principal uso del acetato de isoamilo es el de aromatizante de ciertos productos como refrescos (en Estados Unidos se elaboran líneas de productos como el Juicy Fruit). Se usa como solvente (como por ejemplo de la nitrocelulosa), en la elaboración de perfumes y en esencias artificiales de frutas. Se emplea como feromona y que es capaz de atraer abejas melíferas. La capacidad de disolver la nitrocelulosa hace fuese empleado en los primeros instantes de la industria aeronáutica. Debido a su intenso olor se suele emplear para testear la eficiencia de los respiradores en las máscaras de gas.

5. Escriba los cálculos necesarios para preparar 100 m. L de la solución de bicarbonato de sodio al 5% Como el bicarbonato de sodio se presenta en forma de polvo el porcentaje que requerimos es másico, es decir, se trata de una solución final en % masa/masa; por lo tanto por cada 100 g de solución (recordando que la densidad del agua es igual a 1 g/m. L) 5 g serán de bicarbonato de sodio: 100 m. L de solución = 100 g de solución 100 g * 5%/100% = 5 g de bicarbonato de sodio.

7. Consultando la bibliografía, haga una lista de las propiedades fisicoquímicas, y el uso y precauciones que se deben tener con los reactivos que se utilizaron en la práctica ÁCIDO ACÉTICO GLACIAL: 9. Propiedades físicas y químicas Aspecto: Líquido transparente e incoloro. Olor: Picante p. H ~2, 5(10 g/l) Punto de ebullición : 118°C Punto de fusión : 17°C Punto de inflamación : 40°C Temperatura de auto ignición : 485°C Límites de explosión (inferior/superior): 4 / 17 vol. % Presión de vapor: 15, 4 mbar(20°C Densidad (20/4): 1, 05 Solubilidad: Miscible con agua

ÁCIDO SULFÚRICO:

ALCOHOL ISOAMÍLICO:

BICARBONATO DE SODIO:

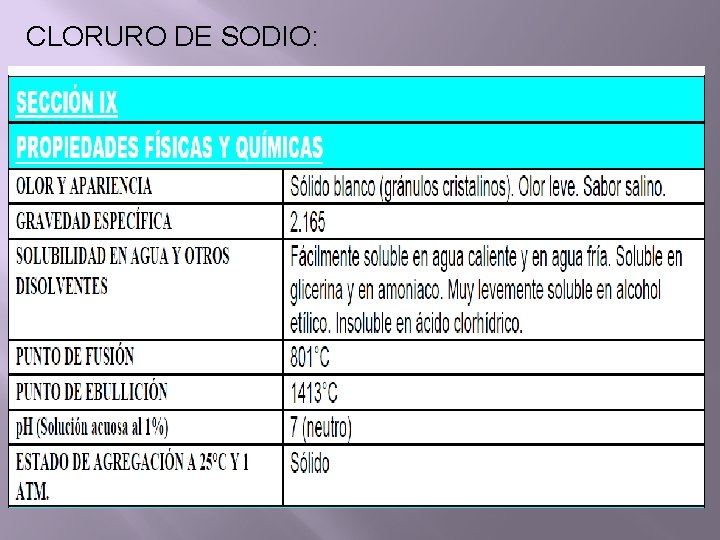
CLORURO DE SODIO:

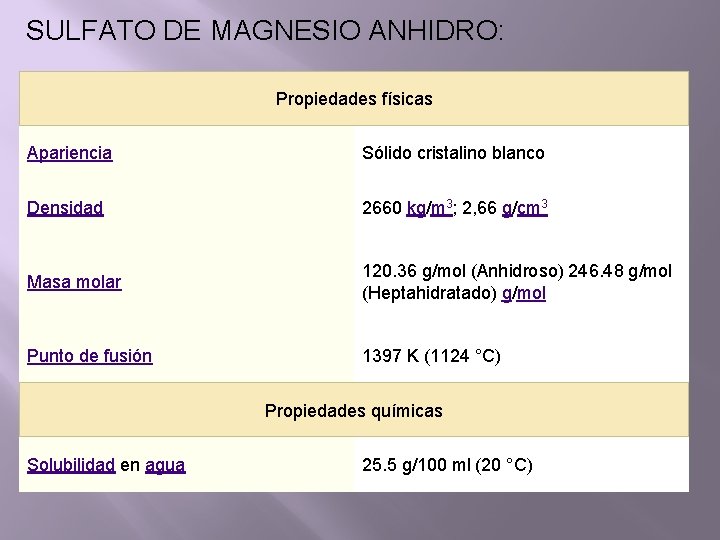
SULFATO DE MAGNESIO ANHIDRO: Propiedades físicas Apariencia Sólido cristalino blanco Densidad 2660 kg/m 3; 2, 66 g/cm 3 Masa molar 120. 36 g/mol (Anhidroso) 246. 48 g/mol (Heptahidratado) g/mol Punto de fusión 1397 K (1124 °C) Propiedades químicas Solubilidad en agua 25. 5 g/100 ml (20 °C)

BIBLIOGRAFÍA http: //es. wikipedia. org/wiki/Acetato_de_isoamilo http: //www. utm. csic. es/documentacion/garciadelcid/acido_acetico. htm http: //www. itsva. edu. mx/archivos/usuarios/5/archivo 693. pdf http: //www. proquimsaec. com/PDF/Hoja. Seguridad/HS_Bicarbonato_de_Sodio%20. p df http: //www. cisproquim. org. co/HOJAS_SEGURIDAD/Acido_sulfurico. pdf http: //antiguo. itson. mx/laboratorios/ALCOHOL%20 ISO-AMILICO. pdf http: //es. wikipedia. org/wiki/Sulfato_de_magnesio MORRISON R. T. , BOYD R. N. , “QUÍMICA ORGÁNICA”, 5 TA. EDICIÓN, EDITORIAL PEARSON, MÉXICO, 1998, PAGS: 858 -867.
 Casbesto
Casbesto Sintesis de acetato de isoamilo
Sintesis de acetato de isoamilo Soluciones y diluciones
Soluciones y diluciones Preparacin
Preparacin Preparacin
Preparacin Sodio en agua
Sodio en agua Fisiologia
Fisiologia Vitrales en acetato
Vitrales en acetato Ferula de estabilizacion
Ferula de estabilizacion Pietro andreone
Pietro andreone Biacetila
Biacetila Tetra acetato dimolybdenum ii
Tetra acetato dimolybdenum ii Que es acetato
Que es acetato La quinta disciplina imagenes
La quinta disciplina imagenes Electroforesis capilar equipo
Electroforesis capilar equipo Reunión de equipo docente
Reunión de equipo docente Hipotesis tipos
Hipotesis tipos Equipo ministerial
Equipo ministerial Cloruro de sodio
Cloruro de sodio Fortalezas de un coordinador
Fortalezas de un coordinador Proceso
Proceso Aprendamos a jugar en equipo
Aprendamos a jugar en equipo Cronometrizado
Cronometrizado Equipo de trabajo autoadministrado
Equipo de trabajo autoadministrado Factor goteo equipo de transfusion
Factor goteo equipo de transfusion Equipo de venopuncion
Equipo de venopuncion Los beisbolistas juegan con un balon
Los beisbolistas juegan con un balon