Equilibri in soluzione di composti poco solubili Se

Equilibri in soluzione di composti poco solubili Se si scioglie una sostanza che dia luogo ad ioni in soluzione (elettrolita) in quantità sufficiente ad ottenere una soluzione satura in presenza del sale indisciolto, si stabilisce un equilibrio tra la sostanza solida indisciolta e gli ioni in soluzione Equilibrio eterogeneo Ag. Cl(s) Ag+ + Cl-

La Keq prende il nome di prodotto di solubilità : Kps Il prodotto di solubiltà Kps si definisce nel modo seguente: In una soluzione satura di un composto ionico poco solubile, il prodotto delle concentrazioni molari degli ioni, ciascuna elevata a una potenza uguale al coefficiente stechiometrico con cui compare nell’equazione di solubilizzazione, è costante a temperatura costante. La validità di questa definizione è limitata a composti poco solubili che danno luogo a soluzioni diluite di ioni. Se la soluzione satura contiene alte concentrazione degli ioni, esistono interazioni tra gli ioni e quindi la concentrazione stechiometrica non è più uguale a quelle sperimentale.
![Prodotto di solubilità : Kps Ag. Cl(s) Ag+ + Cl[Ag+] [ Cl-] [ Ag. Prodotto di solubilità : Kps Ag. Cl(s) Ag+ + Cl[Ag+] [ Cl-] [ Ag.](http://slidetodoc.com/presentation_image_h/c52464e72d1b74961106eaa8398ef50e/image-3.jpg)
Prodotto di solubilità : Kps Ag. Cl(s) Ag+ + Cl[Ag+] [ Cl-] [ Ag. Cl] K = [Ag+] [ Cl-] [Ag. Cl](s) Kps = [Ag+] [ Cl-] In quanto solido, la sua quantità non influsce sulla posizione dell’equilibrio, purchè il solido sia presente Prodotto di Solubilità: Deriva da una costante di equilibrio ma poiché il denominatore é un valore costante, diventa solo il prodotto dei termini di destra della reazione che si sta descrivendo

Esempi di calcolo Se in soluzione ho solo un sale poco solubile, la concentrazione dei due ioni NON sarà indipendente ma dipende dalla Kps e dalla stechiometria del sale Ag. Cl Ag+ + Cl- x x [Ag+]= [ Cl-] = x

Esempi di calcolo Se in soluzione ho solo un sale poco solubile, la concentrazione dei due ioni NON sarà indipendente ma dipende dalla Kps e dalla stechiometria del sale Ag. Cl Pb. Cl 2 Ag+ + Cl- x x [Ag+]= [ Cl-] = x Pb+2 + 2 Cl- x 2 x [Pb+2]= 2[Cl-]

Esempi di calcolo Se in soluzione ho solo un sale poco solubile, la concentrazione dei due ioni NON sarà indipendente ma dipende dalla Kps e dalla stechiometria del sale Ag. Cl Ag+ + Cl- x x Kps = [Ag+] [ Cl-] = x x =x 2 [Ag+]= [ Cl-] = x

Esempi di calcolo Se in soluzione ho solo un sale poco solubile, la concentrazione dei due ioni NON sarà indipendente ma dipende dalla Kps e dalla stechiometria del sale Pb. Cl 2 Pb 2+ + 2 Cl- x 2 x Kps = [Pb 2+] [ Cl-]2 = x (2 x)2 =4 x 3 2[Pb 2+]= [ Cl-]

Prodotto di solubilità (Kps) Consideriamo un composto poco solubile che in acqua si dissocia in ioni secondo il seguente equilibrio: Mm. Xn(solido) m. Mu+ + n. Xv. La costante relativa a questo equilibrio è indicata con Kps ed è data da: Kps = [Mu+]m [Xv-]n

Quando il prodotto delle concentrazioni delle specie che costituiscono il sale poco solubile elevate ai corrispettivi coefficienti stechiometrici fa un numero maggiore della Kps ho precipitazione del composto poco solubile Es. Quando aggiungo 0. 15 m. L di KI 0. 20 M a 100 m. L di Pb(NO 3)2 0. 010 M si avrà formazione di ioduro di piombo? moli I- = 0. 15 X 10 -3 X 0. 2 = 3 X 10 -5 mol [I-] = 3 X 10 -5 mol/0. 10015 dm 3 = 3 X 10 -4 M moli Pb 2+ = 100 X 10 -3 X 0. 01 = 1 X 10 -3 mol [Pb 2+] = 1 X 10 -3 mol/0. 10015 dm 3 = 1, 0 X 10 -2 M [I-]2[Pb 2+] = (3 X 10 -4)2 M (1, 0 X 10 -2 ) = 9 X 10 -10 è minore del valore della Kps = 7. 1 X 10 -9 e quindi non precipita!

Quoziente di reazione (Qps) Pb. Cl 2 Pb 2+ + 2 Cl- Qps = [Pb 2+]iniz [ Cl-] iniz 2 = 0, 01 x 0, 015 > Kps ho soluzione sovra satura e quindi precipita lo ioduro di piombo in soluzione In generale: • Si ha precipitazione se Qps > Kps • Non si ha precipitazione se Qps < Kps • Si ha una soluzione è satura se Qps = Kps
![Prodotto di solubilità di alcune sostanze a 298 K [Ag+][Br-] [Ag+][Cl-] [Ag+][I-] [Ag+]2[CO 32 Prodotto di solubilità di alcune sostanze a 298 K [Ag+][Br-] [Ag+][Cl-] [Ag+][I-] [Ag+]2[CO 32](http://slidetodoc.com/presentation_image_h/c52464e72d1b74961106eaa8398ef50e/image-11.jpg)
Prodotto di solubilità di alcune sostanze a 298 K [Ag+][Br-] [Ag+][Cl-] [Ag+][I-] [Ag+]2[CO 32 -] [Ag+]2[Cr. O 42 -] [Ag+]2[SO 42 -] [Ba 2+][CO 32 -] [Ba 2+][Cr. O 42 -] [Ba 2+][SO 42 -] [Ca 2+][CO 32 -] [Ca 2+][C 2 O 42 -] [Ca 2+][F-]2 [Ca 2+][SO 42 -] [Ca 2+][OH-]2 [Cd 2+][S 2 -] [Co 2+][S 2 -] [Cu 2+][S 2 -] [Fe 2+][OH-]2 5, 0. 10 -13 2, 8. 10 -10 8, 5. 10 -17 8, 2. 10 -12 1, 5. 10 -49 7, 0. 10 -5 1, 5. 10 -8 8, 5. 10 -11 1, 5. 10 -10 4, 8. 10 -9 2, 0. 10 -9 3, 2. 10 -11 2, 4. 10 -5 5, 5. 10 -6 6, 0. 10 -27 5, 0. 10 -22 4, 0. 10 -36 1, 6. 10 -14 [Fe 3+][OH-]3 [Fe 2+][S 2 -] [Hg 2+][S 2 -] [Mg 2+][CO 32 -] [Mg 2+][F-]2 [Mg 2+][OH-]2 [Mn 2+][S 2 -] [Ni 2+][OH-]2 [Ni 2+][S 2 -] [Pb 2+][CO 32 -] [Pb 2+][Cr. O 42 -] [Pb 2+][Cl-]2 [Pb 2+][I-]2 [Pb 2+][S 2 -] [Pb 2+][SO 42 -] [Sn 2+][OH-]2 [Sn 2+][S 2 -] [Zn 2+][S 2 -] 1, 1. 10 -36 1, 5. 10 -18 1, 0. 10 -50 2, 6. 10 -5 7, 0. 10 -9 1, 2. 10 -11 2, 0. 10 -13 8, 0. 10 -14 1, 6. 10 -16 1, 0. 10 -22 1, 5. 10 -13 2, 0. 10 -16 2, 4. 10 -4 8, 3. 10 -9 1, 0. 10 -29 1, 3. 10 -8 1, 0. 10 -18 1, 0. 10 -22 1, 0. 10 -20

Solubilità Si definisce solubilità di una sostanza in un solvente (acqua) la massima quantità della sostanza in soluzione ad una data temperatura. La solubilità si esprime in mol x dm-3 oppure in g x dm-3 (grammi per litro) Se Na. Cl ha una solubilità di 20 g dm-3, significa che in un litro di H 2 O si sciolgono AL MASSIMO 20 g di Na. Cl. Se ne aggiungo, per es. 30 g, otterro’ un sistema nel quale 20 g di Na. Cl sono disciolti in soluzione (solubilizzati) e 10 g di Na. Cl si troveranno sul fondo della bottiglia, allo stato solido. CORPO DI FONDO SOLUZIONE SATURA

Esempi di calcolo Es. Sapendo che Kps Ag. Cl = 2. 8 x 10 -10, calcolare la concentrazione degli ioni in soluzione +] [Ag + Ag. Cl Ag + Cl - [ Cl ] [ Ag. Cl] Kps = [Ag+] [ Cl-] = x 2 = 2. 8 x 10 -10 x = 1. 7 x 10 -5
![Esempi di calcolo [Ag+] =1, 7 x 10 -5 [ Cl-] = 1, 7 Esempi di calcolo [Ag+] =1, 7 x 10 -5 [ Cl-] = 1, 7](http://slidetodoc.com/presentation_image_h/c52464e72d1b74961106eaa8398ef50e/image-14.jpg)
Esempi di calcolo [Ag+] =1, 7 x 10 -5 [ Cl-] = 1, 7 x 10 -5 Ag. Cl Ag+ + Cl- Significa che si é sciolto in soluzione una quantità di sale pari a 1, 7 x 10 -5 moli per dm 3 Quanti grammi di Ag. Cl si sciolgono in un dm 3 di H 2 O? 1. 7 x 10 -5 x PM Ag. Cl

Esempio di calcolo Es. Sapendo che Kps (Fe(OH)2) = 1. 6 x 10 -14, calcolarne la solubilità. Kps = [Fe 2+] [ OH-]2 = 4 x 3 = 1. 6 x 10 -14 x = 1. 6 x 10 -5 La concentrazione di Fe 2+ è uguale alla concentrazione di Fe(OH)2 e quindi il suo valore esprime la solubilità dell’idrossido di Fe(II), mentre la concentrazione degli OH- è due volte quella dell’idrossido e quindi il suo valore non esprime la solubilità dell’idrossido di Fe(II).

La solubilità e la Kps sono correlate. Sapendo Kps mi posso calcolare la solublità e viceversa sapendo la solubilità mi posso calcolare la Kps

Esempio di calcolo La solubilità in acqua del solfato di calcio a 25°C è 0. 20 g per 100 ml. Calcolare la Kps? [Ca 2+]= [SO 42 -] = 0. 20/136*0. 1= 0. 015 M Kps = [Ca 2+] [ SO 4 -2] = 0. 015 * 0. 015 = 2. 3 X 10 -4

Effetto dello ione a comune Poiché il valore del Kps dipende solo dalla temperatura, il prodotto di solubilità deve risultare soddisfatto in qualunque soluzione che contenga ioni Mu+ e Xv-, da qualunque composto essi provengano Dal principio di Le Chatelier si può quindi prevedere che la solubilità di un sale diminuisca in una soluzione contenente uno ione a comune con il sale.

Effetto dello ione a comune Es. Si determini la solubilità di Ag. Cl in una soluzione 0. 10 M in Na. Cl. La conc. totale di Cl- in soluzione sarà 0. 10 + quella che deriva dalla solubilizzazione di Ag. Cl. Quest’ultima sarà uguale alla conc. di Ag+. Kps = 2. 8 x 10 -10 = [Ag+][Cl-] = x (x+0. 10) 2. 8 x 10 -10 0. 10 x [Ag+] = 2. 8 x 10 -9 In acqua pura la solubilità sarebbe stata [Ag+] = 1. 6 x 10 -5

Quali sono le condizioni che favoriscono la precipitazione? ü un valore molto basso della Kps (la concentrazione dello ione interessato che rimane in soluzione sarà molto bassa) üUna concentrazione iniziale alta dello ione interessato (la concentrazione dello ione interessato che resta in soluzione sarà solo una piccolissima frazione del valore iniziale) üUna concentrazione dello ione comune molto più alta di quella dello ione interessato (ciò significa che la concentrazione dello ione comune resterà quasi costante durante la precipitazione)

Precipitazione e ridiscioglimento di composti poco solubili attraverso variazioni di p. H Se nell’equazione del prodotto di solubilità sono presenti ioni H+, OH- o in generale ioni la cui concentrazione dipende dal p. H (come S 2 -, CH 3 COO-, …) la solubilità del composto varia col p. H e quindi può essere controllata.

Solubilità in acqua di ioni metallici Molti ioni metallici hanno un idrossido poco solubile Kps = [Al 3+] [OH-]3 [OH-] dipende dal p. H della soluzione [Al 3+] = Kps / [OH-]3 Al variare del p. H, la solubilità dello ione alluminio varia in modo sostanziale. In ambiente acido lo ione metallico è molto solubile, ma se l’aciditià diminuisce la solubilita’ diminuisce di conseguenza. Al di sopra di un certo valora di p. H sarà impossibile avere in soluzione lo ione metallico.
![Solubilità in acqua di ioni metallici [Al 3+] = Kps / [OH-]3 Al variare Solubilità in acqua di ioni metallici [Al 3+] = Kps / [OH-]3 Al variare](http://slidetodoc.com/presentation_image_h/c52464e72d1b74961106eaa8398ef50e/image-23.jpg)
Solubilità in acqua di ioni metallici [Al 3+] = Kps / [OH-]3 Al variare del p. H, la solubilità dello ione alluminio varia in modo sostanziale. In ambiente acido lo ione metallico è molto solubile, ma se l’aciditià diminuisce la solubilita’ diminuisce di conseguenza. Al di sopra di un certo valora di p. H sarà impossibile avere in soluzione lo ione metallico. [Al 3+] p. H 1 4000000 2 4000 3 4 4 0, 004 5 0, 000004 6 0, 00004 7 4 E-12 8 4, 00 E-15 9 4, 00 E-18 10 4, 00 E-21

Solubilità in acqua di ioni metallici: idrossidi anfoteri Zn(OH)2 Zn 2+ + 2 OH- Kps = [Zn 2+] [OH-]2 [OH-] dipende dal p. H della soluzione ma anche può agire complessando lo Zn formando Zn(OH)4 - sottraendo quindi ioni Zn 2+ all’equilibrio e quindi una certa quantità di Zn(OH) 2 si deve ridisciogliere affinche’ la Kps sia verificata. Zn 2+ + 4 OH- Zn(OH)4 - La formazione di un complesso che coinvolge almeno una delle specie che costituiscono il sale poco solubile aumenta la solubilità del sale poco solubile e maggiore è la Kst del complesso maggiore sarà la solubilità ottenuta

Ridiscioglimento di precipitati attraverso formazione di complessi Ag. Cl Ag+ + Cl- Kps = 2. 8 x 10 -10 Ag. Br Ag+ + Br- Kps = 2. 8 x 10 -13 Ag. I Ag+ + I- Ag+ + 2 NH 3 Kps = 2. 8 x 10 -17 Ag(NH 3)2+ Kst = 1. 7 x 107 Soluzione ammonica diluita è sufficiente per portare Ag. Cl in soluzione, ma per Ag. Br ho bisogno di soluzione di ammoniaca concentrata. Ag. I non si scioglie in ammoniaca, ma si scioglie in KCN perche’ la costante di stabilità Ag(CN)2 - è molto maggiore di Ag(NH 3)+
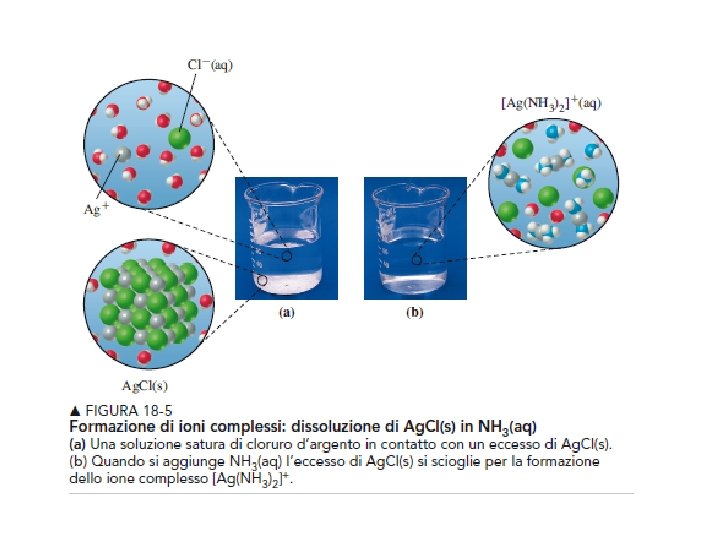

Esempio: solubilizzazione di Ag. Cl(s) + 2 NH 3 Ag. Cl y Ag(NH 3)2+ Kinst = 7. 1 x 10 -8 = x Ag+ Ag(NH 3)2+ + Cl- Kps = 2. 8 x 10 -10 Ag+ + 2 NH 3 [Ag+] [NH 3]2 [Ag(NH 3)2+] = Kinst = 7. 1 x 10 -8 x (1 -2 y)2 y [NH 3]= 1 M Kps = 2. 8 x 10 -10 = [Ag+] [Cl-] = x (x+y) [Ag(NH 3)2+] [Cl-] Approssimazione: Ag+ è tutto complessato
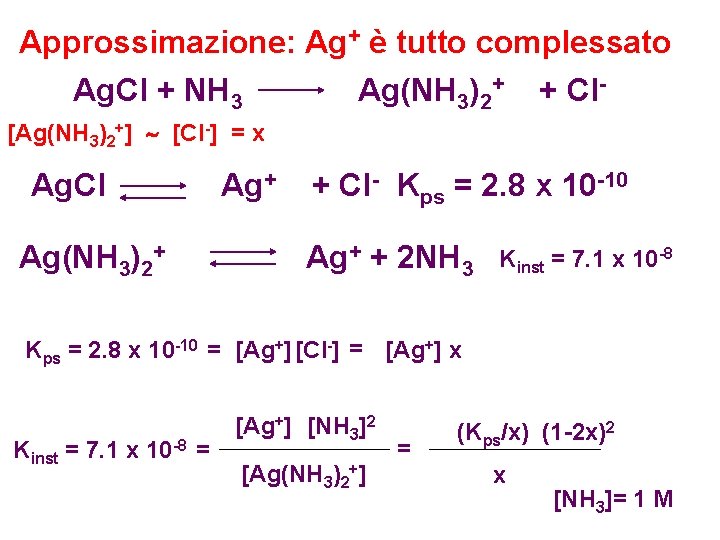
Approssimazione: Ag+ è tutto complessato Ag. Cl + NH 3 Ag(NH 3)2+ + Cl[Ag(NH 3)2+] [Cl-] = x Ag. Cl Ag(NH 3)2+ Ag+ + Cl- Kps = 2. 8 x 10 -10 Ag+ + 2 NH 3 Kinst = 7. 1 x 10 -8 Kps = 2. 8 x 10 -10 = [Ag+] [Cl-] = [Ag+] x Kinst = 7. 1 x 10 -8 = [Ag+] [NH 3]2 [Ag(NH 3)2+] = (Kps/x) (1 -2 x)2 x [NH 3]= 1 M

Conclusione: L’efficacia della formazione di complessi ai fini della solubilità del sale poco solubile è tanto maggiore quanto maggiore è la costante di stabilità del complesso e quanto maggiore è il prodotto di solubilità del sale.
- Slides: 29