EQUAZIONI DIFFERENZIALI Funzioni che mettono in relazione una




















![CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod μ [g/gh] μmax m CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod μ [g/gh] μmax m](https://slidetodoc.com/presentation_image_h/22b36545ae06b3fa98d13819ecf5c4c3/image-35.jpg)
















- Slides: 56

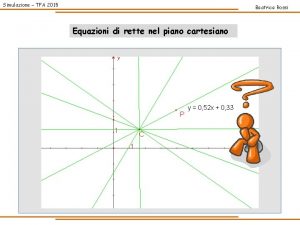
EQUAZIONI DIFFERENZIALI Ø Funzioni che mettono in relazione una variabile indipendente (es. x), una sua funzione ( es. y = f(x) ) e la derivata di quest’ultima ( es. y’ = f’ (x) ). ESEMPIO F(x, y(x), y′ (x), . . . , y(n) (x)) = 0 (1. 1) ØOrdine: massimo grado di derivazione che compare nell’equazione differenziale. SOLUZIONI Generale Ogni equazione differenziale ha infinite soluzioni che differiscono per una costante. Si dirà integrale generale dell’equazione (1. 1) una formula che rappresenti la famiglia di tutte le soluzioni dell’equazione (1. 1), eventualmente al variare di uno o più parametri in essa contenuti. Particolare Si ottiene applicando la condizione iniziale alla soluzione generale trovata

VELOCITÀ DI REAZIONE üIl procedere di una reazione può essere seguito misurando l’ammontare di sostanza di un componente (reagente o prodotto) in tempi successivi üPer velocità di reazione si intende la variazione dell’ammontare di sostanza nell’unità di tempo üNella maggior parte dei casi è conveniente riferire la velocità di reazione a variazioni di concentrazioni üLa velocità di reazione riferita alla concentrazione C di un reagente è data dal valore assoluto della derivata della concentrazione rispetto al tempo

Per una generica reazione • La velocità di reazione si scrive

EFFETTO DELLA CONCENTRAZIONE Consideriamo la reazione omogenea di decomposizione termica del pentossido di azoto Riportando in grafico la velocità della reazione (come variazione della concentrazione del pentossido nel tempo) in funzione del tempo si ottiene una retta, quindi La velocità di decomposizione è proporzionale alla concentrazione di quindi Una reazione che segue una legge di questo tipo viene detta reazione del primo ordine e la costante di proporzionalità è detta costante di -1 velocità o velocità specifica del primo ordine. Le dimensioni di k sono tempo

REAZIONI DEL PRIMO ORDINE • Occorre trovare una relazione tra le concentrazioni e il tempo • Supponiamo che la reazione A prodotti segua una cinetica del primo ordine ricordando la definizione di velocità di reazione: Possiamo scrivere Questa espressione viene chiamata legge cinetica differenziale. Per ottenere un’espressione in cui la dipendenza della concentrazione di A dal tempo sia esplicita è necessario integrare la legge differenziale. Riarrangiando l’equazione precedente, otteniamo

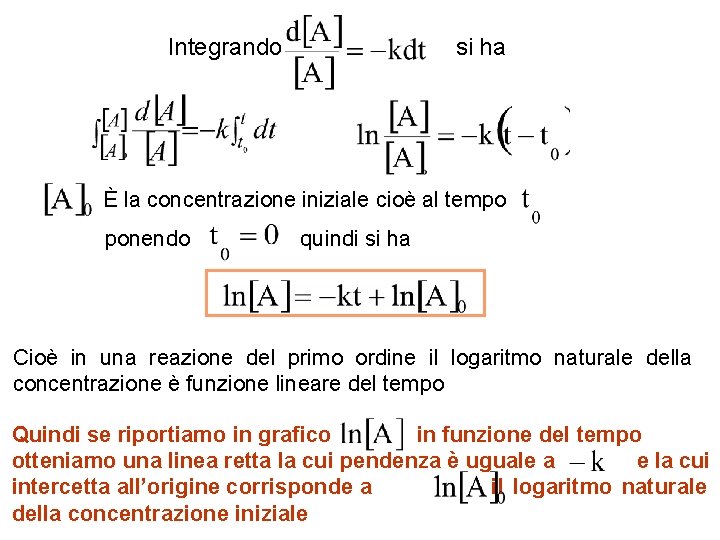
Integrando si ha È la concentrazione iniziale cioè al tempo ponendo quindi si ha Cioè in una reazione del primo ordine il logaritmo naturale della concentrazione è funzione lineare del tempo Quindi se riportiamo in grafico in funzione del tempo otteniamo una linea retta la cui pendenza è uguale a e la cui intercetta all’origine corrisponde a il logaritmo naturale della concentrazione iniziale

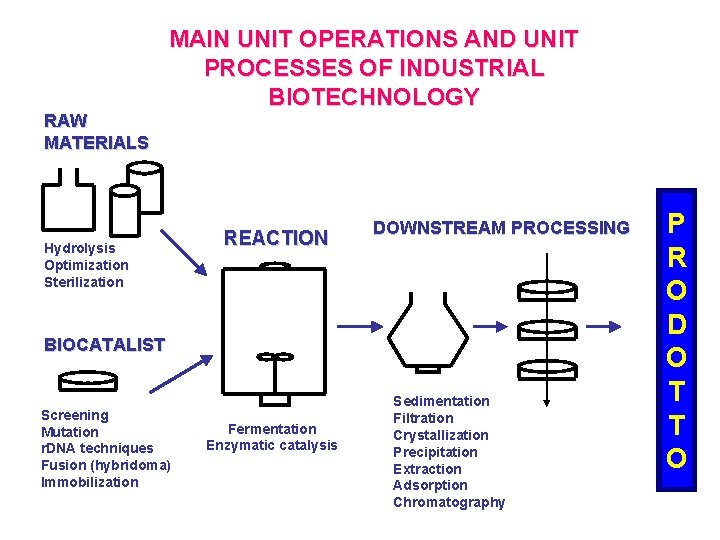
RAW MATERIALS MAIN UNIT OPERATIONS AND UNIT PROCESSES OF INDUSTRIAL BIOTECHNOLOGY Hydrolysis Optimization Sterilization REACTION DOWNSTREAM PROCESSING BIOCATALIST Screening Mutation r. DNA techniques Fusion (hybridoma) Immobilization Fermentation Enzymatic catalysis Sedimentation Filtration Crystallization Precipitation Extraction Adsorption Chromatography P R O D O T T O

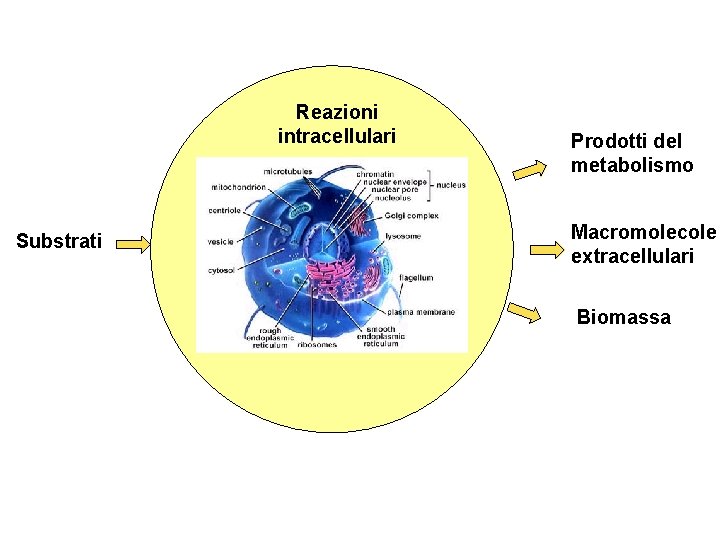
Reazioni intracellulari Substrati Prodotti del metabolismo Macromolecole extracellulari Biomassa

Un biotecnologo mira ad usare i sistemi biologici per massimizzare i profitti e ottimizzare l'efficienza di utilizzazione delle risorse. Per realizzare questo obiettivo, i sistemi cellulari devono essere descritti quantitativamente. Ovvero è necessario conoscere la cinetica del processo poiché solo determinando la cinetica del sistema è possibile predire le rese ed i tempi di reazione e consentire così corretta progettazione del processo di produzione.

DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Occorre costruire un modello matematico del sistema reale. Esso non è altro che un insieme di equazioni, più o meno complesse, che legano tra loro le grandezze che influenzano l’evoluzione del sistema stesso. Normalmente, nello studio di un sistema reale, si individuano alcune variabili considerate come dati d’ingresso dello studio, eventuali parametri costanti ed alcune variabili di uscita; queste ultime sono le grandezze che si vogliono osservare al variare dei dati di ingresso. Le equazioni di un modello sono, quindi, relazioni funzionali tra le grandezze di ingresso e di uscita. Le relazioni sono espresse sotto forma di equazioni matematiche, in dettaglio i modelli sono descritti da equazioni differenziali. lo scopo della modellazione – predizione – ottimizzazione – controllo di processo

DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Tappe della descrizione quantitativa di un processo fermentativo üDescrivere la cinetica del processo, descrivendo le velocità delle reazioni cellulari come funzioni delle variabili attraverso espressioni matematiche üDescrivere il bilancio di massa, specificando come questo parametro varia nel tempo e cosa entra o esce dal reattore üDefinire la complessità del modello, definendo il numero di reazioni da considerare e la loro stechiometria üValutazione dell’adattamento del modello ai dati sperimentali

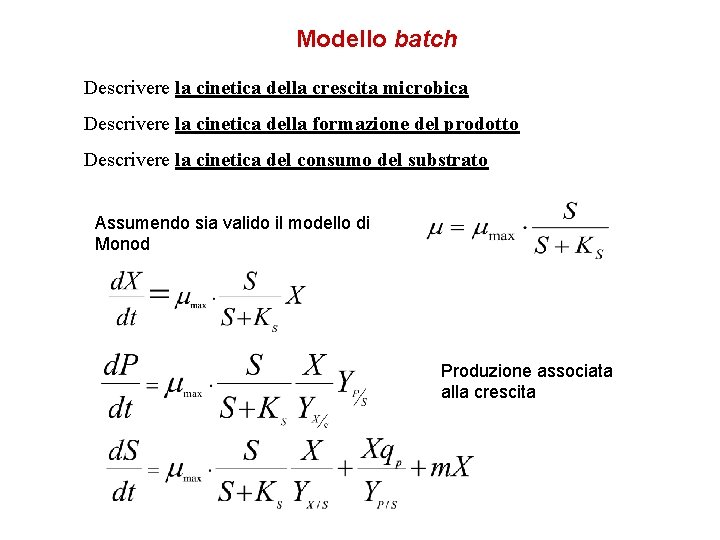
DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Definire espressioni che descrivono come la concentrazione dei componenti (Y variabili di stato) X N S P [g L-1] [n. L-1] [g L-1] Peso secco della biomassa Numero di Cellule Substrato Prodotto üVariano con le condizioni del processo üVariano nel tempo: cinetica del processo Descrivere la cinetica della crescita microbica Descrivere la cinetica della formazione del prodotto Descrivere la cinetica del consumo del substrato

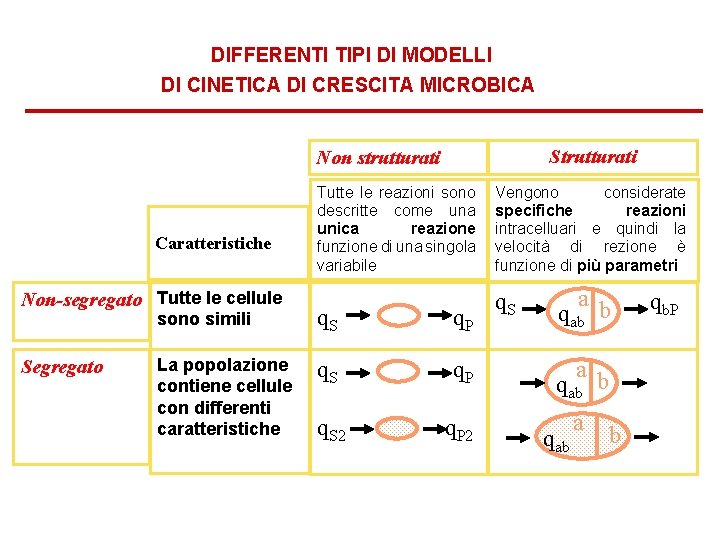
DIFFERENTI TIPI DI MODELLI DI CINETICA DI CRESCITA MICROBICA Strutturati Non strutturati Caratteristiche Non-segregato Tutte le cellule Segregato Tutte le reazioni sono descritte come una unica reazione funzione di una singola variabile Vengono considerate specifiche reazioni intracelluari e quindi la velocità di rezione è funzione di più parametri q. S a b qab sono simili q. S q. P La popolazione contiene cellule con differenti caratteristiche q. S q. P a qab b q. S 2 q. P 2 a qab b qb. P

Noi useremo MODELLI DELLA CINETICA DI CRESCITA MICROBICA NON-SEGREGATI e NON–STRUTTURATI NON-SEGREGATI: si assume che tutte le cellule siano simili Cioè hanno tutte la stessa “età”, lo stesso numero di copie di plasmide, la stessa dimensione, la stessa morfologia…… NON–STRUTTURATI: si assume che la velocità di reazione non sia influenzata dalla struttura intra-cellulare, cioè si assume che la struttura intra-cellulare rimanga sempre la stessa Modello della cellula come scatola nera

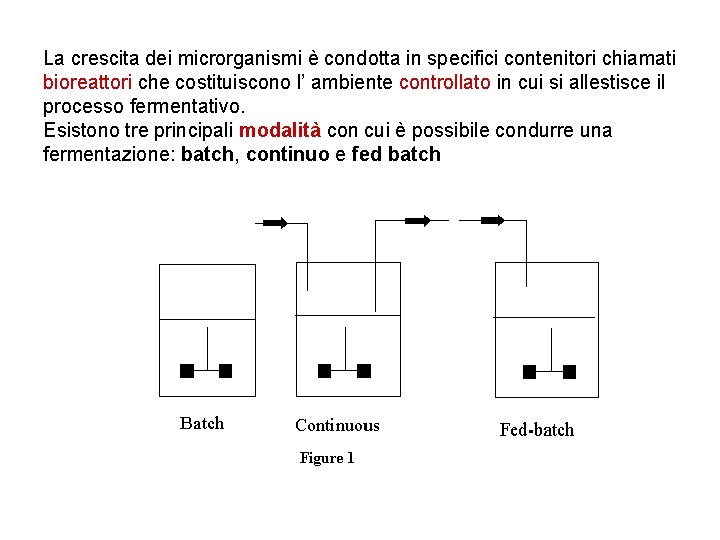
La crescita dei microrganismi è condotta in specifici contenitori chiamati bioreattori che costituiscono l’ ambiente controllato in cui si allestisce il processo fermentativo. Esistono tre principali modalità con cui è possibile condurre una fermentazione: batch, continuo e fed batch

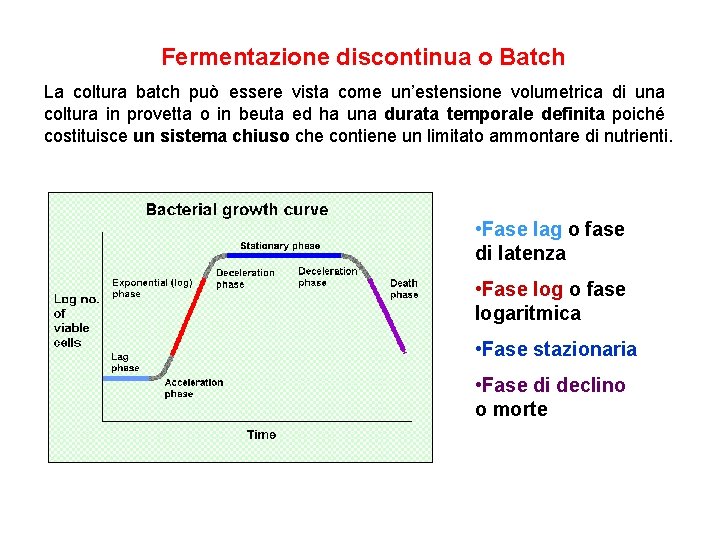
Fermentazione discontinua o Batch La coltura batch può essere vista come un’estensione volumetrica di una coltura in provetta o in beuta ed ha una durata temporale definita poiché costituisce un sistema chiuso che contiene un limitato ammontare di nutrienti. • Fase lag o fase di latenza • Fase log o fase logaritmica • Fase stazionaria • Fase di declino o morte

Fermentazione discontinua o Batch In fase esponenziale non solo la concentrazione cellulare aumenta ma lo fa in maniera esponenziale. Avviene un processo definito auto-catalitico in cui, se gli altri parametri restano costanti, la velocità di aumento della biomassa (cellule) dipende dalla concentrazione di cellule presenti nel bioreattore Where X is the concentration of biomass in the bioreactor. Biomass concentrations are typically expressed in g/l Modello esponenziale o di Malthus µ = Velocità specifica di crescita [kgkg-1 h-1] Rappresenta la velocità di incremento di biomassa per unità di massa di cellule. Descrive l’evoluzione della coltura nel tempo.

Descrive lo sviluppo in uno stadio crescita cellulare. qualsiasi della se µ è costante integrando si ha Queste relazioni sono valide solo nella fase di crescita definita appunto esponenziale Nel caso di una crescita bilanciata ovvero con Incremento ordinato di tutti i componenti chimici della cellula di organismi che si moltiplicano per fissione binaria.

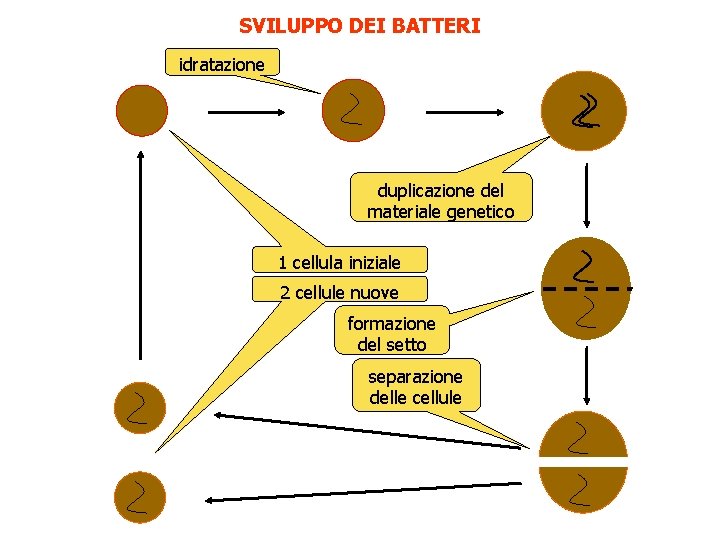
SVILUPPO DEI BATTERI idratazione duplicazione del materiale genetico 1 cellula iniziale 2 cellule nuove formazione del setto separazione delle cellule

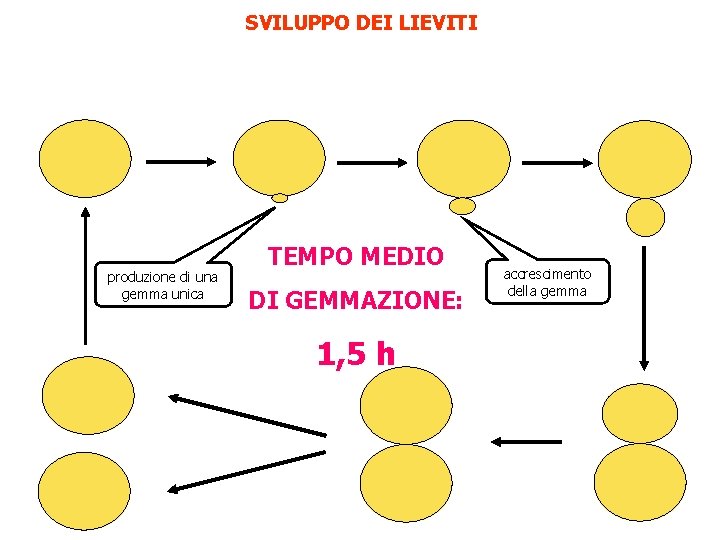
SVILUPPO DEI LIEVITI produzione di una gemma unica TEMPO MEDIO DI GEMMAZIONE: 1, 5 h accrescimento della gemma

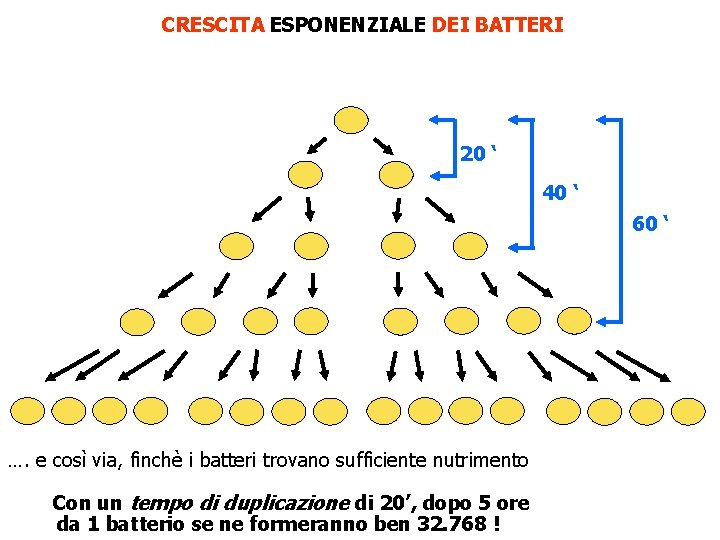
CRESCITA ESPONENZIALE DEI BATTERI 20 ‘ 40 ‘ 60 ‘ …. e così via, finchè i batteri trovano sufficiente nutrimento Con un tempo di duplicazione di 20’, dopo 5 ore da 1 batterio se ne formeranno ben 32. 768 !

Espressione matematica della crescita microbica in funzione del numero di cellule CRESCITA MICROBICA Crescita di una popolazione di microrganismi in determinate condizioni colturali = aumento del numero di cellule in un dato Δt n = numero di generazioni o numero totale di duplicazioni td = tempo di generazione o di duplicazione Al tempo t: ln N 0 t

Al tempo t Velocità di sviluppo caratteristica di ciascun microrganismo in una data condizione td il tempo di duplicazione è caratteristico di ciascun microrganismo in un dato ambiente di sviluppo. In fase esponenziale questo valore si può considerare costante

DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Definire espressioni che descrivono come la concentrazione dei componenti (Y variabili di stato) X N S P [g L-1] [n. L-1] [g L-1] Peso secco della biomassa Numero di Cellule Substrato Prodotto üVariano con le condizioni del processo üVariano nel tempo: cinetica del processo Descrivere la cinetica della crescita microbica Descrivere la cinetica della formazione del prodotto Descrivere la cinetica del consumo del substrato

CINETICA DI CRESCITA CELLULARE IN BATCH DURANTE UN PROCESSO IN BATCH, LA VARIAZIONE DELLA CONCENTRAZIONE DI BIOMASSA (O DEL NUMERO DI CELLULE) NELL’UNITA’ DI TEMPO DIPENDE DALLA BIOMASSA STESSA X (NUMERO DI CELLULE N) E DALLA VELOCITA’ SPECIFICA DI CRESCITA IN QUELLE CONDIZIONI µ µ = Velocità specifica di crescita [kgkg-1 h-1], Descrive l’evoluzione della coltura nel tempo

Come varia µ durante la crescita batch AB C D E F In fase esponenziale Specific growth rate µ [h-1] In fase lag e in fase stazionaria Time

CINETICA DI CRESCITA CELLULARE IN BATCH Anche nelle migliori condizioni colturali una certa quota della popolazione microbica va incontro a morte con una certa velocità quindi la massa microbica presente ad un qualunque tempo t dovrà essere decurtata di un certo fattore di correzione Questo fattore è trascurabile in fase log in cui ma in fase stazionaria diviene rilevante poiché ≥

µ la velocità specifica di crescita S p. H µ T ecc… dove s 1, s 2. . . , sn sono le concentrazioni dei singoli componenti del substrato S, T la temperatura ed i l'azione di inibitori, mentre tra parentesi quadre vengono indicate le attività di ioni o molecole presenti

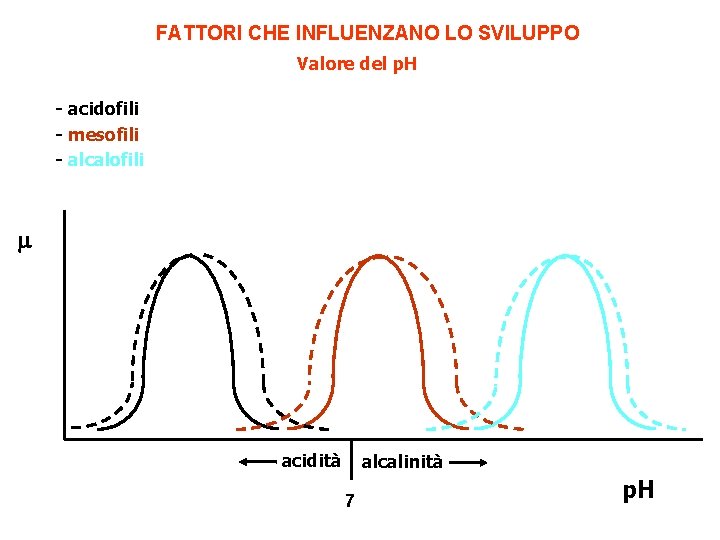
FATTORI CHE INFLUENZANO LO SVILUPPO Valore del p. H - acidofili - mesofili - alcalofili acidità alcalinità 7 p. H

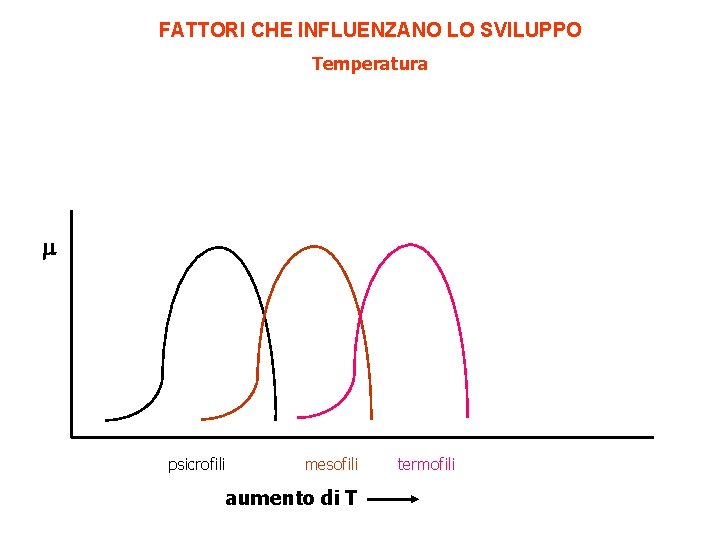
FATTORI CHE INFLUENZANO LO SVILUPPO Temperatura psicrofili mesofili aumento di T termofili

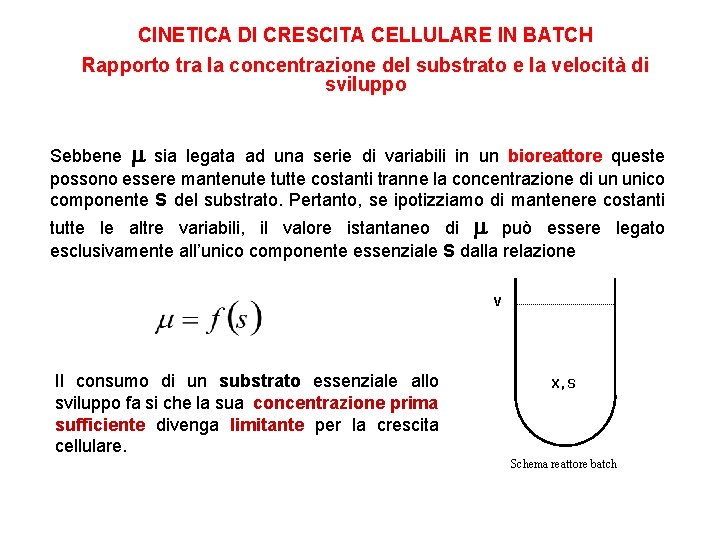
CINETICA DI CRESCITA CELLULARE IN BATCH Rapporto tra la concentrazione del substrato e la velocità di sviluppo Sebbene sia legata ad una serie di variabili in un bioreattore queste possono essere mantenute tutte costanti tranne la concentrazione di un unico componente S del substrato. Pertanto, se ipotizziamo di mantenere costanti tutte le altre variabili, il valore istantaneo di può essere legato esclusivamente all’unico componente essenziale S dalla relazione V Il consumo di un substrato essenziale allo sviluppo fa si che la sua concentrazione prima sufficiente divenga limitante per la crescita cellulare. X, S Schema reattore batch


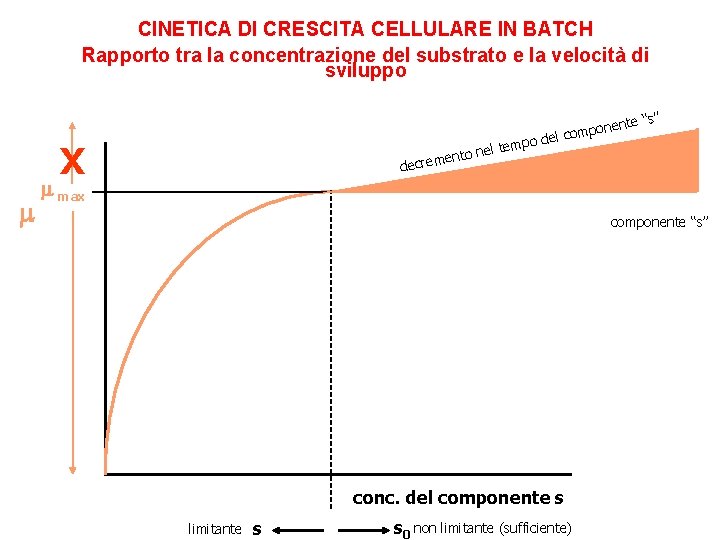
CINETICA DI CRESCITA CELLULARE IN BATCH Rapporto tra la concentrazione del substrato e la velocità di sviluppo te “s” n mpone o c l e d tempo l e n o ent decrem X max componente “s” conc. del componente s limitante s s 0 non limitante (sufficiente)

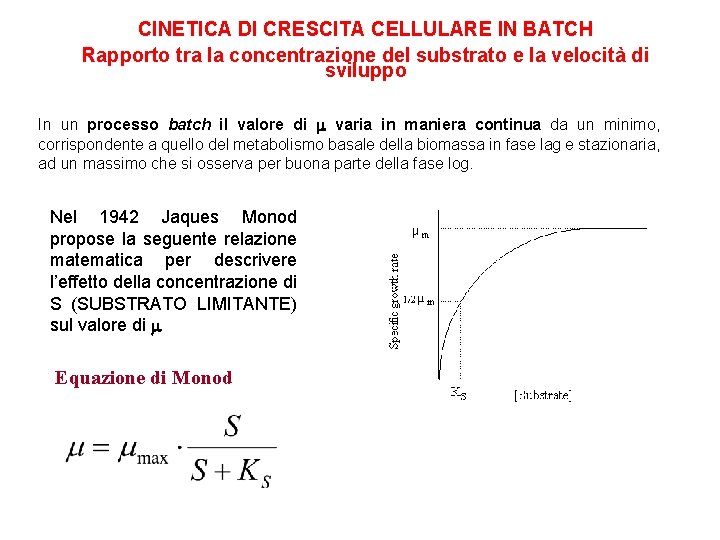
CINETICA DI CRESCITA CELLULARE IN BATCH Rapporto tra la concentrazione del substrato e la velocità di sviluppo In un processo batch il valore di varia in maniera continua da un minimo, corrispondente a quello del metabolismo basale della biomassa in fase lag e stazionaria, ad un massimo che si osserva per buona parte della fase log. Nel 1942 Jaques Monod propose la seguente relazione matematica per descrivere l’effetto della concentrazione di S (SUBSTRATO LIMITANTE) sul valore di Equazione di Monod
![CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod μ ggh μmax m CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod μ [g/gh] μmax m](https://slidetodoc.com/presentation_image_h/22b36545ae06b3fa98d13819ecf5c4c3/image-35.jpg)
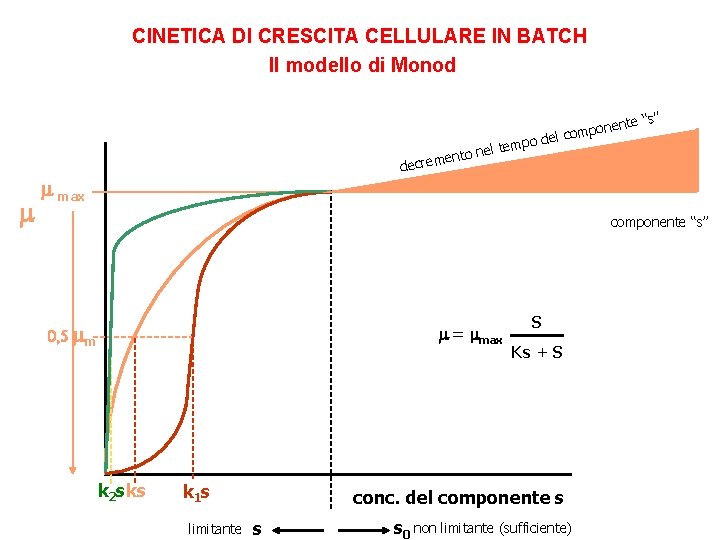
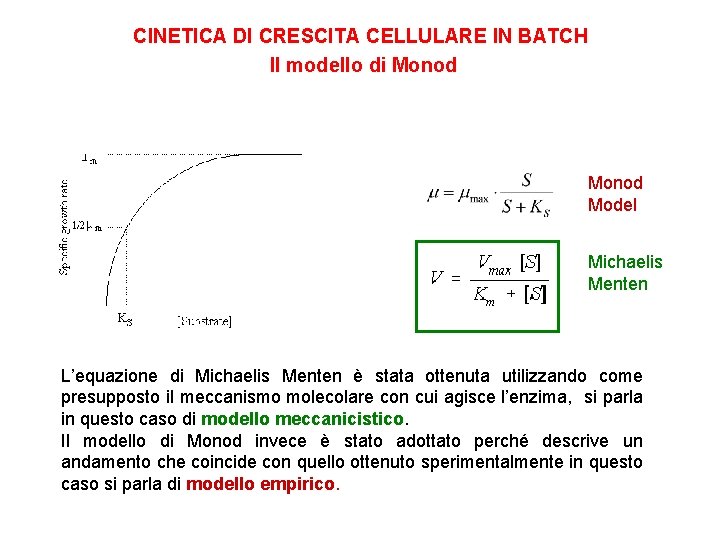
CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod μ [g/gh] μmax m è la velocità di sviluppo osservata è la velocità massima nelle condizioni di coltura mmax S è la concentrazione substrato limitante KS I valori di µmax e Ks dipendono dal l’organismo, il substrato limitante, il terreno di coltura, condizioni ambientali quali p. H e temperatura. Il range di valori per µmax è tra 0. 01 e 3 h-1. La costante di Monod assume tipicamente valori al di sotto di 0. 1 g. L-1. del KS è la costante di affinità, ossia la concentrazione del substrato limitante alla quale il valore di è la metà della massima. Rappresenta quindi un indice dell’efficienza con cui un microrganismo riesce ad utilizzare il substrato

CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod te “s” n mpone o c l e d tempo l e n o ent decrem max componente “s” 0, 5 m = max k 2 sks k 1 s limitante S Ks + S conc. del componente s s s 0 non limitante (sufficiente)

CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod

CINETICA DI CRESCITA CELLULARE IN BATCH Il modello di Monod Model Michaelis Menten L’equazione di Michaelis Menten è stata ottenuta utilizzando come presupposto il meccanismo molecolare con cui agisce l’enzima, si parla in questo caso di modello meccanicistico. Il modello di Monod invece è stato adottato perché descrive un andamento che coincide con quello ottenuto sperimentalmente in questo caso si parla di modello empirico.

CINETICA DI CRESCITA CELLULARE IN BATCH Altri modelli Questi modelli sono tutti empirici ed è futile discutere per stabilire quale sia il migliore , semplicemente bisogna scegliere quello più adatto a descrivere il comportamento del microrganismo di interesse!!!!


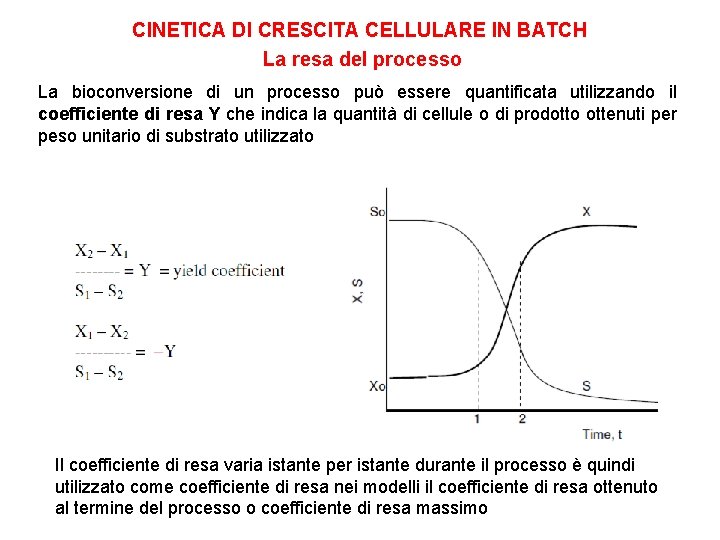
CINETICA DI CRESCITA CELLULARE IN BATCH La resa del processo La bioconversione di un processo può essere quantificata utilizzando il coefficiente di resa Y che indica la quantità di cellule o di prodotto ottenuti per peso unitario di substrato utilizzato Il coefficiente di resa varia istante per istante durante il processo è quindi utilizzato come coefficiente di resa nei modelli il coefficiente di resa ottenuto al termine del processo o coefficiente di resa massimo

CINETICA DI CRESCITA CELLULARE IN BATCH La resa del processo La resa di un processo batch è il rapporto tra il substrato utilizzato e la biomassa (o un dato prodotto) ottenuti durante il processo X 0 and S 0 are the initial concentration of biomass and substrate concentrations X 1 and S 1 are the respective biomass and substrate concentration at the end of the fermentation where P 0 and P 1 are the initial and final product concentrations. I coefficienti di resa Y sono usati per la modellazione del processo fermentativo

CINETICA DI CRESCITA CELLULARE IN BATCH La resa del processo YX/S è coefficiente di resa di biomassa per substrato consumato [g g -1] Esprime in termini quantitativi il fabbisogno nutrizionale QUANDO LA COLTURA RAGGIUNGE IL SUO MASSIMO In batch le concentrazioni di biomassa X e di prodotto P sono proporzionali alla concentrazione iniziale del substrato So. Questo spiega perché per ottenere più prodotto si tende ad incrementare la concentrazione del substrato iniziale

DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Definire espressioni che descrivono come la concentrazione dei componenti (Y variabili di stato) X N S P [g L-1] [n. L-1] [g L-1] Peso secco della biomassa Numero di Cellule Substrato Prodotto üVariano con le condizioni del processo üVariano nel tempo: cinetica del processo Descrivere la cinetica della crescita microbica Descrivere la cinetica della formazione del prodotto Descrivere la cinetica del consumo del substrato

LA CINETICA DI FORMAZIONE DEL PRODOTTO IN BATCH Nel caso di prodotti associati alla crescita poichè sostituendo si ha che… o

LA CINETICA DI FORMAZIONE DEL PRODOTTO IN BATCH SE IL PRODOTTO E’ GROWTH LINKED q. P è proporzionale a µ Più IN GENERALE Se il prodotto è GROWTH-LINKED =0 Se il prodotto è UNLINKED α =0 q. P= Nel caso in cui il prodotto non è associato alla crescita la qp dipende dalla biomassa ma solo nella fase della crescita in cui c’è sintesi del prodotto.

DESCRIZIONE QUANTITATIVA DEL PROCESSO FERMENTATIVO Definire espressioni che descrivono come la concentrazione dei componenti (Y variabili di stato) X N S P [g L-1] [n. L-1] [g L-1] Peso secco della biomassa Numero di Cellule Substrato Prodotto üVariano con le condizioni del processo üVariano nel tempo: cinetica del processo Descrivere la cinetica della crescita microbica Descrivere la cinetica della formazione del prodotto Descrivere la cinetica del consumo del substrato

CINETICA DI CONSUMO DEL SUBSTRATO IN BATCH La concentrazione del substrato S cambierà nel tempo, ossia tenderà comunque a diminuire, secondo un'equazione generale del tipo Concentrazione substrato IN substrato per la crescita substrato per il prodotto substrato per il mantenimento substrato OUT RICORDANDO CHE FS 0/V l’ingresso di substrato fresco e –FS/V l’ uscita di substrato parzialmente consumato dal reattore. Entrambi i termini in un processo batch sono pari a zero.

CINETICA DI CONSUMO DEL SUBSTRATO IN BATCH Dividendo per X Da cui 1/X • d. S/dt indica la velocità specifica di consumo del substrato

CINETICA DI CONSUMO DEL SUBSTRATO IN BATCH qs è proporzionale alla velocità di sviluppo , alla sintesi del prodotto qp ed al metabolismo basale della biomassa m. Nel caso che il substrato venga utilizzato, oltre che per il mantenimento, solo per la sintesi della biomassa la velocità specifica di consumo qs sarà espressa da

CINETICA DI CONSUMO DEL SUBSTRATO IN BATCH COEFFICIENTE DI MANTENIMENTO m (kg kg-1 h-1) Coefficiente che tiene conto del consumo di S non associato ne alla sintesi di biomassa ne alla sintesi del prodotto. Il mantenimento è necessario a mantenere gradienti di concentrazione attraverso la membrana cellulare, sostituire proteine ed altri componenti che sono degradati, sostenere processi che non supportano la crescita ma prevengono la morte. Il mantenimento è tipicamente 1 -10% di qs, max; ma può essere più alto in cellule stressate: poiché il mantenimento è in parte usato per mantenere gradienti di concentrazione ambienti estremi rispetto a concentrazione salina, p. H e temperatura determinano un aumento del mantenimento e una riduzione del coefficiente di resa

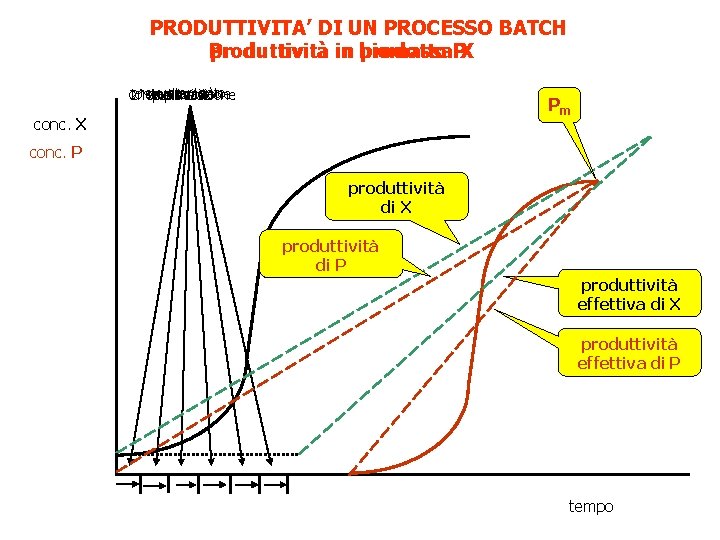
Produttività nel processo batch Con il termine di produzione si indica la quantità di biomassa o di prodotti ottenuti alla fine del processo. La produzione totale si limita a quantificare il prodotto P ottenuto alla fine del processo senza tener conto del tempo impiagato per ottenerlo e può essere espressa in g. La produttività specifica qp corrisponde alla velocità di produzione del prodotto/o biomassa e viene calcolata come g di P o di cellule su h. La produttività volumetrica Q è la concentrazione delle cellule o di P per volume unitario e per unità di tempo ed è espressa in g/l • h Xmax è il massimo della concentazione cellulare raggiunto durante la fermentazione X 0 è la concentrazione iniziale all’inoculo ti è il tempo in cui il microrganismo cresce con velocità massima mmax tii è il tempo in cui il microrganismo non cresce a mmax(fase lag, stazionaria, tempo di sterilizzazione…)

PRODUTTIVITA’ DI UN PROCESSO BATCH Produttività produttività in biomassa prodotto PX svuotamento 1^sterilizzazione contr. sterilità riempimento pulizia 2^ sterilizzazione Pm conc. X conc. P produttività di X produttività di P produttività effettiva di X produttività effettiva di P tempo

Modello batch - la velocità specifica di sviluppo della biomassa X, - la velocità specifica di sintesi del prodotto P - la velocità specifica di utilizzazione del substrato S

Modello batch Descrivere la cinetica della crescita microbica Descrivere la cinetica della formazione del prodotto Descrivere la cinetica del consumo del substrato Assumendo sia valido il modello di Monod Produzione associata alla crescita

Logistic Equation Rate Expression for Growth (1) Yield Expression (2) Substituting into Eq. 1 for S from Eq 2: Integrating Describes Sigmoidal shape batch growth curve
 Equazioni differenziali schema riassuntivo
Equazioni differenziali schema riassuntivo Schema equazioni differenziali
Schema equazioni differenziali Metodo di eulero
Metodo di eulero Equazioni differenziali applicazioni economiche
Equazioni differenziali applicazioni economiche Siate di quelli che mettono in pratica la parola
Siate di quelli che mettono in pratica la parola Quanto ci mette una lattina a decomporsi
Quanto ci mette una lattina a decomporsi Cos'è un trasduttore
Cos'è un trasduttore Costi emergenti e costi cessanti
Costi emergenti e costi cessanti Frasi sulla testa dura
Frasi sulla testa dura Frasi oggettive esplicite
Frasi oggettive esplicite La vita che avrai non sarà mai distante dall'amore che dai
La vita che avrai non sarà mai distante dall'amore che dai Che che kooley
Che che kooley Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Esempio relazione tirocinio
Esempio relazione tirocinio Svolgere una relazione
Svolgere una relazione Esempio di relazione
Esempio di relazione Los elementos de las ondas
Los elementos de las ondas Mittente e destinatario
Mittente e destinatario Funzioni del csm
Funzioni del csm Trasformazioni geometriche funzioni goniometriche
Trasformazioni geometriche funzioni goniometriche Teoremi sulle funzioni continue
Teoremi sulle funzioni continue Ciclo vitale dei viventi
Ciclo vitale dei viventi Equazioni esponenziali non elementari
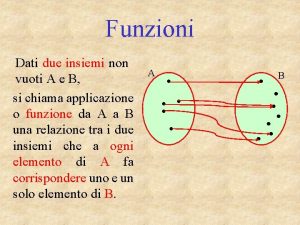
Equazioni esponenziali non elementari Introduzione alle funzioni
Introduzione alle funzioni Circolo portale ipofisario
Circolo portale ipofisario Funzioni trascendenti
Funzioni trascendenti Pulsazione di una funzione goniometrica
Pulsazione di una funzione goniometrica Funzioni vitali esseri viventi
Funzioni vitali esseri viventi Funzioni in c
Funzioni in c Esercizi equazioni esponenziali zanichelli
Esercizi equazioni esponenziali zanichelli Elementi fiaba
Elementi fiaba Studio di funzioni
Studio di funzioni Codici g fanuc
Codici g fanuc Definizione di sistema operativo
Definizione di sistema operativo Simmetrie studio di funzione
Simmetrie studio di funzione Massimi e minimi vincolati metodo di sostituzione
Massimi e minimi vincolati metodo di sostituzione Qualificatori icf
Qualificatori icf Ruoli e funzioni aziendali
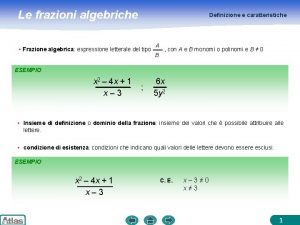
Ruoli e funzioni aziendali Semplificazione di frazioni algebriche
Semplificazione di frazioni algebriche Le funzioni dello scheletro
Le funzioni dello scheletro Funzioni participio latino
Funzioni participio latino I principi nutritivi e le loro funzioni
I principi nutritivi e le loro funzioni Funzioni logiche in excel
Funzioni logiche in excel Funzioni di stato
Funzioni di stato Funzioni a due variabili
Funzioni a due variabili Dominio funzioni a due variabili
Dominio funzioni a due variabili Le funzioni di propp nella fiaba di pollicino
Le funzioni di propp nella fiaba di pollicino Morfema grammaticale
Morfema grammaticale Metodo augustus slide
Metodo augustus slide Funzioni empiriche esempi
Funzioni empiriche esempi Esempio funzione continua
Esempio funzione continua Funzioni di stato
Funzioni di stato Opanoidi
Opanoidi Funzioni del sistema finanziario
Funzioni del sistema finanziario Robot curiosity funzioni
Robot curiosity funzioni Basso valore biologico
Basso valore biologico Le funzioni aziendali mappa concettuale
Le funzioni aziendali mappa concettuale