EPGENETK Prof Dr Nurten Kara Tbbi Biyoloji Anabilim

EPİGENETİK Prof. Dr. Nurten Kara Tıbbi Biyoloji Anabilim Dalı

Epigenetiğin Tarihçesi 1940’lar Conrad Waddington’un, gelişimsel fenotipleri indükleyen çevre-gen etkileşimleri olarak epigenetiği tanımlaması 1975 Holliday ve Pugh’ın DNA metilasyonunu belirlemesi 1988 X kromozomu inaktivasyonu ve DNA metilasyonu 1990’lar Damgalanmış genler, allelik ekspresyonlar ve DNA metilasyonu 1995 Histon modifikasyonları ve kromatin yapısı 2000’ler Küçük kodlamayan RNA’lar 2005 Epigenom haritalaması (Skinner ve ark. 2009).

Ökromatin Transkripsiyonel olarak aktif, gevşek yapıda Heterokromatin Transcripsiyonal olarak daha az aktif, sıkı katlanmış yapıda a) Konstitutiv heterokromatin sentromerler, telomeres b) Facultative heterochromatin r. DNA, transposonlar, inactive X kromozomu
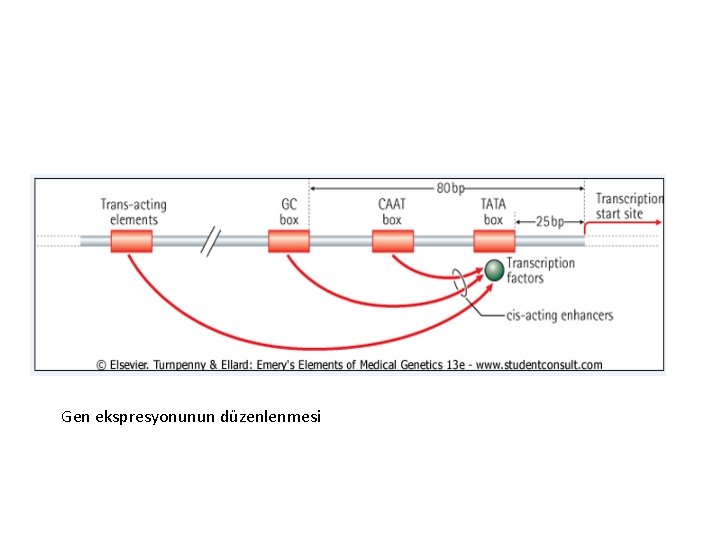
Gen ekspresyonunun düzenlenmesi

TANIMLAR • Epi: Üzerinde, dışında • Epigenetik: DNA dizisinde değişim olmaksızın kromozomda/DNA stabil kalıtılabilir fenotipik değişimlerdir. – Histon modifikasyonları – DNA metilasyonu Epigenomik: genomdaki epigenetik değişimlerin tümü olarak tanımlanır Epigenetik kod: farklı hücrelerde farklı fenotipleri koruyan epigenetik özelliklerdir

Epigenetik Kod • DNA metilasyonları ve Histon modifikasyonları epigenetik kodu oluştururlar • DNA dizisinde bazı bazların metilasyonu gen aktivasyonunun baskılanmasına neden olur. • Histon proteinlerin asetillenmesi gen aktivasyonu, deasetilasyonu ise inaktivasyon nedenidir.
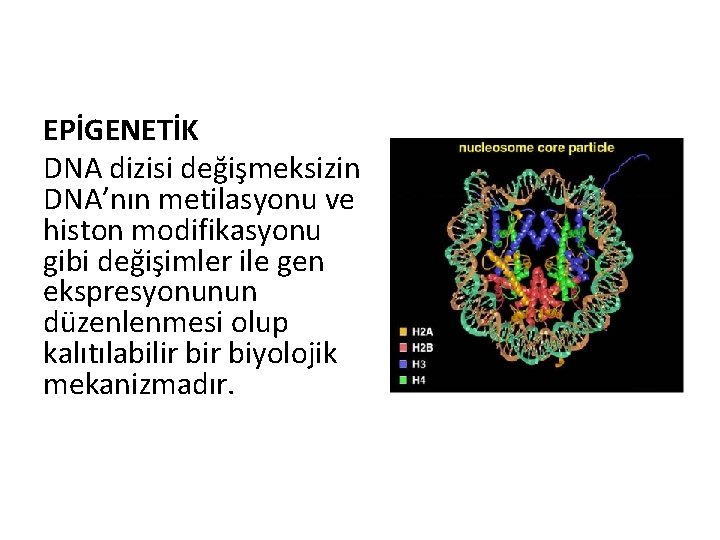
EPİGENETİK DNA dizisi değişmeksizin DNA’nın metilasyonu ve histon modifikasyonu gibi değişimler ile gen ekspresyonunun düzenlenmesi olup kalıtılabilir biyolojik mekanizmadır.
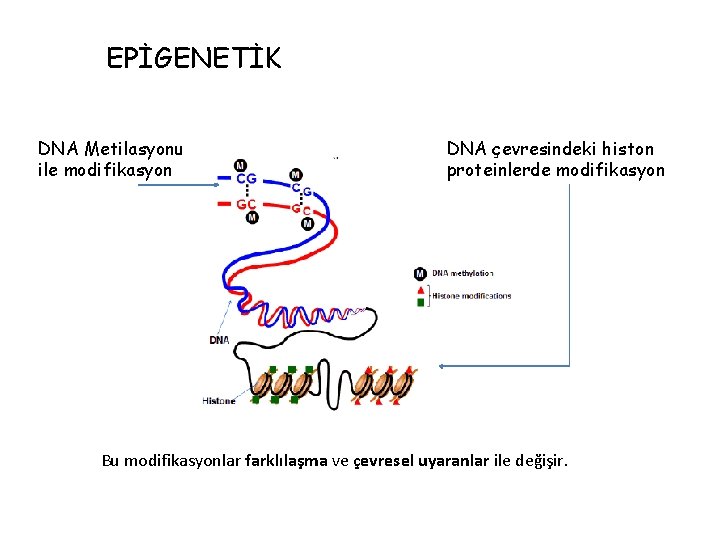
EPİGENETİK DNA Metilasyonu ile modifikasyon DNA çevresindeki histon proteinlerde modifikasyon Bu modifikasyonlar farklılaşma ve çevresel uyaranlar ile değişir.

• Tek yumurta ikizleri nasıl farklı kürk rengine sahip olabilir? Genetik olarak aynı olan Agouti farelerinin farklı kürk renkleri
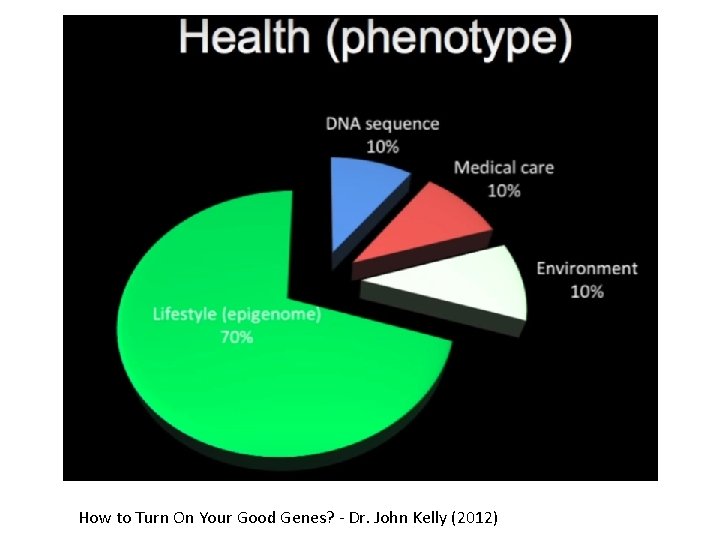
How to Turn On Your Good Genes? - Dr. John Kelly (2012)

Ne yiyorsanız o sunuz. Beslenme ve yaşam tarzınız gelecek nesillerin akıbetini belirler
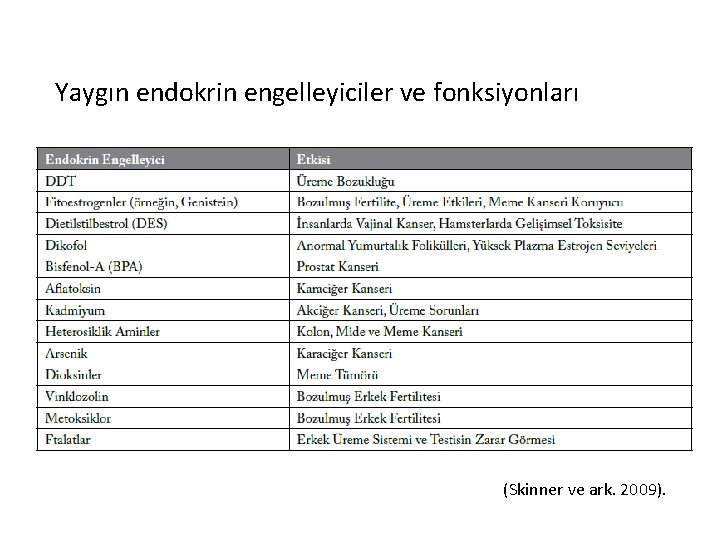
Yaygın endokrin engelleyiciler ve fonksiyonları (Skinner ve ark. 2009).

Farklı yetişkin kök hücrelerin kaderleri nasıl belirlenir. Aynı DNA dizilerini içermelerine rağmen, – Myoblasts sadece kas hücrelerini – Keratinocytes deri hücrelerini – Hematopoetik hücreler kan hücrelerini oluşturabilir
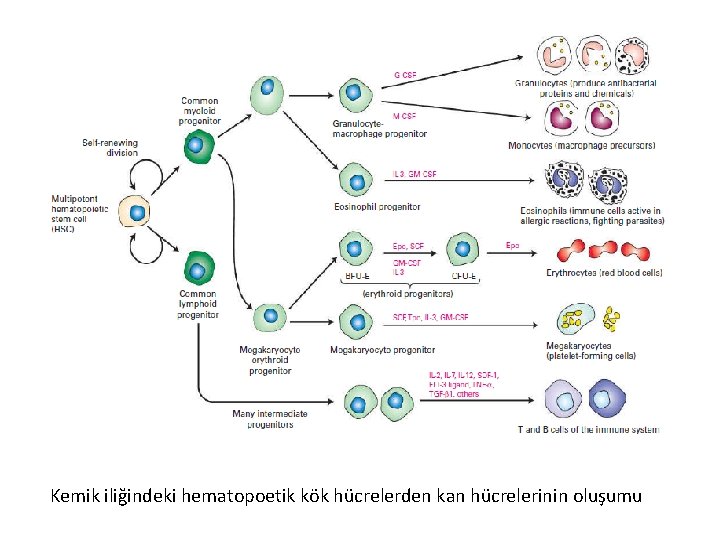
Kemik iliğindeki hematopoetik kök hücrelerden kan hücrelerinin oluşumu

Epigenetik Mekanizmalar • Transkripsiyonel epigenetik mekanizmalar Kromatin yeniden şekillenmesi, Histon modifikasyonları DNA metilasyonu • Transkripsiyon sonrası epigenetik mekanizmalar Kodlamayan RNA’lar (mi. RNA ve Inc. RNA) Hatalı protein katlanması (Prionlar), Kromozom pozisyon etkisi
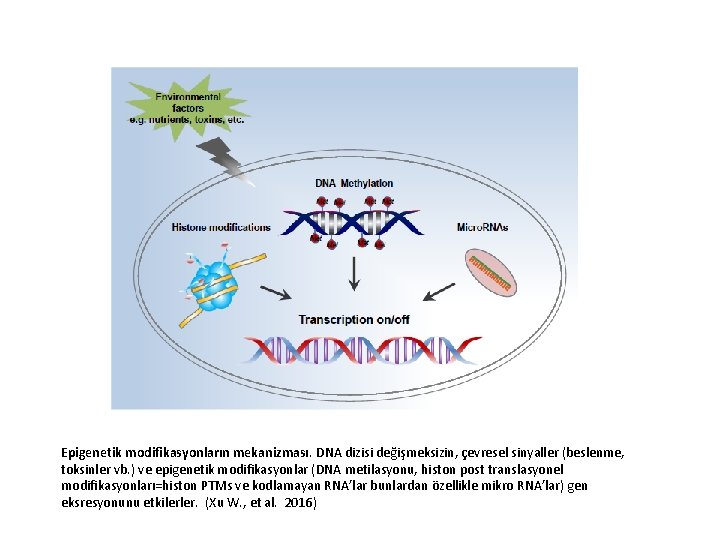
Epigenetik modifikasyonların mekanizması. DNA dizisi değişmeksizin, çevresel sinyaller (beslenme, toksinler vb. ) ve epigenetik modifikasyonlar (DNA metilasyonu, histon post translasyonel modifikasyonları=histon PTMs ve kodlamayan RNA’lar bunlardan özellikle mikro RNA’lar) gen eksresyonunu etkilerler. (Xu W. , et al. 2016)
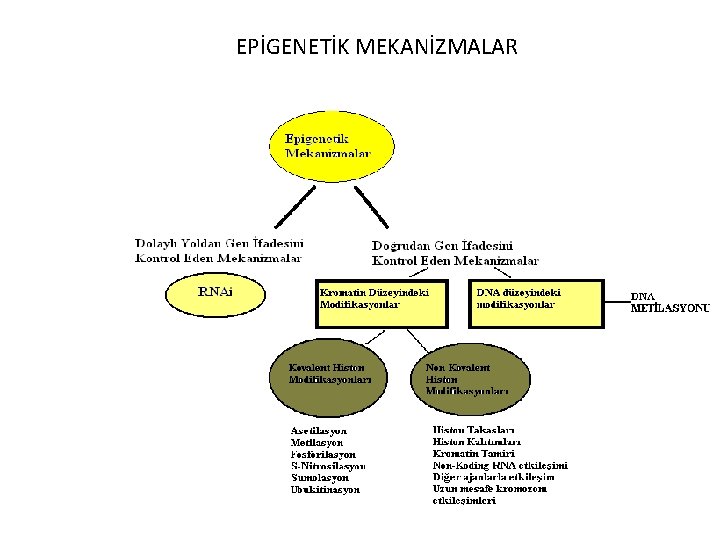
EPİGENETİK MEKANİZMALAR

Doğrudan Gen İfadesini Kontrol Eden Mekanizmalar • Kromatin düzeyindeki modifikasyonlar • DNA düzeyindeki modifikasyonlar

Kromatin Düzeyindeki Modifikasyonlar • Bu modifikasyonlar hem kovalent hem de nonkovalent olabilirler. • Genlerin sessizleşmesine neden olurlar. Sessizleşme geni inaktive edici bir mutasyon veya delesyon gibi genetik bir mekanizmayla eşdeğerdir.

A. Kovalent Histon Modifikasyonları Genin transkripsiyon aşamasının düzenlenmesini sağlayan faktörlerdir. Bunlar; • • • Asetilasyon, Metilasyon, Fosforilasyon, S-nitrosilasyon, Ubikitinasyon Sumolasyon
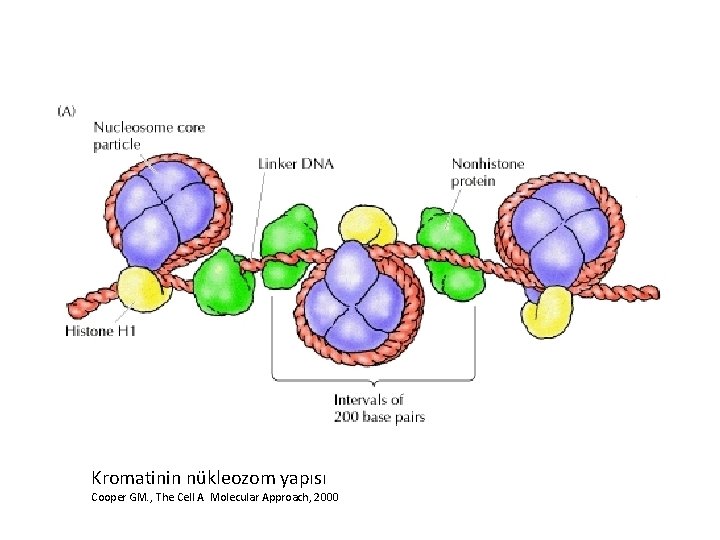
Kromatinin nükleozom yapısı Cooper GM. , The Cell A Molecular Approach, 2000
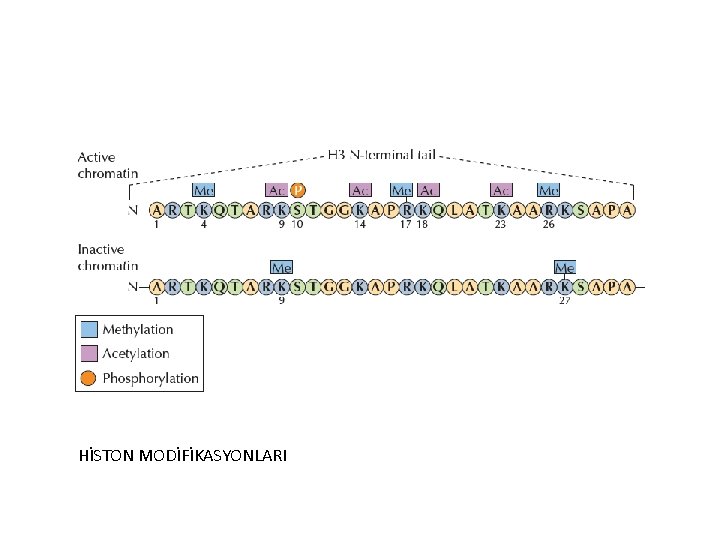
HİSTON MODİFİKASYONLARI
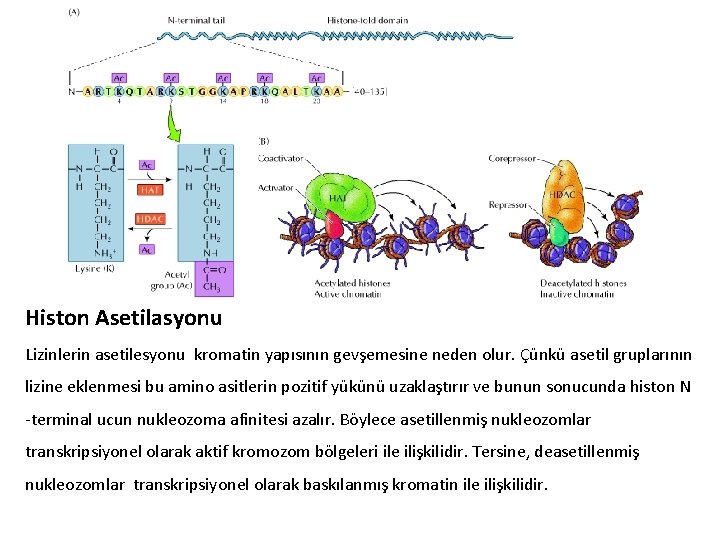
Histon Asetilasyonu Lizinlerin asetilesyonu kromatin yapısının gevşemesine neden olur. Çünkü asetil gruplarının lizine eklenmesi bu amino asitlerin pozitif yükünü uzaklaştırır ve bunun sonucunda histon N -terminal ucun nukleozoma afinitesi azalır. Böylece asetillenmiş nukleozomlar transkripsiyonel olarak aktif kromozom bölgeleri ile ilişkilidir. Tersine, deasetillenmiş nukleozomlar transkripsiyonel olarak baskılanmış kromatin ile ilişkilidir.
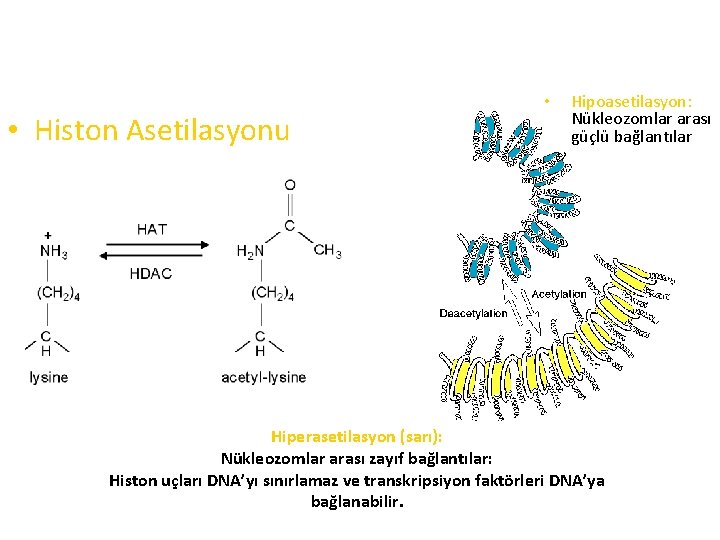
• Histon Asetilasyonu • Hipoasetilasyon: Nükleozomlar arası güçlü bağlantılar Hiperasetilasyon (sarı): Nükleozomlar arası zayıf bağlantılar: Histon uçları DNA’yı sınırlamaz ve transkripsiyon faktörleri DNA’ya bağlanabilir.

Metilasyon: Histon metiltransferaz enzimleri tarafından histon proteinlerinde bulunan amino asitlere 1, 2 veya 3 tane metil grubu (tri metilasyon) eklenmesi olayıdır. Bir genin ifade edilip edilmeyeceğini o geni açık veya kapalı konuma (switch on- switch off) getiren olay, bu ve benzeri modifikasyonlardır. Açık/Kapalı gen setleri bulunduğu hücre tipine göre farklılık gösterir.
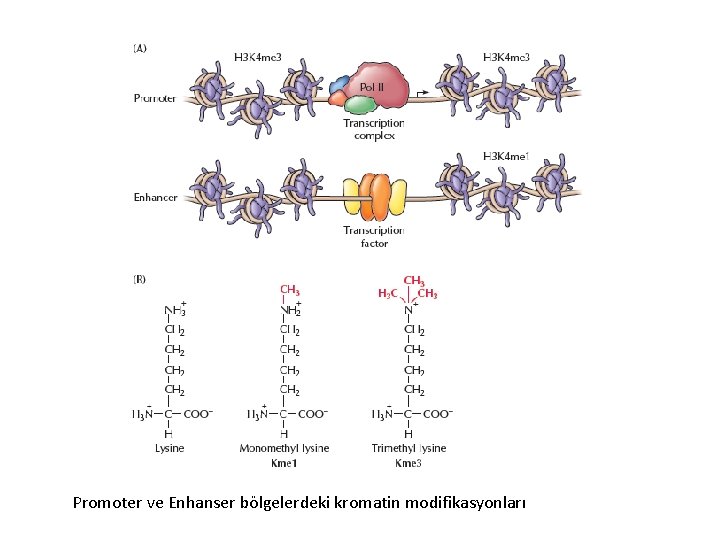
Promoter ve Enhanser bölgelerdeki kromatin modifikasyonları
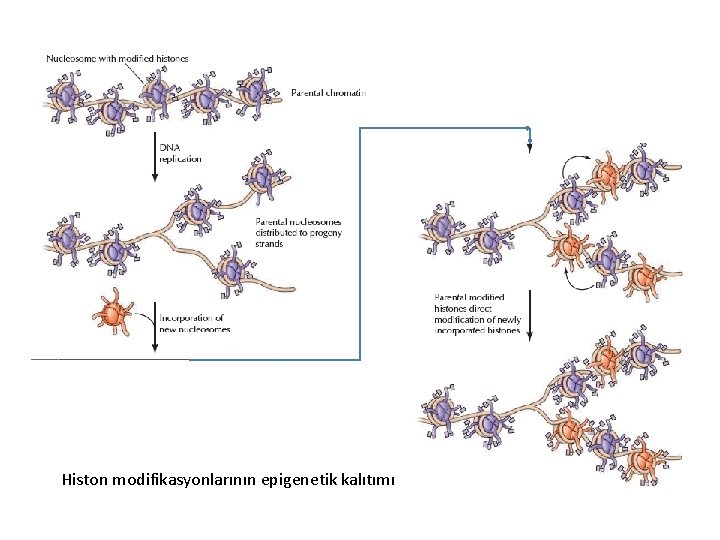
Histon modifikasyonlarının epigenetik kalıtımı

Histon Metilasyonu Arjinin metilasyonu Gen aktivasyonu ile ilgilidir. Lizin metilasyonu I. Transkripsiyonel baskılama (heterokromatin organizasyonu) • H 3 K-4, K-36, K-79 II. Transkripsiyonel aktivasyon (ökromatin organizasyonu) • H 3 K-9, K-27; H 4 K-20

Fosforilasyon: Histon deasetilazlara geri dönüşümlü olarak fosfat gruplarının bağlanmasıdır. Fosfatlar histon deasetilazlara serin, treonin ve tirozin rezidülerinden bağlanır. Fosforilasyon protein kinazlar (PK) ve protein fosfatazlar (PP) tarafından gerçekleştirilen bir reaksiyondur.
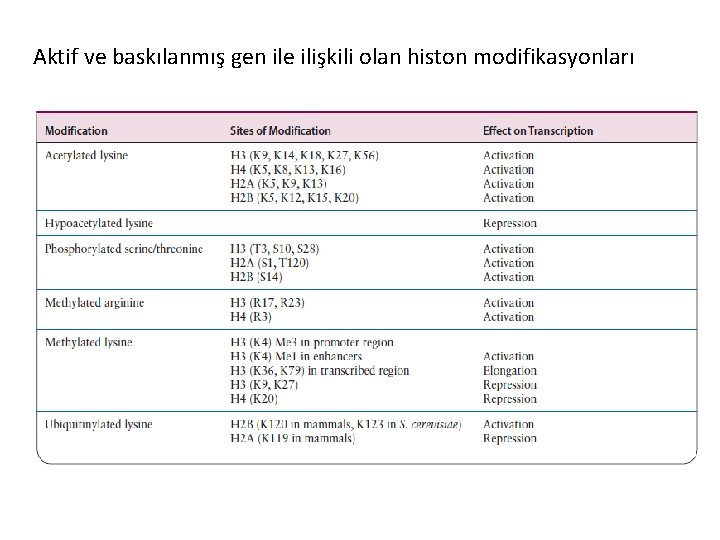
Aktif ve baskılanmış gen ile ilişkili olan histon modifikasyonları

S-nitrasilasyon: Histon deasetilazlara sistein rezidüsünden nitrosil (NO) grubunun eklenmesi olayıdır. Bu olay katalitik aktiviteyi etkiler ve bunun sonucunda kromatinden korepresörlerin ayrılamamasına neden olur.

Ubukitinasyon: Ubukitin (Ub) lizin rezidüsü ile bağlanabilen küçük bir proteindir. Üç aşamalı bir enzimatik reaksiyonun oluşumuna neden olur. Bu reaksiyonlar, E 1, E 2, E 3 enzimleri tarafından gerçekleştirilir. Ubukitinasyon , proteinlerin yıkılma yolu olan proteosom yolağına proteinlerin girmesine ve degrade olmasına neden olur.

Sumolasyon: SUMO (small ubuquitin-like modifier) 1, 2, 3 proteinlerinin ubukitin ile birleşmesi olayıdır. Ubukutine benzer bir protein olan SUMO proteinleri lizin rezidülerinden proteinlere bağlanır ve bunun sonucunda protein degradasyonu engellenir.

Nonkovalent Histon Modifikasyonlar • Kromozom içi ya da kromozomlar arası etkileşimler, histon takasları, kromatin tamiri, nonkoding RNA (si. RNA, mi. RNA) ile etkileşim nonkovalent histon modifikasyonları olarak sayılabilir

• Tüm bu mekanizmalar, kromatin yapısında değişiklikler oluşturarak transkripsiyonu düzenleyici komplekslerin DNA’ya ulaşabilirliğini etkilerler. Ayrıca birçok histon modifikasyonu geri dönüşümlüdür ve modifikasyon seviyesi ile transkripsiyon seviyesi sıkı ilişki içerisindedir.

II. DNA düzeyindeki modifikasyonların en bilinen ve en işlevsel olanı DNA metilasyonudur. DNA metilasyonu, DNA'nın bir kimyasal değişimidir, kalıtsal olup sonradan ilk dizi geri gelecek şekilde çıkartılabilir. Bu özelliği nedeniyle epigenetik koda aittir ve en iyi karakterize edilmiş epigenetik mekanizmadır.

DNA Metilasyonu • 1975’te Robin Holliday ve Hugg tarafından tanımlanmıştır. • Memeli DNA’sında C nükleotidinin 5 -metil sitozine dönüştürülmesi • Gen kontrol mekanizması • Metilasyon diziye özgündür. • Metilasyon bölgesi Cp. G kümesindeki C nükleotidleridir.

• Omurgalılarda tipik olarak Cp. G bölgelerine DNA metil transferaz enzimi ile bir metil grubunun bağlanması neticesinde gerçekleşir. Metil grubu DNA’nın sitozin bazının pirimidin halkasının 5 numaralı karbonuna eklenir. Metil vericisi olarak S-Adenozil Metiyonin (SAM) görev yapar.

DNA Metilasyonu • Genomda 28 milyon Cp. G bölgesi vardır • Cp. G’lerin %60 -80’i metillenmiştir • Cp. G adacıkları 100 ile 2000 bç arasında değişir ve sıklıkla promoter bölgelerde bulunur • Hücre tiplerine göre metilasyon değişir

DNA metilasyonunun rolü • Transkripsiyonal susturma • Transpozisyondan (transpozabıl elementler) genomun korunması • Genomic imprinting • X inaktivasyonu • Doku spesifik gen ekpresyonu
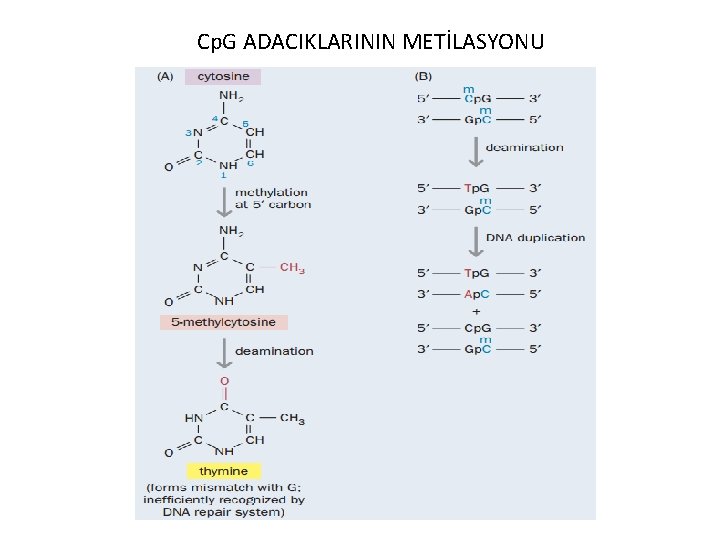
Cp. G ADACIKLARININ METİLASYONU
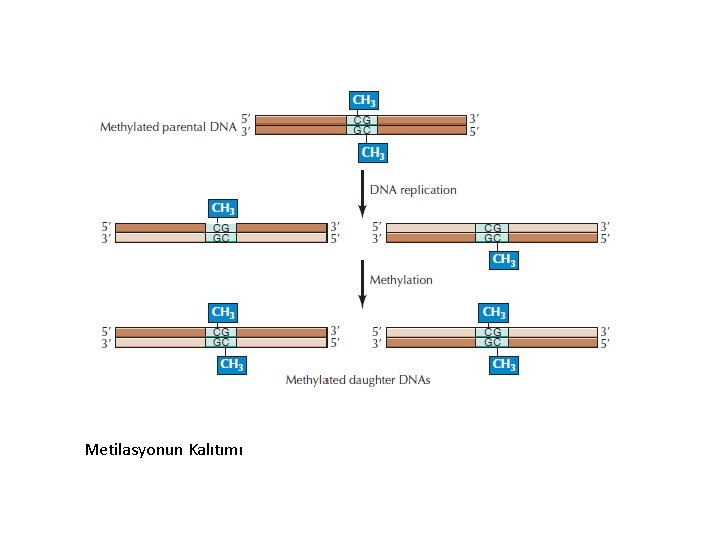
Metilasyonun Kalıtımı
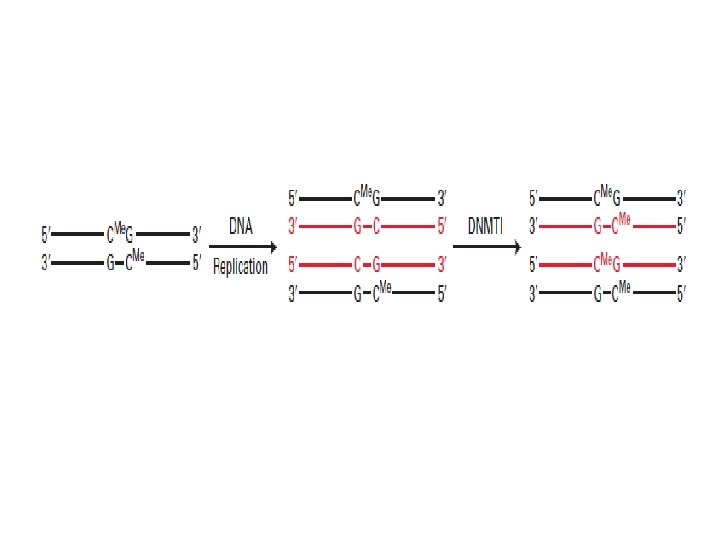

• Metilasyon DNA’nın inaktive olmasına neden olarak protein oluşumunu engelleyen bir işlemdir. • Erişkin somatik dokularda DNA metilasyonu tipik olarak Cp. G dinükleotit dizilerinde meydana gelir. • Cp. G dışı metilasyon embriyonik kök hücrelerde hâkimdir.

Metilasyonun Kanıtları • X-inaktivasyonu ile gen suskunluğunun DNA’nın metilasyonu ile ilişkili olduğu gösterilmiştir. • Genomik İmrinting (baskılama): Metilasyon yoluyla parental kökene bağlı olan allelik dışlama olarak tanımlanır • Kanser: tümör baskılayıcı genlerin promoter bölgelerinin metilasyonu bu genlerin inaktivasyonuna yol açar.

Kanserde metilasyon profili • Cp. G adacıklarının hipermetilasyonu Tümür baskılayıcı genlerin promoterleri metillenmiştir Tumör baskılayıcı genler inaktiftir Tümörler büyüyebilir • Genel hipometilasyon
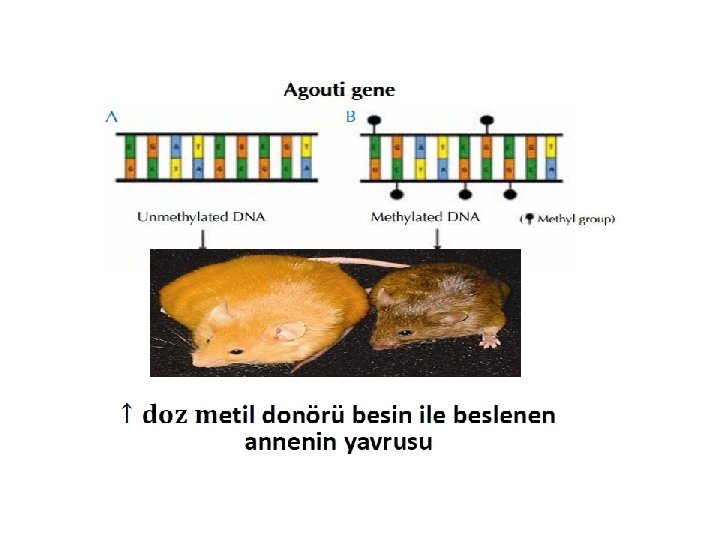
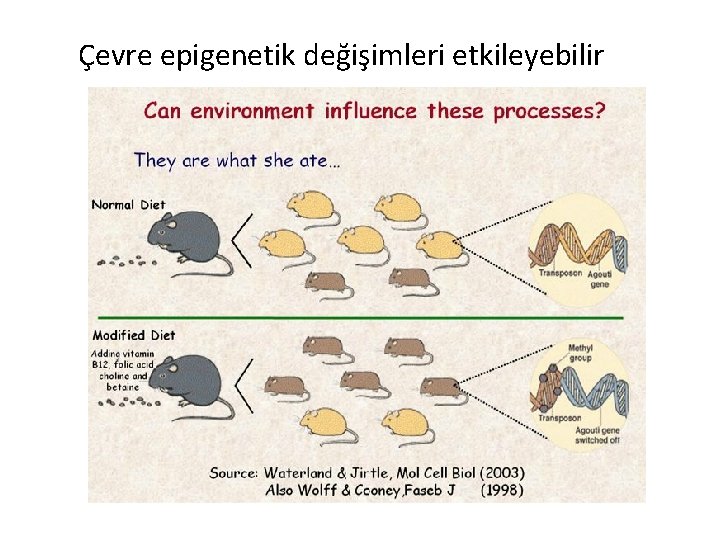
Çevre epigenetik değişimleri etkileyebilir
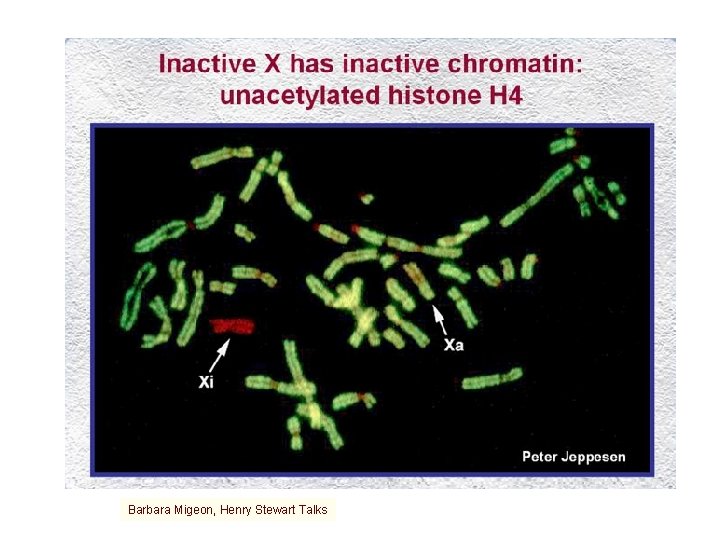
Barbara Migeon, Henry Stewart Talks

Long noncoding RNAs (lnc. RNAs)= Uzun kodlama yapmayan RNA’lar • Memelilerin dişilerinde X-kromozom inaktivasyonu (epigenetik baskılama) lnc. RNAs aracılığı ile gerçekleşir. • X kromozom inaktivasyonu, X inaktivasyon center (Xist) olarak adlandırılan 100 kb’lık bir bölge tarafından kontrol edilir. Xist 17 kb uzunluğunda bir Inc RNA’dır ve inaktif X’e bağlanarak transkripsiyonu engeller. • İnsanda 50 000’den fazla lnc. RNA tanımlanmıştır. • Inc. RNA’ların birkaçı kırmızı kan hücrelerinin gelişimini durdurur. • Bazı lnc. RNA’lar gen aktivasyonu ile ilişkilidir.
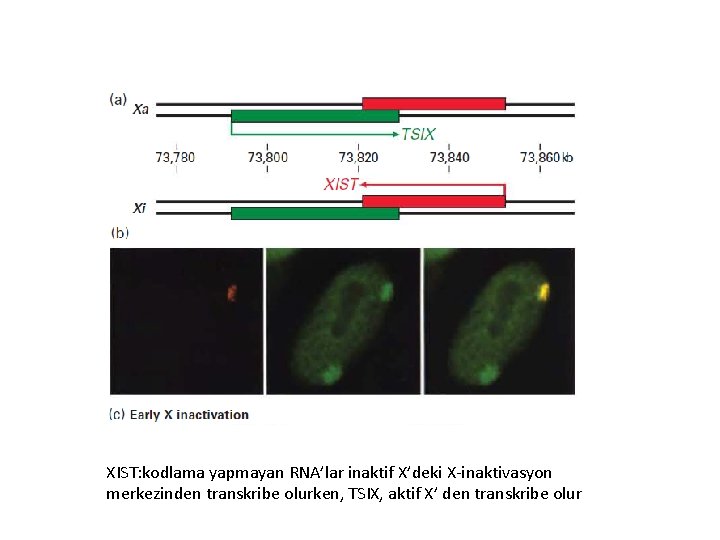
XIST: kodlama yapmayan RNA’lar inaktif X’deki X-inaktivasyon merkezinden transkribe olurken, TSIX, aktif X’ den transkribe olur
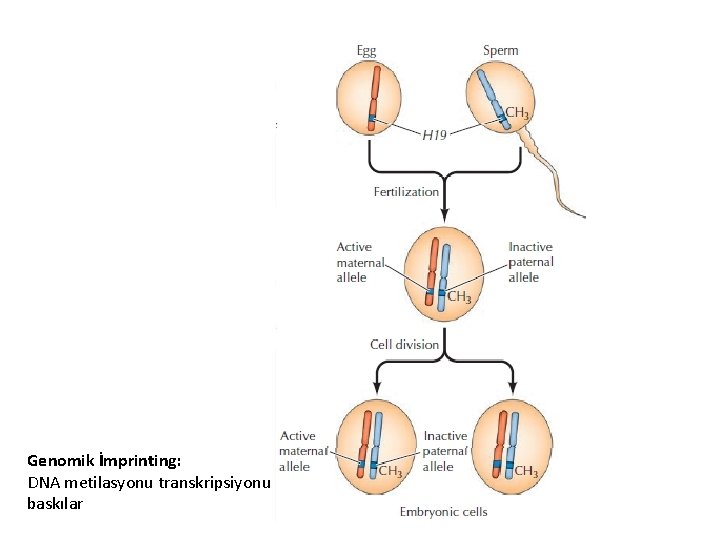
Genomik İmprinting: DNA metilasyonu transkripsiyonu baskılar

• Dolaylı Yoldan Gen İfadesini Kontrol Eden Mekanizmalar • POST-TRANSKRİPSİYONEL MEKANİZMALAR RNA INTERFERENCE (RNAi): • Transkripsiyon sonrası ~ 20 nükleotidlik çift zincirli kodlama yapmayan (antisens) RNA’ların sentezlenen m. RNA’yı parçalayarak veya tranlasyonu engelleyerek yaptığı gen sessizleştirme işlemidir. • Protein kodlayan genlerin yaklaşık %60’ı mikro RNA’lar ile düzenlenmektedir.
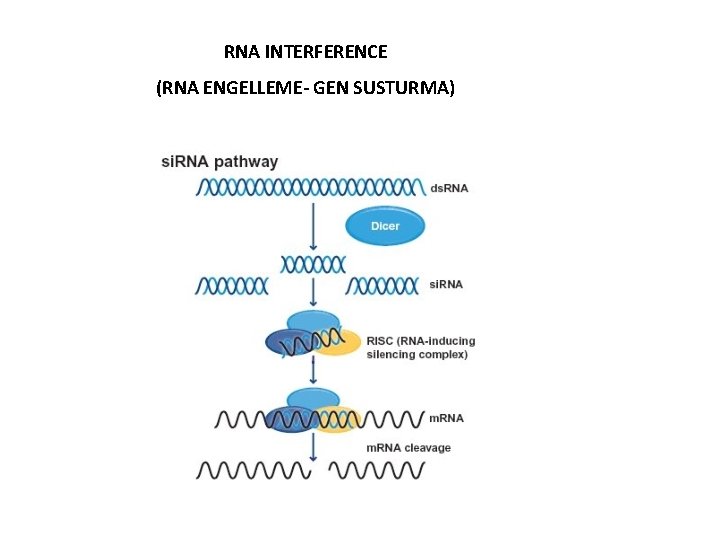
RNA INTERFERENCE (RNA ENGELLEME- GEN SUSTURMA)
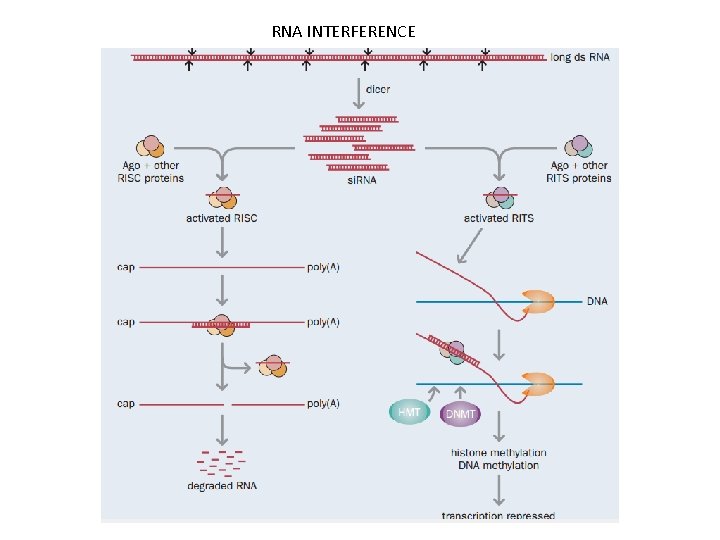
RNA INTERFERENCE
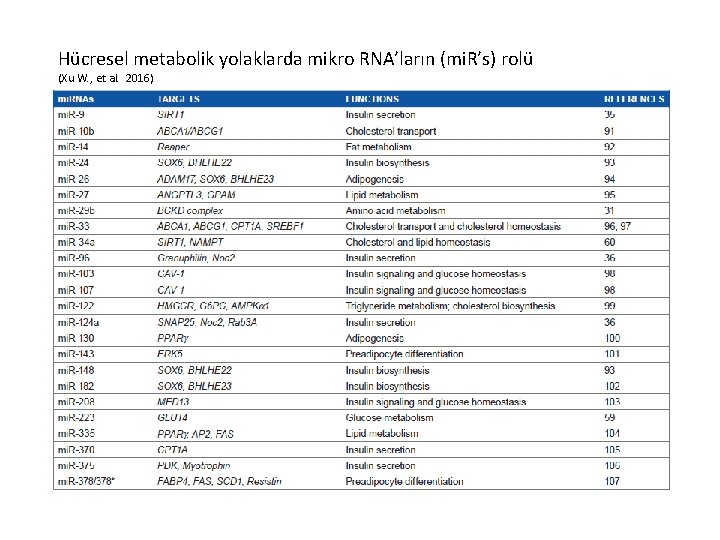
Hücresel metabolik yolaklarda mikro RNA’ların (mi. R’s) rolü (Xu W. , et al. 2016)
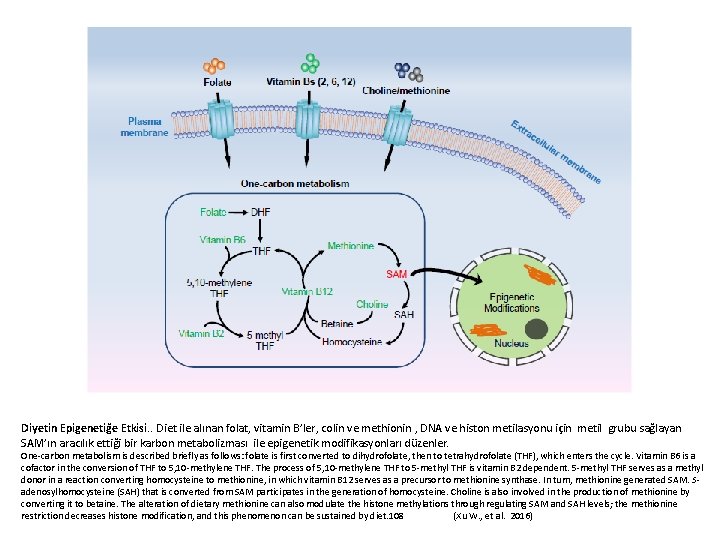
Diyetin Epigenetiğe Etkisi. . Diet ile alınan folat, vitamin B’ler, colin ve methionin , DNA ve histon metilasyonu için metil grubu sağlayan SAM’ın aracılık ettiği bir karbon metabolizması ile epigenetik modifikasyonları düzenler. One-carbon metabolism is described briefly as follows: folate is first converted to dihydrofolate, then to tetrahydrofolate (THF), which enters the cycle. Vitamin B 6 is a cofactor in the conversion of THF to 5, 10 -methylene THF. The process of 5, 10 -methylene THF to 5 -methyl THF is vitamin B 2 dependent. 5 -methyl THF serves as a methyl donor in a reaction converting homocysteine to methionine, in which vitamin B 12 serves as a precursor to methionine synthase. In turn, methionine generated SAM. Sadenosylhomocysteine (SAH) that is converted from SAM participates in the generation of homocysteine. Choline is also involved in the production of methionine by converting it to betaine. The alteration of dietary methionine can also modulate the histone methylations through regulating SAM and SAH levels; the methionine restriction decreases histone modification, and this phenomenon can be sustained by diet. 108 (Xu W. , et al. 2016)
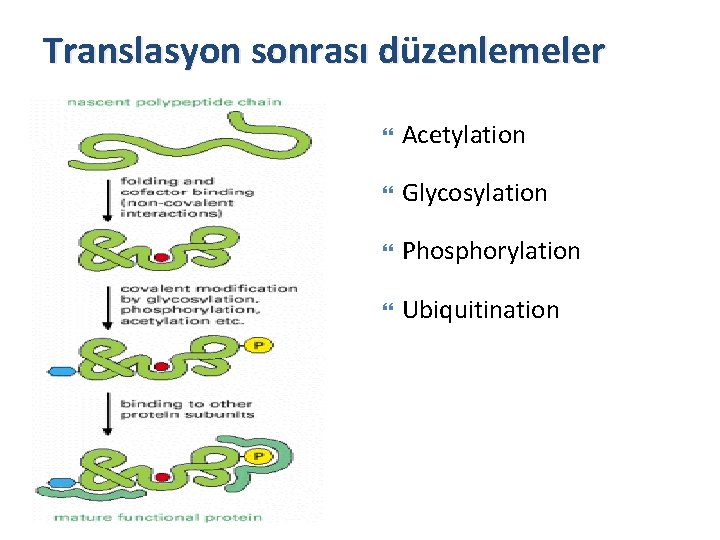
Translasyon sonrası düzenlemeler Acetylation Glycosylation Phosphorylation Ubiquitination
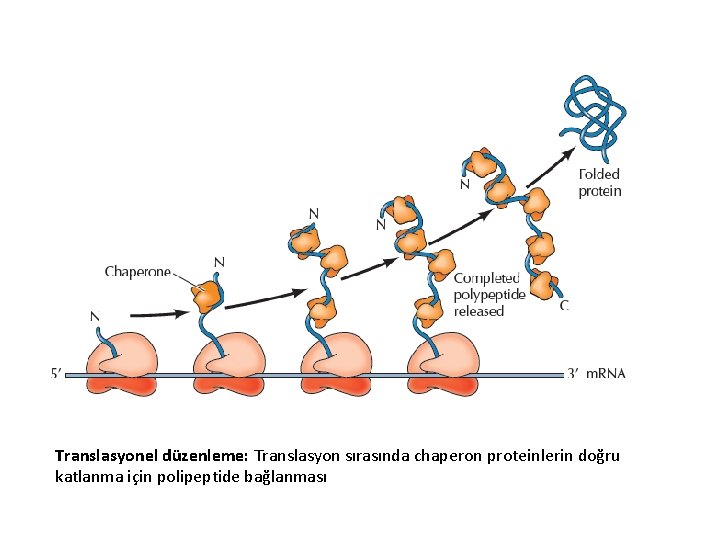
Translasyonel düzenleme: Translasyon sırasında chaperon proteinlerin doğru katlanma için polipeptide bağlanması
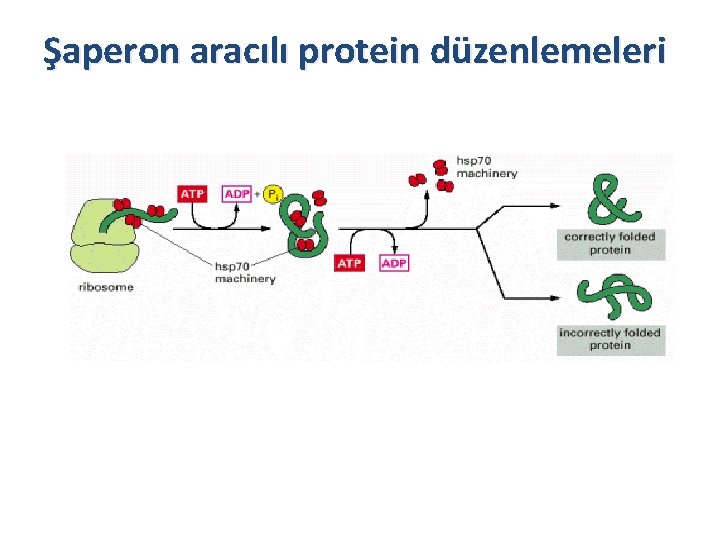
Şaperon aracılı protein düzenlemeleri
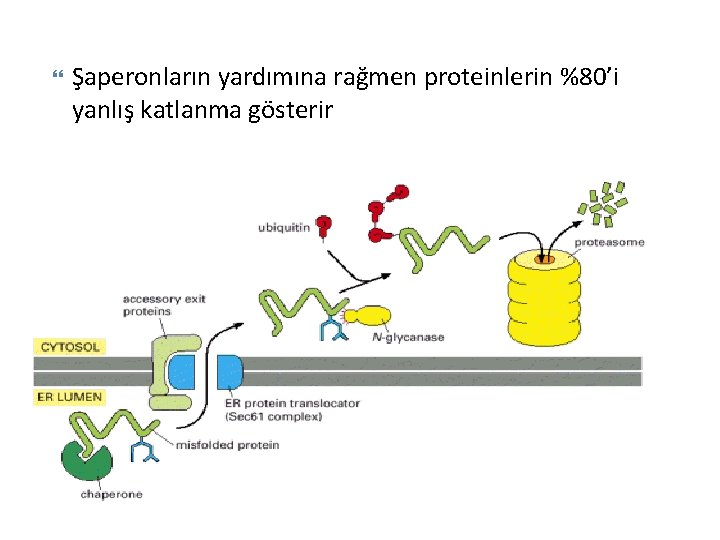
Şaperonların yardımına rağmen proteinlerin %80’i yanlış katlanma gösterir

Yanlış katlanmış proteinlerin yıkımı Lizozomal (hücre dışı) Sitosilik (hücre içi) ◦ Ubiquitin Proteosom yolu

Prionlar • Prionlar protein molekülleri olup kendini çoğaltan patojen (hastalık etkeni) proteinlerin yegâne örnekleridir. Ciddi hastalıklara sebep olurlar. • Bakteri, virüs ve diğer bilinen patojenlerin tersine, prionların konakçı hücreleri istila etmesi ve onların içinde çoğalması nükleik asitler (DNA veya RNA) ile olmaz. Çok küçük olup en küçük virüslerden 100 kat daha küçüktür. • Prion proteinlerin nasıl replike oldukları, kan beyin bariyerini nasıl geçtikleri ve türler arası geçişin nasıl mümkün olduğu henüz bilinmemektedir. • Prionların, santral sinir sisteminde zamanla birikimi sonucunda Creutzfeld-Jacob hastalığı (v. CJD) olarak bilinmekte olup, nakledilebilir süngerimsi beyin hastalıklarından (İng. transmissible spongiform encephalopathy (TSE)) biridir.
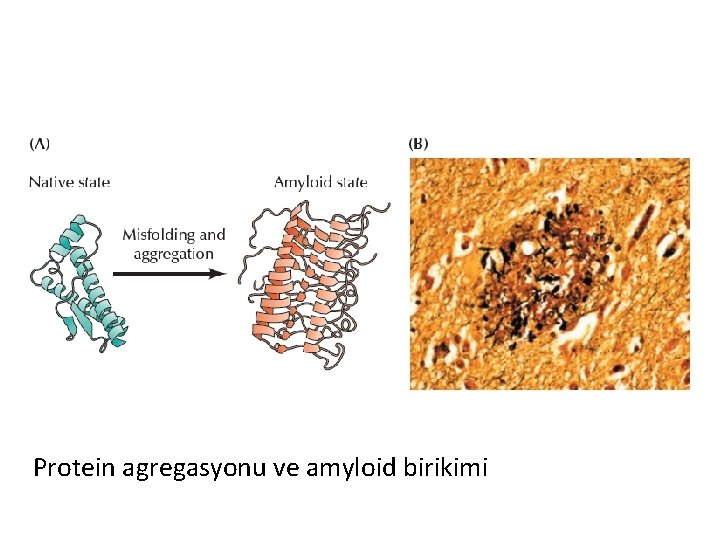
Protein agregasyonu ve amyloid birikimi
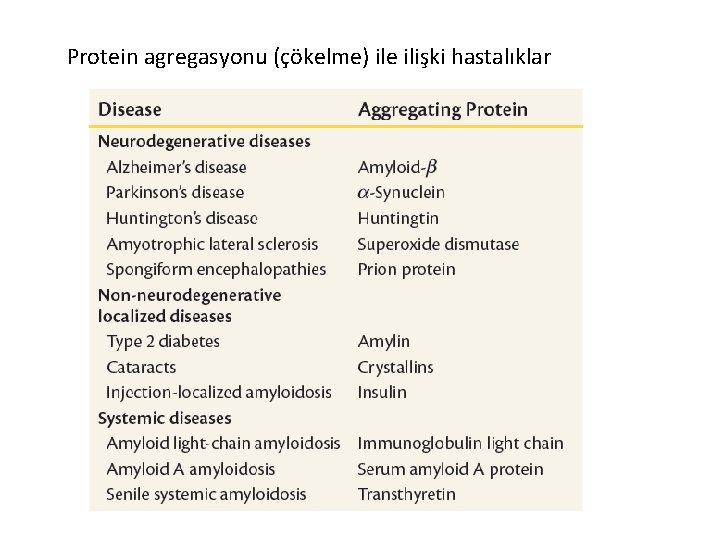
Protein agregasyonu (çökelme) ile ilişki hastalıklar

Kromozom pozisyon etkisi • Ökaryotlarda bir genin kromozom üzerinde yer değişikliği expresyonunu etkilemektedir. Bakterilerde bu etki zayıftır. Kromozom translokasyonları

Kaynaklar • Xu W. , et al. Epigenetic and cellular metabolism, Genetics and Epigenetics, 2016; (8): 43 -51. • Jonathan L Haines, Margaret Pericak-Vance, Genetic Analysis of Complex Diseases. Second Edition, P: 52 -63, 2006, USA • Klug W. S. , Cummings M. R. , Spencer C. A. , Essential of Genetics. Sixth Edition, Pearson International Edition. 2007. • İzmirli M. Epigenetik Mekanizmalar. MKÜ. Tıp Fakültesi, Tıbbi Biyoloji A. D. • Human Genom Organization capter 9
- Slides: 67