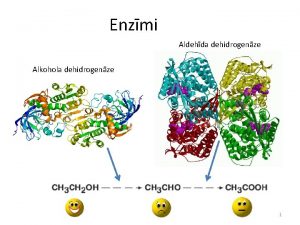
Enzimoloija 12 Lekcijas saturs Praktisk enzimoloija Enzmi diagnostik



























- Slides: 40

Enzimoloģija 12. Lekcijas saturs: Praktiskā enzimoloģija. Enzīmi diagnostikā. Enzīmi terapijā. Enzīmi tautsaimniecībā. Molekulāras bioloģijas (bioķīmijas)katedra 2009/2010. akad. gads

Praktiskā enzimoloģija 1. Diagnostiskā enzimoloģija a) aktivitāte orgānos (prenatālā diagnostika) b) asinīs (klīnikā nosaka apmēram 30 enzīmu aktivitātessvarīgākās As. AT, Al. AT, LDH), izoenzīmi c) ELISA 2. Enzīmi kā farmakopreparāti: a) aizvietotājterāpija b) hemostāzes modulācija c) viroterāpija d) onkoloģija e) pretiekaisuma terāpija 3. Enzīmi rūpniecībā: himozīns (rennīns), amilāze, lipāzes 4. Praktiskās enzimoloģijas perspektīvas: a) liposomas b) imobilizācija c) rekombinantu biotehnoloģija d) gēnu terapija

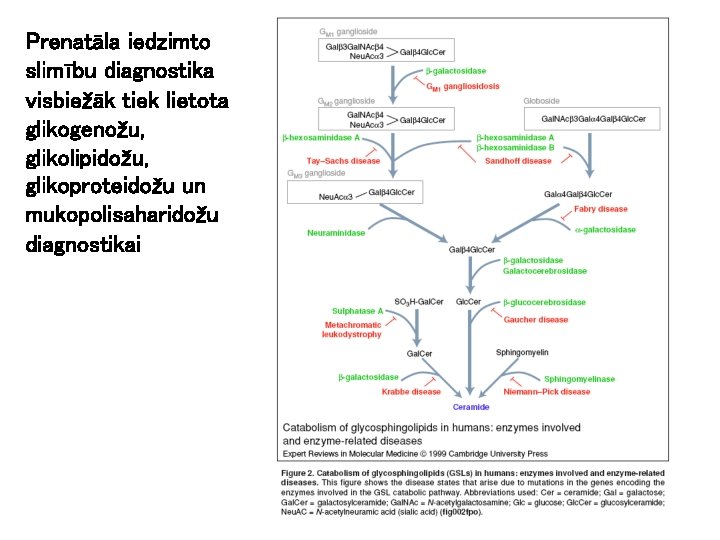
Enzīmi prenatālai iedzimto slimību diagnostikai

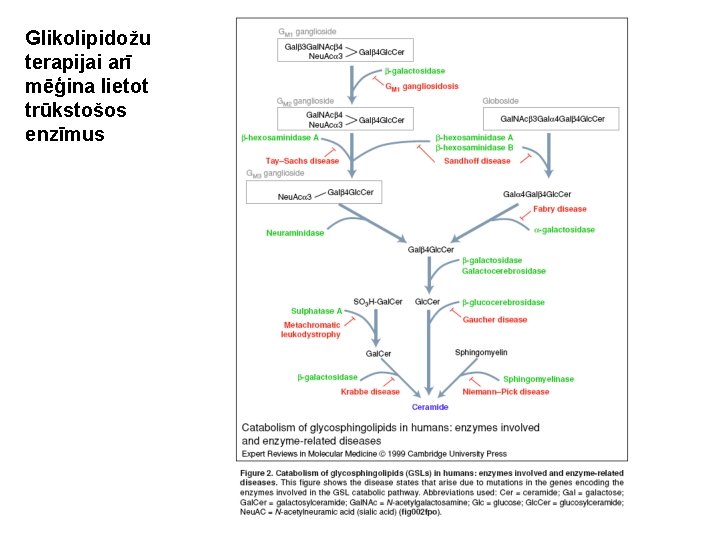
Prenatāla iedzimto slimību diagnostika visbiežāk tiek lietota glikogenožu, glikolipidožu, glikoproteidožu un mukopolisaharidožu diagnostikai

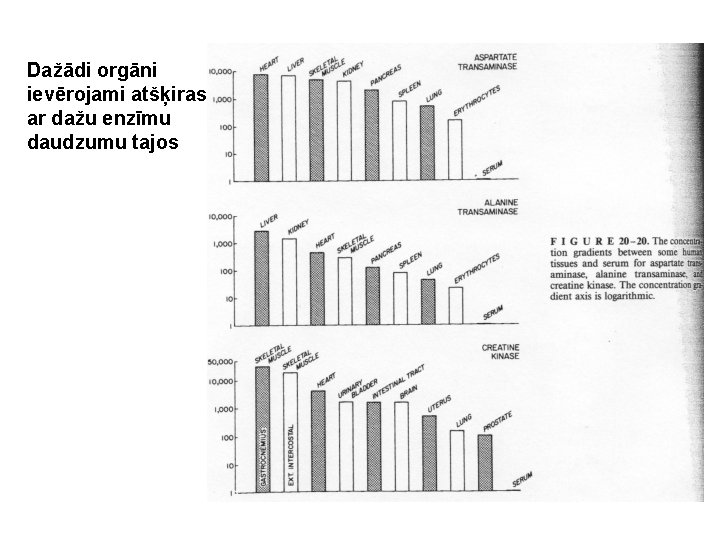
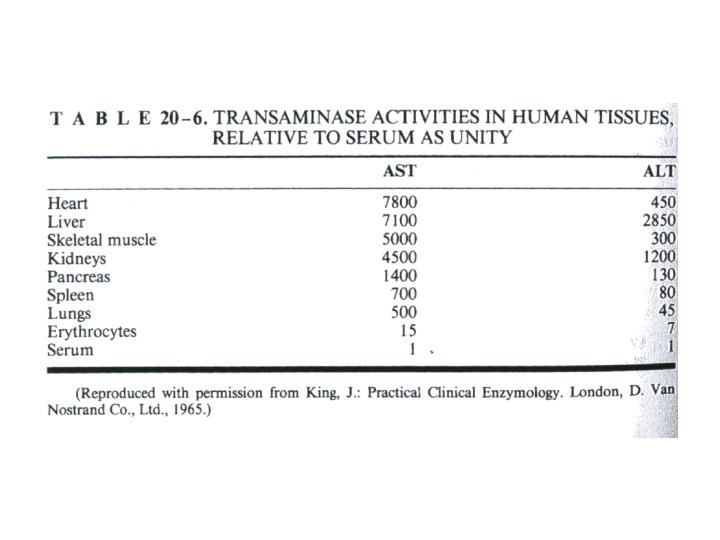
Indikatorie enzīmi asinīs Aknu indikatorie enzīmi: 1. Aminotransferāzes – As. AT, Al. AT 2. Holīnesterāze 3. Fruktozes -1, 6 - difosfāt aldolāze 4. Histidāze 5. Sorbītdehidrogenāze Sirds indikatorie enzīmi: 1. Laktātdehidrogenāze 2. Aspartātaminotransferāze 3. Kreatīnkināze Pankreasa indikatorie enzīmi: 1. Amilāze 2. Lipāze Eritrocītu enzīmi: • Glikozes-6 -fosfātdehidrogenāze Prostatas indikatorie enzīmi • Skābā fosfatāze Kaulaudu indikatorie enzīmi • Alkālā fosfatāze

Dažādi orgāni ievērojami atšķiras ar dažu enzīmu daudzumu tajos


Alkālai fosfatāzei ir daudzas izoformas

Visātrākais infarkta marķieris ir kreatīnkināzes MB izoforma (CK 2)

Laktātdehidrogenāzes izoenzīmu spektrs dažādos orgānos

Indikatorie enzīmi urīnā Pankreasa enzīmi • amilāze Kaulaudu enzīmi • TRACP - tartrāta rezistentā skābās fosfatāzes izoforma Urogenitalās sistēmas marķierenzīmi • γ-Glutamīltransferāze, γ-Glutamīlpeptīd : Aminoskābe • Laktātdehidrogenāze

Enzīmi bioanalītikā

Imunoenzimātiskās reakcijas: a) peroksidāze b) alkālā fosfatāze c) glikozooksidāze d) beta- galaktozidāze e) glukozes-6 -fosfāt-dehidrogenāze f) malātdehidrogenāze 2. Nukleīnskābju ķīmijā a) avidīna- biotīna konjugāti b) fluorescentie substrāti 1.

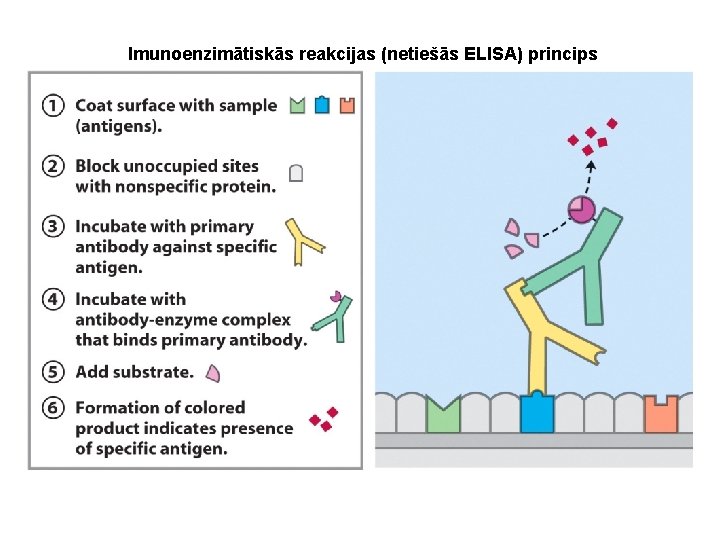
Imunoglobulīnu analīzes metodes III Imunoanalīzes metodes uz cietās fāzes: imunoenzimātiskās metodes, radioimunometodes. 1. Imunometožu tipi: antivielu saistība (antibody capture assay) - piemērs: antivielu titra noteikšana ar enzīmsaistīto imunosorbenta analīzi (Enzyme-linked Immunosorbent Assays) antigēna saistība (antigen capture assay) divu antivielu saistība (two-antibody sandwich assys) 2. Populārākie ELISA varianti: a) tiešā ELISA b) netiešā c) konkurentā tiešā d) konkurentā netiešā e) divpusējā (sandwich) 3. Izpildīšanas tehnika

Imunoenzimātiskās reakcijas (netiešās ELISA) princips

Hemostāzi modulējošie enzīmi

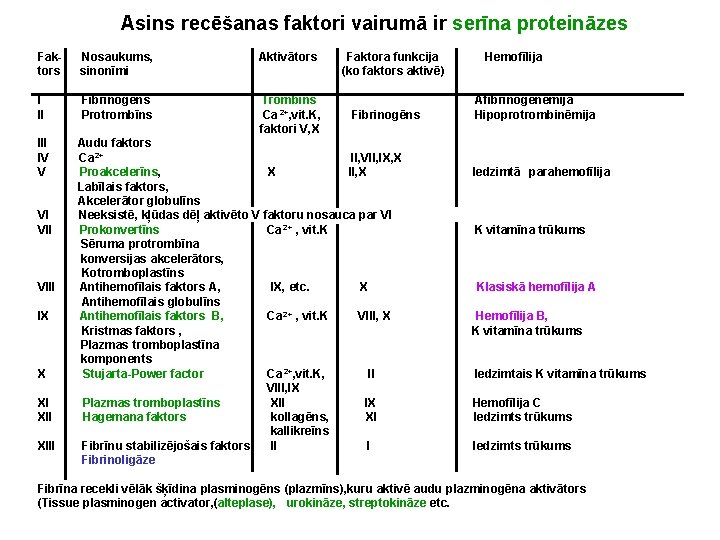
Asins recēšanas faktori vairumā ir serīna proteināzes Faktors Nosaukums, sinonīmi Aktivātors I II Fibrinogēns Protrombīns Trombīns Ca 2+, vit. K, faktori V, X III IV V VI VIII IX X XI XIII Faktora funkcija (ko faktors aktivē) Fibrinogēns Audu faktors Ca 2+ II, VII, IX, X Proakcelerīns, X II, X Labīlais faktors, Akcelerātor globulīns Neeksistē, kļūdas dēļ aktivēto V faktoru nosauca par VI Prokonvertīns Ca 2+ , vit. K Sēruma protrombīna konversijas akcelerātors, Kotromboplastīns Antihemofīlais faktors A, IX, etc. X Antihemofīlais globulīns Antihemofīlais faktors B, Ca 2+ , vit. K VIII, X Kristmas faktors , Plazmas tromboplastīna komponents Stujarta-Power factor Ca 2+, vit. K, II VIII, IX Plazmas tromboplastīns XII IX Hagemana faktors kollagēns, XI kallikreīns Fibrīnu stabilizējošais faktors II I Fibrinoligāze Hemofīlija Afibrinogenēmija Hipoprotrombinēmija Iedzimtā parahemofīlija K vitamīna trūkums Klasiskā hemofīlija A Hemofīlija B, K vitamīna trūkums Iedzimtais K vitamīna trūkums Hemofīlija C Iedzimts trūkums Fibrīna recekli vēlāk šķīdina plasminogēns (plazmīns), kuru aktivē audu plazminogēna aktivātors (Tissue plasminogen activator, (alteplase), urokināze, streptokināze etc.

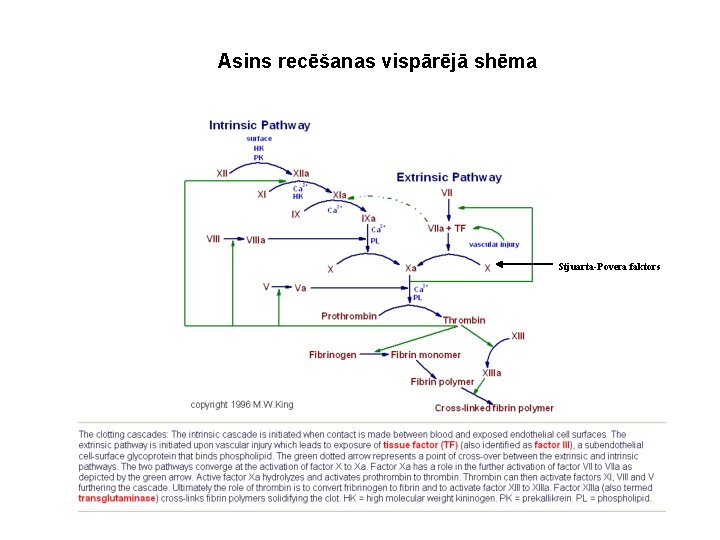
Faktors XIII, fibrinoligāze ir transferāze EC 2. 3. 2. 13 Accepted name: protein-glutamine γ-glutamyltransferase Reaction: protein glutamine + alkylamine = protein N 5 -alkylglutamine + NH 3 Other name(s): transglutaminase; Factor XIIIa; fibrinoligase; fibrin stabilizing factor; glutaminylpeptide γ-glutamyltransferase; polyamine transglutaminase; tissue transglutaminase; R-glutaminyl-peptide: amine γ-glutamyl transferase Systematic name: protein-glutamine: amine γ-glutamyltransferase Comments: Requires Ca 2+. The γ-carboxamide groups of peptide-bound glutamine residues act as acyl donors, and the 6 -amino-groups of proteinand peptide-bound lysine residues act as acceptors, to give intra- and intermolecular N 6 -(5 -glutamyl)-lysine crosslinks. Formed by proteolytic cleavage from plasma Factor XIII References: 1. Folk, J. E. and Chung, S. I. Molecular and catalytic properties of transglutaminases. Adv. Enzymol. Relat. Areas Mol. Biol. 38 (1973) 109 -191. [Medline UI: 74169138]



Asins recēšanas vispārējā shēma Stjuarta-Povera faktors

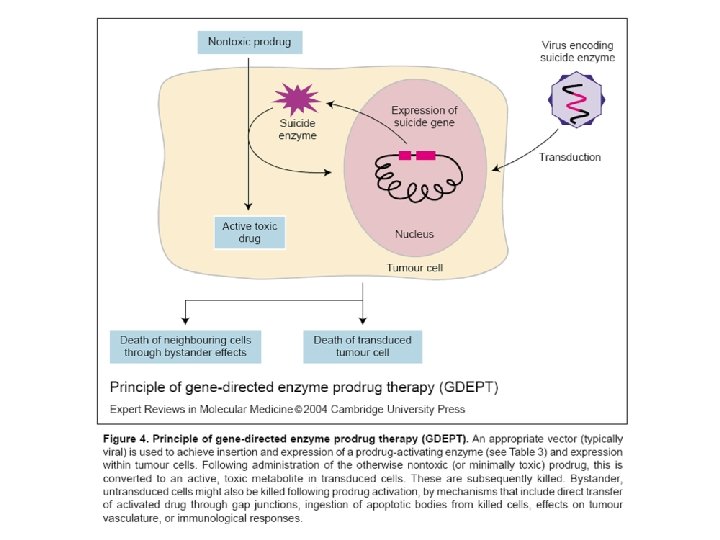
Enzīmi citu slimību ārstēšanā

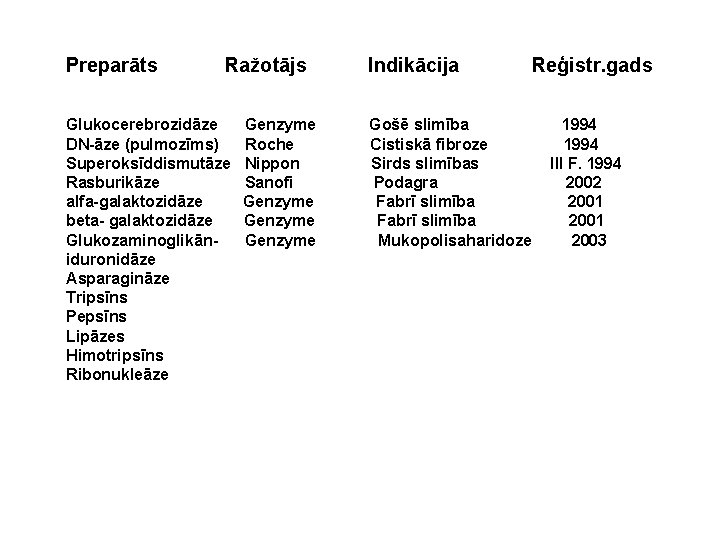
Preparāts Ražotājs Glukocerebrozidāze DN-āze (pulmozīms) Superoksīddismutāze Rasburikāze alfa-galaktozidāze beta- galaktozidāze Glukozaminoglikāniduronidāze Asparagināze Tripsīns Pepsīns Lipāzes Himotripsīns Ribonukleāze Genzyme Roche Nippon Sanofi Genzyme Indikācija Gošē slimība Cistiskā fibroze Sirds slimības Podagra Fabrī slimība Mukopolisaharidoze Reģistr. gads 1994 III F. 1994 2002 2001 2003

Glikolipidožu terapijai arī mēģina lietot trūkstošos enzīmus


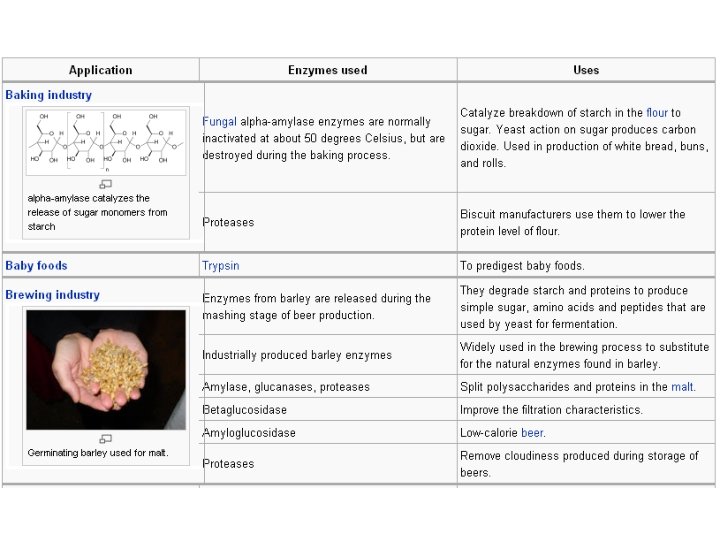
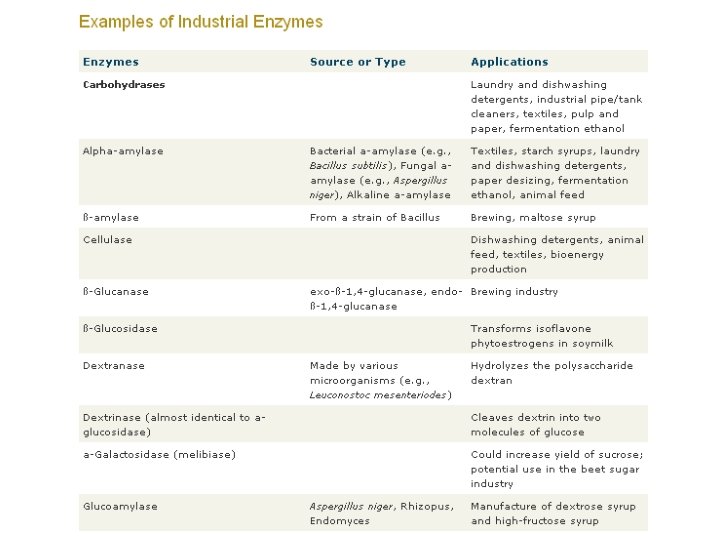
Enzīmi tautsaimniecībā




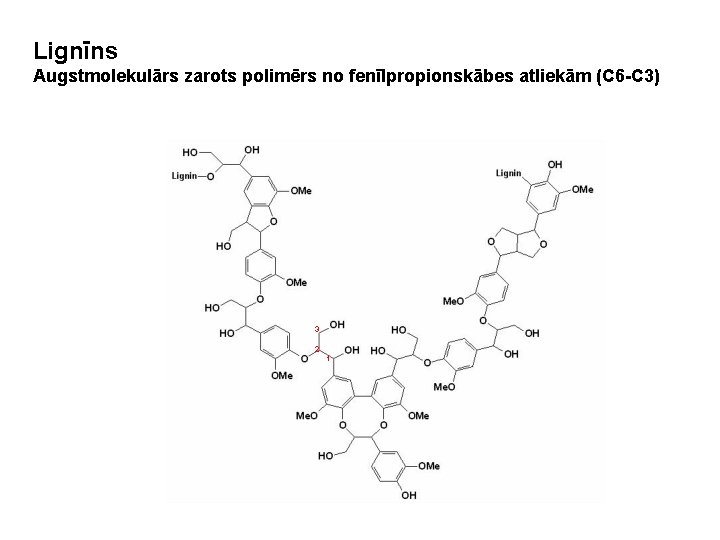
Lignīns Augstmolekulārs zarots polimērs no fenīlpropionskābes atliekām (C 6 -C 3) 3 2 1

Lignin is a complex polymer of phenylpropanoid subunits. It is an essential component of woody tissue, to which it imparts structural rigidity. Lignin is remarkably resistant to degradation by most microbes; nevertheless, a few species of white-rot fungi are able to catalyse its oxidation to CO 2. Its biodegradation is of great ecological significance because, next to cellulose, lignin is the most abundant renewable polymer on Earth. The first step in lignin degradation is depolymerization, catalysed by the lignin peroxidase isozymes (ligninases). These isozymes are secreted, along with hydrogen peroxide (H 2 O 2) by the fungus Phanerochaete chrysosporium Burds. under conditions of nutrient (nitrogen) limitation. Ligninases are not only important in lignin biodegradation, but are also potentially valuable in chemical waste disposal because of their ability to degrade environmental pollutants. We have undertaken the cloning of the ligninase genes to understand further their regulation and enzymology. We report here the isolation and characterization of a ligninase complementary DNA clone with a full-length insert. The c. DNA sequence shows that the sequence of the mature ligninase is preceded by a 28 -residue leader, and the mature protein is predicted to have a relative molecular mass of 37, 000. Consistent with the classification of ligninase as a peroxidase certain residues thought to be essential for peroxidase activity can be identified and near these residues the ligninase shows homology with other known peroxidases. Our c. DNA clone has also allowed us to show that expression of ligninase is regulated at the messenger RNA level.







Grūtības enzīmu pielietošanā un to pārvarēšana

Enzīmu biotehnoloģija 1. Mikrobialā biosintēze 2. Rekombinantu biotehnoloģija 3. Virzīta mutagenēze 4. Enzīmu imobilizācija

 Saturs
Saturs Kontrastkrāsas
Kontrastkrāsas Enzmi
Enzmi Enzmi
Enzmi Enzmi
Enzmi Enzmi
Enzmi Affärside
Affärside Praktisk idrottspsykologi
Praktisk idrottspsykologi Praktisk teori
Praktisk teori Pyt praktisk yrkesteori
Pyt praktisk yrkesteori Forhandlingstrening
Forhandlingstrening Bağıl ölçüt
Bağıl ölçüt Bartonellen diagnostik
Bartonellen diagnostik Pentaksiran diagnostik
Pentaksiran diagnostik Macam asesmen diagnostik
Macam asesmen diagnostik Formatif summatif diagnostik
Formatif summatif diagnostik Kasbiy o'zlikni anglashdagi ziddiyatlar haqida tushuncha
Kasbiy o'zlikni anglashdagi ziddiyatlar haqida tushuncha Objektif pemulihan khas
Objektif pemulihan khas Huber 360 price
Huber 360 price Psychologische diagnostik definition
Psychologische diagnostik definition