ENZIMAS Caractersticas Cofactores Tipos de enzimas Mecanismos de







- Slides: 29

ENZIMAS • • Características Cofactores Tipos de enzimas Mecanismos de catálisis Efecto del p. H y la temperatura Cinética Regulación de la actividad enzimática

ENZIMAS COMO CATALIZADORES BIOLÓGICOS Las enzimas son proteínas que: - Aumentan la velocidad de reacción - No se transforman - Participan en casi todas las reacciones que ocurren en un organismo • Son altamente específicas • Algunas son estereoespecíficas • Algunas son reguladas A + B + E C +D + E Sustratos Productos


Nomenclatura 1. - Se nombran por su sustrato más la terminación asa ejemplo: carboxipeptidasa A 2. - Se nombran por su acción y a continuación se coloca el número de clasificación ejemplo: peptidil -L-aminoácido hidrolasa (EC 3. 4. 17. 1 EC: enzyme commission Número es clase, sub-sub clase y un número arbitrario

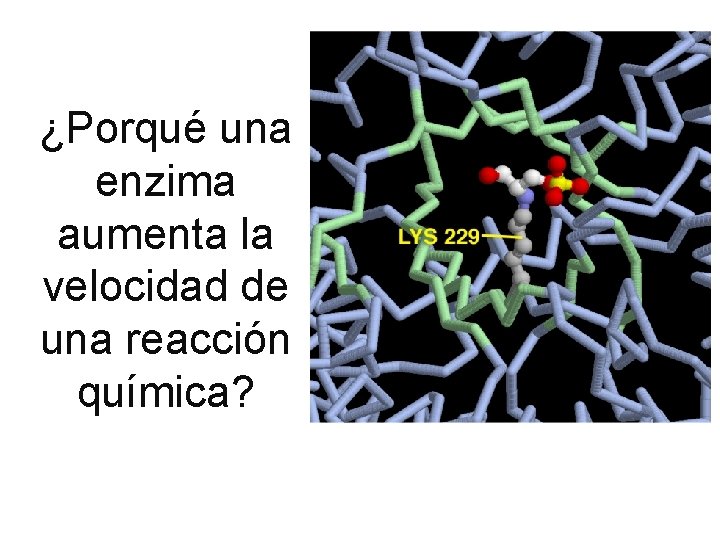
¿Porqué una enzima aumenta la velocidad de una reacción química?

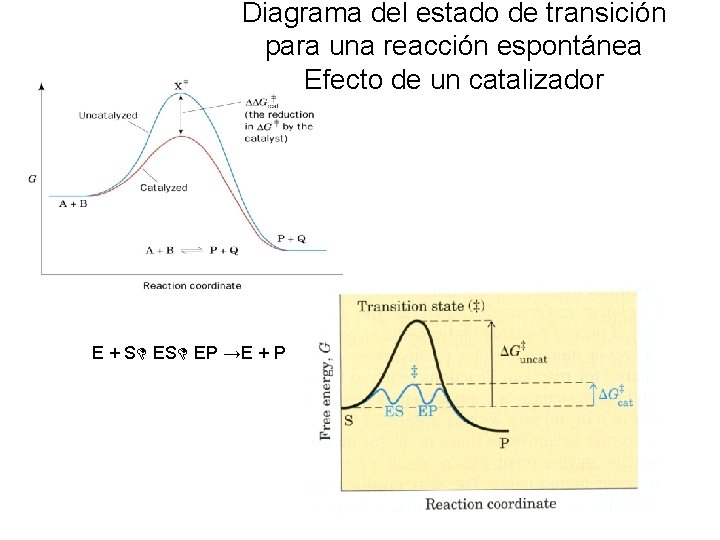
Diagrama del estado de transición para una reacción espontánea Efecto de un catalizador E + S ES EP →E + P

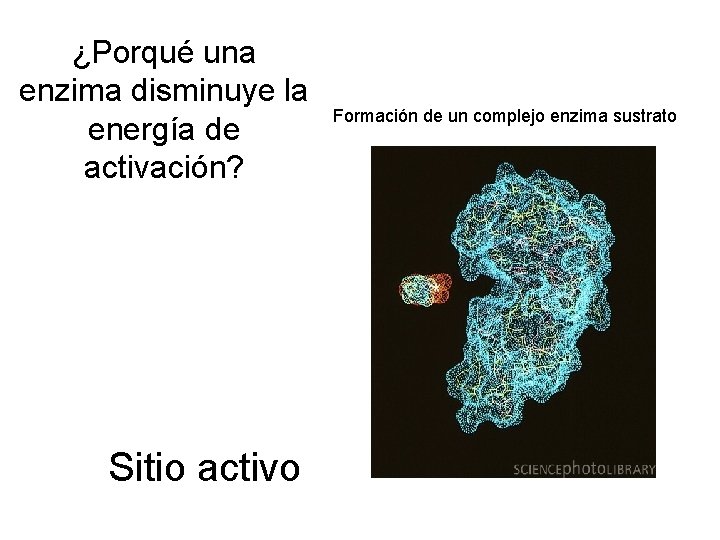
¿Porqué una enzima disminuye la energía de activación? Sitio activo Formación de un complejo enzima sustrato

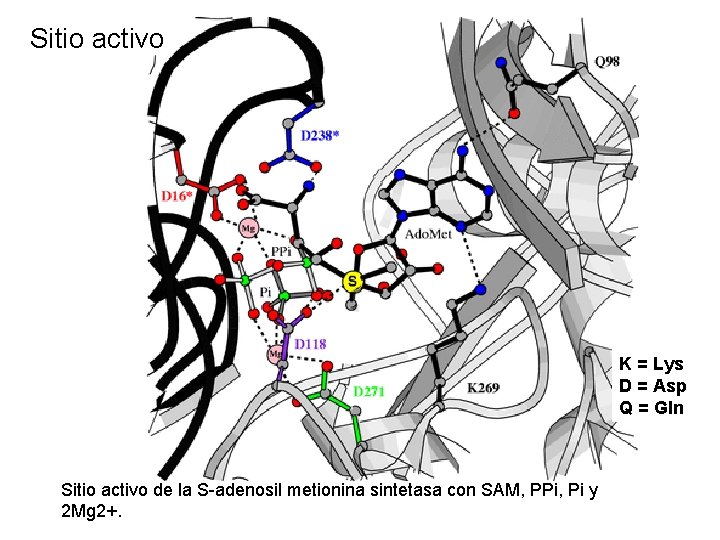
Sitio activo K = Lys D = Asp Q = Gln Sitio activo de la S-adenosil metionina sintetasa con SAM, PPi, Pi y 2 Mg 2+.

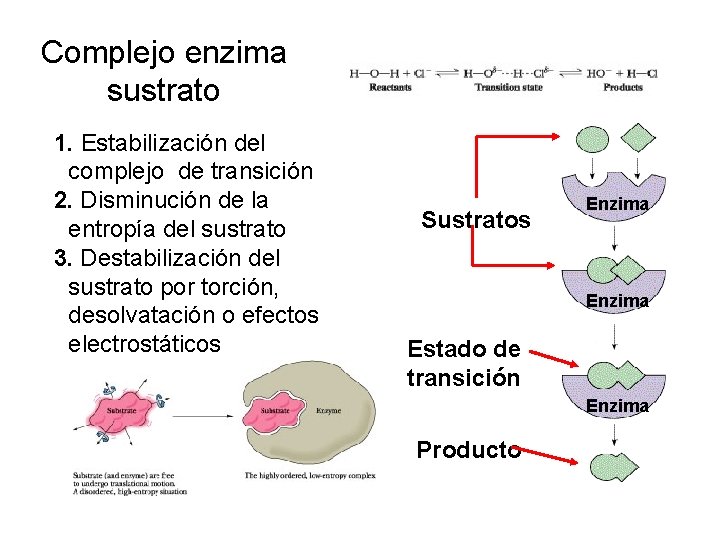
Complejo enzima sustrato 1. Estabilización del complejo de transición 2. Disminución de la entropía del sustrato 3. Destabilización del sustrato por torción, desolvatación o efectos electrostáticos Sustratos Enzima Estado de transición Enzima Producto

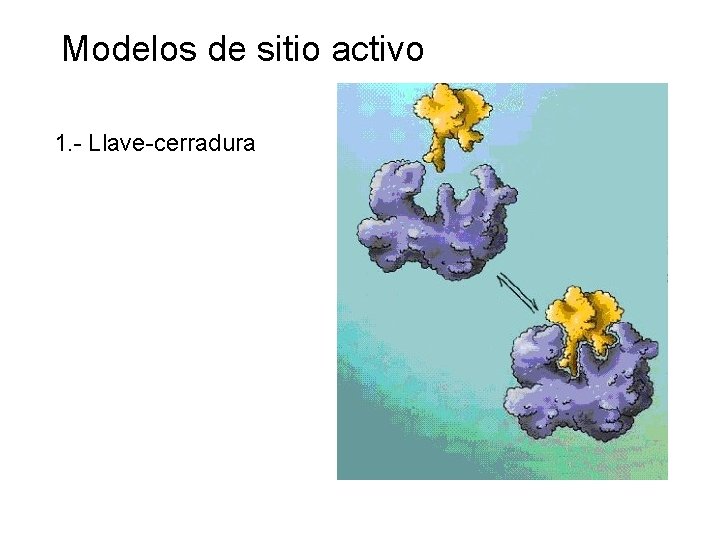
Modelos de sitio activo 1. - Llave-cerradura

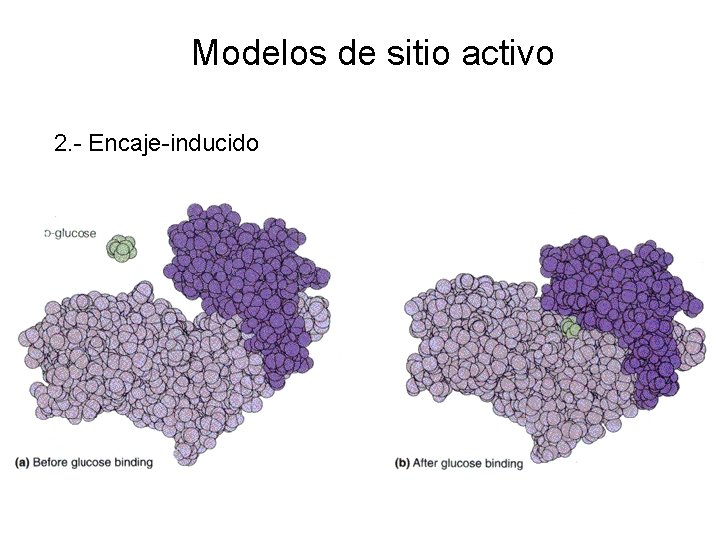
Modelos de sitio activo 2. - Encaje-inducido

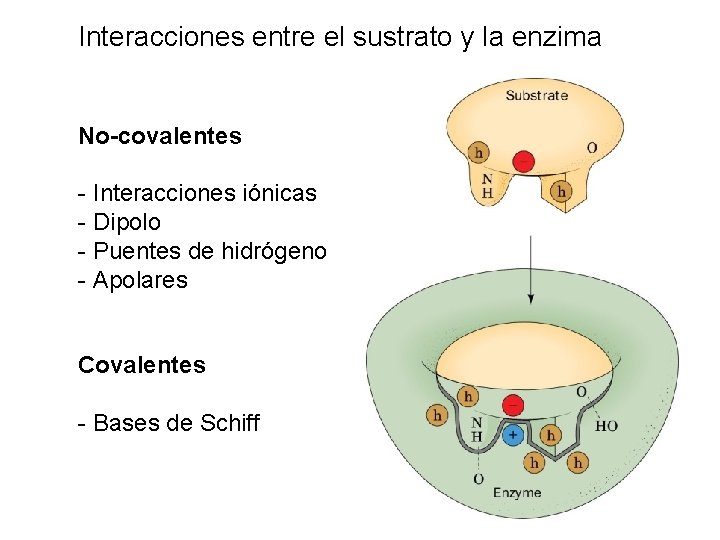
Interacciones entre el sustrato y la enzima No-covalentes - Interacciones iónicas - Dipolo - Puentes de hidrógeno - Apolares Covalentes - Bases de Schiff

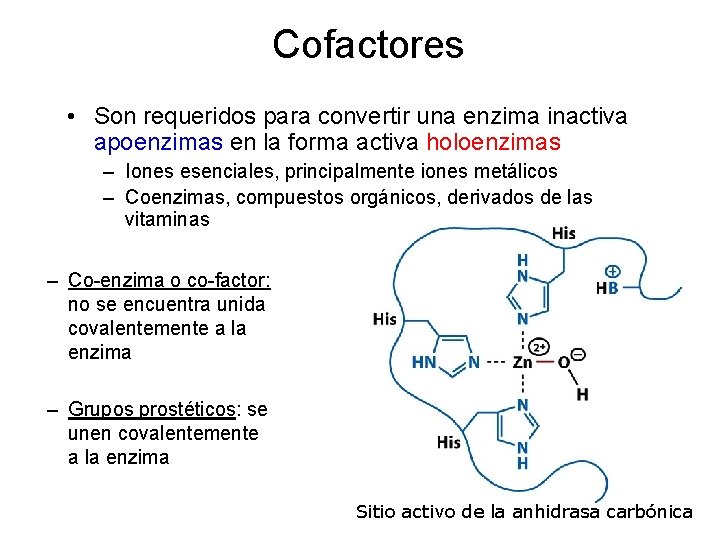
Cofactores • Son requeridos para convertir una enzima inactiva apoenzimas en la forma activa holoenzimas – Iones esenciales, principalmente iones metálicos – Coenzimas, compuestos orgánicos, derivados de las vitaminas – Co-enzima o co-factor: no se encuentra unida covalentemente a la enzima – Grupos prostéticos: se unen covalentemente a la enzima Sitio activo de la anhidrasa carbónica

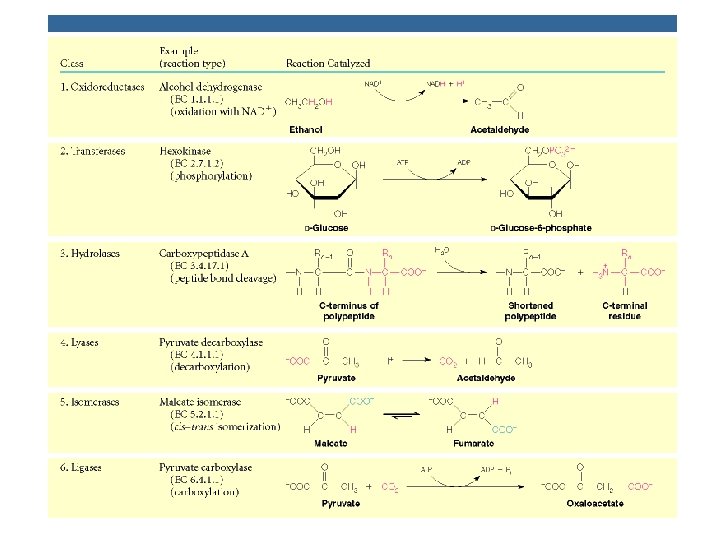
Clasificación de las enzimas 1. - Oxidoreductasas: Catalizan reacciones de oxido -reducción 2. - Transferasas: Transfieren un grupo funcional de una molécula a otra 3. - Hidrolasas: Catalizan el rompimiento hidrolítico de un enlace

Clasificación de las enzimas, cont…. 4. - Liasas: Catalizan la eliminación de un grupo generando un doble enlace, la adición de un grupo a un doble enlace o el rompimiento de un enlace que involucra rearreglo electrónico 5. - Isomerasas: Catalizan cambios geométricos o estructurales en una molécula 6. - Ligasas: Catalizan la unión de dos moléculas acopladas a la hidrólisis de ATP


Estrategias de catálisis • Aproximación y orientación • Covalente • Acido-base • Ión metálico

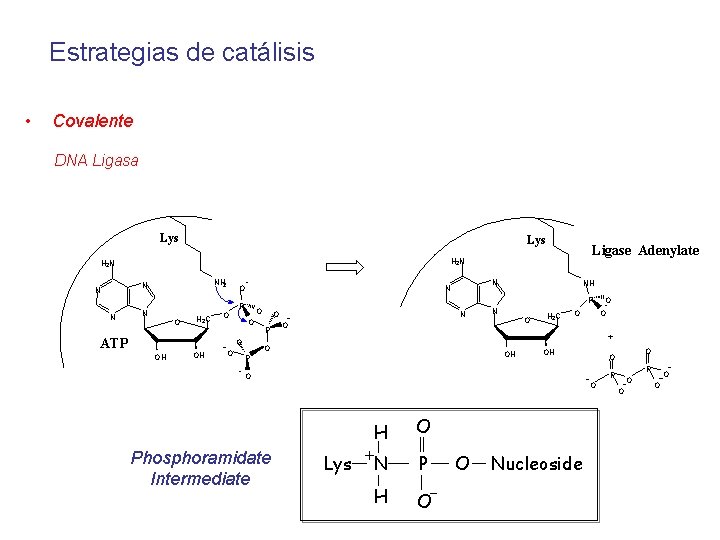
Estrategias de catálisis • Covalente DNA Ligasa Lys NH 2 N N N Ligase Adenylate H 2 N O H 2 C ATP OH OH O O O NH P P N N N O O O N O P N O O H 2 C O + O OH P OH O O P P O O H Phosphoramidate Intermediate O O Lys + O N P H O O Nucleoside O O

Estrategias de catálisis • Covalente Enzymes 1. Chymotrypsin Elastase Esterases Subtilisin Thrombin Trypsin 2. Glyceraldehyde-3 -phosphate dehydrogenase Papain 3. Alkaline phosphatase Phosphoglucomutase 4. Phosphoglycerate mutase Succinyl-Co. A synthetase 5. Aldolase Decarboxylases Pyridoxal phosphate-dependent enzymes Reacting Group Covalent Intermediate

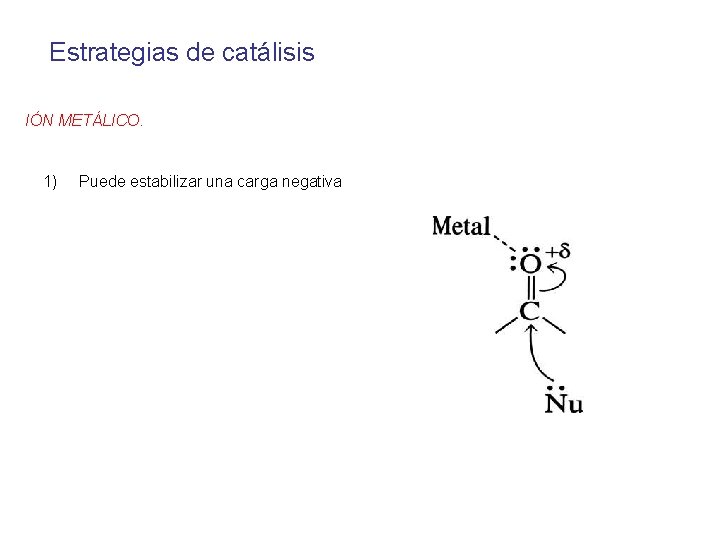
Estrategias de catálisis IÓN METÁLICO. 1) Puede estabilizar una carga negativa

Estrategias de catálisis Acido-base Triosa fosfato isomerasa

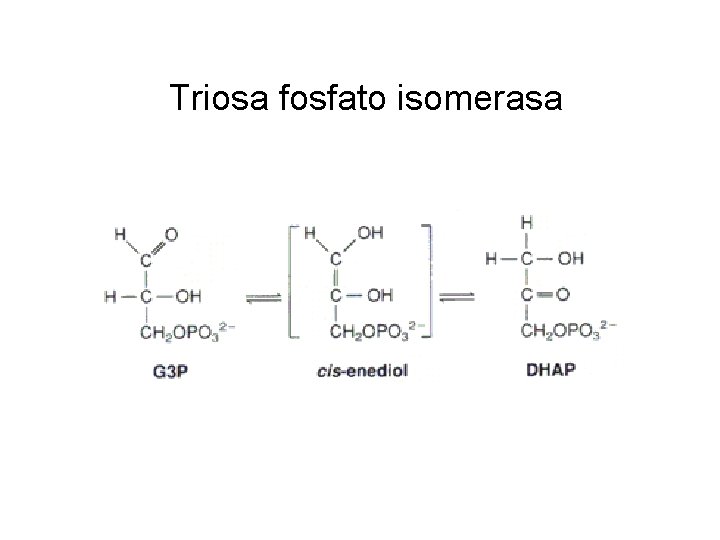
Triosa fosfato isomerasa

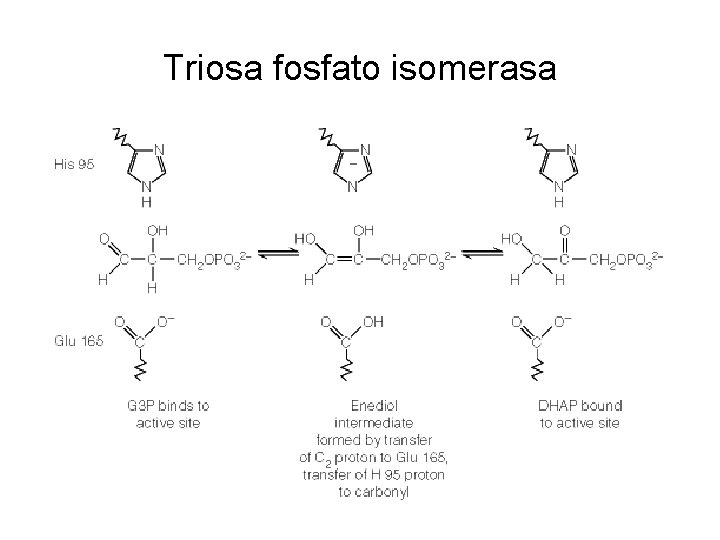
Triosa fosfato isomerasa

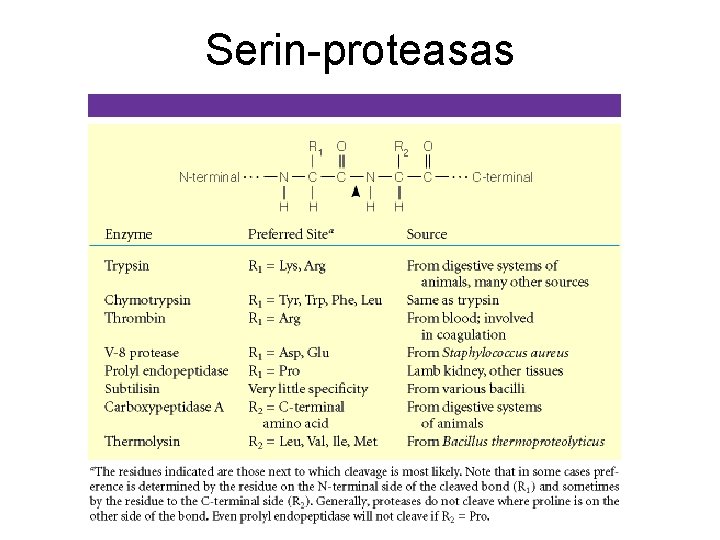
Serin-proteasas

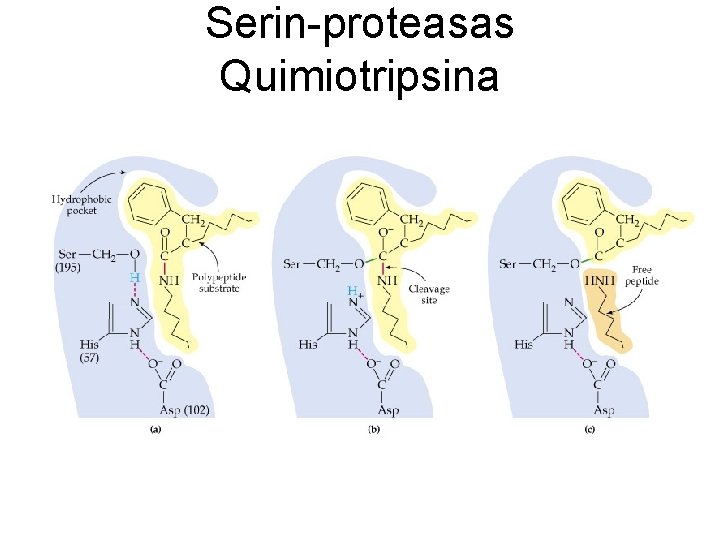
Serin-proteasas Quimiotripsina

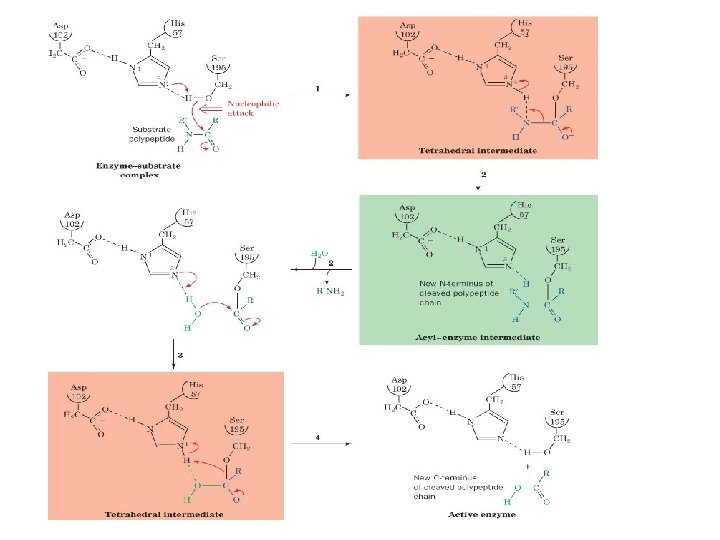
Mecanismo catalítico de una serin proteasa

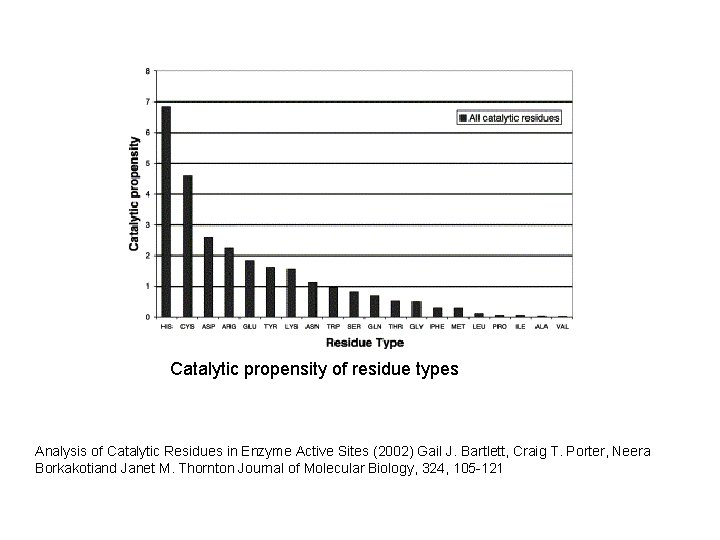
Catalytic propensity of residue types Analysis of Catalytic Residues in Enzyme Active Sites (2002) Gail J. Bartlett, Craig T. Porter, Neera Borkakotiand Janet M. Thornton Journal of Molecular Biology, 324, 105 -121

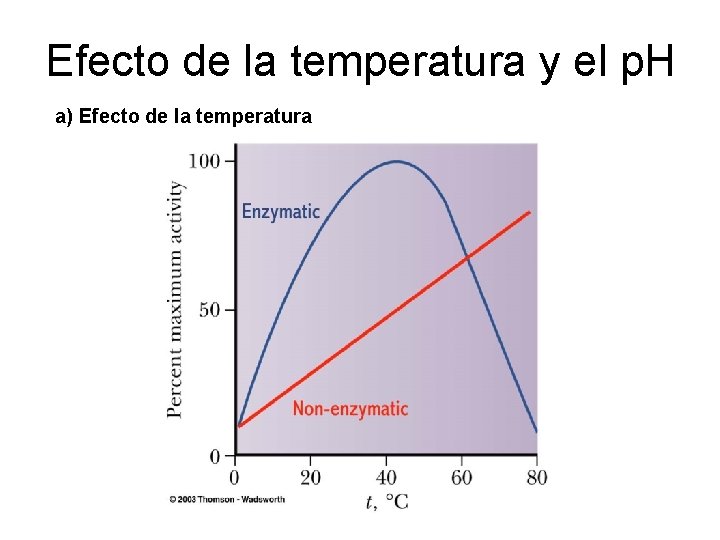
Efecto de la temperatura y el p. H a) Efecto de la temperatura

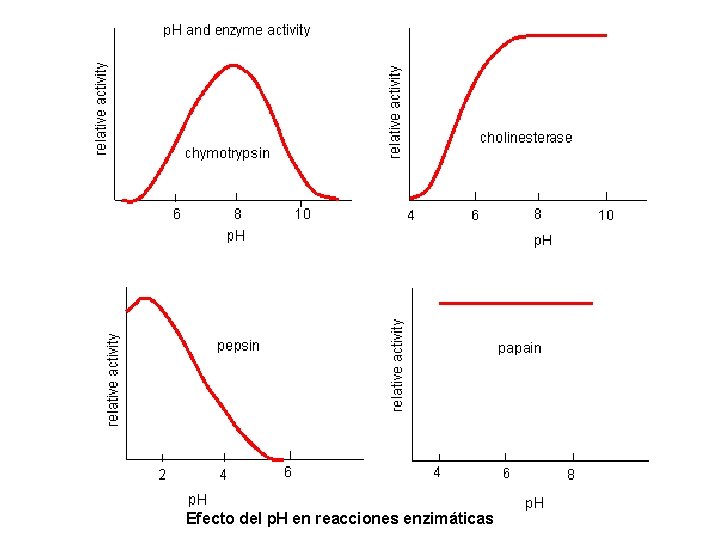
Efecto del p. H en reacciones enzimáticas