ENZIM Fery Indradewi Armadany Defenisi enzim Asal kata





























































- Slides: 72

ENZIM Fery Indradewi Armadany

Defenisi enzim Asal kata : bahasa Yunani (en dan zyme, arti : di dalam sel/ragi Defenisi : • katalis dalam proses biokimia, baik di luar maupun di dalam sel. • Menurut Dixon dan Webb : protein yang bersifat katalis disebabkan kemampuannya mengaktifkan senyawa lain secara spesifik. Bagian-bagian enzim Apoenzim : bagian protein dari suatu enzim Holoenzim : keseluruhan bagian enzim yang memiliki aktivitas biologi. Kofaktor : gugus selain protein pada enzim. Nama lain dari kofaktor adalah koenzim.

Kofaktor adalah nama yang mula-mula diberikan bagi koenzim karena pada penelitian awal tentang enzim disadari adanya faktor lain yang berperan dalam mengaktifkan kerja enzim selain protein. Selain itu kofaktor/koenzim dapat dipandang sebagai kosubstrat. Alasan yang mendasari : Apa yang terjadi pada koenzim tepat kebalikan dari apa yang terjadi pada substrat (cth bila substrat mengalami oksidasi maka koenzim akan mengalami reduksi, bila substrat melepaskan suatu gugus misalnya gugus metil maka koenzim akan mengalami metilasi. Apa yang terjadi pada koenzim lebih merupakan tujuan reaksi daripada apa yang dialami oleh substrat. Cth : dalam peristiwa glikolisis, pembentukan asam laktat atau asam piruvatlah yang penting, yang penting adalah apakah NAD dapat terus dipertahankan atau tidak. Jika NAD tidak dapat dipertahankan tetap dalam keadaan teroksidasi sehingga siap direduksi menjadi NADH, proses glikolisis itu sendiri akan terhenti dan sel akaan segera terancam mati. Cth lain adalah reaksi pengikatan energy, proses penerimaan gugus fosfat dari ADP menjadi ATP dipandang sebagai reaksi utama , bukan sebagai reaksi samping, padahal dari segi enzim dan koenzim, ADP maupun ATP berfungsi sebagai koenzim dimana ADP adalah penerima gugus fosfat dari substrat yang diolah dan ATP adalah pemberi (cth : peristiwa perubahan glukosa menjadi glukosa 6 -fosfat)

Koenzim : kofaktor yang tidak begitu kuat terikat pada bagian protein enzim (mudah dipisahkan dengan cara dialisis). Koenzim terdiri atas berbagai molekul organik, diantaranya adalah vitamin dan turunannya. Jika koenzim ini terikat dengan kuat pada protein enzim maka disebut sebagai gugus prostetik. Vitamin sebagai koenzim Peran vitamin di dalam proses metabolism adalah sebagai koenzim, baik dalam bentuk langsung ataupun bentuk turunannya

Aktivator : molekul kimia kecil, dapat berupa atom logam/unsur atau senyawa dengan BM kecil yang terikat dengan kuat ataupun longgar dengan bagian apoenzim. Peran logam pada suatu enzim seringkali sangat menentukan aktivitas enzimatik berkaitan dg adanya kenyataan bahwa banyak katalis bukan enzim adalah logam. fungsi katalis terpusat pada logam ini, sedangkan molekul apoenzim memberi suasana yang mendukung bagi berjalannya proses katalisis. Enzim dimana terdapat logam yang terikat dengan kuat pada apoenzim dan tidak dapat dipisahkan dengan cara dialisis, pengendapan atau ultrafiltrasi tanpa merusak apoenzim metaloenzim.

Sedangkan yang berikatan dengan longgar enzim yang diaktifkan oleh logam. Proenzim (zymogen) : enzim-enzim yang diseksresikan dalam bentuk belum aktif. Umumnya enzim-enzim ini diproduksi di tempat berbeda dari tempat dimana ia dibutuhkan. Contoh : pepsin disekresikan oleh sel-sel utama epitel mukosa lambung dalam bentuk pepsinogen. Oleh HCl yang disekresikan oleh sel-sel parietal epitel lambung, pepsinogen dihidrolisis menjadi pepsin dan peptida kecil di lambung dan siap bekerja untuk memecah protein. Jika pepsin telah terbentuk di epitel lambung maka bisa terjadi kerusakan epitel mukosa itu sendiri.

Enzim-enzim ini diberi awalan pro atau ditambahkan akhiran ogen. Cth : protrombin dan tripsinogen. • Contoh Apoenzim : pepsin dan tripsin • Contoh Kofaktor : Amilase dalam ludah akan bekerja lebih baik dengan adanya ion Cl dan Ca • Contoh Gugus Prostetik : Heme = molekul mengandung besi tersusun dari sejumlah enzim, diantaranya : katalase, peroksida. • Contoh Koenzim : NAD koenzim yang sangat penting dalam respirasi seluler



Klasifikasi dan tata nama enzim • Berdasarkan substrat Contoh : laktase, maltase, proteinase. Kelemahan : terdapat banyak jenis enzim yang berlainan yang bekerja pada satu substrat dengan cara yang berbeda pula namun menghasilkan produk yang sama. Contoh : Glukosa + O 2 glukonolakton + H 2 O 2 (enzim yang bekerja dinamakan glukase) Glukosa + NADP+ glukonolakton + NADPH + H+ (enzim yang bekerja dinamakan glukase)

• Berdasarkan jenis ikatan kimia substrat Contoh : peptidase, fosfatase, esterase. Ada kerancuan seperti pada fosfatase yang sebenarnya juga merupakan esterase (memecah ikatan ester) Peptidase sendiri dapat dibagi menjadi beberapa jenis lagi yang mempunyai kekhususan tersendiri seperti karboksipeptidase, aminopeptidase, dipeptidase. Tata nama ini tidak menjelaskan apakah ikatan kimia yang menjadi dasar penamaan tsb dipecah atau dibentuk oleh enzim yang bersangkutan.

• Berdasarkan jenis reaksi Contoh ; glukosa oksidase, amino transferase/transaminase. Jika berdasarkan asas ini maka enzim-enzim yang melakukan hidrolisis seperti esterase, glikosidase seharusnya dinamakan hidrolase.

Hubungan tata nama dan klasifikasi Klasifikasi yang tepat dan deskriptif haruslah didasarkan pada suatu tata nama yang tepat. Hal tsb terlihat dari usaha klasifikasi sebelumnya (bagian 1 -3) dimana ada cukup banyak enzim yang tidak tertampung dalam system tsb. Klasifikasi yang dilakukan oleh Baldwin (berdasarkan jenis reaksi, terbagi dalam 4 kelas) belum menghasilkan tata nama yang deskriptif dan informatif. Demikian pula oleh Webb dan Dixon (berdasarkan jenis reaksi yang dikatalisis, terbagi dalam 3 kelas) tidak lebih memuaskan dibandingkan dengan klasifikasi oleh Baldwin.

Klasifikasi Berdasarkan IUB Dasar klasifikasi : jenis reaksi. Terbagi atas 6 kelas yang dibagi lagi menjadi 4 -20 subkelas. Oksidoreduktase Adalah enzim yang mengkatalisis pemindahan hydrogen dari suatu substrat ke substrat lainnya. Terbagi atas golongan dehidrogenase dan oksidase. Secara umum golongan ini terbagi atas 20 subkelas. Transferase Adalah enzim yang bekerja sebagai katalis pada reaksi pemindahan suatu gugus dari suatu senyawa ke senyawa lainnya. terbagi atas 8 subkelas. Contohnya : Metiltransferase Hidroksimetiltransferase Karboksiltransferase Aminotransferase / transaminase

Hidrolase Adalah enzim yang bekerja sebagai katalis pada reaksi hidrolisis. Terbagi atas 11 sub kelas. Contohnya : Liase Adalah enzim yang berperan dalam reaksi pemisahan suatu gugus dari suatu substrat atau sebaliknya dengan cara selain hidrolisis. Terbagi atas 7 sub kelas. Contohnya dekarboksilase, aldolase, hidratase. Isomerase Adalah enzim yang bekerja pada perubahan intramolekuler, yaitu reaksi isomerisasi. (Isomer adalah senyawa yg memiliki rumus molekul sama tetapi rumus strukturnya berbeda). Terbagi atas 6 sub kelas. Contohnya adalah

Ligase Adalah enzim yang bekerja pada reaksi penggabungan dua molekul. Dinamakan juga sintetase. Ikatan yang terbentuk dari penggabungan ini adalah ikatan C-O, C-S, C-N, C-C, disertai penguraian ikatan berenergi tinggi seperti ATP. Terbagi atas 5 sub kelas. Contohnya :

Tata nama menurut IUB Tiap enzim ditetapkan ke dalam empat tingkat nomor kelas dan diberikan suatu nama sistematik yang mengidentifikasi reaksi yang dikatalisis. Contoh : EC. W. X. Y. Z, dimana EC menunjukkan penamaan menurut Enzyme Commission Number System W kelas reaksi yang dikatalisis (gol. I – VI) X subkelas, yaitu substrat atau gugus yang bereaksi Y sub-subkelas, yaitu substrat spesifik atau koenzim yang terlibat Z nomor seri enzim


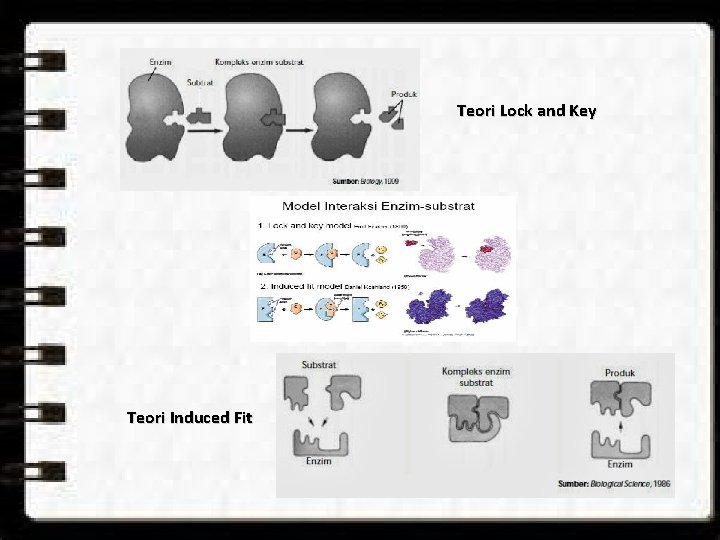
PEMODELAN ENZIM Model Kunci dan Anak Kunci (Lock and Key) oleh Fischer Ketika substrat bertemu dengan enzim dalam perbenturan keduanya mungkin terjadi perbenturan pada bagian tertentu dari molekul enzim yang strukturnya sedemikian rupa sehingga dapat diduduki secara pas oleh substrat dan terbentuk kompleks ES. dapat menerangkan proses katalisis dengan satu substrat ataupun sejumlah substrat yang terjadi berurutan. cocok untuk menerangkan analisis kinetika sederhana seperti yang diajukan oleh Michaelis-Menten; menerangkan ikatan enzim dengan penghambat bersaing dengan adanya bagian aktif (active site) yang spesifik juga menerangkan hanya sebagian kecil dari bagian molekul enzim yang berperan dalam proses katalitik enzim.

Kekurangan : Bentuk enzim dan substrat yang digambarkan adalah tegar/kaku/tidak lentur. Ada atau tidak ada substrat di sekitarnya struktur 3 D molekul tidak berubah dan situs aktif tetap terbuka dalam keadaan siaga mempunyai tingkat energy tertentu yang terusmenerus harus dipertahankan, pertanyaannya darimana energy ini berasal jika enzim tsb telah dimurnikan dikeringkan dalam waktu cukup lama (sulit diterima bila energy termodinamik berasal dari lingkungan dalam hal ini akibat adanya gerak acak Brown dimana pada nilai tertentu energy termodinamik malah berpotensi merusak molekul enzim).

Hasil benturan yang merupakan peristiwa acak dan hanya bagian kecil molekul enzim yang berperan dalam maka peluang tiap benturan tidak sama (kecil). Tidak memberikan gagasan bagaimana proses katalisis terjadi. Enzim tidak dapat membedakan mana substrat dan bukan substrat. Tidak ada penjelasan apa yang terjadi setelah tebentuk kompleks dimana mengapa kompleks ES diolah sedangkan kompleks EI tidak (tidak dapat membedakan tahap pengikatan dan tahap pengolahan). Tidak mampu menjelaskan fenomena penghambatan nirsaing dan tak bersaing (uncompetitive and non competitive) dimana kompleks ES tetap terbentuk namun kompleks yang dihasilkan tidak menghasilkan apa-apa.

Model Suai-Bentur (Induced Fit) oleh Koschland Berdasarkan analisis spectrum dan gambaran kristalografi sinar X kompleks ES dalam antaraksi enzim-substrat, untuk dapat mengikat dan mengolah substrat tidak hanya bagaian molekul enzim yang berkontak dengan substrat, akan tetapi seluruh bagian molekul enzim aktif menyesuaikan diri mengambil bentuk sedemikian rupa sehingga ada bagian yang dapat mengikat dan mengolah substrat (terjadi perubahan konformasi 3 D). Istilah bagian aktif menjadi kurang tepat karena semua bagian molekul enzim berperan aktif dalam menyusun diri sedemikian rupa sehingga substrat dapat diikat diperkenalkan istilah bagian katalitik (catalytic site). dapat mengatasi beberapa fenomena yang tidak dapat dijelaskan sblmnya namun masih belum dapat menjelaskan secara khusus fenomena penghambatan nirsaing (unkompetitif penghambatan irreversibel) dan tak bersaing (non kompetitif).

Teori Lock and Key Teori Induced Fit

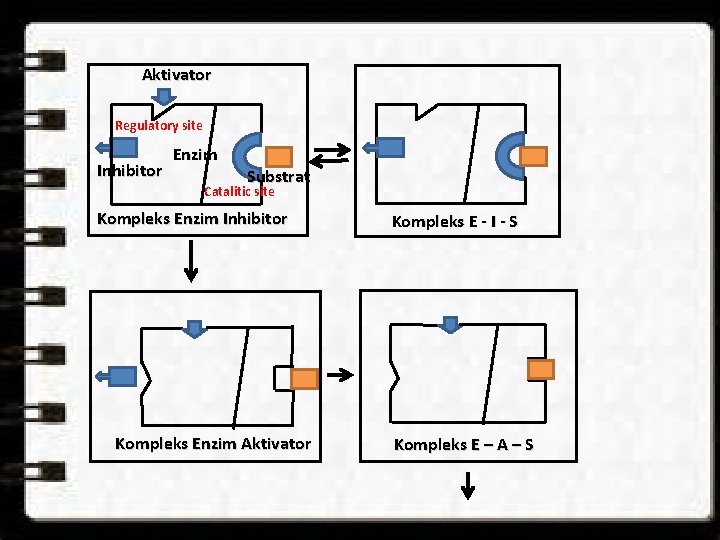
Model Ketuk Tular (Pengaturan Alosterik) oleh Monod. Wyman-Changeux (Pengaturan / regulasi kerja enzim) Adanya tempat lain yang dikenal dengan nama bagian alosterik (bahasa Yunani, allos : yang lain; stereos : ruang) selain bagian katalitik. Perubahan konformasi subunit yang mengandung bagian/tempat alosterik menjalar ke subunit yang mengandung tempat/bagian katalitik sedemikian rupa sehingga bagian katalitik dapat mengikat substrat tetapi tidak dapat mengolahnya lebih lanjut untuk menghasilkan produk.

Aktivator Regulatory site Inhibitor Enzim Substrat Catalitic site Kompleks Enzim Inhibitor Kompleks Enzim Aktivator Kompleks E - I - S Kompleks E – A – S

produk Enzim


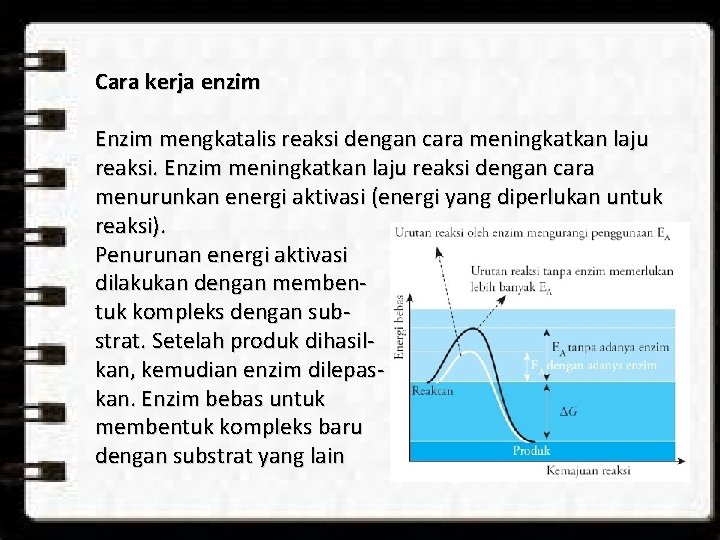
Cara kerja enzim Enzim mengkatalis reaksi dengan cara meningkatkan laju reaksi. Enzim meningkatkan laju reaksi dengan cara menurunkan energi aktivasi (energi yang diperlukan untuk reaksi). Penurunan energi aktivasi dilakukan dengan membentuk kompleks dengan substrat. Setelah produk dihasilkan, kemudian enzim dilepaskan. Enzim bebas untuk membentuk kompleks baru dengan substrat yang lain

Spesifitas kerja enzim Spesifitas stereoisomer Tergantung pada banyaknya suatu stereoisomer substrat yang bersangkutan terdapat di alam dan yang digunakan oleh mahluk hidup. Pada umumnya spesifitas ini dapat dipandang sebagai “mekanisme sensor” pertama dari enzim. Spesifitas ikatan kimia Untuk ikatan-ikatan yang berbeda diperlukan enzim yang berbeda pula. Spesifitas gugus Enzim bekerja hanya terhadap substrat yang memiliki gugus tertentu

Tingkat spesifitas Spesifitas enzim mempunyai tingkatan tertentu. Ada yang hanya mempedulikan ikatan kimia saja, dengan demikian dapat mengolah beberapa jenis substrat. Enzim demikian dikatakan memiliki spesifitas yang rendah. Contohnya enzim-enzim pencernaan. Adapula yang memerlukan sarat-sarat tambahan lainnya sehingga hanya mampu mengolah satu substrat saja sehingga dikatakan mempunyai spesifitas yang tinggi. Contohnya enzim-enzim yang diperlukan dalam metabolism antara (intermediate metabolism)

Mekanisme katalisis (Daya Katalitik) Faktor-faktor yang mendukung efisiensi katalisis enzim : Letak dan orientasi substrat dalam hubungannya dengan gugus katalitik Enzim mempunyai ukuran yang sangat besar sehingga dalam perbandingan yang ekuimolar, ukuran yang besar tsb memberi peluang yang sangat besar bagi benturan antar molekul. Adanya benturan tsb membuat enzim memulai perubahan konformasi untuk membentuk struktur tiga dimensi peralihan. Dalam bentuk seperti ini ketika substrat berjumpa dengan bagian enzim yang melakukan proses katalisis, dengan mudah substrat akan mengambil tempat dan duduk dengan pas pada tempat katalisis yang tersedia.

Dengan demikian terjadi pendekatan gugus-gugus aktif dari enzim dan substrat. Kemampuan ini dinamakan sebagai pengarahan orbital (orbital steering) dan merupakan reaksi yang benar-benar terarah (bukan keadaan yang acak). Stabilisasi stadium transisi, yaitu dorongan perubahan yang tepat. Jika telah terjadi pengiblatan yang tepat dari elektron orbit gugus-gugus reaktif, maka substrat diregang sehingga struktur transisi dicapai untuk selanjutnya tercapai bentuk antara dan disusul dengan transaksi proton sehingga terbentuk senyawa produk yang dilepaskan oleh enzim.

Katalisator umum asam basa Katalisator nukleofilik dimiliki oleh enzim Katalisator elektrofilik Katalisator kovalen Secara umum proses katalisis bukan enzim dapat dikelompokkan dalam katalisis asam-basa, katalisis elektrostatik, dan katalisis kovalen. Asam memantapkan suatu bentuk peralihan dari suatu senyawa dengan memberikan elektron sedangkan basa memantapkannya dengan cara menerima elektron. Contohnya katalisis ester oleh suatu basa. Demikian pula asam akan mudah memutus kebanyakan ikatan kovalen. Katalisis ligam biasanya bekerja dengan cara membentuk ikatan elektrostatis sehingga dinamakan juga katalis elektrostatis.

Proses katalisis dapat juga terjadi melalui pembentukan ikatan kovalen sementara antara molekul katalis dengan molekul substrat. Katalis demikian dinamakan katalis kovalen. Dalam pembentukan ikatan kovalen selalu ada gugus yang cenderung untuk memberikan pasangan electron ke gugus lain (bersifat nukleofil). Bender dkk menunjukkan senyawa yang mempunyai gugus amina tersier mempunyai sifat nukleofil dan dapat bekerja sebagai katalis kovalen. Selain senyawa yang bersifat nukleofil tentu ada senyawa yang bersifat elektrofil, dalam hubungan enzim atau katalis dengan substrat, enzim atau katalis nuklerofil akan menyerahkan pasangan elektron ke substrat elektrofil.

Sebaliknya, katalis yang bekerja secara elektrofil dalam membentuk ikatan kovalen juga ada, misalnya katalis logam tembaga (Cu) dipandang sebagai katalis kovalen elektrofil karena kemampuannya untuk menyerap pasangan electron dari gugus / senyawa lain. Dalam molekul protein tidak ada residu AA yang mempunyai gugus elektrofil namun dalam hal ini, untuk enzim dibantu dengan adanya gugus prostetik shg fungsi ini tetap dapat berjalan. Contohnya tiamin pirofosfat yang memindahkan gugus keto.

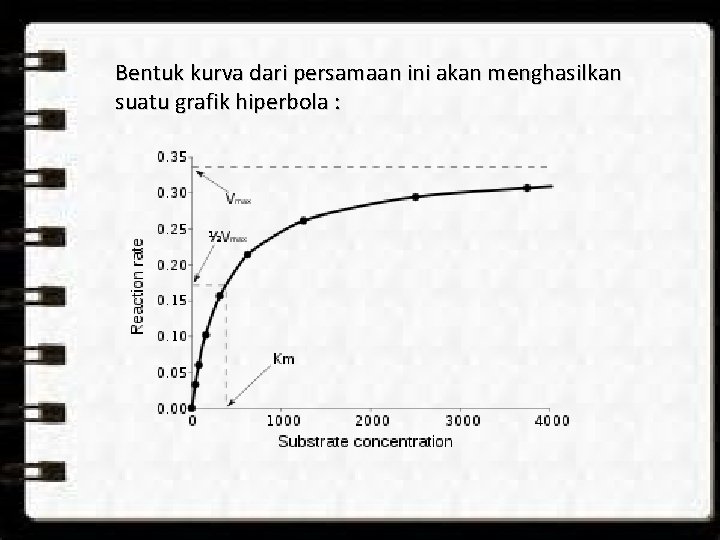
Faktor-faktor yang mempengaruhi kerja enzim Konsentrasi substrat Mengikuti persamaan Michaelis-Menten, dimana pada saat konsentrasi substrat rendah maka laju reaksi mengikuti reaksi orde satu dimana kenaikan konsentrasi substrat akan meningkatkan laju reaksi sedangkan pada saat konsentrasi substrat meningkat hingga jauh melampaui harga Km maka peningkatan konsentrasi substrat tidak akan mempengaruhi laju reaksi (laju reaksi berada pada orde nol). Konsentrasi enzim Laju reaksi berbanding lurus dengan konsentrasi enzim makin tinggi konsentrasi enzim makin besar laju reaksinya.

p. H karena merupakan suatu protein maka enzim mempunyai aktivitas maksimum pada p. H tertentu yang dikenal dengan nama p. H optimum. Di luar nilai p. H optimum maka aktivitas enzim akan berkurang bahkan dapat kehilangan aktivitasnya. Hal ini disebabkan karena terjadi denaturasi. Suhu Enzim juga bekerja pada suhu tertentu. Suhu dimana aktivitas enzim maksimum disebut suhu optimum. Makin besar perbedaan suhu reaksi dengan suhu optimum, makin rendah laju reaksi. Pada suhu yang lebih rendah penyebab kurangnya laju reaksi enzimatik adalah kurangnya gerak termodinamik yang menyebabbkan kurangnya tumbukan antara molekul enzim dan substrat.

Sedangkan pada daerah yang suhunya lebih tinggi dari suhu optimum selain gerak termodinamik yang akan meningkat sehingga benturan molekul akan lebih sering terjadi. Selain itu juga terjadi denaturasi sehingga bentuk tiga dimensinya berubah secara bertahap.

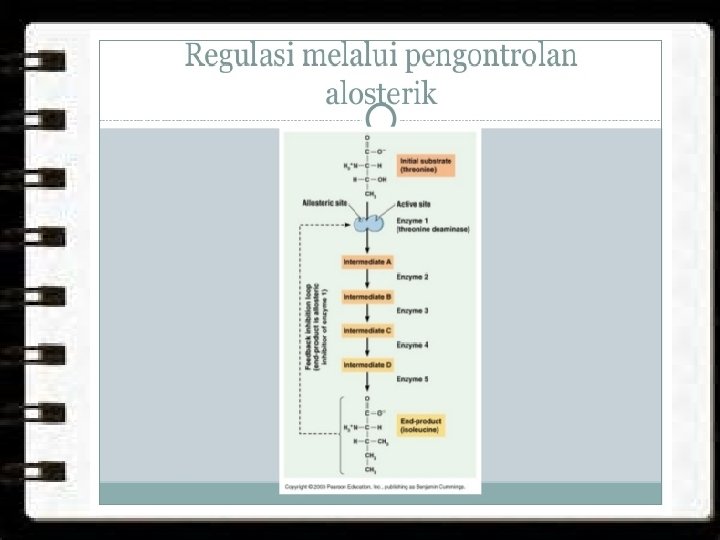
Kontrol terhadap kerja enzim Dalam sistem biologis, kecepatan kerja enzim dapat dipengaruhi oleh kehadiran suatu molekul lain yang dapat berperan sebagai pemicu (activator) atau penghambat (inhibitor), keduanya biasanya disebut secara bersama sebagai efektor. Pada jalur metabolisme pola umum pengontrolan biasanya terjadi ketika enzim pertama pada jalur metabolisme tersebut dihambat kerjanya oleh hasil akhir dari jalur metabolisme tersebut. Penghambatan ini biasanya dinamakan feedback inhibition (lihat model enzim Monod) Kontrol kerja enzim lainnya dapat berbentuk pengaturan pada proses terjadinya enzim yang aktif yang berasal dari enzim yang belum aktif (proenzim atau zymogen).

Contoh, beberapa jenis enzim diproduksi oleh kelenjar tertentu dalam tubuh masih berupa proenzim atau zymogen yang belum aktif. Aktivasi zymogen menjadi enzim aktif bisa dilakukan oleh enzim lainnya yang sudah aktif. Sebagai contoh, enzim tripsin, pertama kali diproduksi oleh pankreas masih berupa tripsinogen. Tripsinogen dibawa ke usus halus dan diaktivasi oleh enzim enteropeptidase yang dihasilkan oleh usus halus membentuk enzim tripsin yang aktif. Selanjutnya enzim tripsin dapat mengaktivasi balik tripsi nogen atau zymogen lainnya misalnya chymotrypsinogen dan proelastase menjadi chymotripsin dan elastase

Penghambatan kerja enzim (inhibisi enzim) Adalah senyawa yang menurunkan kecepatan reaksi enzimatik. Hampir semua jenis enzim dapat dihambat oleh senyawa kimia tertentu. Terdapat 2 jenis penghambat utama enzim, yaitu : Penghambatan tidak dapat balik (irreversible), yaitu penghambat yang bekerja dengan cara bereaksi dengan atau merusakkan suatu gugus fungsional pada molekul enzim yang penting bagi aktivitas katalitiknya. Contohnya : diisopropilfluorofosfat (DFP) yang bekerja menghambat enzim asetilkolenesterase sehingga dapat mengganggu transmisi impuls saraf.

Namun terdapat manfaat lain dari DFP yaitu menginaktivasi malathion (suatu jenis insektisida) sehingga dapat diuraikan oleh hewan tingkat tinggi menjadi produk yang tidak berbahaya bagi manusia dan hewan tsb, namun pada serangga, oleh enzim-enzim yang terdapat dalam serangga diubah menjadi senyawa penghambat aktif asetilkolinesterase serangga tsb. Penghambatan dapat balik (reversible), terbagi atas : Penghambat kompetitif dan Penghambat nonkompetitif


COOǀ CH 2 ǀ COOSuksinat (substrat) - COOǀ COOC=O ǀ ǀ CH 2 ǀ ǀ COOCOOMalonat Oksaloasetat Penghambat kompetitif

Pengaruh inhibitor pada kecepatan reaksi Penghambatan kompetitif • inhibitor bersaing dgn substrat untuk terikat pd sisi aktif • Biasanya inhibitor berupa senyawa yg menyerupai substratnya, & mengikat enzim membentuk kompleks EI • krn terikat scr reversible penghambatannya bias, yaitu ketika ditambah substrat maka penghambatan berkurang

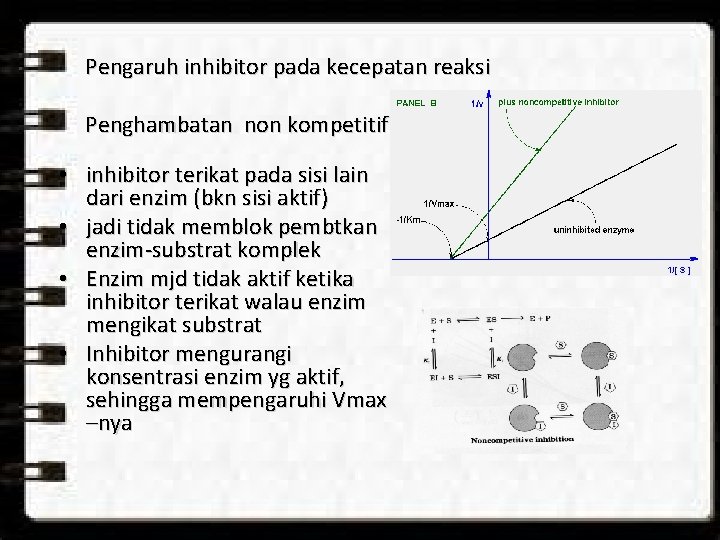
Pengaruh inhibitor pada kecepatan reaksi Penghambatan non kompetitif • inhibitor terikat pada sisi lain dari enzim (bkn sisi aktif) • jadi tidak memblok pembtkan enzim-substrat komplek • Enzim mjd tidak aktif ketika inhibitor terikat walau enzim mengikat substrat • Inhibitor mengurangi konsentrasi enzim yg aktif, sehingga mempengaruhi Vmax –nya

Pengaruh inhibitor pada kecepatan reaksi Penghambatan un kompetitif • Terikat pd sisi selain sisi aktif enzim • Berbeda dgn noncompetitive inhibitor ini hanya terikat pd ES komplek • Sehingga tidak terikat pd enzim bebas • Vmax berubah, dan Km juga berubah




Bentuk kurva dari persamaan ini akan menghasilkan suatu grafik hiperbola :



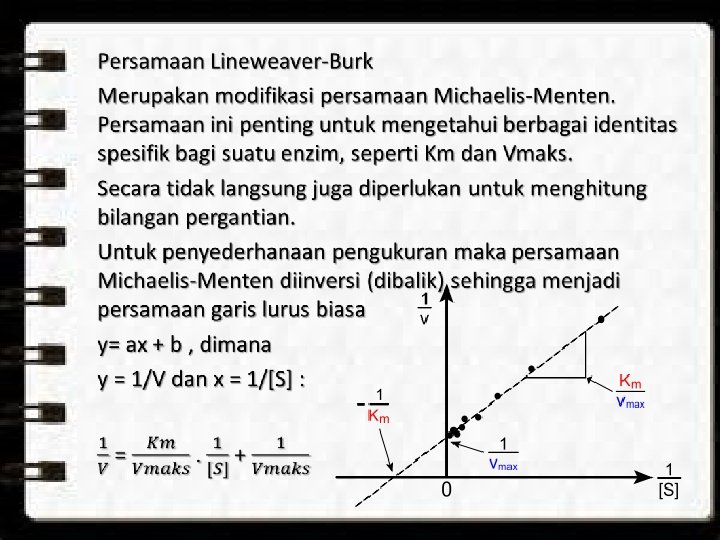
Karena Km = k 2 /k 1 dapat dikatakan bahwa Km adalah Kd dari reaksi E + S ↔ ES. Dalam hal ini Km dapat digunakan untuk melihat afinitas antara substrat dengan enzim. Makna k 3 merupakan bilangan pergantian (turn over number) / tetapan laju katalisis.



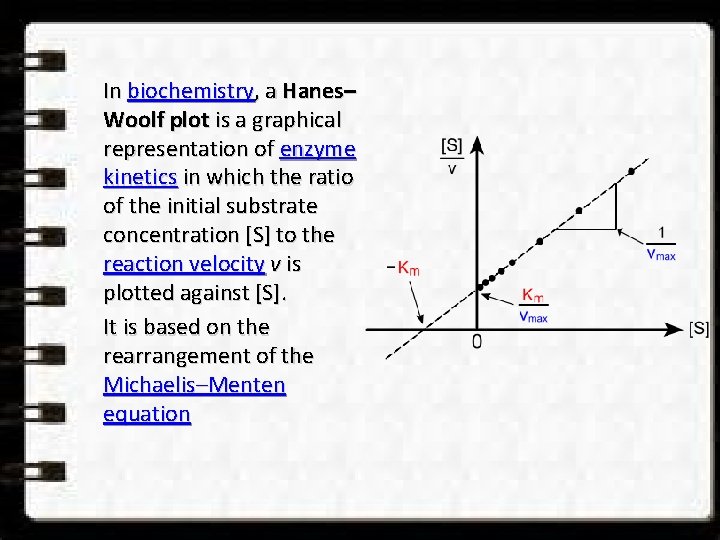
In biochemistry, a Hanes– Woolf plot is a graphical representation of enzyme kinetics in which the ratio of the initial substrate concentration [S] to the reaction velocity v is plotted against [S]. It is based on the rearrangement of the Michaelis–Menten equation

v Specific activity is the amount of product formed by an enzyme in a given amount of time under given conditions per milligram of enzyme. v The rate of a reaction is the concentration of substrate disappearing (or product produced) per unit time (mol. L-1 s-1) v The enzyme activity is the moles converted per unit time (rate × reaction volume). Enzyme activity is a measure of quantity of enzyme present. The SI unit is the katal, 1 katal = 1 mols-1 , but this is an excessively large unit. A more practical value is 1 enzyme unit (EU) = 1 μmol min-1 (μ = micro, x 10 -6). v The specific activity is the moles converted per unit time per unit mass of enzyme (enzyme activity / actual mass of enzyme present). The SI units are katal kg-1, but more practical units are μmol mg-1 min-1. Specific activity is a measure of enzyme efficiency, usually constant for a pure enzyme.

v If the specific activity of 100% pure enzyme is known, then an impure sample will have a lower specific activity, allowing purity to be calculated. v The % purity is 100% × (specific activity of enzyme sample / specific activity of pure enzyme). The impure sample has lower specific activity because some of the mass is not actually enzyme.

Pemanfaatan enzim Bidang industri Industri pangan Penggunaan protease pancreas dan papain sebagai pengempuk daging. Penggunaan protease hewan (rennin) dalam pembuatan keju (sebagai penggumpal susu) Penggunaan enzim Termamyl® (enzim amylase termofil) dalam pembuatan gula cair (HFS, high fructose syrup) Industri non pangan Penggunaan enzim (protease, σ-kapa-amilase, dll) dalam deterjen untuk mempercepat pelepasan kotoran dari pakaian Penggunaan enzim (dekstranase) dalam pasta gigi untuk mengurangi karies gigi

Bidang kesehatan (kedokteran dan farmasi) Penyelidikan reaksi-reaksi metabolik dan pengaturannya Enzim sebagai target pengobatan Contoh : Kekurangan enzim pencernaan dalam tubuh dapat diatasi dengan memberikan obat berupa enzim pencernaan yang diperoleh dari tumbuhan/hewan untuk mengatasi kekurangan produksi enzim pada tubuh. Aplikasi enzim did alam penyembuhan luka, misalnya pemberian enzim proteolitik untuk meniadakan atau mengurangi cairan luka, nanah, dan jaringan nekrosa yang timbul pada kasus luka bakar (jaringan fibrin, mukoprotein, kolagen dsb pada luka menjadi substrat bagi enzim dan kemudian diuraikan sehingga bekas luka menjadi “bersih” dan licin)

Pemanfaatan enzim untuk diagnose klinik Aktivitas katalitik enzim dapat diukur dengan metode yang spesifik dan sensitive, dan pengukuran aktivitas enzim ini dapat digunakan untuk memantau penyakit secara jelas, kecenderungan genetic terhadap keadaan penyakit, dan tanggapan pasien terhadap jenis terapi tertentu (endonuklease retriksi) Penggunaan enzim sebagai petanda kerusakan jaringan Secara teoritis enzim intrasel seharusnya tidak terlacak dalam cairan ekstrasel, namun akibat adanya sel-sel yang mati dan pecah maka terdapat enzim intrasel dalam caiaran ekstrasel. Jumlah enzim ini selalu rendah dan mempunyai harga maksimum yang jumlah ditentukan oleh laju pergantian atau “turn over rate” yang berhubungan dengan keadaan fisiologis tertentu.

Bila jumlah enzim tsb berada di luar ambang batas normalnya maka dapat dipastikan telah terjadi sesuatu pada jaringan. Peningkatan kadar suatu enzim di dalam sel dapat pula terjadi karena sel memasuki suatu tahap tertentu dalam daur seluler, kemungkinan lain adalah terjadinya perbanyakan atau proliferasi sel-sel khusus yang membuat enzim tertentu dasar penggunaan enzim dan protein bukan enzim sebagai petanda tumor (tumor marker).

Penggunaan enzim sebagai reagen Enzim murni yang tersedia di pasaran dapat digunakan sebagai reagen untuk penentuan secara akurat adanya suatu zat yang kadarnya kecil dalam darah seperti glukosa, urea, asam urat, dan trigliserida. Seringkali metode ini lebih spesifik dan lebih cepat daripada penentuan kimiawi. Enzim ini berasal dari hewan dan tumbuhan serta sumber mikrobiologis yang digunakan untuk penentuan darah manusia atau komponen jaringan. Contohnya : kit untuk mengetahui adanya gula dalam urine.

Penggunaan enzim sebagai reagen pemberi label Enzim dapat dipergunakan sebagai alat bantu diagnostic dengan cara lain, yaitu pengukuran berdasarkan angka “turn over”nya / nilai aktivitas enzim, yaitu jumlah mol substrat yang diubah menjadi produk tiap menit (atau tiap detik) per mol enzim. Angka ini bermanfaat dalam membandingkan enzim yang sama dari jaringan yang berbeda dan dalam membandingkan isozim yang berlainan Contohnya adalah untuk penentuan secara cepat penyalahgunaan obat, seperti penentuan morfin dan shabu dalam urin. Cara kerjanya yaitu pembentukan antibody termodifikasi dengan cara menggabungkan suatu antibody (missal dari darah kelinci) dengan beberapa enzim yang memiliki angka “turn over” yang tinggi seperti fosfatase.

Jika morfin ditambahkan ke dalam antibody termodifikasi tsb akan terbentuk endapan (kompleks antigen-antibodi). Endapan tsb dikumpulkan, dicuci dan didisosiasi. Jika suatu substrat fosfatase yang sesuai ditambahkan dan campuran tsb diinkubasi dengan benar akan dihasilkan suatu warna yang sesuai dengan jumlah enzim. Warna tsb menentukan apakah zat tsb mengandung morfin atau tidak. Intensitas warna yang dihasilkan menunjukkan kadar morfin yang dihasilkan. Contoh lain : kit uji dengan metode ELISA (Enzyme Linked Immuno Sorbant Assay).

Enzim “immobilized” Enzim dapat disambung-silangkan (cross-linked) secara kimiawi terhadap permukaan lembam, atau dijepit antara permukaan-permukaan semipermeabel lembam tanpa kehilangan daya katalitik. Misalnya urease dapat ditempelkan pada lembar-lembar atau tabung membrane dialysis. seseorang dengan penyakit ginjal berat yang menjalani dialysis di luar tubuh untuk menurunkan konsentrasi urea dalam darahnya. Apabila pipa dialysis mengandung urease “immobilized” darah yang melaluinya akan terbebas dari urea dengan cepat (adanya urease akan mengurai urea dalam darah menjadi ammonia dan karbondioksida.

Contoh lainnya : pembuatan enzim electrode untuk analisis elektrokimia kadar zat/komponen penyusun darah seperti glukosa dan kolesterol. Pembuatan kit immunoassay untuk penggunaan pola isozim dari enzim tertentu dengan elektroforesis dan teknik imunokimia, pelacakan dan penentuan kuantitas isozim untuk kepentingan diagnose diferensial. Isozim : enzim yg mengkatalisis rx yg sama, tetapi sifat fisika dan kimia protein menunjukkan perbedaan yg bermakna

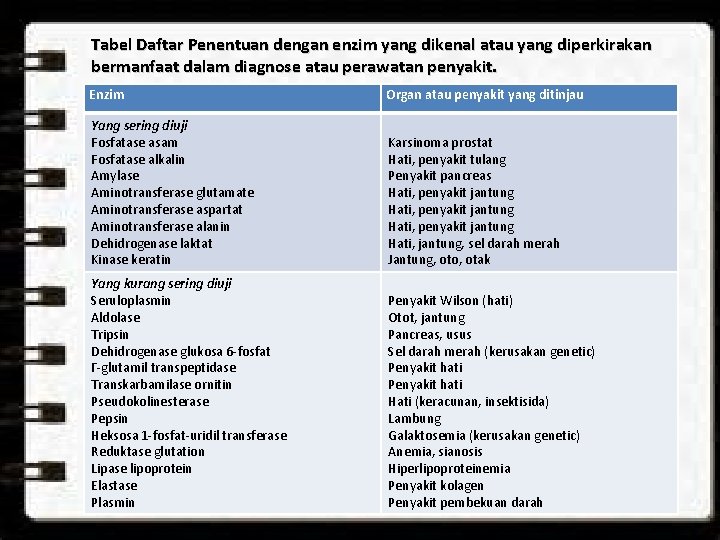
Tabel Daftar Penentuan dengan enzim yang dikenal atau yang diperkirakan bermanfaat dalam diagnose atau perawatan penyakit. Enzim Organ atau penyakit yang ditinjau Yang sering diuji Fosfatase asam Fosfatase alkalin Amylase Aminotransferase glutamate Aminotransferase aspartat Aminotransferase alanin Dehidrogenase laktat Kinase keratin Karsinoma prostat Hati, penyakit tulang Penyakit pancreas Hati, penyakit jantung Hati, jantung, sel darah merah Jantung, oto, otak Yang kurang sering diuji Seruloplasmin Aldolase Tripsin Dehidrogenase glukosa 6 -fosfat Γ-glutamil transpeptidase Transkarbamilase ornitin Pseudokolinesterase Pepsin Heksosa 1 -fosfat-uridil transferase Reduktase glutation Lipase lipoprotein Elastase Plasmin Penyakit Wilson (hati) Otot, jantung Pancreas, usus Sel darah merah (kerusakan genetic) Penyakit hati Hati (keracunan, insektisida) Lambung Galaktosemia (kerusakan genetic) Anemia, sianosis Hiperlipoproteinemia Penyakit kolagen Penyakit pembekuan darah

Pembagian Enzim plasma berdasarkan fungsinya • Enzim plasma fungsional: Enzim atau proenzim tertentu terdapat sepanjang waktu dlm sirkulasi individu normal, substrat juga terdapat dlm sirkulasi dan melakukan fungsi fisiologis dlm darah Contoh: Lipoprotein lipase, pseudokolinesterse, proenzim bekuan darah dan lisis bekuan darah umumnya disintesis dlm hati, konsentrasi dlm darah sama atau lebih tinggi dibandingkan dlm jaringan • Enzim plasma non fungsional: • Tidak melakukan fungsi fisiologis dlm darah • Substrat sering tdk ada dlm plasma • Konsentrasi dlm darah individu normal berjuta kali lebih rendah dibanding dlm jaringan

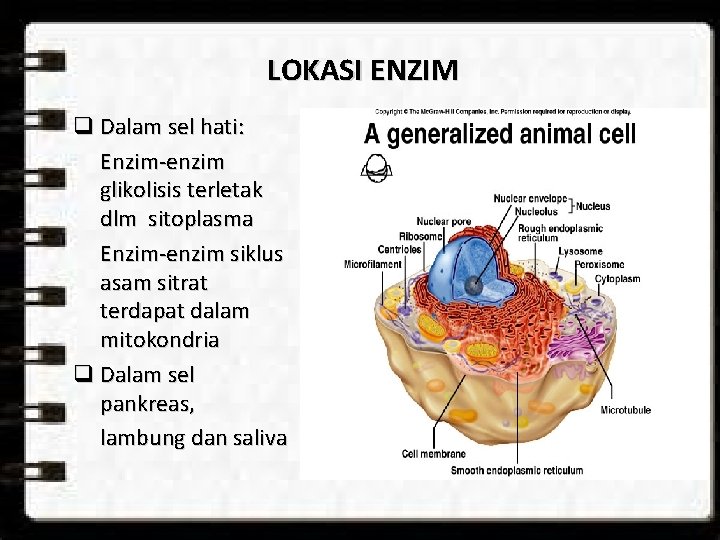
LOKASI ENZIM q Dalam sel hati: Enzim-enzim glikolisis terletak dlm sitoplasma Enzim-enzim siklus asam sitrat terdapat dalam mitokondria q Dalam sel pankreas, lambung dan saliva

LETAK ENZIM DALAM SEL Berkaitan dengan fungsi organel tersebut : * ENZIM MITOKONDRIAL : reaksi pengadaan energi, reaksi oksidasi yang menghasilkan energi * ENZIM RIBOSOMAL : reaksi biosintesis protein * ENZIM INTI : berkaitan dgn perangkat genetik * ENZIM LISOSIM : - proses digestif intraselluler - destruksi hidrolititk bahan yg tak diperlukan sel * ENZIM MIKROSOMAL : - reaksi hidroksilasi pd sintesis hormon steroid - metabolisme dan inaktivasi obat