Entropia Estatstica e o Ensino da 2 Lei

















































































- Slides: 127

Entropia Estatística e o Ensino da 2ª Lei da Termodinâmica Carlos Eduardo Aguiar Programa de Pós-Graduação em Ensino de Física Instituto de Física - UFRJ VII EEEFis – UFRGS Porto Alegre, agosto de 2017

Baseado na dissertação de mestrado de Marcos Moura “Entropia Estatística e o Ensino da 2ª Lei da Termodinâmica” Mestrado Nacional Profissional em Ensino de Física Instituto de Física - UFRJ, 2016

Sumário • Ensino e aprendizagem da segunda lei da termodinâmica • Entropia e a segunda lei da termodinâmica: uma sequência didática 1. 2. 3. 4. 5. A seta do tempo Entropia, energia e temperatura Entropia, volume e pressão Equação de estado de sistemas ideais A distribuição de Boltzmann • Comentários finais

Ensino e Aprendizagem da Segunda Lei da Termodinâmica

Os Fatos da Vida “Agora, na segunda lei da termodinâmica. . . ”

Nenhuma outra lei científica contribuiu mais para a liberação do espírito humano que a segunda lei da termodinâmica. Ela é a base para a compreensão do motivo de qualquer mudança ocorrer. P. Atkins, Four Laws that Drive the Universe

Entropia e a 2ª Lei da Termodinâmica • Temas fundamentais para a compreensão de boa parte da física, química e biologia. • “Não conhecer a 2ª lei da termodinâmica equivale a nunca ter lido um trabalho de Shakespeare” (C. P. Snow, The Two Cultures) • “Na verdade eu tenho sérias dúvidas sobre se Snow entendia a 2ª lei, mas concordo com seus sentimentos” (P. Atkins, Four Laws that Drive the Universe)

Entropia e a 2ª Lei da Termodinâmica • “Termodinâmica é algo que alguma outra pessoa certamentende. ” (opinião de muitos estudantes de Física, segundo E. Lieb e J. Yngvason) • “Ninguém sabe o que é entropia, de modo que você sempre terá a vantagem em um debate. ” (conselho de J. von Neumann a C. Shannon)

Entropia e a 2ª Lei da Termodinâmica • “A termodinâmica é uma ciência com fundamentos seguros e definições claras. ” (J. C. Maxwell) • “Todo matemático sabe que é impossível entender um curso elementar de termodinâmica. ” (V. I. Arnold)

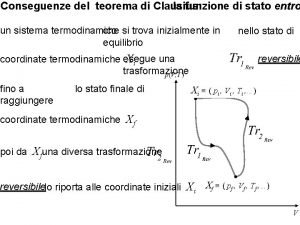
As leis da termodinâmica no ensino superior • • • Equilíbrio. Lei Zero. Temperatura e termômetros. Trabalho adiabático. Energia interna: ∆U = ‒W(adiab. ) Calor e a 1ª lei da termodinâmica: ∆U = Q ‒ W Processos termodinâmicos. Máquinas térmicas. Eficiência. 2ª lei da termodinâmica: formulações de Kelvin e Clausius. Irreversibilidade. Teorema de Carnot. Definição termodinâmica de temperatura. Teorema de Clausius. Entropia. Formulação entrópica da 2ª lei: ∆S ≥ 0 num sistema isolado. Por exemplo: Nussenzweig, Física Básica; Zemansky & Dittman, Heat and Thermodynamics

As leis da termodinâmica no ensino médio • • • Temperatura e termômetros. Calor: transferência de energia por diferença de temperatura. Trabalho e a 1ª lei da termodinâmica: ∆U = Q ‒ W Processos termodinâmicos. Máquinas térmicas. Eficiência. 2ª lei da termodinâmica: formulações de Kelvin e Clausius. Irreversibilidade e noções sobre entropia. Por exemplo: Máximo & Alvarenga, Curso de Física; Hewitt, Conceptual Physics

Aprendizagem da 2ª lei da termodinâmica Dificuldades comuns entre os estudantes: • Não tratar a entropia como função de estado; por exemplo, tomar S ≠ 0 em um ciclo. • Considerar que a entropia é uma grandeza conservada. • Confundir sistema e universo e supor que entropia do sistema nunca diminui. • Não utilizar a 2ª lei para determinar se um dado processo pode ocorrer; usar apenas a 1ª lei.

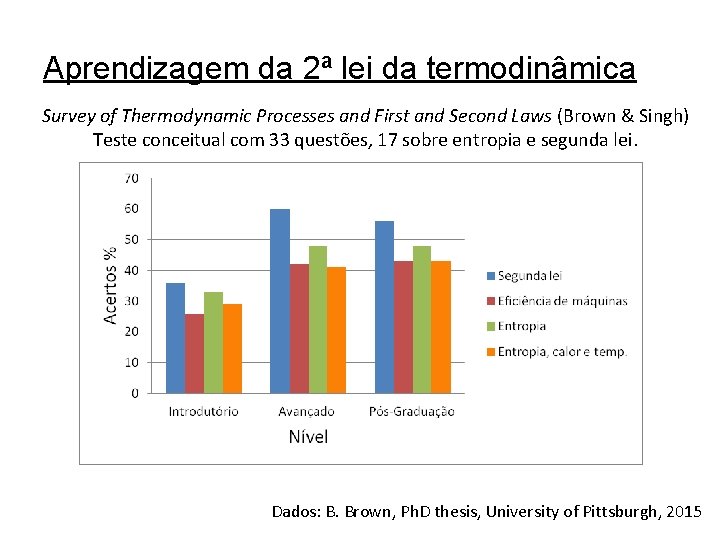
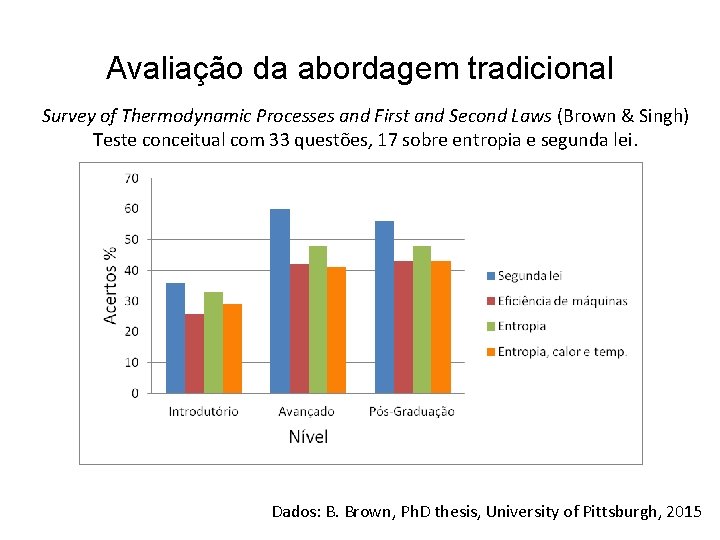
Aprendizagem da 2ª lei da termodinâmica Survey of Thermodynamic Processes and First and Second Laws (Brown & Singh) Teste conceitual com 33 questões, 17 sobre entropia e segunda lei. Dados: B. Brown, Ph. D thesis, University of Pittsburgh, 2015

Problemas da abordagem tradicional • Pouco atraente; boa parte dos alunos não demonstra interesse por máquinas térmicas. • Entropia, o conceito central, só aparece após um longo e tortuoso processo. • Ao final desse processo temos uma definição de entropia, mas não uma interpretação intuitiva do conceito e da origem da irreversibilidade.

Problemas da abordagem tradicional É um eufemismo dizer que os estudantes têm dificuldades com a abordagem tradicional [da definição de entropia]. Os argumentos que levam a ela são sutis e sofisticados e o resultado final, d. S = d. Qrev / T, não tem um significado físico evidente. Mais ainda, como a entropia pode mudar em processos irreversíveis mesmo quando d. Q = 0, essa definição gera uma confusão considerável. Harvey Leff, Am. J. Phys. 64, 1261 (1996)

É possível fazer melhor? • Abordagem diferente da tradicional (Carnot. Kelvin-Clausius), mas ainda macroscópica. Por exemplo, o enfoque axiomático de H. Callen em Thermodynamics and an Introduction to Thermostatistics (Wiley, 1985), talvez o livro de termodinâmica mais citado na literatura em física. • Abordagem microscópica (estatística). Entropia definida pelo número de estados microscópicos compatíveis com o estado termodinâmico. Explicação estatística da irreversibilidade.

Abordagem microscópica: “Física Térmica” • F. Reif, Fundamentals of Statistical and Thermal Physics (Mc. Graw-Hill, 1965). • C. Kittel, H. Kroemer, Thermal Physics (Freeman, 1997). • R. Bairlein, Thermal Physics (Cambridge U. P. , 1999). • D. V. Schroeder, An Introduction to Thermal Physics (Addison-Wesley, 2000).

Física Térmica nos cursos básicos • F. Reif, Statistical Physics, Berkeley Physics Course v. 5 (Mcgraw-Hill, 1967) • R. Chabay, B. Sherwood, Matter & Interactions (Wiley, 2015)

Referências • F. Reif, Thermal physics in the introductory physics course: Why and how to teach it from a unified atomic perspective, Am. J. Phys. , p. 1051 (1999). • R. Baierlein, Entropy and the second law: A pedagogical alternative, Am. J. Phys. 62, p. 15 (1994). • T. A. Moore, D. V. Schroeder, A different approach to introducing statistical mechanics, Am. J. Phys. 65, p. 26 (1997). • R. W. Chabay, B. A. Sherwood, Bringing atoms into firstyear physics, Am. J. Phys. 67, p. 1045 (1999).

Física Térmica no ensino médio Mesmo os textos mais recentes mencionam a definição estatística da entropia apenas ao final da apresentação da 2ª lei (quando o fazem).

Entropia e a Segunda Lei da Termodinâmica _______ Uma Sequência Didática

“A culpa é da entropia. ”

Características da sequência didática • O ponto de partida é a seta do tempo, um tema mais atraente que máquinas térmicas. • O conceito de entropia é introduzido logo ao início da sequência. • A definição estatística fornece diretamente uma interpretação intuitiva da entropia (contagem). • A irreversibilidade tem uma explicação simples. • A entropia é reconhecida facilmente como função de estado.

Características da sequência didática • Os principais resultados associados à 2ª lei são obtidos com facilidade: – Formulações de Clausius e Kelvin. – Teorema de Carnot. – Desigualdade de Clausius. – Definição clássica (não-estatística) de entropia. • Pode-se ir além da termodinâmica clássica: – Equação de estado de sistemas simples. – Distribuição de Boltzmann

Pré-requisitos: • Conceitos de equilíbrio, temperatura e calor. • Trabalho, energia e a 1ª lei da termodinâmica. • Variáveis de estado e de processo • Gases ideais • Um pouco de análise combinatória Podem ser reduzidos à conservação da energia numa versão simplificada da sequência.

A Seta do Tempo

O tempo acaba o ano, o mês e a hora, a força, a arte, a manha, a fortaleza; o tempo acaba a fama e a riqueza, o tempo o mesmo tempo de si chora. Luís de Camões


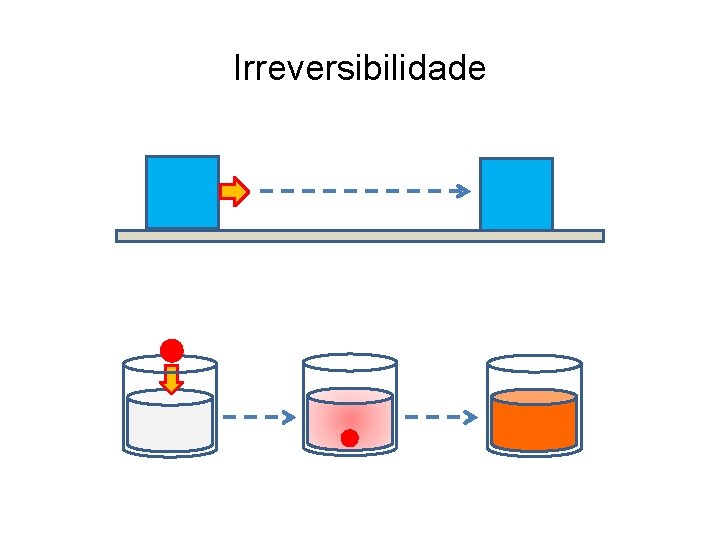
Irreversibilidade

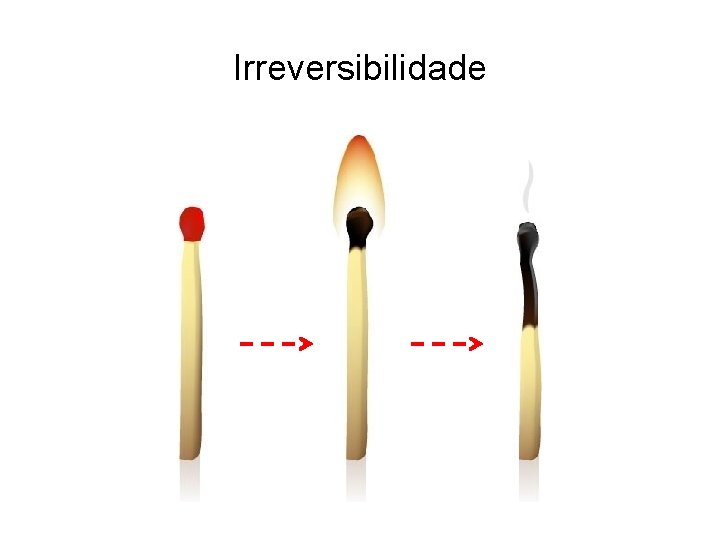
Irreversibilidade

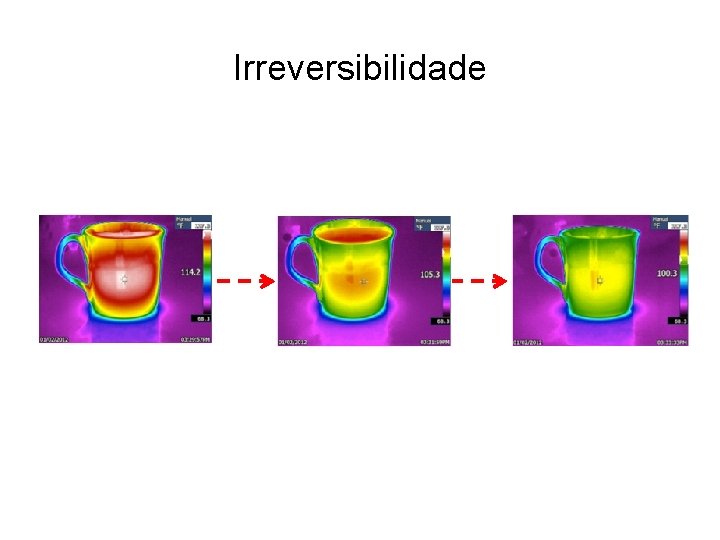
Irreversibilidade

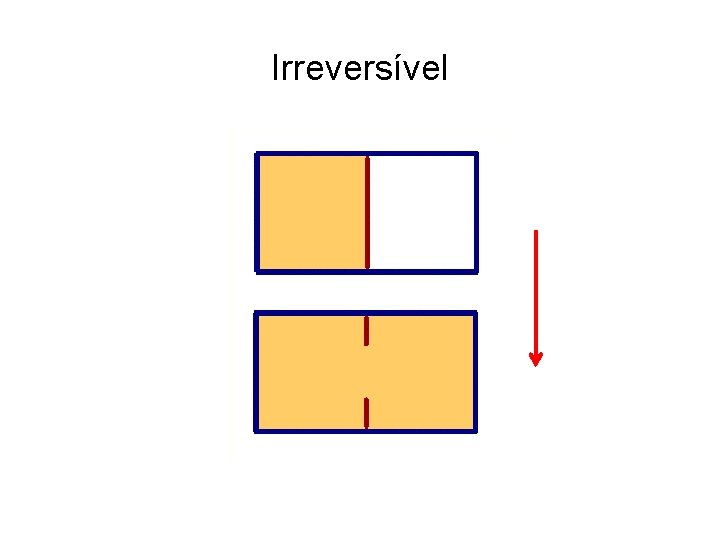
Irreversibilidade Os processos cotidianos são irreversíveis; eles não ocorrem espontaneamente na ordem temporal reversa.

Pergunta: Qual lei dinâmica (microscópica) da física determina um sentido para a passagem do tempo? Resposta: Nenhuma. As leis físicas fundamentais não distinguem passado de futuro. Há uma exceção: a interação fraca viola a simetria de inversão temporal.

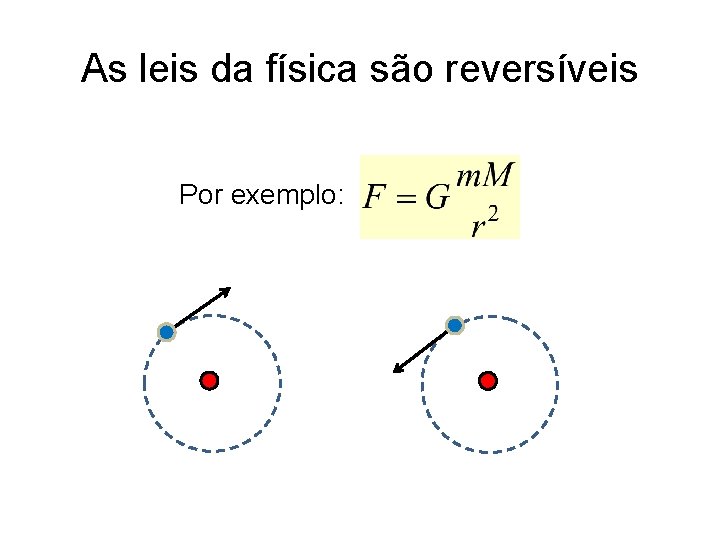
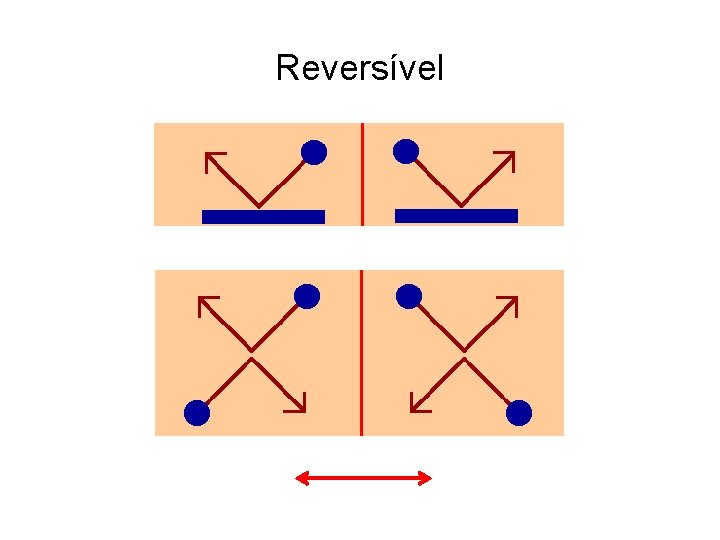
As leis da física são reversíveis Por exemplo:

As leis fundamentais da física não distinguem passado de futuro. mas. . . As transformações à nossa volta são irreversíveis.

Ludwig Boltzmann

Irreversível

Reversível

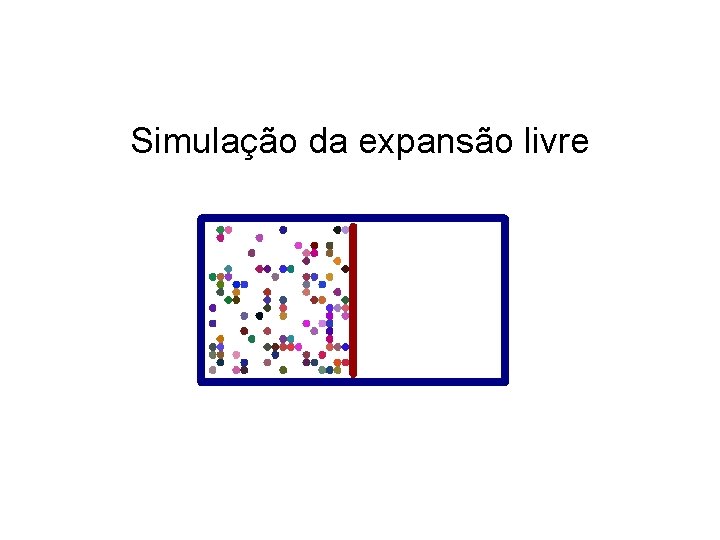
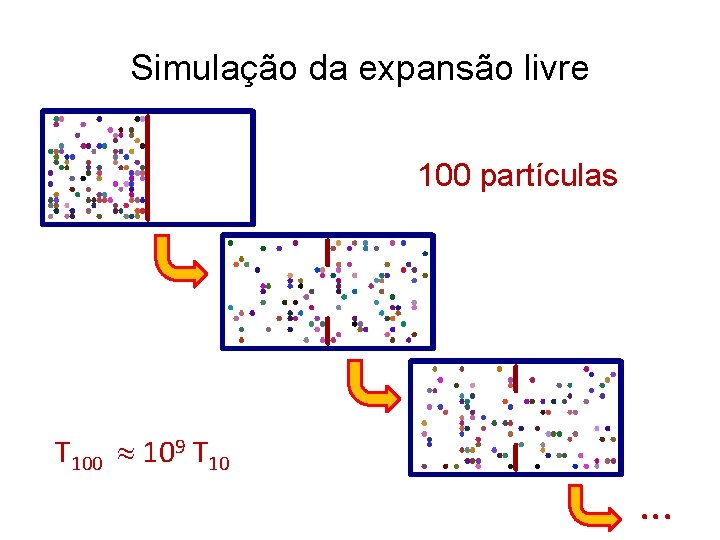
Simulação da expansão livre

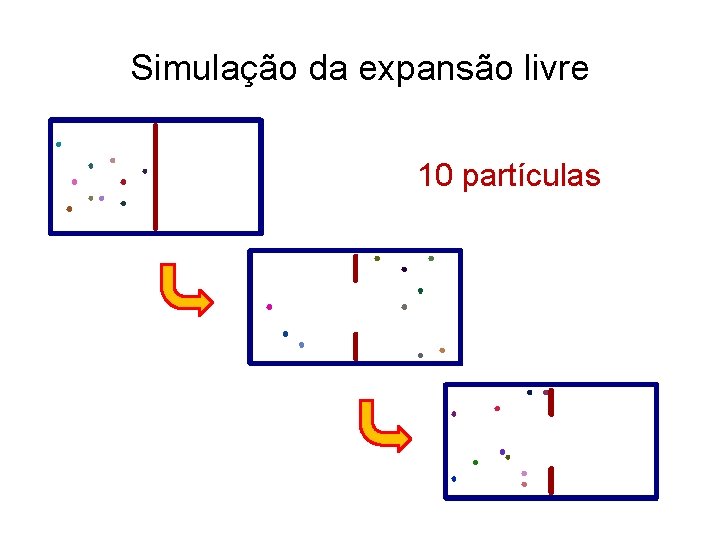
Simulação da expansão livre 10 partículas

Simulação da expansão livre 100 partículas T 100 109 T 10 . . .

A seta do tempo (irreversibilidade) surge quando o número de partículas é grande! Por quê?

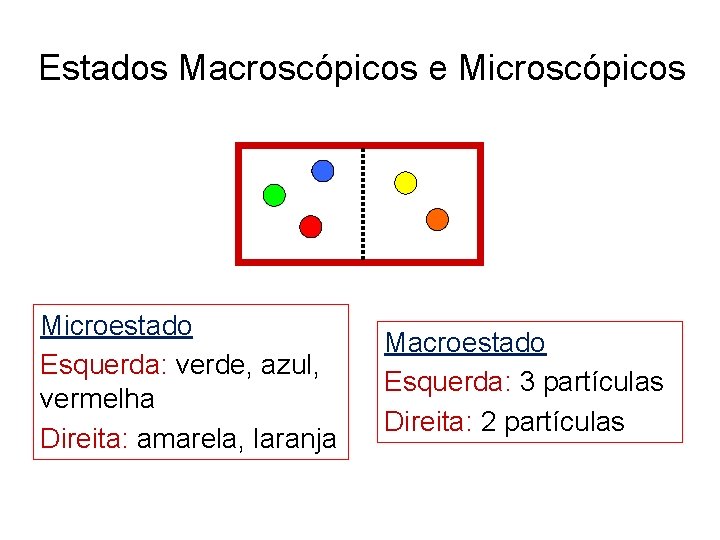
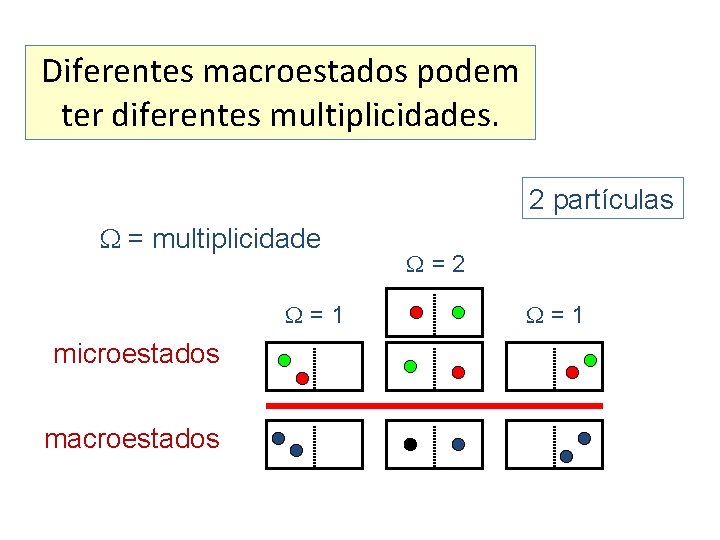
Estados Macroscópicos e Microscópicos Microestado Esquerda: verde, azul, vermelha Direita: amarela, laranja Macroestado Esquerda: 3 partículas Direita: 2 partículas

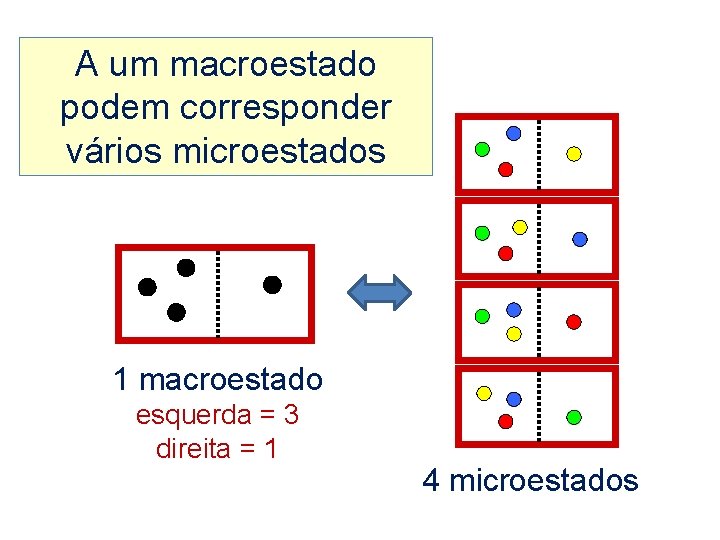
A um macroestado podem corresponder vários microestados 1 macroestado esquerda = 3 direita = 1 4 microestados

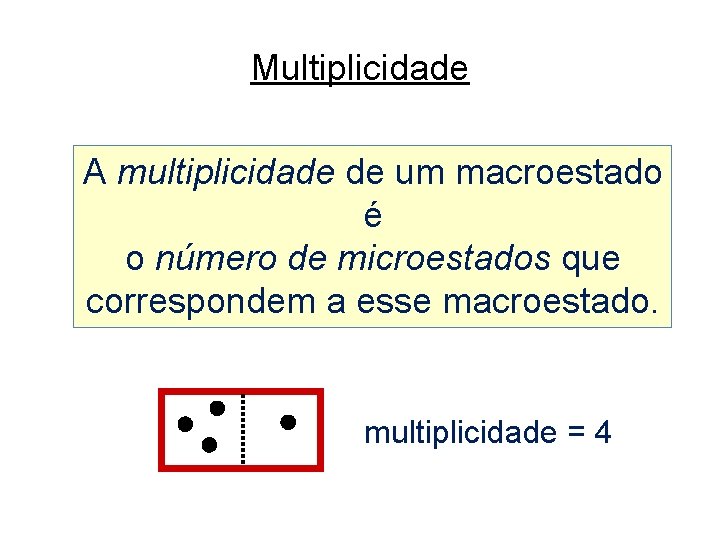
Multiplicidade A multiplicidade de um macroestado é o número de microestados que correspondem a esse macroestado. multiplicidade = 4

Diferentes macroestados podem ter diferentes multiplicidades. 2 partículas = multiplicidade =1 microestados macroestados =2 =1

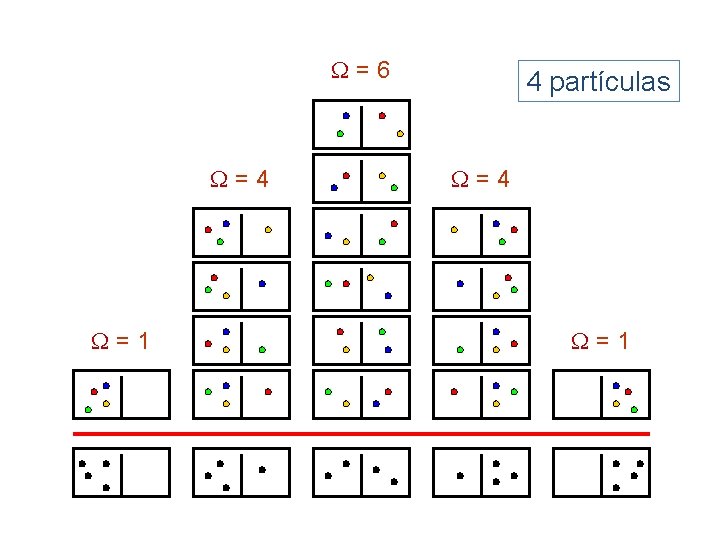
=6 =4 =1 4 partículas =4 =1

Cálculo da Multiplicidade. . . n N‒n N partículas (n, N) = multiplicidade do macroestado com n partículas à esquerda e N‒n à direita

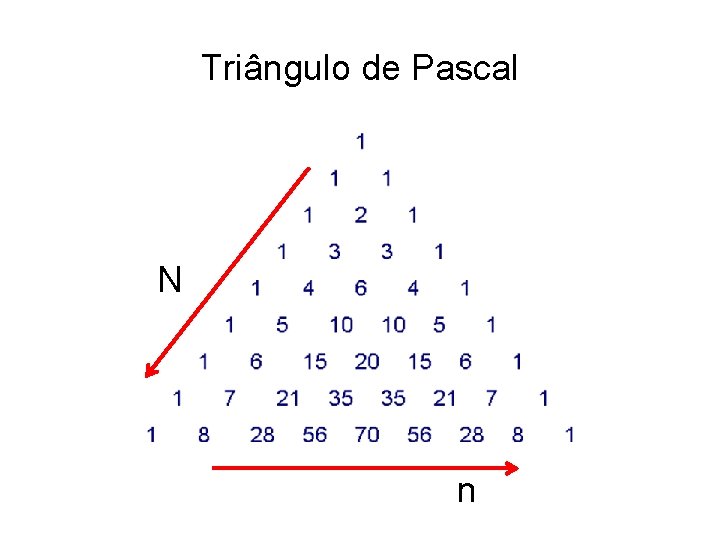
Triângulo de Pascal N n

Multiplicidade máxima Para N (aproximação de Stirling): Quase todos os 2 N microestados correspondem a n N / 2.

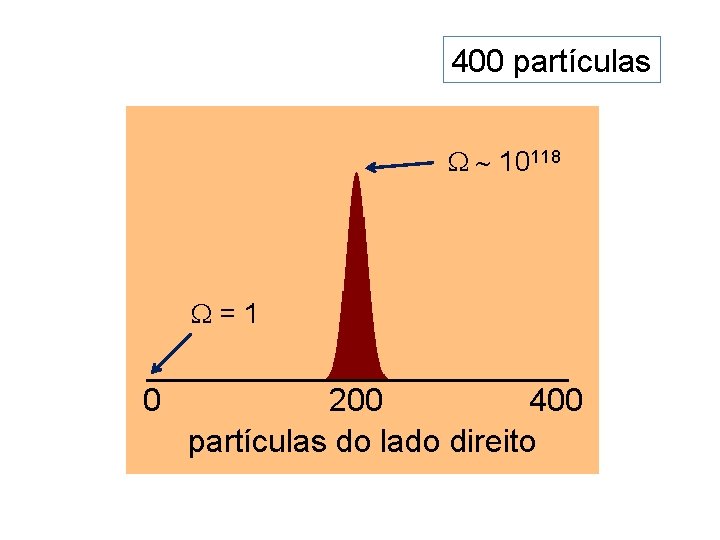
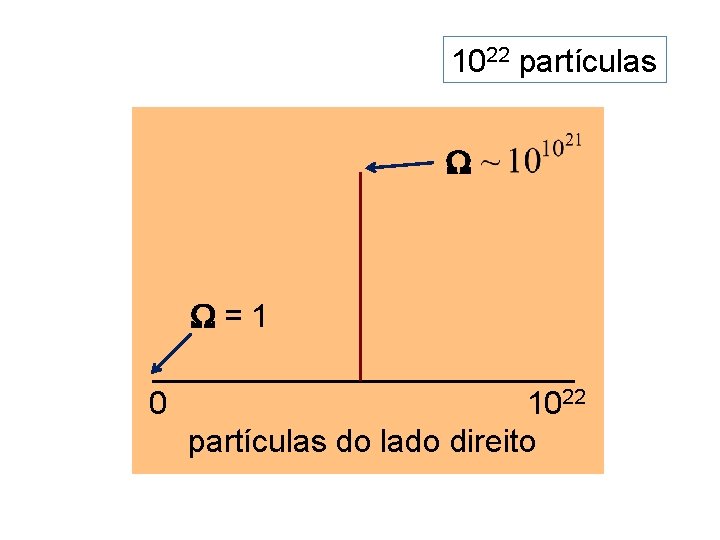
400 partículas 10118 =1 0 200 400 partículas do lado direito

1022 partículas =1 0 1022 partículas do lado direito

Para um sistema de muitas partículas, a diferença de multiplicidades entre macroestados distintos pode ser enorme! Sistemas macroscópicos típicos têm N~1023 partículas.

Equiprobabilidade Microscópica Todos os microestados de um sistema isolado são igualmente prováveis. O sistema divide seu tempo igualmente por todos os microestados acessíveis.

Probabilidade Macroscópica Os macroestados de um sistema isolado não são igualmente prováveis. A probabilidade do sistema ser encontrado em um dado macroestado é proporcional à multiplicidade do macroestado.

A origem da irreversibilidade Para um sistema isolado de muitas partículas: Muitíssimo provável (sempre) baixa multiplicidade alta multiplicidade Pouquíssimo provável (nunca) alta multiplicidade baixa multiplicidade

A 2ª Lei da Termodinâmica Um sistema isolado nunca passa espontaneamente de um estado de alta multiplicidade para um de baixa multiplicidade.

Uma analogia (cruel) oásis bêbado deserto R. Baierlein, Am. J. Phys. 46, 1042 (1978)

Entropia S constante de Boltzmann: k = 1, 4 10‒ 23 J/K = R / NAvog. 1 2 1 1+2 = 1 2 S 1+2 = S 1 + S 2

A 2ª Lei da Termodinâmica A entropia de um sistema isolado nunca diminui. Em qualquer transformação do sistema:

Processos Reversíveis • Reversível: • Irreversível: • Impossível: S é a entropia total do sistema (isolado).

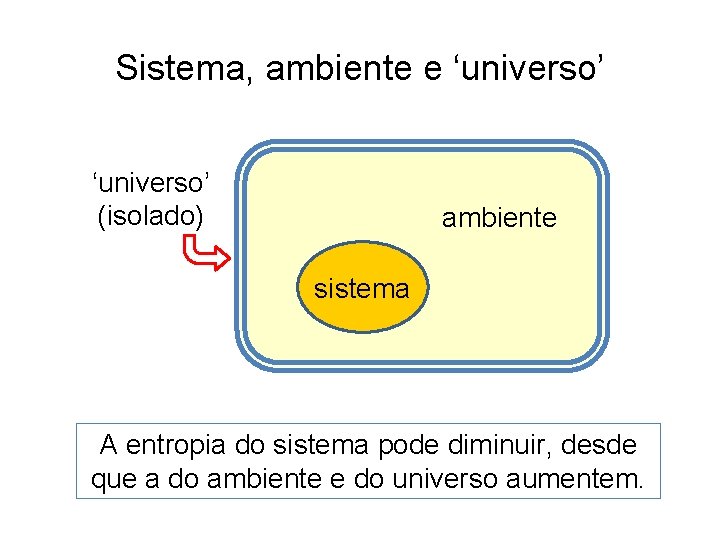
Sistema, ambiente e ‘universo’ (isolado) ambiente sistema A entropia do sistema pode diminuir, desde que a do ambiente e do universo aumentem.

O epitáfio de Boltzmann

Entropia, Energia e Temperatura

A entropia é uma função de estado macroestado termodinâmico U, V, N, T, P. . . independentes equações de estado

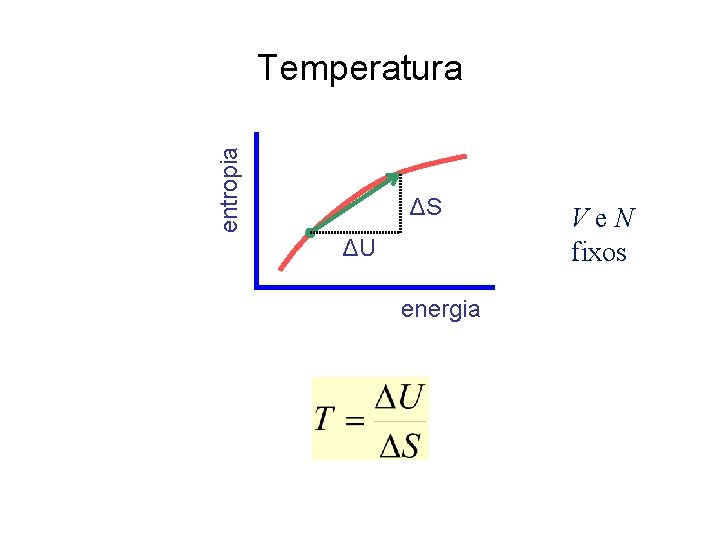
entropia Temperatura ΔS ΔU energia Ve. N fixos

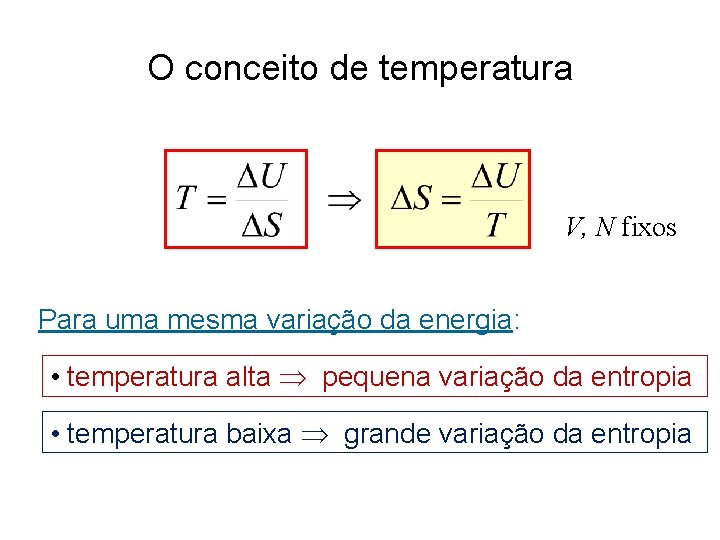
Temperatura Dado S (U, V, N), é a definição termodinâmica de temperatura.

O conceito de temperatura V, N fixos Para uma mesma variação da energia: • temperatura alta pequena variação da entropia • temperatura baixa grande variação da entropia

O conceito (usual) de temperatura • Aquilo que se mede com um termômetro. • A coisa que se torna igual após dois objetos ficarem em contato por muito tempo. • Calor flui espontaneamente do corpo de maior temperatura para o de menor temperatura. • Grau de agitação das moléculas de um corpo.

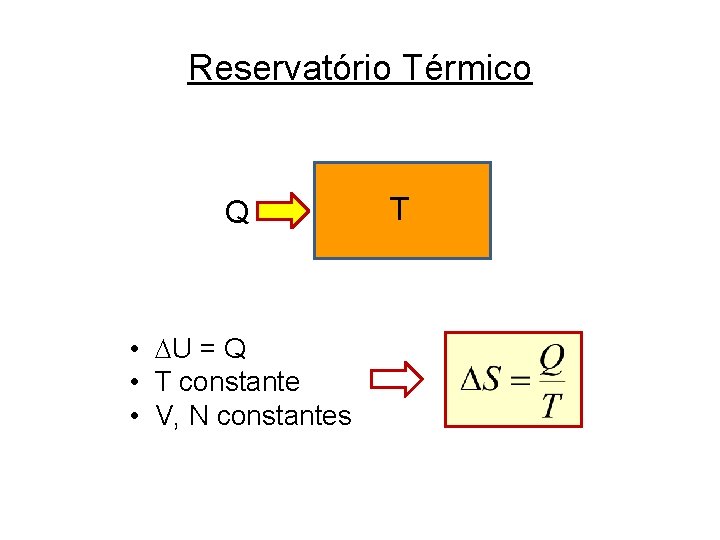
Reservatório Térmico Q • U = Q • T constante • V, N constantes T

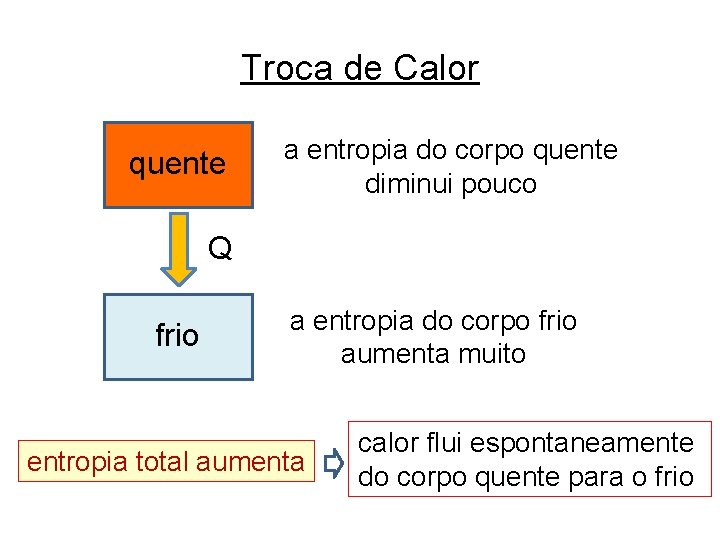
Troca de Calor quente a entropia do corpo quente diminui pouco Q frio a entropia do corpo frio aumenta muito entropia total aumenta calor flui espontaneamente do corpo quente para o frio

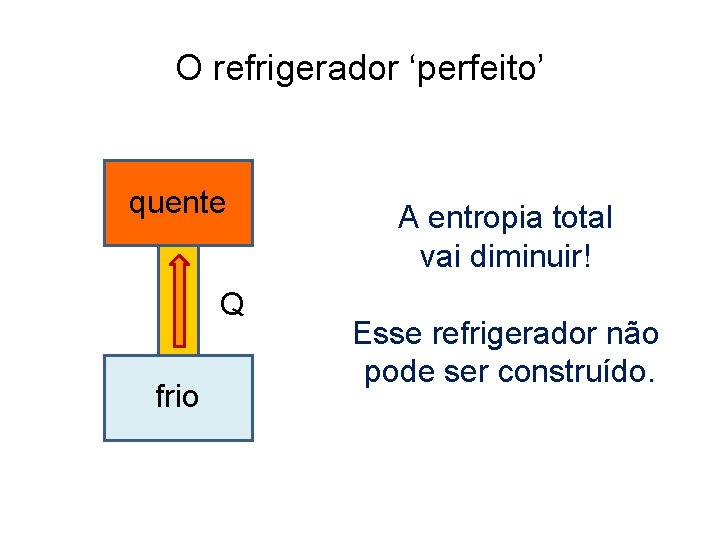
O refrigerador ‘perfeito’ quente Q frio A entropia total vai diminuir! Esse refrigerador não pode ser construído.

A 2ª Lei da Termodinâmica (Clausius) É impossível realizar um processo cujo único efeito seja transferir calor de um corpo frio para um corpo mais quente. R. Clausius (1822 -1888)

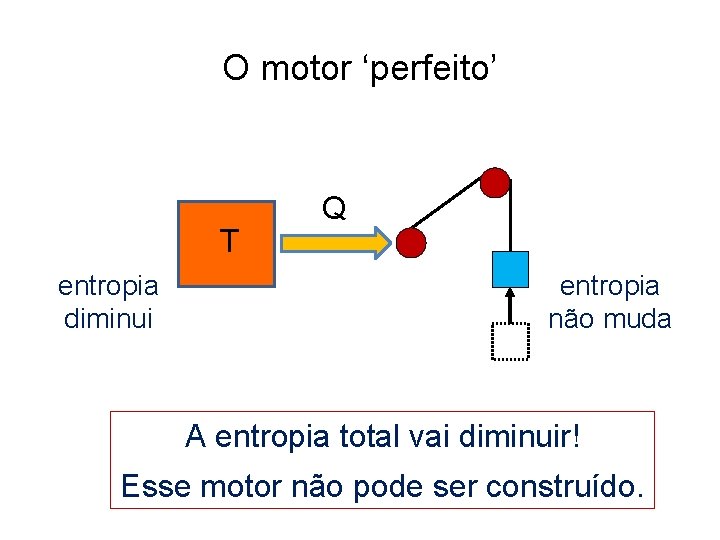
O motor ‘perfeito’ T entropia diminui Q entropia não muda A entropia total vai diminuir! Esse motor não pode ser construído.

A 2ª Lei da Termodinâmica (Kelvin) É impossível realizar um processo cujo único efeito seja remover calor de um corpo e produzir uma quantidade equivalente de energia mecânica. W. Thomson Lord Kelvin (1824 -1907)

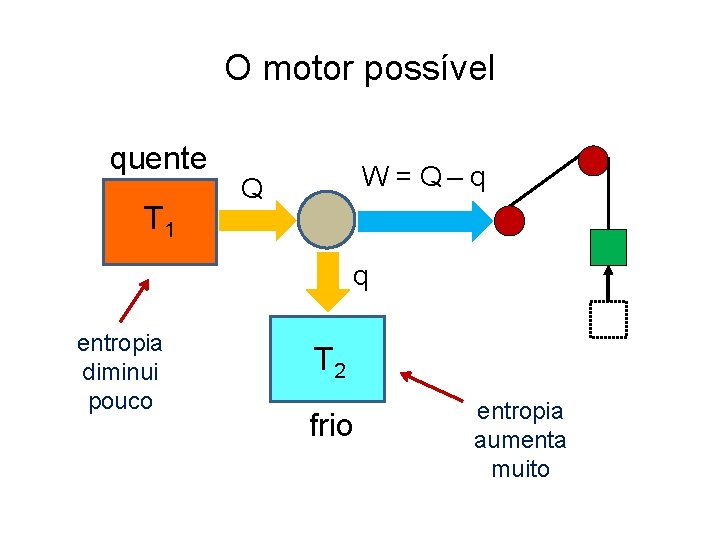
O motor possível quente T 1 W = Q‒ q Q q entropia diminui pouco T 2 frio entropia aumenta muito

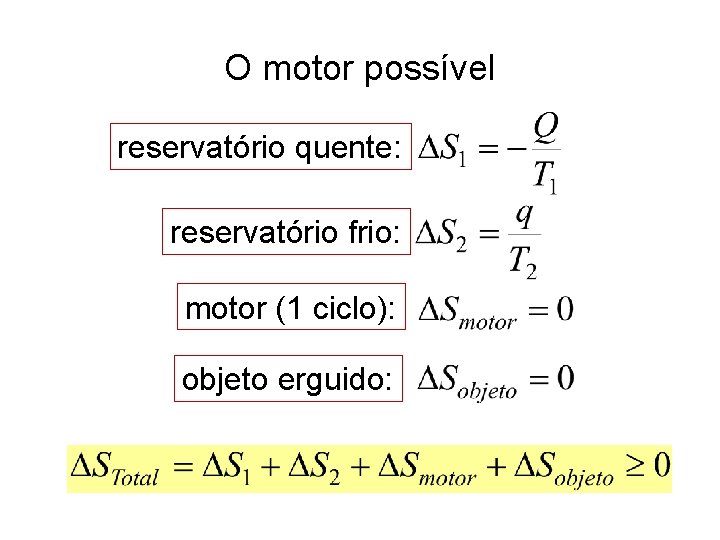
O motor possível reservatório quente: reservatório frio: motor (1 ciclo): objeto erguido:

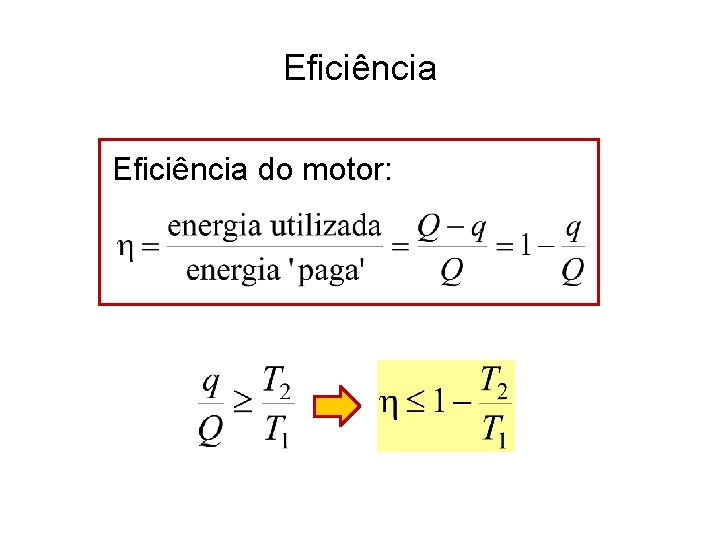
O motor possível Há sempre um ‘desperdício’ q/Q. O menor desperdício possível é q/Q = T 2/T 1

Eficiência do motor:

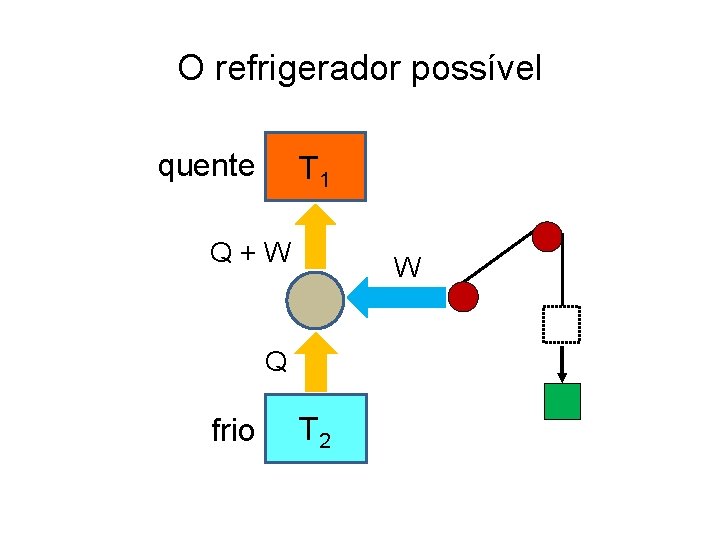
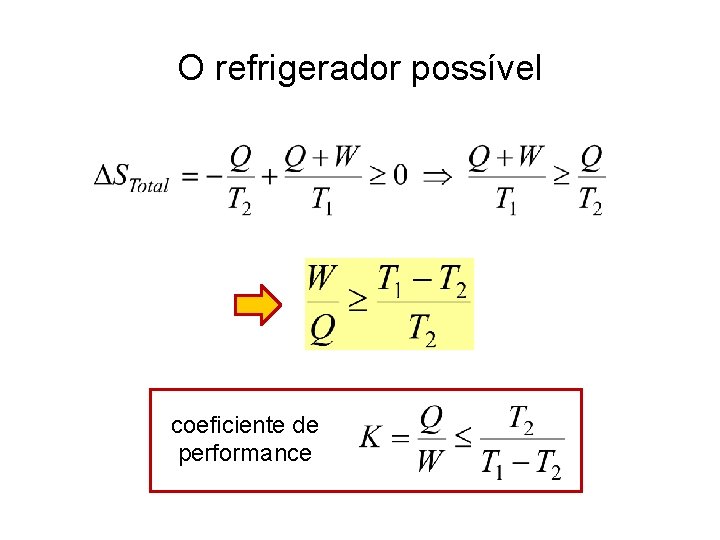
O refrigerador possível quente T 1 Q+W W Q frio T 2

O refrigerador possível coeficiente de performance

A Máquina de Carnot máquina reversível operando entre T 1 e T 2 Sadi Carnot (1796 -1832)

O Teorema de Carnot • As máquinas reversíveis são as máquinas mais eficientes operando entre T 1 e T 2. • A eficiência das máquinas reversíveis depende apenas de T 1 e T 2

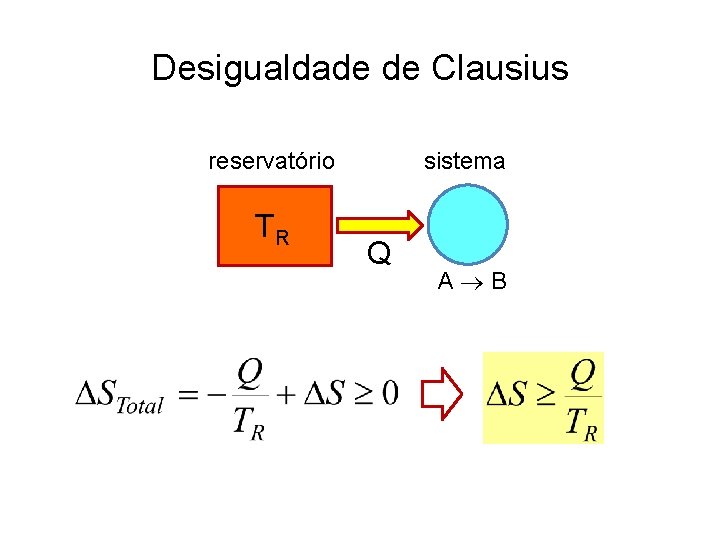
Desigualdade de Clausius sistema reservatório TR Q A B

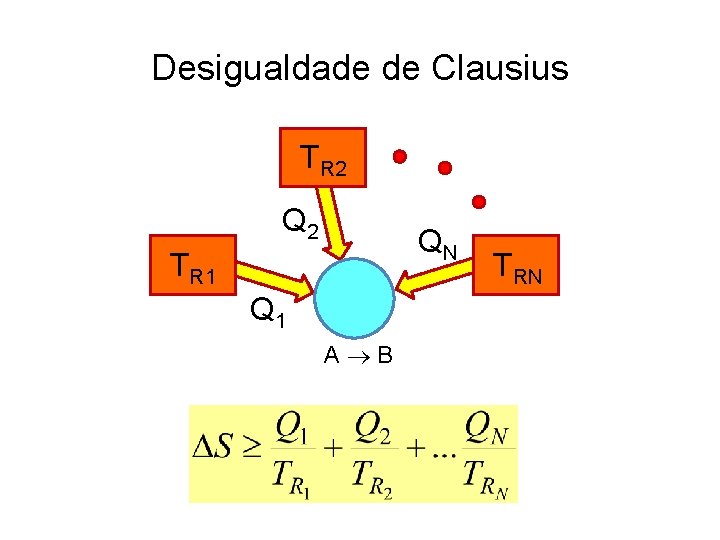
Desigualdade de Clausius TR 2 QN TR 1 Q 1 A B TRN

Desigualdade de Clausius • Infinitos reservatórios com diferenças infinitesimais de temperatura: • Processo cíclico A = B S = 0

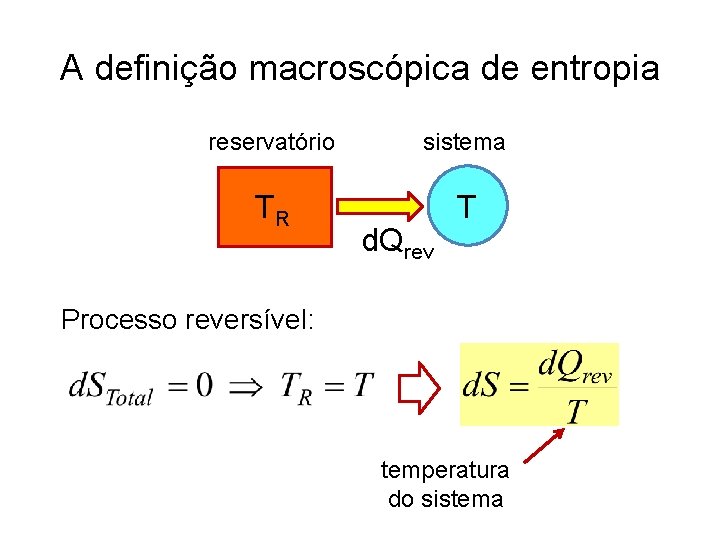
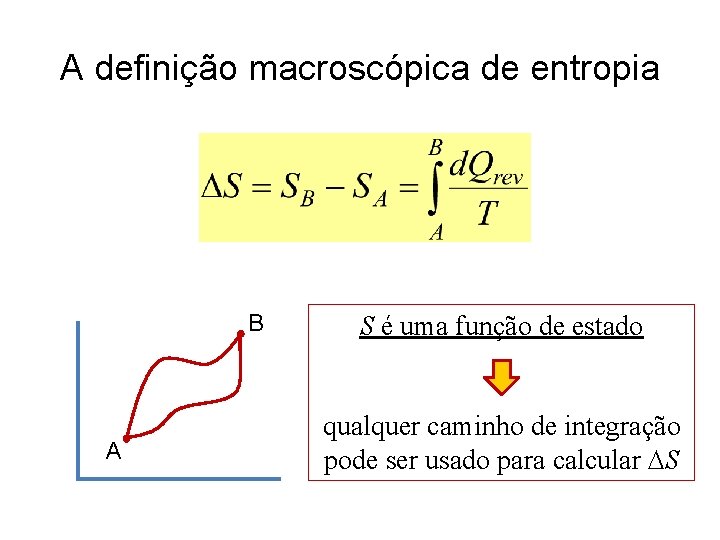
A definição macroscópica de entropia reservatório sistema TR T d. Qrev Processo reversível: temperatura do sistema

A definição macroscópica de entropia B A S é uma função de estado qualquer caminho de integração pode ser usado para calcular S

A definição macroscópica de entropia: Clausius, 1865

Entropia, Volume e Pressão

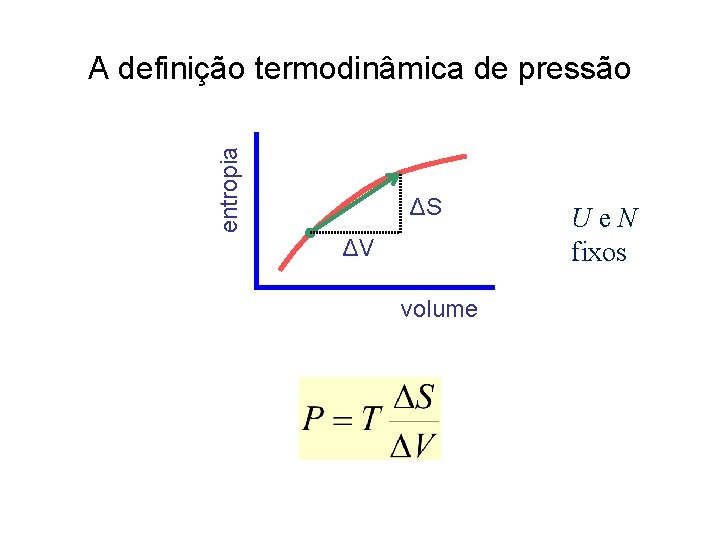
entropia A definição termodinâmica de pressão ΔS ΔV volume Ue. N fixos

A definição termodinâmica de pressão Dado S (U, V, N), é a definição termodinâmica de pressão.

O conceito termodinâmico de pressão V, N fixos Para T fixo e uma mesma variação de volume: • pressão alta grande variação da entropia • pressão baixa pequena variação da entropia

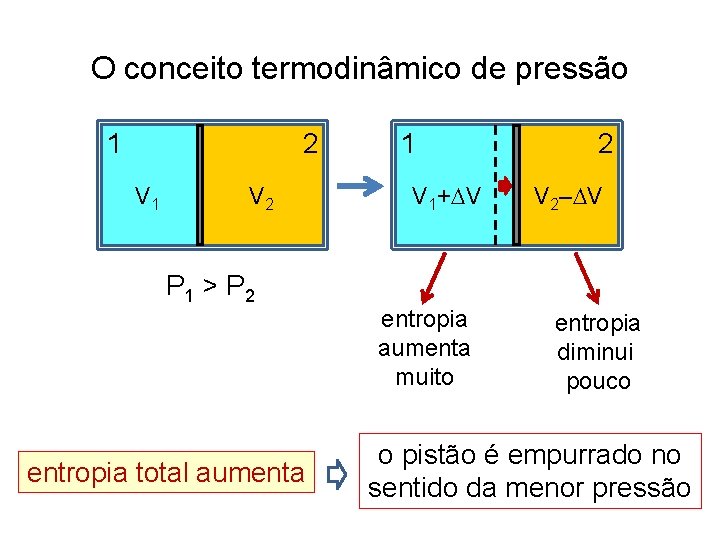
O conceito mecânico de pressão • Definição: F A • Na ausência de outras forças (gravitacional, etc. ) a pressão em um fluido em equilíbrio mecânico é uniforme. • Um corpo imerso num fluido será empurrado no sentido da maior para a menor pressão.

O conceito termodinâmico de pressão 1 2 V 1 V 2 P 1 > P 2 entropia total aumenta 1 V 1+ V entropia aumenta muito 2 V 2‒ V entropia diminui pouco o pistão é empurrado no sentido da menor pressão

Formalmente:

A identidade termodinâmica

A identidade termodinâmica 1ª lei da termodinâmica: Identid. termodinâmica: Processo reversível: A definição termodinâmica da pressão é consistente com a expressão usual para o trabalho reversível.

Equação de Estado de Sistemas Simples

Gás Ideal

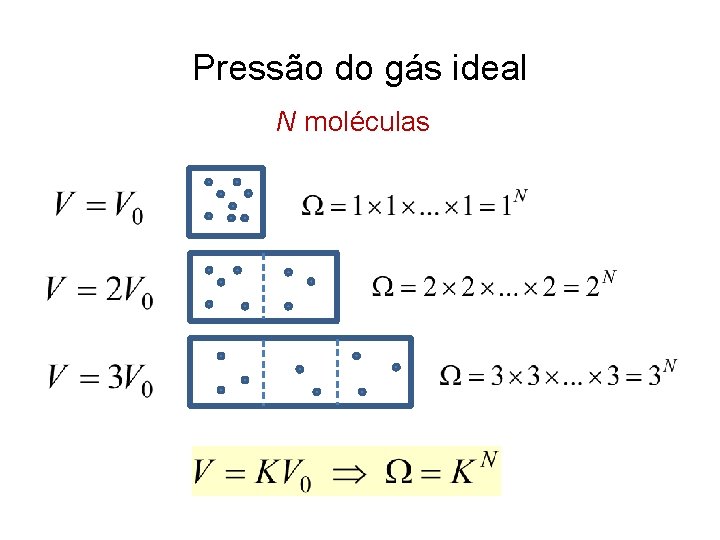
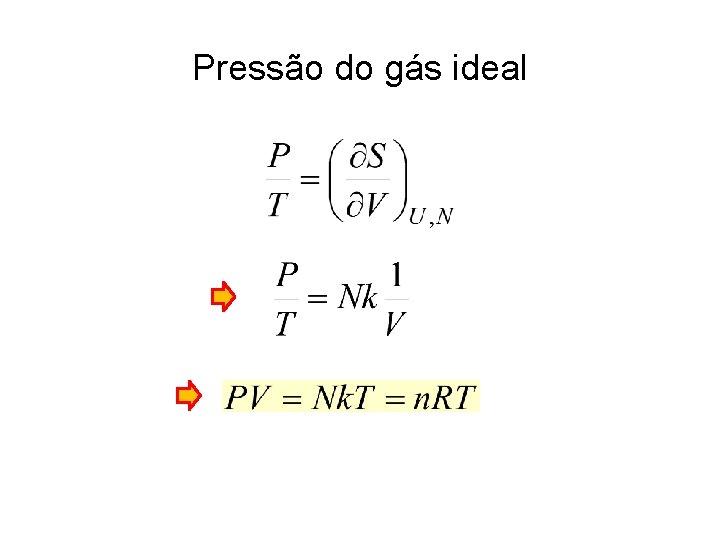
Pressão do gás ideal N moléculas

Pressão do gás ideal depende de U e N

Pressão do gás ideal

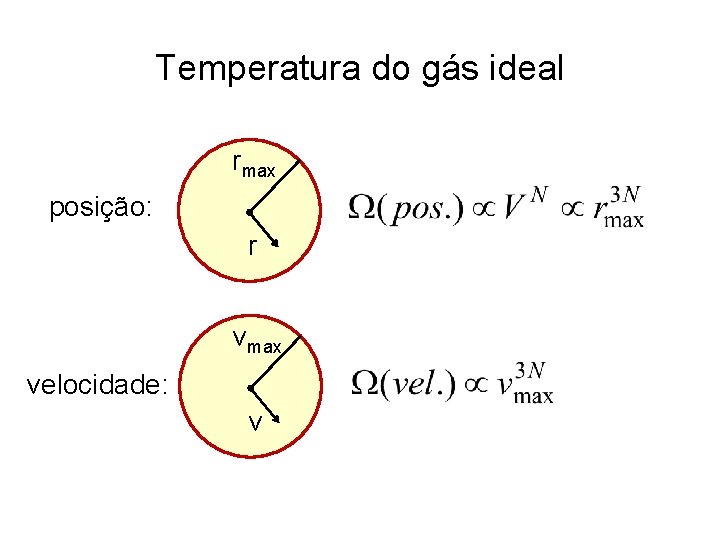
Temperatura do gás ideal rmax posição: r vmax velocidade: v

Temperatura do gás ideal depende de V e N

Temperatura do gás ideal energia cinética média:

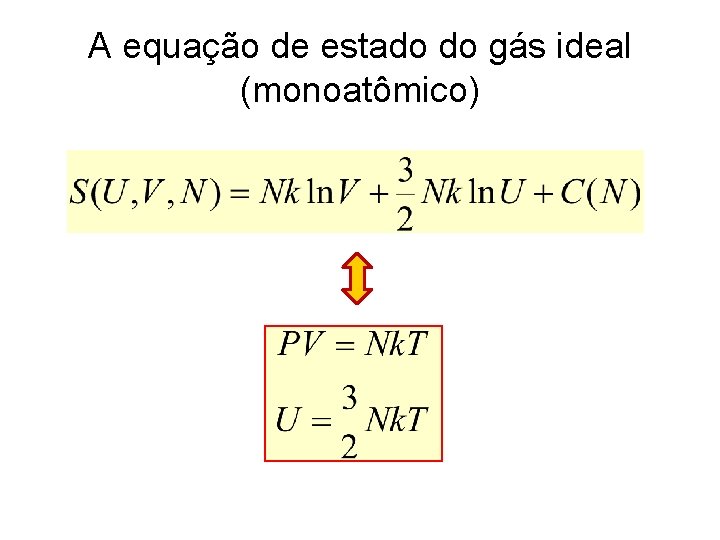
A equação de estado do gás ideal (monoatômico)

Borracha ideal

Modelo de uma fita elástica ‘monômero’ barra rígida de comprimento a N monômeros: N 1 para a direita, N 2 para a esquerda comprimento: comprimento máximo:

Modelo de uma fita elástica multiplicidade:

Entropia da fita elástica depende de N e U

Força elástica F > 0 com a troca de sinal lei de Hooke

Força elástica • A força elástica aumenta com a temperatura. • A força elástica é puramente entrópica. Vídeo completo em https: //youtu. be/ov. VO 8 NDdon 4

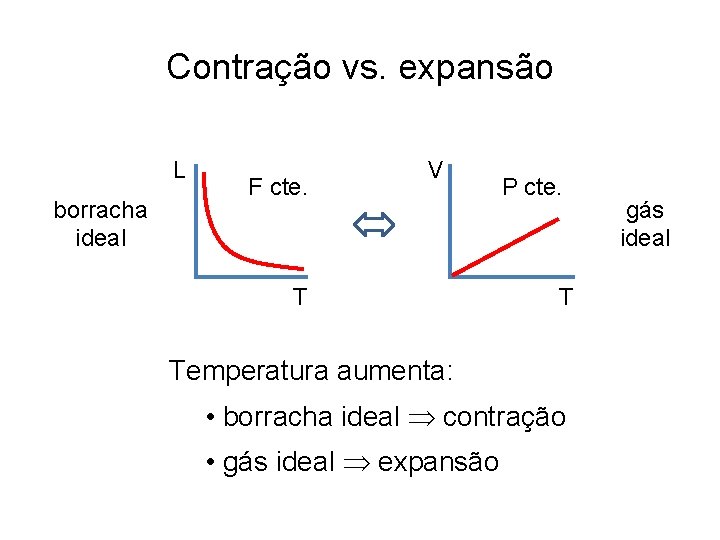
Contração vs. expansão L borracha ideal F cte. V T P cte. T Temperatura aumenta: • borracha ideal contração • gás ideal expansão gás ideal

Extensão adiabática d. Q = 0 , d. L > 0 F e CL positivos temperatura aumenta durante a extensão (diminui numa contração)

Extensão adiabática Vídeo completo em https: //youtu. be/vqz. W 25 gj 0 EI Vídeo completo em https: //youtu. be/lfmrvx. B 154 w

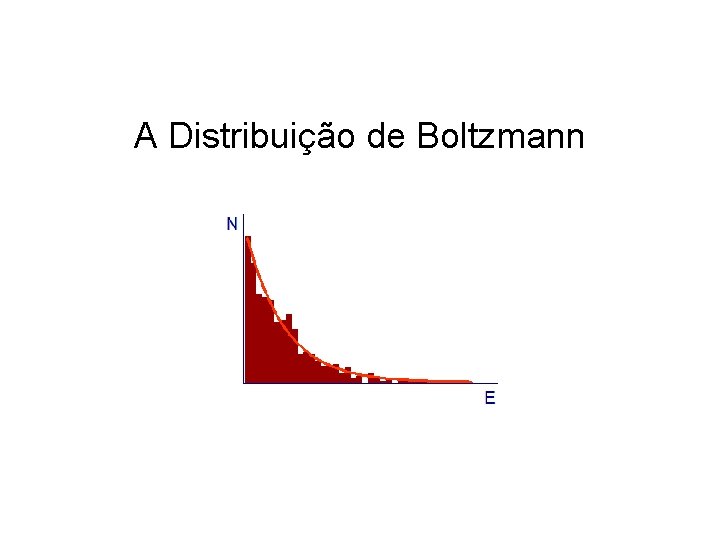
A Distribuição de Boltzmann

A Distribuição de Boltzmann sistema e U–e T reservatório térmico

A Distribuição de Boltzmann

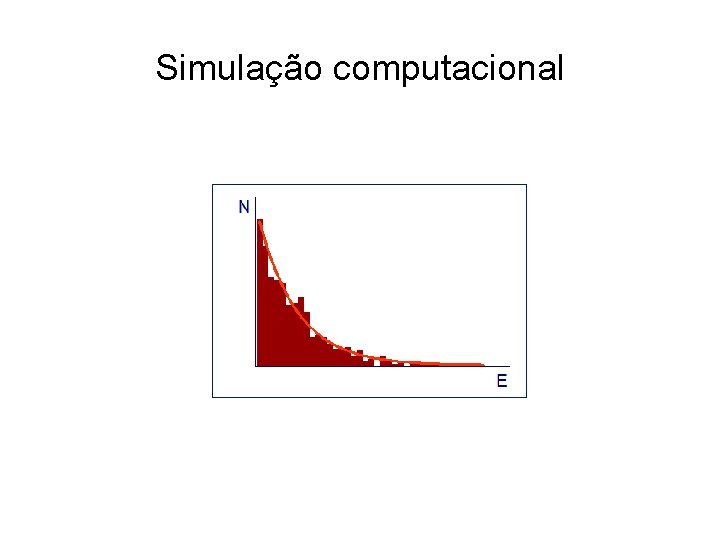
Simulação computacional

Comentários Finais

Avaliação da abordagem tradicional Survey of Thermodynamic Processes and First and Second Laws (Brown & Singh) Teste conceitual com 33 questões, 17 sobre entropia e segunda lei. Dados: B. Brown, Ph. D thesis, University of Pittsburgh, 2015

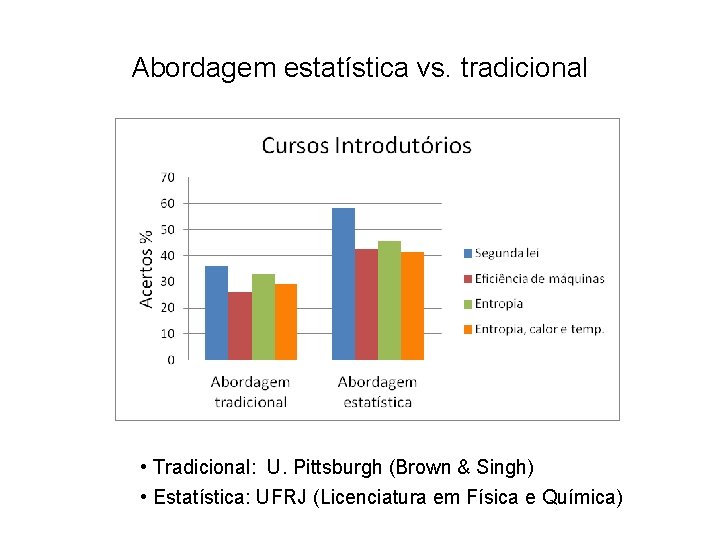
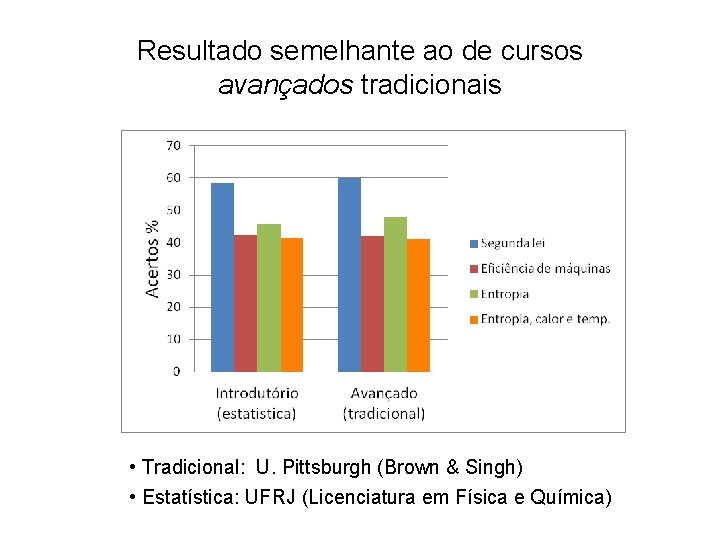
Abordagem estatística vs. tradicional • Tradicional: U. Pittsburgh (Brown & Singh) • Estatística: UFRJ (Licenciatura em Física e Química)

Resultado semelhante ao de cursos avançados tradicionais • Tradicional: U. Pittsburgh (Brown & Singh) • Estatística: UFRJ (Licenciatura em Física e Química)

Comentários finais • A 2ª lei da termodinâmica e o conceito de entropia são temas de aprendizagem notoriamente difícil. • A introdução do conceito estatístico de entropia logo ao início do estudo da 2ª lei parece reduzir essas dificuldades. • A definição da temperatura termodinâmica a partir da entropia permite obter imediatamente a maioria dos resultados associados à 2ª lei.

Comentários finais • A abordagem estatística da entropia pode levar além da 2ª lei: – Equação de estado de sistemas simples (gás ideal, por exemplo). – Distribuição de Boltzmann. • Com adaptações, a abordagem pode ser utilizada no ensino médio.

http: //www. if. ufrj. br/~carlos/palestras/ setadotempo/livro-2 a-lei. pdf
 Campo eletrico e força eletrica
Campo eletrico e força eletrica Entropia chimica
Entropia chimica Entropía ejemplos
Entropía ejemplos Soluzione satura
Soluzione satura Variacion entropia
Variacion entropia Terceira lei da termodinâmica
Terceira lei da termodinâmica Site:slidetodoc.com
Site:slidetodoc.com Entropia residual
Entropia residual Funzioni di stato
Funzioni di stato Stanyx
Stanyx La teoria matematica
La teoria matematica Equazione di boltzmann
Equazione di boltzmann Entropia
Entropia Aumento de entropia
Aumento de entropia Entropia wzory
Entropia wzory Hos entropia
Hos entropia Entropia
Entropia Componente curricular bncc ensino medio
Componente curricular bncc ensino medio Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Colonizacao
Colonizacao Contas do 3 ano do ensino medio
Contas do 3 ano do ensino medio Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Font
Font Modelo de considerações finais
Modelo de considerações finais Agitação térmica
Agitação térmica Plano de ensino anhanguera
Plano de ensino anhanguera Ensino
Ensino Português ensino fundamental
Português ensino fundamental Diretoria de ensino norte 2
Diretoria de ensino norte 2 Diretoria de ensino de são bernardo
Diretoria de ensino de são bernardo Atpc diretoria de ensino diadema
Atpc diretoria de ensino diadema Diretoria ensino osasco
Diretoria ensino osasco Projeto de vida - tecendo relações
Projeto de vida - tecendo relações Diretoria de itaquaquecetuba
Diretoria de itaquaquecetuba Ensino
Ensino Regra de cramer
Regra de cramer Filosofia 2 ano ensino médio
Filosofia 2 ano ensino médio Ensino superior jobs
Ensino superior jobs álgebra 3 ano ensino fundamental
álgebra 3 ano ensino fundamental Projeto integrado anhanguera
Projeto integrado anhanguera Ensino fundamental
Ensino fundamental Diretoria de ensino da marinha
Diretoria de ensino da marinha Diretoria de ensino de botucatu
Diretoria de ensino de botucatu Leste 4 diretoria de ensino
Leste 4 diretoria de ensino Diretoria de ensino osasco
Diretoria de ensino osasco Diretoria de ensino de limeira
Diretoria de ensino de limeira Projeto gentileza gera gentileza ensino médio
Projeto gentileza gera gentileza ensino médio Contas de matematica 1 ano ensino medio
Contas de matematica 1 ano ensino medio Inequação modular
Inequação modular Ensino régio
Ensino régio Todas as habilidades da bncc
Todas as habilidades da bncc Texto sobre vida e morte ensino religioso
Texto sobre vida e morte ensino religioso 5. qual é a finalidade do texto dramático (teatral)?
5. qual é a finalidade do texto dramático (teatral)? O que é ensino religioso
O que é ensino religioso Centro de ensino vicente maia
Centro de ensino vicente maia Música infantil
Música infantil Concepção dialética da liberdade
Concepção dialética da liberdade Diretoria de ensino de osasco
Diretoria de ensino de osasco As sete leis do ensino
As sete leis do ensino Exercícios de intervalos reais 9o ano
Exercícios de intervalos reais 9o ano Ensino
Ensino Arte 8 ano
Arte 8 ano Atividade orientadora de ensino
Atividade orientadora de ensino Diretoria de ensino caieiras
Diretoria de ensino caieiras Paralelogramo articulado
Paralelogramo articulado N
N Evolução dos microprocessadores
Evolução dos microprocessadores Eletromagnetismo
Eletromagnetismo Fases da lavagem de dinheiro
Fases da lavagem de dinheiro _
_ Lei do cosseno
Lei do cosseno Lei de ampere
Lei de ampere Lei de snell
Lei de snell Lei das doze tábuas
Lei das doze tábuas Lei maria da penha slide
Lei maria da penha slide Xhzby
Xhzby Lei de hubble
Lei de hubble Formula lei de hooke
Formula lei de hooke Lei 1079/50 art 39
Lei 1079/50 art 39 Entalpia
Entalpia 29052007
29052007 Jet lei
Jet lei Entreferro
Entreferro Lei de laplace
Lei de laplace Lei
Lei Fluidos
Fluidos Lei de amdahl
Lei de amdahl Lei do efeito thorndike
Lei do efeito thorndike Lei 7839/89
Lei 7839/89 2a lei de mendel
2a lei de mendel Lei de coulomb
Lei de coulomb Lei 1048/2000
Lei 1048/2000 Fluxo de campo eletrico
Fluxo de campo eletrico Pitts-lei model
Pitts-lei model Lei de hooke
Lei de hooke Permeabilidade
Permeabilidade Transições
Transições Ptolomeu (90-168 d.c.)
Ptolomeu (90-168 d.c.) Lei 80691990
Lei 80691990 Tacgat
Tacgat Jesus não veio destruir a lei
Jesus não veio destruir a lei Hansheng lei
Hansheng lei 12850 2013
12850 2013 Sistafe definição
Sistafe definição Saida mak implementasaun
Saida mak implementasaun Lei rouanet beneficiados
Lei rouanet beneficiados Gases
Gases Lei 11 346
Lei 11 346 O que é equilíbrio térmico
O que é equilíbrio térmico Lei de darcy
Lei de darcy Meteorology today
Meteorology today Lei de igualdade espiritismo slide
Lei de igualdade espiritismo slide As estatisticas indicam que o uso do cinto de segurança
As estatisticas indicam que o uso do cinto de segurança Lei de moore
Lei de moore 2 lei de ohm
2 lei de ohm Lei das proporções múltiplas
Lei das proporções múltiplas Lei do cosseno de lambert
Lei do cosseno de lambert Positivismo sociologia
Positivismo sociologia Lei da prioridade taxonomia
Lei da prioridade taxonomia Surgimento da sociologia
Surgimento da sociologia Nem rei nem lei nem paz nem guerra
Nem rei nem lei nem paz nem guerra Lei de progresso
Lei de progresso Locuzioni avverbiali tabella
Locuzioni avverbiali tabella Lei de lamarck uso e desuso
Lei de lamarck uso e desuso Lei de maxwell
Lei de maxwell Segunda lei de newton
Segunda lei de newton Wilhelm wundt estruturalismo
Wilhelm wundt estruturalismo Lei n7.498/86
Lei n7.498/86