Energi dan Hk 1 Termodinamika mahasiswa akan dapat

















- Slides: 37

Energi dan Hk. 1 Termodinamika

mahasiswa akan dapat menganalisis hubungan kerja, panas dan energi dalam sistem terbuka dan tertutup melalui proses adiabatik dan non adiabatik. Mampu menginterpretasi grafik yang dipakai untuk menetapkan kerja proses. Mampu menguraikan kasus yang berhubungan dengan Hukum Pertama Termodinamika 2

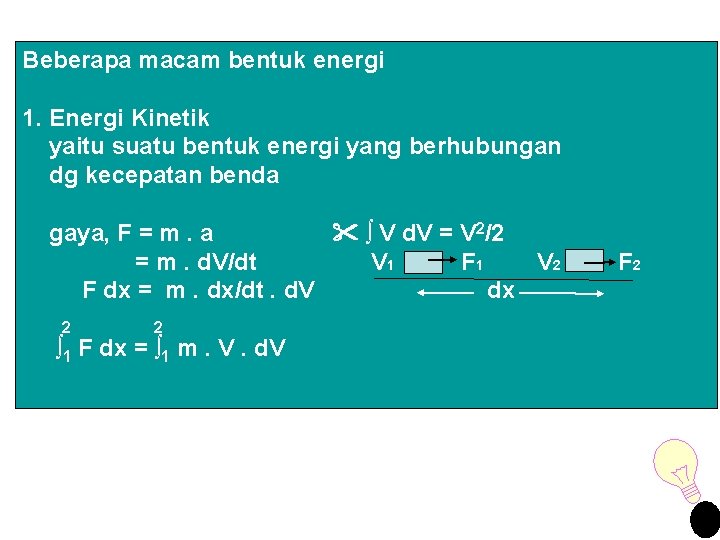
Beberapa macam bentuk energi 1. Energi Kinetik yaitu suatu bentuk energi yang berhubungan dg kecepatan benda gaya, F = m. a ∫ V d. V = V 2/2 = m. d. V/dt V 1 F 1 V 2 F dx = m. dx/dt. d. V dx 2 2 ∫ 1 F dx = ∫ 1 m. V. d. V F 2

Kesimpulan : energi kerja adalah suatu bentuk energi yg berhubungan dg gaya yg bekerja selama perpindahan Sehingga perubahan energi kinetik dapat dpt ditulis sbb: Δ Ek = ½ m 2 2 (V 2 – ∫ 1 F dx = ½ m 2 V 1) 2 (V 2 – 2 V 1)

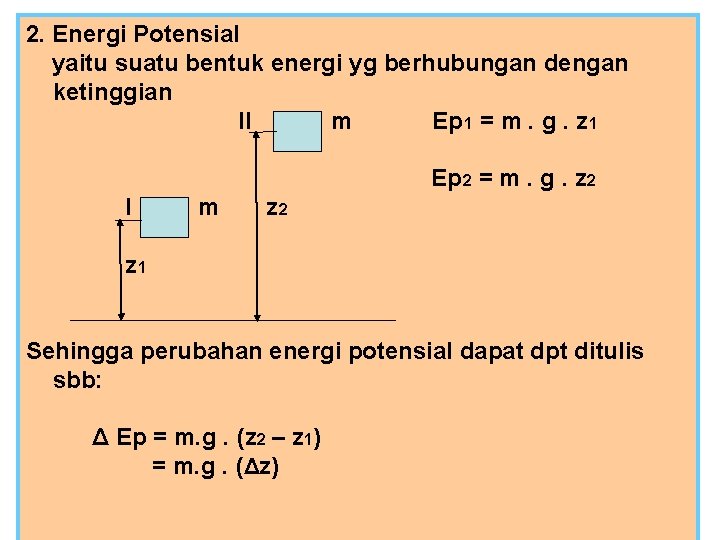
2. Energi Potensial yaitu suatu bentuk energi yg berhubungan dengan ketinggian II m Ep 1 = m. g. z 1 Ep 2 = m. g. z 2 I m z 2 z 1 Sehingga perubahan energi potensial dapat dpt ditulis sbb: Δ Ep = m. g. (z 2 – z 1) = m. g. (Δz)

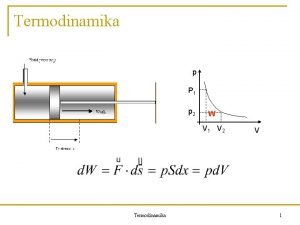
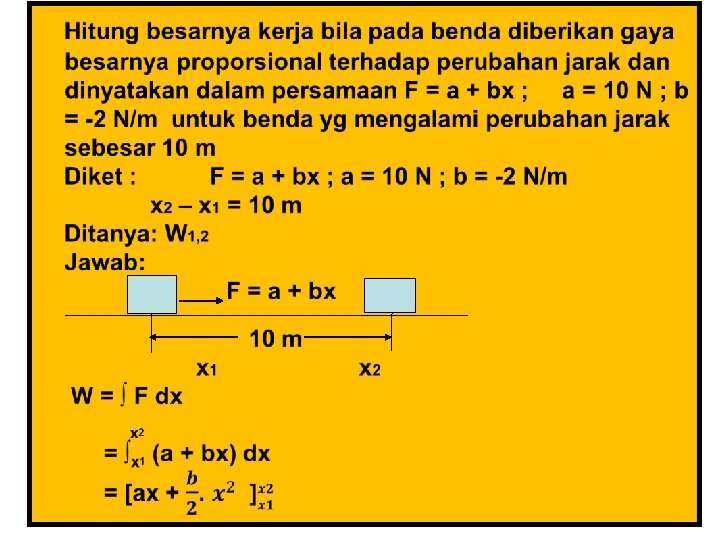
3. Energi Kerja yaitu suatu bentuk energi yg berhubungan dengan gaya yg bekerja selama perpindahan Kerja = gaya x perubahan jarak δW = F. Dx 2 ∫ 1 δW = ∫x 1 F. dx x 2 W 1, 2 = ∫x 1 F. dx Besarnya W belum dapat dihitung sebelum kita tahu fungsi terhadap X

Contoh 1. Hitung besarnya kerja bila padanya diberi gaya konstan sebesar 10 N dengan perpindahan jarak sebesar 15 m Diket: F = 10 N (konstan) x 2 – x 1 = 15 m Ditanya: W 1, 2 Jawab: x 2 W 1, 2 = ∫x 1 F. dx x 2 = F. ∫x 1 dx = F (x 2 – x 1) = 10 N (15 m) = 150 Nm = 150 J F = konstan


2 2 W = a ( x 2 – x 1 ) + b/2 ( x 2 – x 1 ) = 10 N. 10 m + ( - 2/2 N/m) ( 102 m 2 – 0) = 100 J – 100 J =0 4. Energi Panas yaitu suatu bentuk perpindahan energi sebagai akibat adanya perbedaan temperatur 5. Energi Dalam yaitu suatu bentuk energi yg bersembunyi di dlm benda tersebut

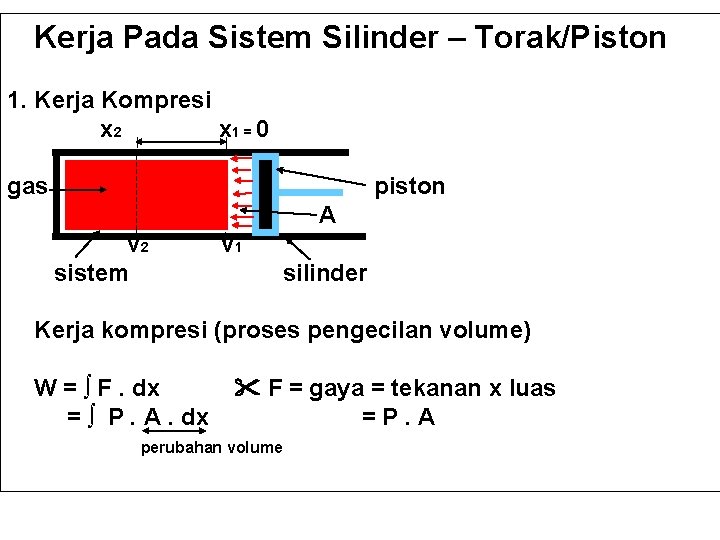
Kerja Pada Sistem Silinder – Torak/Piston 1. Kerja Kompresi x 2 x 1 = 0 gas piston A v 2 sistem v 1 silinder Kerja kompresi (proses pengecilan volume) W = ∫ F. dx = ∫ P. A. dx F = gaya = tekanan x luas =P. A perubahan volume

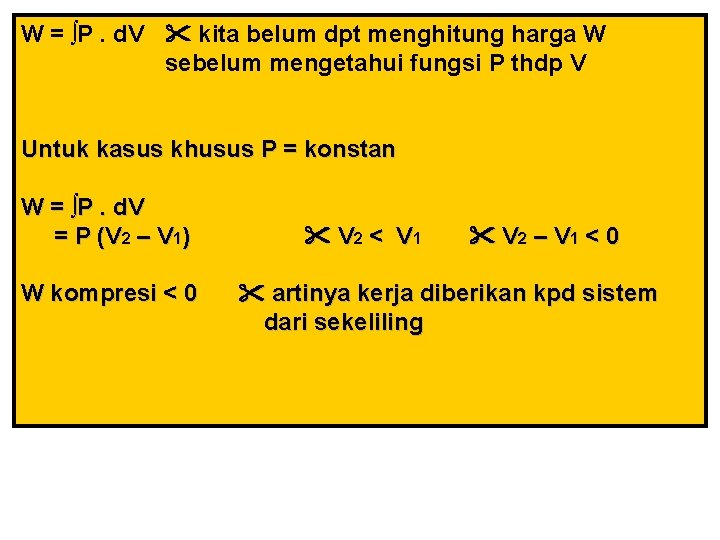
W = ∫P. d. V kita belum dpt menghitung harga W sebelum mengetahui fungsi P thdp V Untuk kasus khusus P = konstan W = ∫P. d. V = P (V 2 – V 1) W kompresi < 0 V 2 < V 1 V 2 – V 1 < 0 artinya kerja diberikan kpd sistem dari sekeliling

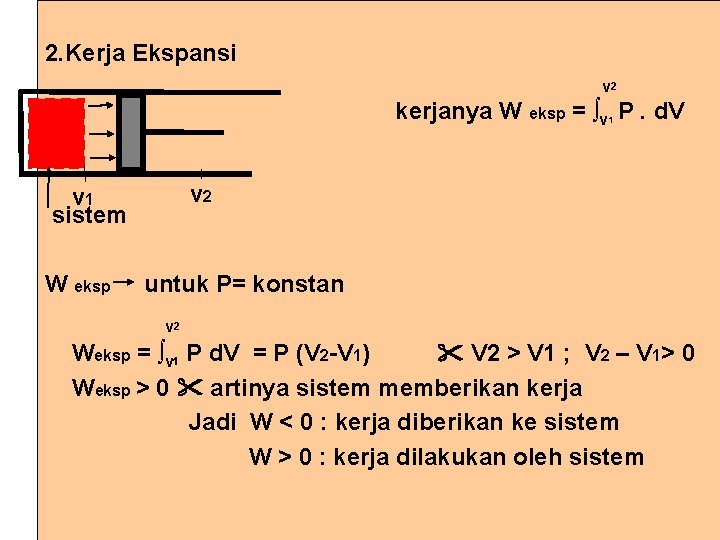
2. Kerja Ekspansi v 2 kerjanya W eksp = ∫v P. d. V 1 v 2 v 1 sistem W eksp untuk P= konstan v 2 Weksp = ∫v 1 P d. V = P (V 2 -V 1) V 2 > V 1 ; V 2 – V 1> 0 Weksp > 0 artinya sistem memberikan kerja Jadi W < 0 : kerja diberikan ke sistem W > 0 : kerja dilakukan oleh sistem

Gas Idial adalah suatu kondisi gas yg memenuhi persamaan bahwa: P. v=R. T dimana: P = tekanan (Pa; lbf/ft 2) v = volume jenis molekul (m 3/kg mol; ft 3/lb mol) T = temperatur absolut ( 0 K; 0 R) R = konstata gas universal = 1545 lbf ft/lb mol 0 R = 8, 314 k. J/kg mol 0 K = 1, 986 Btu/lb mol 0 R P. v = R. T : M v = v/M M = berat molekul M H 2 O = 18 lbm/lb mol = 18 kg/kmol (SI) ↔ R = R/M

P. v = R. T dimana v = volume jenis (m 3/kg; ft 3/lbm) R = konstata gas tersebut P. v = R. T x m m = massa (kg; lbm) shg menjadi: P. m. v=m. R. T m. v=V PV = m. R. T

Contoh soal Udara sebagai gas idial sebanyak 5 lbm berada di dalam silinder torak, mula-mula pada P 1 = 1 atm dan T 1 = 70 0 F dikompresikan sehingga V 2 = ½ V 1. Hitung kerja kompresi bila proses: a. Tekanan konstan b. Temperatur konstan c. PVn = konstan Diket: Silinder torak dg fluida udara dikompresikan shg V 2 = ½ V 1 P 1 = 1 atm W T 1 = 70 0 F Ditanya: udara sistem massa atur a. P = c b. T = c c. PVn = c

Kesetimbangan Termal & Hukum Termodinamika ke-0 l Jika dua buah benda dengan suhu yang berbeda diletakkan sedemikian rupa sehingga terjadi kontak, maka lama-kelamaan kedua benda akan mempunyai suhu yang sama. Kemudian dikatakan bahwa kedua benda mengalami kesetimbangan termal. l Hukum termodinamika ke-0; Jika dua buah sistem berada dalam keadaan kesetimbangan termal dengan sistem ke-3, maka kedua sistem itu berada dalam kesetimbangan termal satu sama lain. Misalkan ada 3 buah sistem A, B, dan C. Jika TA = TC dan TB = TC, maka TA = TB.

EK = 0 Energi tidak dapat diciptakan atau dimusnahkan Energi hanya dapat diubah dari satu bentuk ke bentuk lainnya EP = mgh EK = ½mu 2 EP = 0 EK = ½mu 2

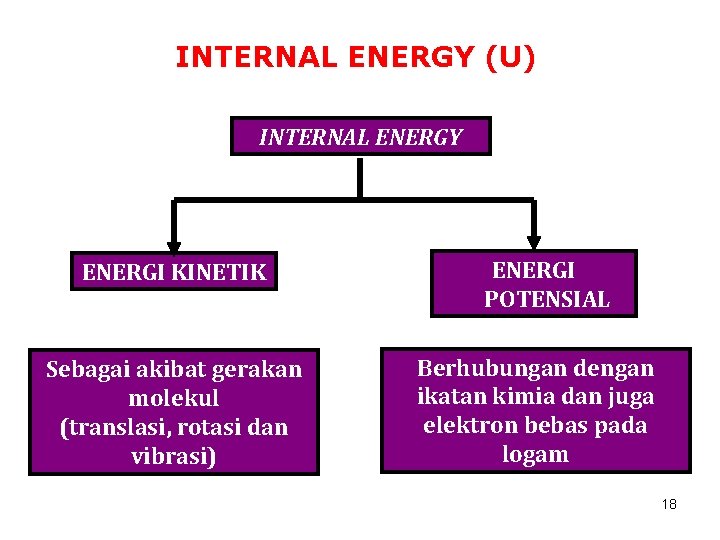
INTERNAL ENERGY (U) INTERNAL ENERGY ENERGI KINETIK Sebagai akibat gerakan molekul (translasi, rotasi dan vibrasi) ENERGI POTENSIAL Berhubungan dengan ikatan kimia dan juga elektron bebas pada logam 18

Transfer Energi oleh Kerja Umumnya, kerja yang terjadi dievaluasi menggunakan persamaan Q positif ketika sistem menerima panas dan negatif jika kehilangan panas. W positif jika kerja dilakukan oleh sistem dan negatif jika kerja dilakukan pada sistem kerja adalah energi yang dipindahkan rerata, dimana tidak peduli apakah ditransfer atau disimpan dalam sistem. Harga W 1 2 tergantung rincian interaksi yang diambil antara sistem dan sekelilingkungannya selama proses seperti F(s), dan tidak hanya keadaan awal dan akhir saja.

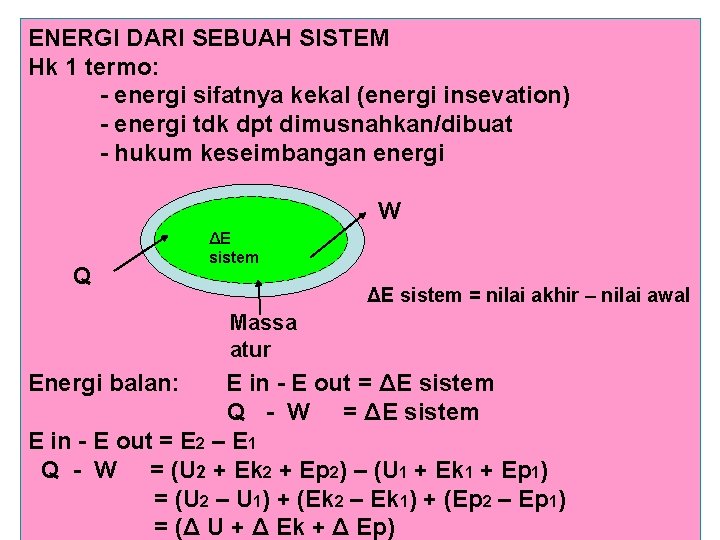
ENERGI DARI SEBUAH SISTEM Hk 1 termo: - energi sifatnya kekal (energi insevation) - energi tdk dpt dimusnahkan/dibuat - hukum keseimbangan energi W Q ΔE sistem = nilai akhir – nilai awal Massa atur Energi balan: E in - E out = ΔE sistem Q - W = ΔE sistem E in - E out = E 2 – E 1 Q - W = (U 2 + Ek 2 + Ep 2) – (U 1 + Ek 1 + Ep 1) = (U 2 – U 1) + (Ek 2 – Ek 1) + (Ep 2 – Ep 1) = (Δ U + Δ Ek + Δ Ep)

Contoh soal: Kalor sebanyak 1000 J ditambahkan ke sistem sementara kerja dilakukan pada (terhadap) sistem sebesar 500 J. Berapa perubahan energi dalam sistem? Jawab = ∆U = Q – W = ( + 1000 K ) – (-500 J) = 1500 J. Perhatikan bahwa HK 1 dalam bentuk ∆U = Q – W Q positip : KALOR DITAMBAHKAN KE SISTEM Q negatip: KALOR DILEPASKAN OLEH SISTEM W positip KERJA DILAKUKAN OLEH SISTEM W negatip KERJA DILAKUKAN PADA SISTEM

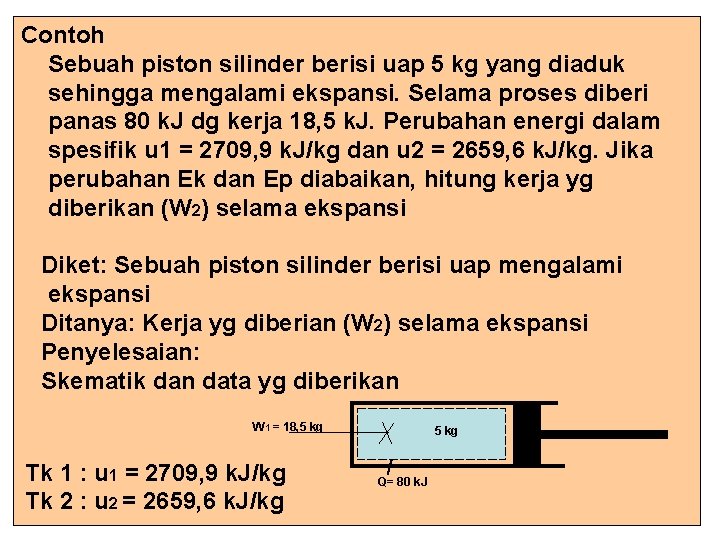
Contoh Sebuah piston silinder berisi uap 5 kg yang diaduk sehingga mengalami ekspansi. Selama proses diberi panas 80 k. J dg kerja 18, 5 k. J. Perubahan energi dalam spesifik u 1 = 2709, 9 k. J/kg dan u 2 = 2659, 6 k. J/kg. Jika perubahan Ek dan Ep diabaikan, hitung kerja yg diberikan (W 2) selama ekspansi Diket: Sebuah piston silinder berisi uap mengalami ekspansi Ditanya: Kerja yg diberian (W 2) selama ekspansi Penyelesaian: Skematik dan data yg diberikan W 1 = 18, 5 kg Tk 1 : u 1 = 2709, 9 k. J/kg Tk 2 : u 2 = 2659, 6 k. J/kg 5 kg Q= 80 k. J

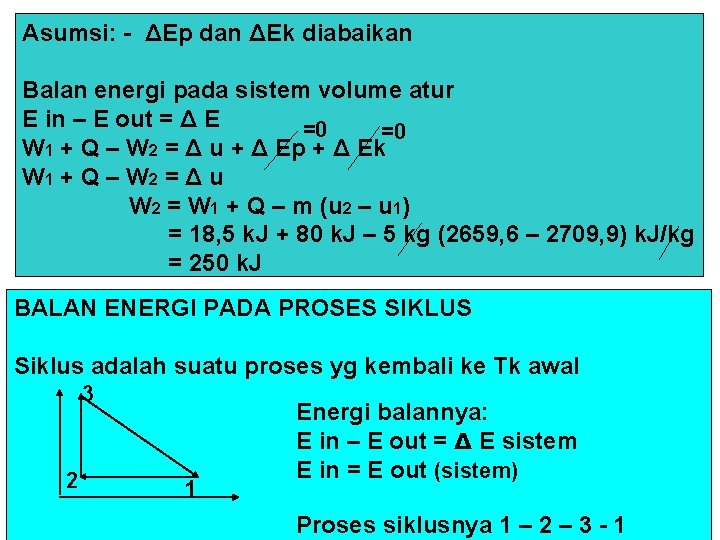
Asumsi: - ΔEp dan ΔEk diabaikan Balan energi pada sistem volume atur E in – E out = Δ E =0 =0 W 1 + Q – W 2 = Δ u + Δ Ep + Δ Ek W 1 + Q – W 2 = Δ u W 2 = W 1 + Q – m (u 2 – u 1) = 18, 5 k. J + 80 k. J – 5 kg (2659, 6 – 2709, 9) k. J/kg = 250 k. J BALAN ENERGI PADA PROSES SIKLUS Siklus adalah suatu proses yg kembali ke Tk awal P 3 Energi balannya: E in – E out = Δ E sistem E in = E out (sistem) 2 1 V Proses siklusnya 1 – 2 – 3 - 1

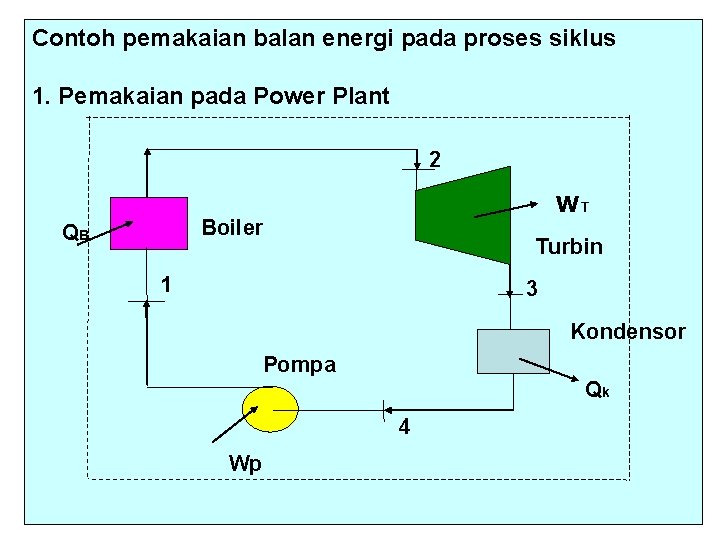
Contoh pemakaian balan energi pada proses siklus 1. Pemakaian pada Power Plant 2 WT Boiler QB Turbin 1 3 Kondensor Pompa Qk 4 Wp

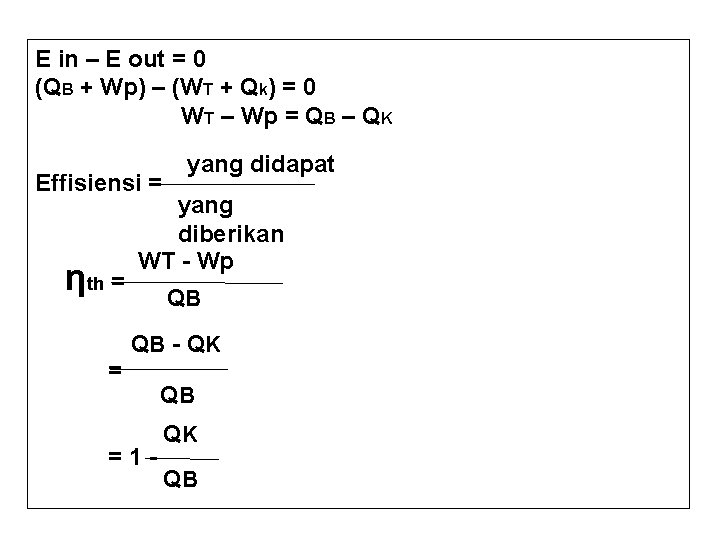
E in – E out = 0 (QB + Wp) – (WT + Qk) = 0 WT – Wp = QB – QK Effisiensi = ηth = yang didapat yang diberikan WT - Wp QB QB - Q K = =1 - QB QK QB

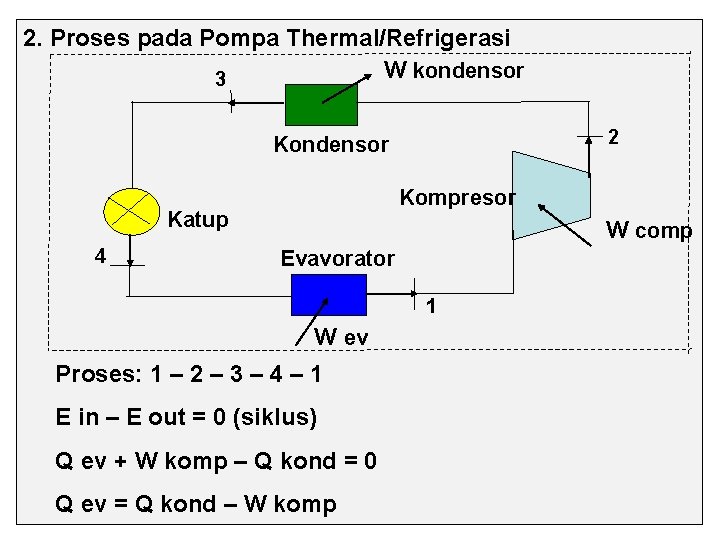
2. Proses pada Pompa Thermal/Refrigerasi W kondensor 3 2 Kondensor Kompresor Katup 4 W comp Evavorator 1 W ev Proses: 1 – 2 – 3 – 4 – 1 E in – E out = 0 (siklus) Q ev + W komp – Q kond = 0 Q ev = Q kond – W komp

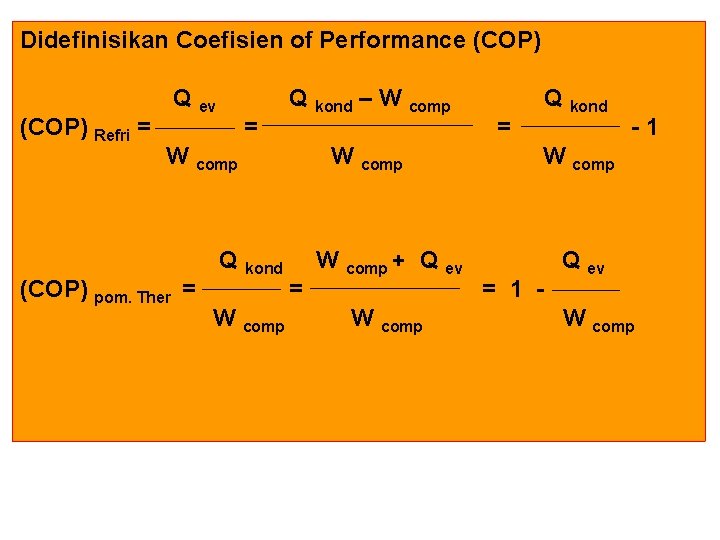
Didefinisikan Coefisien of Performance (COP) Refri = Q ev = Q kond – W comp Q (COP) pom. Ther = W W comp kond comp = W comp + Q ev W comp = Q kond -1 W comp = 1 - Q ev W comp

Contoh soal: Uap air di dalam piston silinder mengalami proses sbb: proses 1 -2 ekspansi dengan u 2 -u 1 = 9, 6 Btu/lbm, W 12/m = 30, 4 Btu/lbm, proses 2 -3 tekanan konstan dengan P 2 = 180 psi, v 2 = 2, 648 ft 3 /lbm, v 3 = 1, 866 ft 3 /lbm, proses 3 -4 perubahan energi dalamnya (u 1 – u 3) = 211, 3 Btu/lbm dan W 31/m = 0. Jika perubahanenergi potensial dan energi kinetik diabaikan, hitung a. panas untuk setiap proses b. Efisiensi thermal siklus

Diket: Piston silinder dg fluida uap air mengalami suatu proses : - proses 1 -2: ekspansi dg u 2 -u 1 = 9, 6 Btu/lbm, Uap air W 12/m = 30, 4 Btu/lbm, - proses 2 -3: tekanan konstan dg P 2 = 180 psi, v 2 = 2, 648 ft 3 /lbm, piston v 3 = 1, 866 ft 3 /lbm - proses 3 -4: (u 1 – u 3) = 211, 3 Btu/lbm dan W 31/m = 0. Δ Ep dan Δ Ek diabaikan, Ditanya: a. Q untuk setiap proses b. Efisiensi thermal siklus

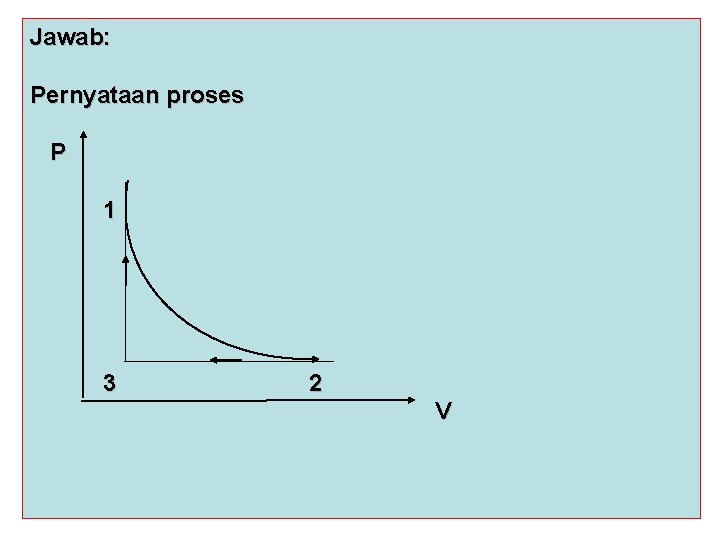
Jawab: Pernyataan proses P 1 3 2 V

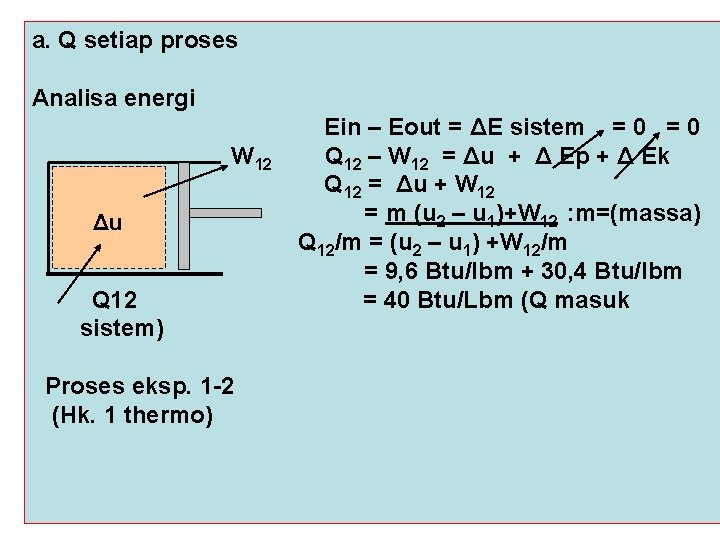
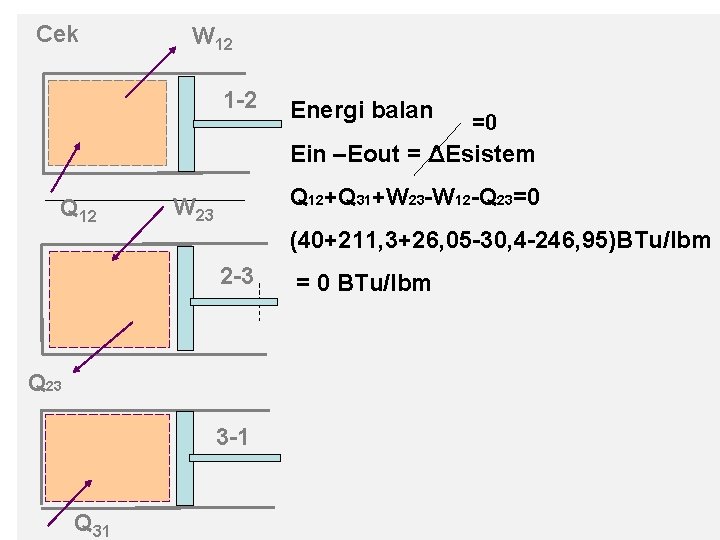
a. Q setiap proses Analisa energi W 12 Δu Q 12 sistem) Proses eksp. 1 -2 (Hk. 1 thermo) Ein – Eout = ΔE sistem = 0 Q 12 – W 12 = Δu + Δ Ep + Δ Ek Q 12 = Δu + W 12 = m (u 2 – u 1)+W 12 : m=(massa) Q 12/m = (u 2 – u 1) +W 12/m = 9, 6 Btu/lbm + 30, 4 Btu/lbm = 40 Btu/Lbm (Q masuk

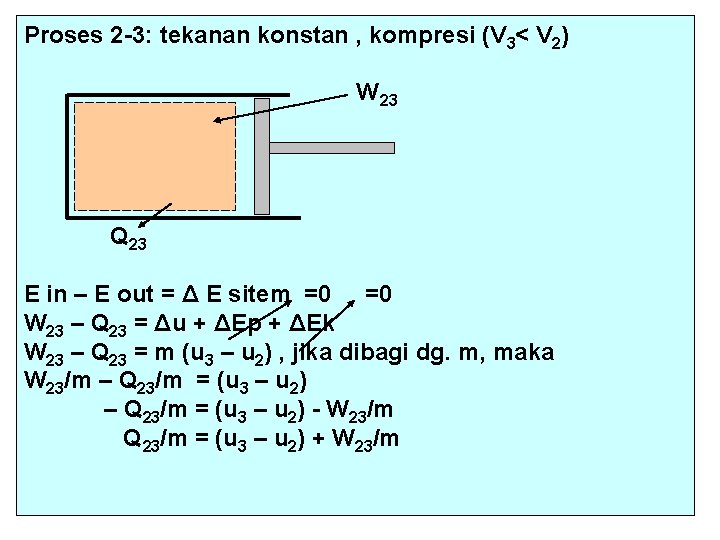
Proses 2 -3: tekanan konstan , kompresi (V 3< V 2) W 23 Q 23 E in – E out = Δ E sitem =0 =0 W 23 – Q 23 = Δu + ΔEp + ΔEk W 23 – Q 23 = m (u 3 – u 2) , jika dibagi dg. m, maka W 23/m – Q 23/m = (u 3 – u 2) - W 23/m Q 23/m = (u 3 – u 2) + W 23/m

3 3 W 23/m =∫ 2 p dv = p ∫ 2 dv = p 2 (v 3 – v 2) = 180 lbf/in 2. 144 in 2/ft 2 (1, 866 – 2, 648) ft 3/lbm. 1 BTu/778 lbf = - 26, 05 BTu/lbm (kerja kompresi) u 3 – u 2 = u 3 + u 1 – u 2 – u 1 = (- u 2 + u 1) + (u 3 – u 1) = -(u 2 - u 1) - (u 1 – u 3) = (- 9, 6 – 211, 3 )Btu/lbm = - 220, 9 Btu/lbm Q 23/m = (u 3 – u 2) + W 23/m = (- 220, 9 – 26, 05) BTu/lbm = -246, 95 BTu/lbm

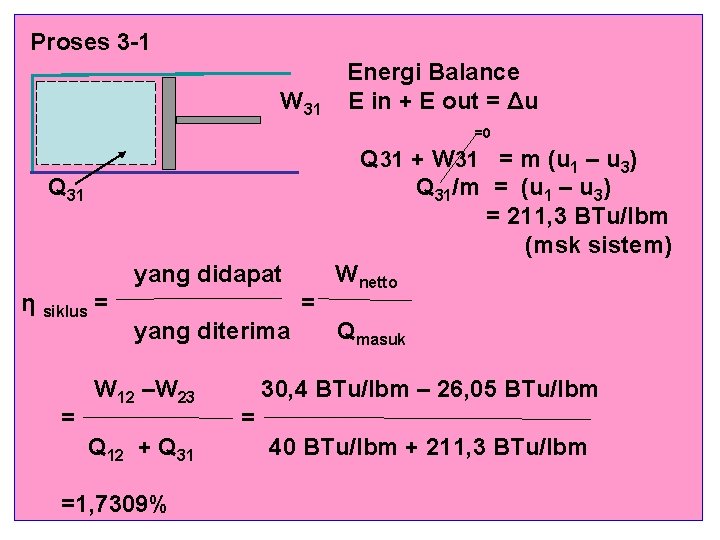
Proses 3 -1 W 31 Energi Balance E in + E out = Δu =0 Q 31 + W 31 = m (u 1 – u 3) Q 31/m = (u 1 – u 3) = 211, 3 BTu/lbm (msk sistem) Q 31 yang didapat η siklus = = = yang diterima W 12 –W 23 Q 12 + Q 31 =1, 7309% Wnetto Qmasuk 30, 4 BTu/lbm – 26, 05 BTu/lbm = 40 BTu/lbm + 211, 3 BTu/lbm

Cek W 12 1 -2 Energi balan =0 Ein –Eout = ΔEsistem Q 12+Q 31+W 23 -W 12 -Q 23=0 W 23 (40+211, 3+26, 05 -30, 4 -246, 95)BTu/lbm 2 -3 Q 23 3 -1 Q 31 = 0 BTu/lbm

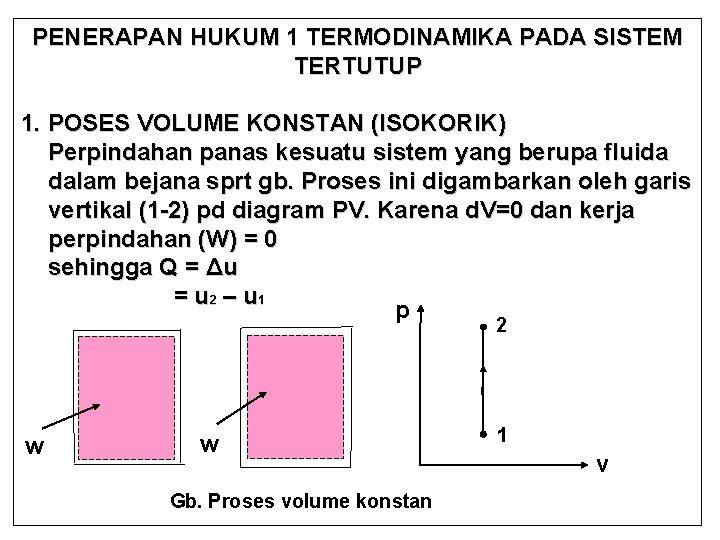
PENERAPAN HUKUM 1 TERMODINAMIKA PADA SISTEM TERTUTUP 1. POSES VOLUME KONSTAN (ISOKORIK) Perpindahan panas kesuatu sistem yang berupa fluida dalam bejana sprt gb. Proses ini digambarkan oleh garis vertikal (1 -2) pd diagram PV. Karena d. V=0 dan kerja perpindahan (W) = 0 sehingga Q = Δu = u 2 – u 1 p 2 w w Gb. Proses volume konstan 1 v

Contoh soal: Satu kg udara (diasumsikan sebagai gas ideal, R=0, 287 k. J/kg. K) diisikan ke dlm bejana volume konstan. Volume dan tekanan awal udara masing-masing 0, 2 m dan 350 k. Pa. Jika 120 k. J kalor dipasokan pada gas, temperaturnya naik hingga 411, 5 K Hitung: a. Kerja yg dilakukan b. Perubahan energi dalam c. Kalor spesifik gas pada volume konstan Diket: Bejana dg fluida udara bekerja pd volume konstan udara Q= 120 k. J m =1 kg V 1 = 0, 2 m P 1 = 350 k. Pa T 2 = 411, 5 K P 2 350 1 V 37
 Katup 4/2
Katup 4/2 Sebuah ketel listrik dihubungkan ke baterai
Sebuah ketel listrik dihubungkan ke baterai Energi kalor menjadi energi listrik
Energi kalor menjadi energi listrik Sebuah setrika listrik 200 watt
Sebuah setrika listrik 200 watt Energi listrik adalah energi yang berasal dari muatan
Energi listrik adalah energi yang berasal dari muatan Apa itu deret ukur
Apa itu deret ukur Sebanyak 5 mahasiswa akan mengikuti ujian sarjana
Sebanyak 5 mahasiswa akan mengikuti ujian sarjana Termokimia dan termodinamika
Termokimia dan termodinamika Energi yang sumbernya dapat pulih kembali disebut
Energi yang sumbernya dapat pulih kembali disebut Contoh disiplin dan tanggung jawab sebagai mahasiswa
Contoh disiplin dan tanggung jawab sebagai mahasiswa Termodinamika zadaci srednja škola
Termodinamika zadaci srednja škola Proses termodinamika adalah
Proses termodinamika adalah Thermodinamika
Thermodinamika Gess qonuni matematik ifodasi
Gess qonuni matematik ifodasi Cp-cv=r/m
Cp-cv=r/m Diagram t-s termodinamika
Diagram t-s termodinamika Hukum ke nol termodinamika
Hukum ke nol termodinamika Hukum termodinamika 1
Hukum termodinamika 1 Hukum pertama termodinamika
Hukum pertama termodinamika Termodinamika teknik kimia
Termodinamika teknik kimia Cv termodinamika
Cv termodinamika Proses spontan termodinamika
Proses spontan termodinamika Jika dianggap udara mengalir horizontal
Jika dianggap udara mengalir horizontal Termodinamika 2
Termodinamika 2 Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 2 zakon termodinamike
2 zakon termodinamike Termodinamika
Termodinamika Konsep dasar termodinamika
Konsep dasar termodinamika T-s diagram értelmezése
T-s diagram értelmezése Hukum termodinamika
Hukum termodinamika Hukum 1 termodinamika
Hukum 1 termodinamika Hukum termodinamika
Hukum termodinamika Hukum kedua termodinamika
Hukum kedua termodinamika Termodinamika 2. főtétele
Termodinamika 2. főtétele Hemijska termodinamika
Hemijska termodinamika Termodinamika
Termodinamika Termodinamika főtételei
Termodinamika főtételei Termodinamika főtételei
Termodinamika főtételei