Empirijska i molekulska formula CH O 2 C












- Slides: 13

Empirijska i molekulska formula CH O 2 C 6 H 12 O 6 Nastavni predmet: Opća kemija Nastavni plan i program/Kurikulum: Ekološki tehničar 1. razred Trajanje: 2 sata Autor: Adela Lukavski

Dragi učenici i drage učenice, kako bismo vam olakšali učenje za vas smo pripremili materijale za samostalni rad. U ovoj prezentaciji su sadržaji koji se odnose na nastavni predmet: Opća kemija Također prezentacija sadrži i zadatake za vježbu. Na kraju prezentacije nalaze se pitanja za ponavljanje gradiva. Vaši nastavnici će vam također pružati podršku u učenju na daljinu. Želimo vam sretno i ugodno učenje.

Pitanja za ponavljanje

-poznavanjem masenog udjela elemenata u nekom spoju može se odrediti empirijska formula Empirijska formula – najmanji mogući omjer broja atoma elemenata u spoju -spoj se podvrgava kvantitativnoj kemijskoj analizi spoj kemijska analiza rezultira maseni udio računamo empirijska formula Molekulska formula- prikazuje točan omjer broja atoma u spoju

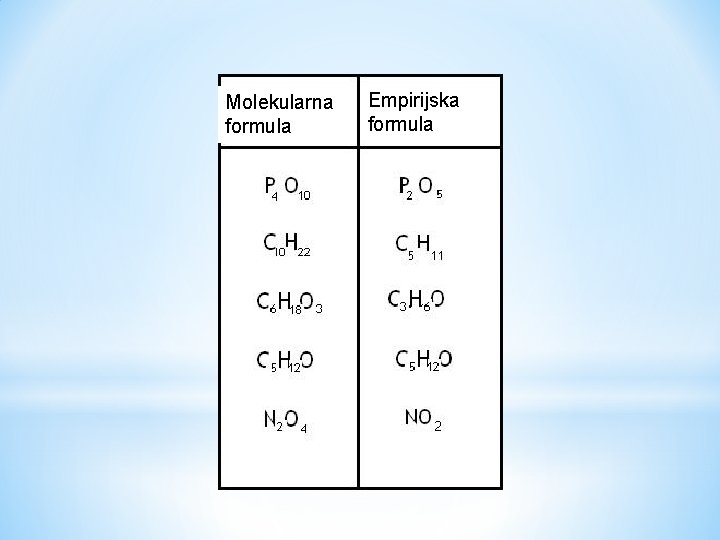
Molekularna formula Empirijska formula

-ako se promatra opća formula spoja Ax. By tada za omjer broja atoma A i B u spoju vrijedi: uvrštavanjem dobije se:

Primjer: Spoj sadrži 88, 8 % bakar i 11, 2 % kisika. Odredi empirijsku formulu spoja Zadano : w(Cu) = 88, 8 % = 0, 888 w(O) = 11, 2 % =0, 112 Traži se : Empirijska formula n(Cu) : n(O) = N(Cu) : N(O)

= = - Omjer broja atoma iz gornjih izraza treba svesti na omjer cijelih brojeva - Rezultate treba podijeliti manjim brojem u omjeru N(Cu) : N(O) = 2 : 1 Empirijska formula spoja je: Cu 2 O

Za molekulsku formulu potreban je eksperimentalni podatak o M ( molarnoj ili relativnoj molekulskoj masi) empirijska formula molekulska formulu M odgovara empirijska formula M ne odgovara treba odrediti koliko se puta trebaju povećati koeficijenti da odgovara M

Primjer: Empirijska formula je C 3 H 7 Eksperimentalna molekularna masa = 86, 172 g mol– 1 M(C 3 H 7) = 43, 066 g mol– 1 M(Cx. Hy) : M(C 3 H 7) = 86, 172 g mol– 1 : 43, 066 g mol– 1 /: 43, 066 g mol– 1 2 : M(Cx. Hy) =( C 3 H 7)2 = C 6 H 14 1

Zadano: m(H) : m(C) : m(O) = 1 : 3 : 4 Mr(spoj) = 32 Traži se: formula spoja - Nije zadana masa elemenata, niti maseni udjeli - Pretpostavka je da m(H) = 1 g - m(C)= 3 m(H) = 3 g - m(O)= 4 m(H) = 4 g - m(spoj) = m(H) + m(C) + m(O) = 8 g - Maseni udjeli: w(H) = m(H) / m(spoj) = 1 g / 8 g = 0, 125 w(C) = m(C) / m(spoj) = 3 g / 8 g = 0, 375 w(O) = m(O) / m(spoj) = 4 g / 8 g = 0, 5

N(C) : N(H) : N(O) = w(C) / Ar(C) : w(H) / Ar(H) : w(O) / Ar(O) N(C) : N(H) : N(O) = 0, 375 / 12, 0 : 0, 125 / 1, 0 : 0, 5 / 16, 0 N(C) : N(H) : N(O) = 0, 0313 : 0, 125 : 0, 0313 - Potrebno je podijeliti sa najmanjim brojem /: 0, 0313 N(C) : N(H) : N(O) = 1 : 3, 99 : 1 N(C) : N(H) : N(O) = 1 : 4 : 1 Empirijska formula je CH 4 O Izračunamo molekulsku masu od empirijske formule Er = Ar (C)+ 4 Ar(H) + Ar(O)= 12, 01 + 4. 1, 008 + 16, 00 = 32, 042 Iz omjera poznate relativne molekulske mase i empirijske izračunamo molekulsku formulu Er / Mr = 32, 042 / 32 = 1

Zadaci za ponavljanje: 1. Odredite molekulsku formulu spoja koji se sastoji od 1. 03 % vodika, 33 % sumpora i 66 % kisika. Relativna molekulska masa je 195. 2. Freon-12 sadrži 9, 9 % ugljika, 31, 4 %fluora i 58, 7 % klora. Odredite empirijsku formulu. 3. Dokazano je da se u nekom spoju veže 6 g ugljika na 1 g vodika. Relativna molekulska masa spoja je 56. Odredite molekulsku formulu spoja. 4. Ženski spolni hormon estrogen sadrži ugljik, vodik i kisik, a maseni udjeli w(C)=79. 9%, w(H)=8. 2%, w(O)=11. 8%. Odredite empirijsku i molekulsku formulu ako je Mr = 270, 4. 5. Kemijskom analizom vitamina C ustanovljeno je da su maseni udjeli elemenata u njemu: w (C) = 40, 91 %, w (O) = 54, 55 %, a ostalo je vodik. a) Odredite empirijsku formulu vitamina C b) Odredite molekulsku formulu ako je poznato da je relativna molekulska masa 176, 12.