Elementos qumicos conjunto de tomos de um mesmo
























- Slides: 46


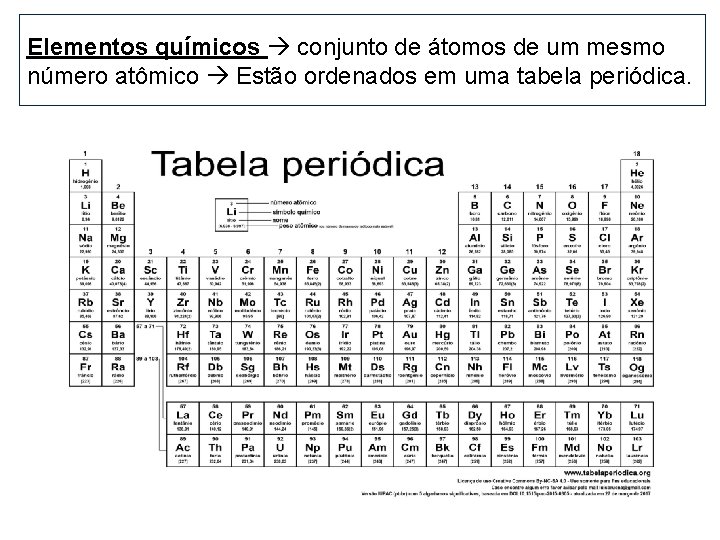
Elementos químicos conjunto de átomos de um mesmo número atômico Estão ordenados em uma tabela periódica.

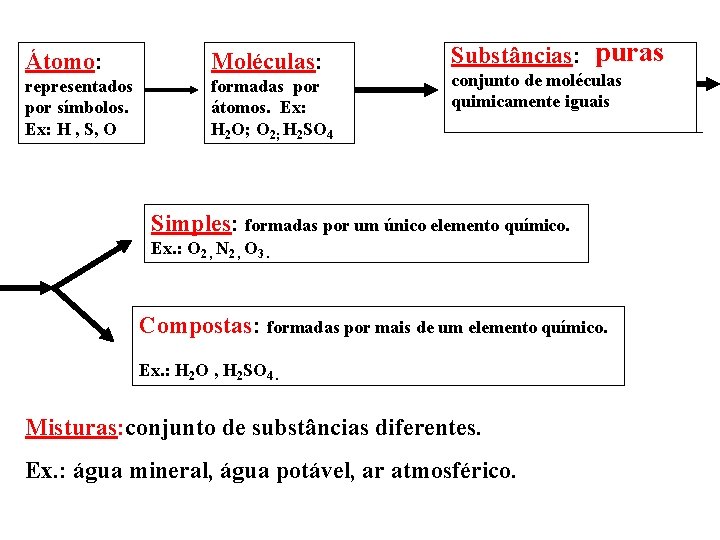
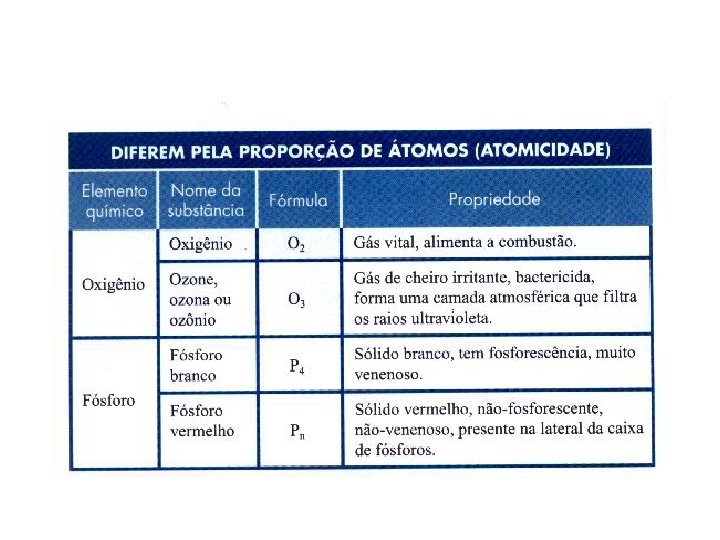
Átomo: Moléculas: representados por símbolos. Ex: H , S, O formadas por átomos. Ex: H 2 O; O 2; H 2 SO 4 Substâncias: puras conjunto de moléculas quimicamente iguais Simples: formadas por um único elemento químico. Ex. : O 2 , N 2 , O 3. Compostas: formadas por mais de um elemento químico. Ex. : H 2 O , H 2 SO 4. Misturas: conjunto de substâncias diferentes. Ex. : água mineral, água potável, ar atmosférico.

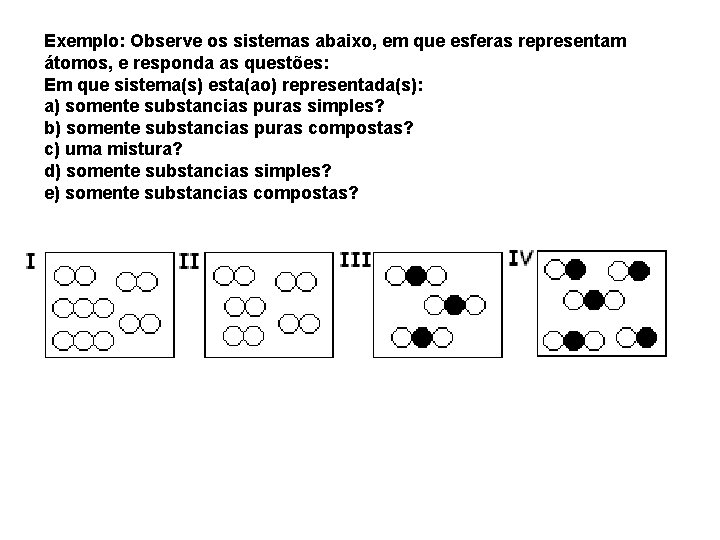
Exemplo: Observe os sistemas abaixo, em que esferas representam átomos, e responda as questões: Em que sistema(s) esta(ao) representada(s): a) somente substancias puras simples? b) somente substancias puras compostas? c) uma mistura? d) somente substancias simples? e) somente substancias compostas?

Exemplo: Em qual das sequencias abaixo estão representados um elemento, uma substância simples e uma substancia composta, respectivamente? a) H 2, Cl 2, O 2 b) N, HI, He c) Cl 2, N 2, HI d) Ne, H 2 O e) H 2 O, O 2, H 2 D Outro exemplo: Uma substancia pura: a) e necessariamente uma substancia simples b) pode ser uma substancia simples ou uma substancia composta c) e necessariamente uma substancia composta d) e formada apenas por moléculas de átomos iguais e) e formada apenas por moléculas de átomos diferentes B

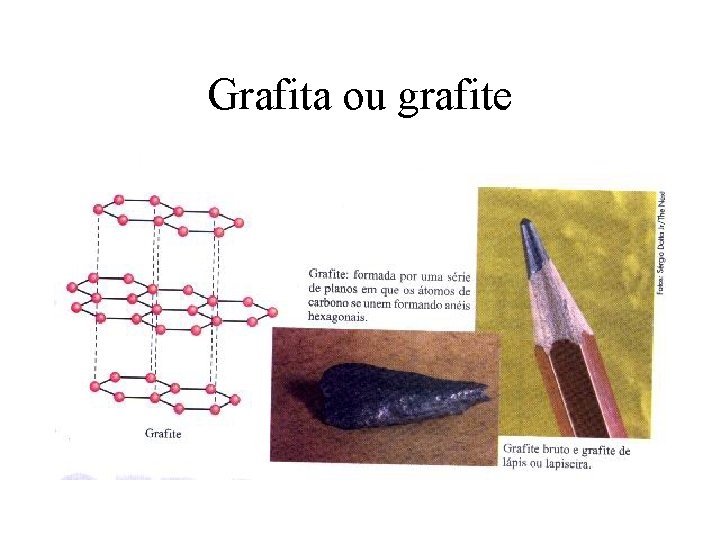
Alotropia- ocorre quando o mesmo elemento químico forma substâncias simples diferentes.

Grafita ou grafite

Diamante

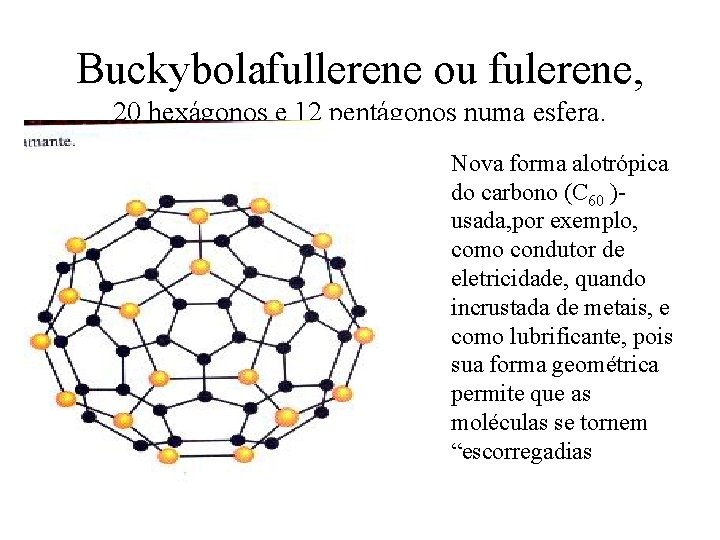
Buckybolafullerene ou fulerene, 20 hexágonos e 12 pentágonos numa esfera. Nova forma alotrópica do carbono (C 60 )usada, por exemplo, como condutor de eletricidade, quando incrustada de metais, e como lubrificante, pois sua forma geométrica permite que as moléculas se tornem “escorregadias

Enxofre rômbico e monoclinico (S 8) ambos são sólidos e de cor amarela, a rômbica é mais estável


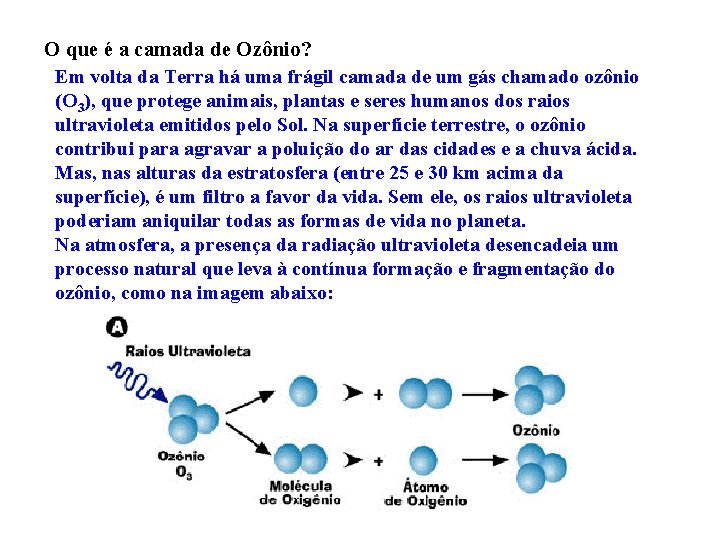
O que é a camada de Ozônio? Em volta da Terra há uma frágil camada de um gás chamado ozônio (O 3), que protege animais, plantas e seres humanos dos raios ultravioleta emitidos pelo Sol. Na superfície terrestre, o ozônio contribui para agravar a poluição do ar das cidades e a chuva ácida. Mas, nas alturas da estratosfera (entre 25 e 30 km acima da superfície), é um filtro a favor da vida. Sem ele, os raios ultravioleta poderiam aniquilar todas as formas de vida no planeta. Na atmosfera, a presença da radiação ultravioleta desencadeia um processo natural que leva à contínua formação e fragmentação do ozônio, como na imagem abaixo:

Se a camada de ozônio não existisse, poderíamos ficar menos tempo no sol sem nos queimarmos

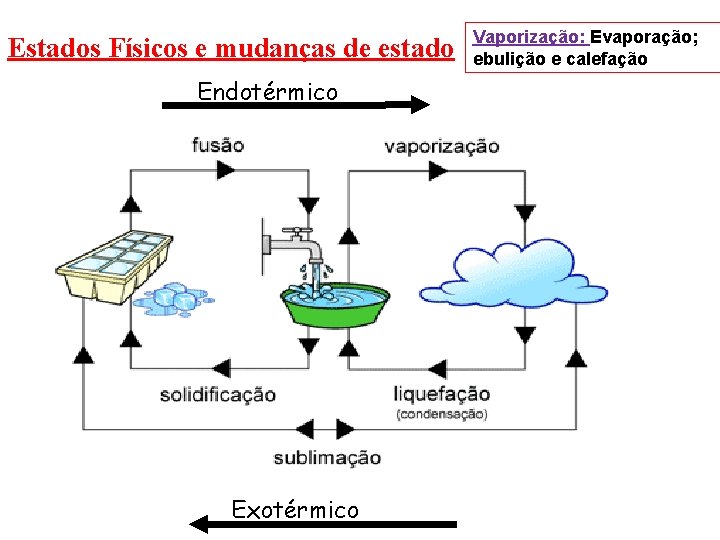
Estados Físicos e mudanças de estado Endotérmico Exotérmico Vaporização: Evaporação; ebulição e calefação

Gelo seco (CO 2(s)) Iodo (I 2(S))

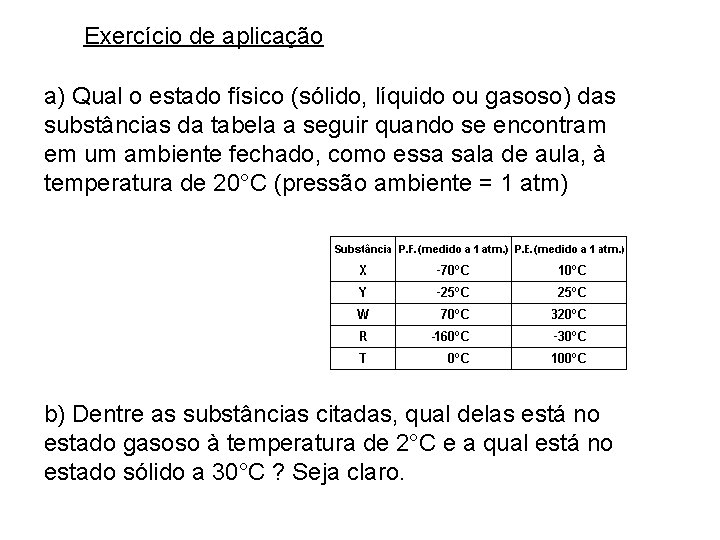
Exercício de aplicação a) Qual o estado físico (sólido, líquido ou gasoso) das substâncias da tabela a seguir quando se encontram em um ambiente fechado, como essa sala de aula, à temperatura de 20°C (pressão ambiente = 1 atm) b) Dentre as substâncias citadas, qual delas está no estado gasoso à temperatura de 2°C e a qual está no estado sólido a 30°C ? Seja claro.

Substâncias Puras e Misturas: Diferenciamos uma mistura de uma substância pura normalmente através de suas constantes físicas, tais como: ponto de ebulição (PE), ponto de fusão (PF), densidade (d)e solubilidade (solub). As substâncias puras mantêm suas constantes durante as mudanças de estado, diferentemente das misturas. Exemplo: • Água pura: - PE = 100ºC; PF = 0ºC; d = 1 g/cm 3. • Água e sal de cozinha (Na. Cl): não apresentam constantes. • Álcool Puro: PE = 78, 5ºC; PF = -177ºC; d = 0, 79 g/cm 3. • Álcool e Água: não apresentam constantes.

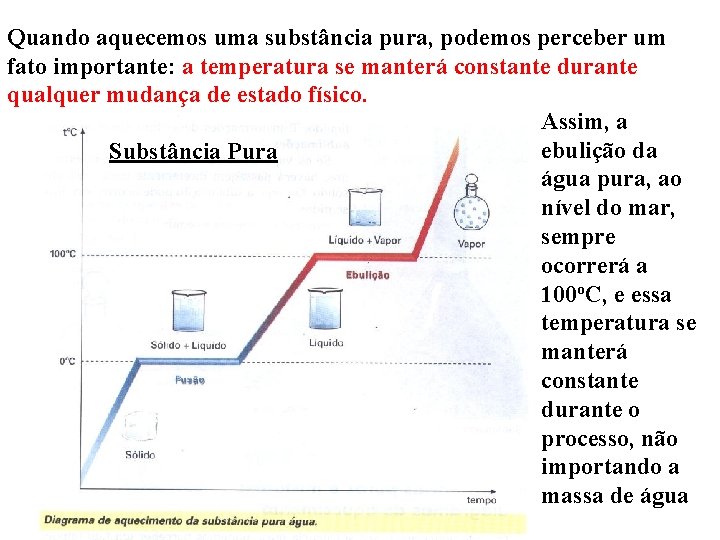
Quando aquecemos uma substância pura, podemos perceber um fato importante: a temperatura se manterá constante durante qualquer mudança de estado físico. Assim, a ebulição da Substância Pura água pura, ao nível do mar, sempre ocorrerá a 100 o. C, e essa temperatura se manterá constante durante o processo, não importando a massa de água

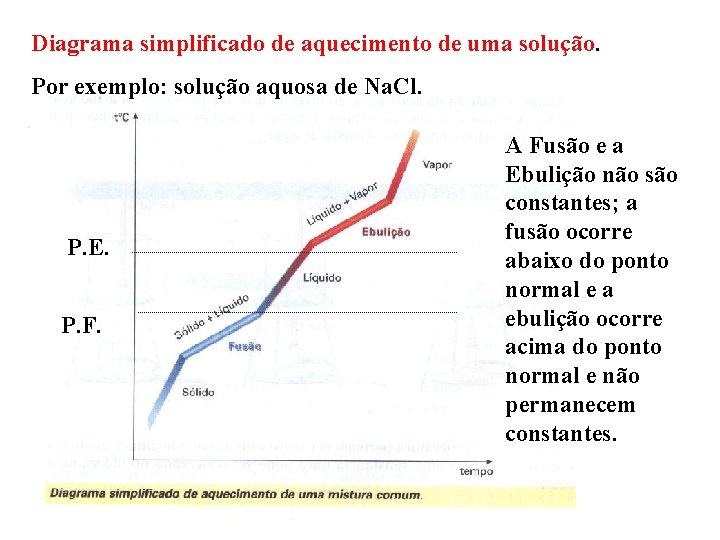
Diagrama simplificado de aquecimento de uma solução. Por exemplo: solução aquosa de Na. Cl. P. E. P. F. A Fusão e a Ebulição não são constantes; a fusão ocorre abaixo do ponto normal e a ebulição ocorre acima do ponto normal e não permanecem constantes.


Densidade : é uma propriedade especifica de um material No mar morto a densidade chega a ser maior que a densidade do corpo humano, impossibilitando uma pessoa de afundar em suas águas, gerando uma situação inusitada como é possível observar na foto

Fuvest-2012 Na obra O poço do Visconde, de Monteiro Lobato, há o seguinte diálogo entre o Visconde de Sabugosa e a boneca Emília: - Senhora Emília, explique-me o que é hidrocarboneto. A atrapalhadeira não se atrapalhou e respondeu: - São misturinhas de uma coisa chamada hidrogênio com outra coisa chamada carbono. Os carocinhos de um se ligam aos carocinhos de outro. Nesse trecho, a personagem Emília usa o vocabulário informal que a caracteriza. Buscando-se uma terminologia mais adequada ao vocabulário utilizado em Química, devem-se substituir as expressões “misturinhas”, “coisa” e “carocinhos”, respectivamente, por: a) compostos, elemento, átomos. b) misturas, substância, moléculas. c) substâncias compostas, molécula, átomos. d) misturas, substância, átomos. e) compostos, misturas, moléculas. A

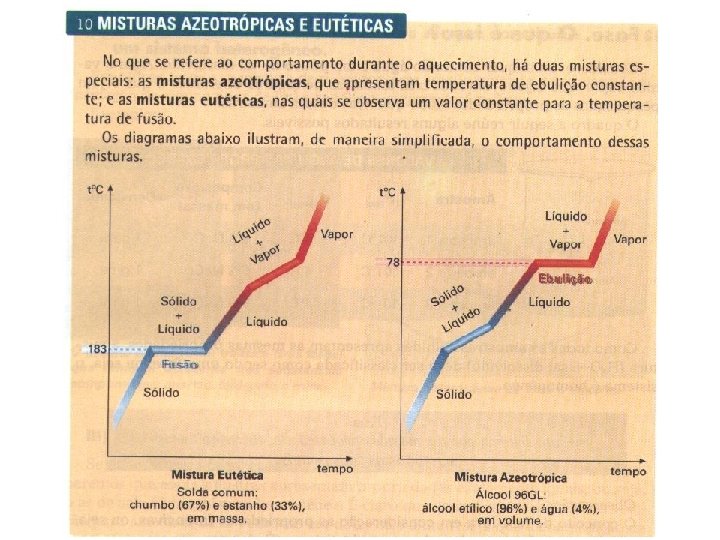
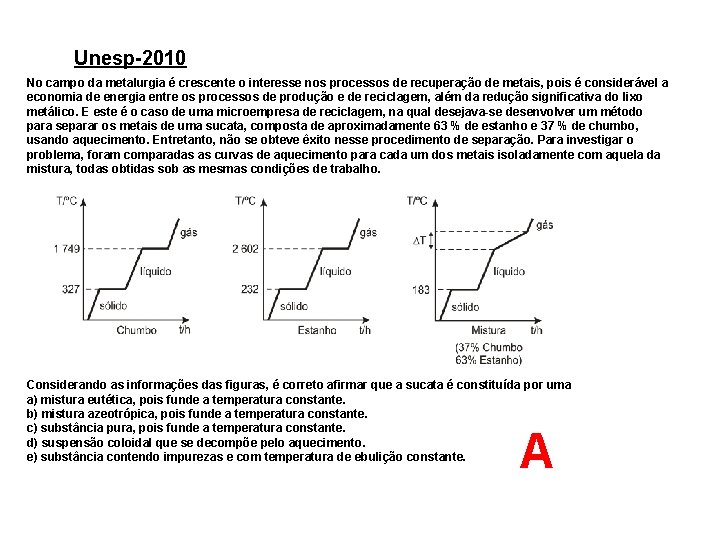
Unesp-2010 No campo da metalurgia é crescente o interesse nos processos de recuperação de metais, pois é considerável a economia de energia entre os processos de produção e de reciclagem, além da redução significativa do lixo metálico. E este é o caso de uma microempresa de reciclagem, na qual desejava-se desenvolver um método para separar os metais de uma sucata, composta de aproximadamente 63 % de estanho e 37 % de chumbo, usando aquecimento. Entretanto, não se obteve êxito nesse procedimento de separação. Para investigar o problema, foram comparadas as curvas de aquecimento para cada um dos metais isoladamente com aquela da mistura, todas obtidas sob as mesmas condições de trabalho. Considerando as informações das figuras, é correto afirmar que a sucata é constituída por uma a) mistura eutética, pois funde a temperatura constante. b) mistura azeotrópica, pois funde a temperatura constante. c) substância pura, pois funde a temperatura constante. d) suspensão coloidal que se decompõe pelo aquecimento. e) substância contendo impurezas e com temperatura de ebulição constante. A

PUC-MG Considere o quadro, que apresenta algumas substâncias com suas respectivas temperaturas de fusão (TF) e de ebulição (TE) ao nível do mar e a solubilidade em água, a 25 °C. D Considerando-se esses dados, é CORRETO afirmar que: a) à temperatura em que o naftaleno ferve, o ácido sulfúrico se encontra na forma de vapor. b) o estado físico da substância cloro, à temperatura ambiente, é sólido. c) o processo mais adequado para se separar uma mistura de ácido sulfúrico com água, é por decantação fracionada. d) a mistura de cloro com oxigênio, à temperatura ambiente, forma um sistema homogêneo. e) à temperatura de 0ºC, três das quatro substâncias encontram-se no estado sólido.

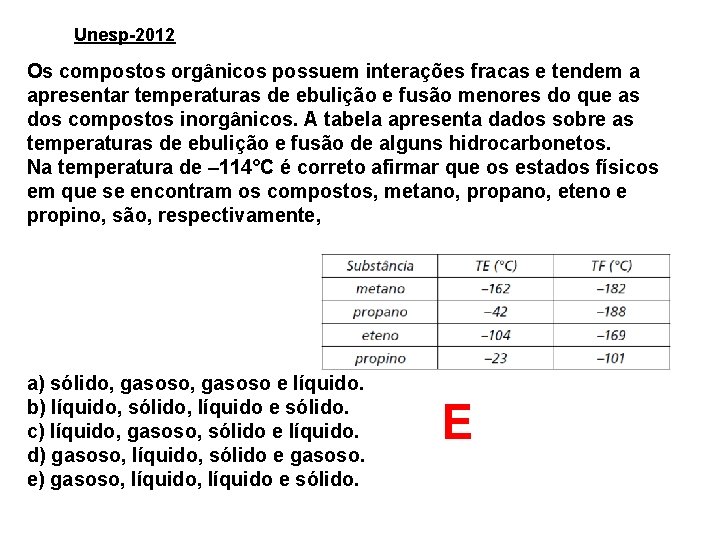
Unesp-2012 Os compostos orgânicos possuem interações fracas e tendem a apresentar temperaturas de ebulição e fusão menores do que as dos compostos inorgânicos. A tabela apresenta dados sobre as temperaturas de ebulição e fusão de alguns hidrocarbonetos. Na temperatura de – 114°C é correto afirmar que os estados físicos em que se encontram os compostos, metano, propano, eteno e propino, são, respectivamente, a) sólido, gasoso e líquido. b) líquido, sólido, líquido e sólido. c) líquido, gasoso, sólido e líquido. d) gasoso, líquido, sólido e gasoso. e) gasoso, líquido e sólido. E

(Unicamp 2017) “Quem tem que suar é o chope, não você”. Esse é o slogan que um fabricante de chope encontrou para evidenciar as qualidades de seu produto. Uma das interpretações desse slogan é que o fabricante do chope recomenda que seu produto deve ser ingerido a uma temperatura bem baixa. Pode-se afirmar corretamente que o chope, ao suar, tem a sua temperatura a) diminuída, enquanto a evaporação do suor no corpo humano evita que sua temperatura aumente. b) aumentada, enquanto a evaporação do suor no corpo humano evita que sua temperatura diminua. c) diminuída, enquanto a evaporação do suor no corpo humano evita que sua temperatura diminua. d) aumentada, enquanto a evaporação do suor no corpo humano evita X que sua temperatura aumente.

(Unicamp 2016) As empresas que fabricam produtos de limpeza têm se preocupado cada vez mais com a satisfação do consumidor e a preservação dos materiais que estão sujeitos ao processo de limpeza. No caso do vestuário, é muito comum encontrarmos a recomendação para fazer o teste da firmeza das cores para garantir que a roupa não será danificada no processo de lavagem. Esse teste consiste em molhar uma pequena parte da roupa e colocá-la sobre uma superfície plana; em seguida, coloca-se um pano branco de algodão sobre sua superfície e passa-se com um ferro bem quente. Se o pano branco ficar manchado, sugere-se que essa roupa deve ser lavada separadamente, pois durante esse teste ocorreu um processo de a) fusão do corante, e o ferro quente é utilizado para aumentar a pressão sobre o tecido. b) liquefação do corante, e o ferro quente é utilizado para acelerar o processo. c) condensação do corante, e o ferro quente é utilizado para ajudar a sua transferência para o pano branco. d) dissolução do corante, e o ferro quente é utilizado para acelerar o X processo.


Mistura Heterogênea 1) Líquido sólido: usamos a FILTRAÇÃO SIMPLES. Ex. : água e areia; água e limalha de ferro (ferro em pó), etc Poderíamos usar como método alternativo a SIFONAÇÃO

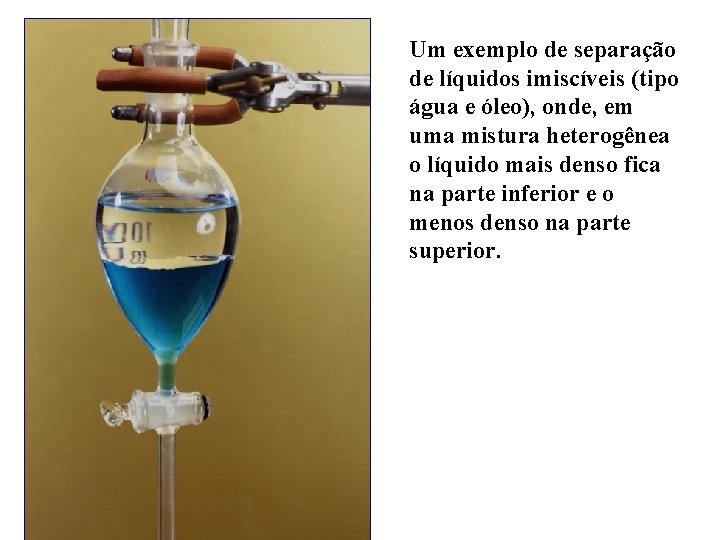
Um exemplo de separação de líquidos imiscíveis (tipo água e óleo), onde, em uma mistura heterogênea o líquido mais denso fica na parte inferior e o menos denso na parte superior.

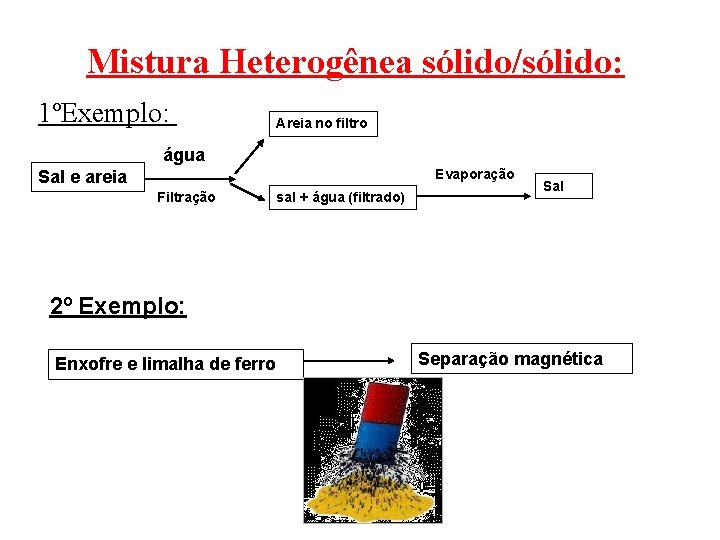
Mistura Heterogênea sólido/sólido: 1ºExemplo: Areia no filtro água Evaporação Sal e areia Filtração sal + água (filtrado) Sal 2º Exemplo: Enxofre e limalha de ferro Separação magnética

Mistura Homogênea sólido/Líquido Ex. : água e sal; água e açúcar. Melhor técnica: DESTILAÇÃO SIMPLES. A destilação trabalha com os pontos de ebulição. A ordem de obtenção das substâncias segue a ordem do menor para o maior ponto de ebulição. Nesse caso o termômetro é dispensável, pois o ponto de ebulição da água (100°C) é muito distante do sal de cozinha(P. E. =1465°C)

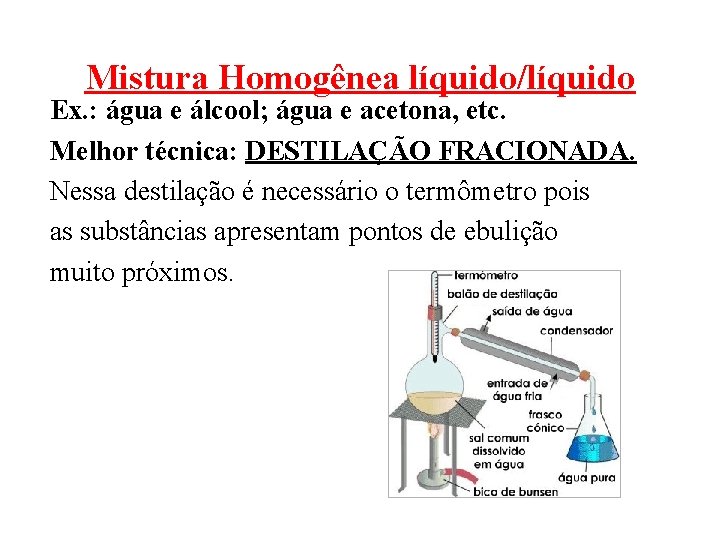
Mistura Homogênea líquido/líquido Ex. : água e álcool; água e acetona, etc. Melhor técnica: DESTILAÇÃO FRACIONADA. Nessa destilação é necessário o termômetro pois as substâncias apresentam pontos de ebulição muito próximos.

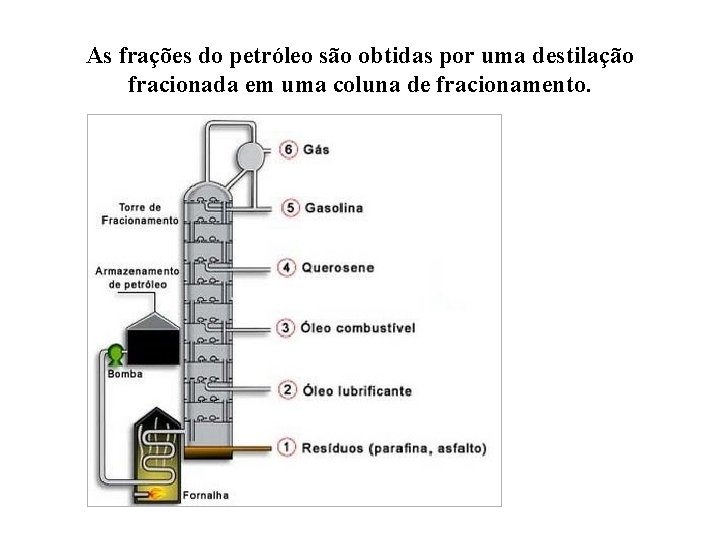
As frações do petróleo são obtidas por uma destilação fracionada em uma coluna de fracionamento.

Ex. : 1 – UNESP-2005 A água potável é um recurso natural considerado escasso em diversas regiões do nosso planeta. Mesmo em locais onde a água é relativamente abundante, às vezes é necessário submetê-la a algum tipo de tratamento antes de distribuí-la para consumo humano. O tratamento pode, além de outros processos, envolver as seguintes etapas: I. manter a água em repouso por um tempo adequado, para a deposição, no fundo do recipiente, do material em suspensão mecânica. II. remoção das partículas menores, em suspensão, não separáveis pelo processo descrito na etapa I. III. evaporação e condensação da água, para diminuição da concentração de sais (no caso de água salobra ou do mar). Neste caso, pode ser necessária a adição de quantidade conveniente de sais minerais após o processo. Às etapas I, II e III correspondem, respectivamente, os processos de separação denominados a) filtração, decantação e dissolução. b) destilação, filtração e decantação. c) decantação, filtração e dissolução. Xd) decantação, filtração e destilação. e) filtração, destilação e dissolução.

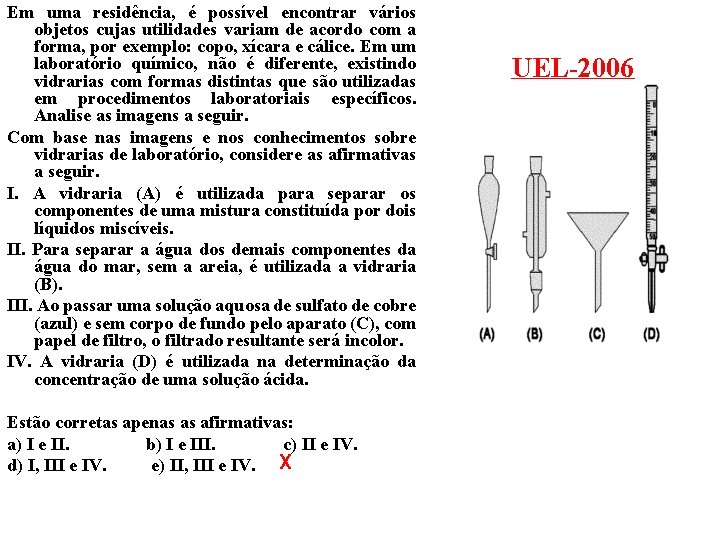
Em uma residência, é possível encontrar vários objetos cujas utilidades variam de acordo com a forma, por exemplo: copo, xícara e cálice. Em um laboratório químico, não é diferente, existindo vidrarias com formas distintas que são utilizadas em procedimentos laboratoriais específicos. Analise as imagens a seguir. Com base nas imagens e nos conhecimentos sobre vidrarias de laboratório, considere as afirmativas a seguir. I. A vidraria (A) é utilizada para separar os componentes de uma mistura constituída por dois líquidos miscíveis. II. Para separar a água dos demais componentes da água do mar, sem a areia, é utilizada a vidraria (B). III. Ao passar uma solução aquosa de sulfato de cobre (azul) e sem corpo de fundo pelo aparato (C), com papel de filtro, o filtrado resultante será incolor. IV. A vidraria (D) é utilizada na determinação da concentração de uma solução ácida. Estão corretas apenas as afirmativas: a) I e II. b) I e III. c) II e IV. d) I, III e IV. e) II, III e IV. X UEL-2006

UNESP-2006 A preparação de um chá utilizando os já tradicionais saquinhos envolve, em ordem de acontecimento, os seguintes processos: a) filtração e dissolução. b) filtração e extração. c) extração e filtração. X d) extração e decantação. e) dissolução e decantação.

Unicamp-2012 Em algumas extrações de ouro, sedimentos de fundo de rio e água são colocados em uma bateia, recipiente cônico que se assemelha a um funil sem o buraco. Movimentos circulares da bateia permitem que o ouro metálico se deposite sob o material sólido ali presente. Esse depósito, que contém principalmente ouro, é posto em contato com mercúrio metálico; o amálgama formado é separado e aquecido com um maçarico, separando-se o ouro líquido do mercúrio gasoso. Numa região próxima dali, o mercúrio gasoso se transforma em líquido e acaba indo para o leito dos rios. Os três segmentos acima grifados se referem, respectivamente, às seguintes propriedades: a) peso, temperatura de gaseificação e temperatura de liquefação. b) densidade, temperatura de sublimação e temperatura de fusão. c) peso, temperatura de ebulição e temperatura de fusão. d) densidade, temperatura de ebulição e temperatura de liquefação. D

ENEM-2010 Em visita a uma usina sucroalcooleira, um grupo de alunos pôde observar a série de processos de beneficiamento da cana-de-açúcar, entre os quais se destacam: I. A cana chega cortada da lavoura por meio de caminhões e é despejada em mesas alimentadoras que a conduzem para as moendas. Antes de ser esmagada para a retirada do caldo açucarado, toda a cana é transportada por esteiras e passada por um eletroímã para a retirada de materiais metálicos. II. Após se esmagar a cana, o bagaço segue para as caldeiras, que geram vapor e energia para toda a usina. III. O caldo primário, resultante do esmagamento, é passado por filtros e sofre tratamento para transformar-se em açúcar refinado, apenas pela retirada da água do caldo de cana e etanol, após fermentação do caldo. Com base nos destaques da observação dos alunos, quais operações físicas de separação de materiais foram realizadas nas etapas de beneficiamento da cana-deaçúcar? Processo 1 = Separação a) Separação mecânica, extração, decantação e decantação. magnética. b) Separação magnética, combustão, filtração e evaporação. Processo 2 = O processo físico é uma espécie de extração. c) Separação magnética, extração, filtração e evaporação. X Nota: a combustão do d) Imantação, combustão, peneiração e evaporação. bagaço é uma e) Imantação, destilação, filtração e decantação. transformação química. Processo 3: O processo físico é uma filtração. Resposta: C

Análise Imediata Cotidiano Estações de Tratamento de Água

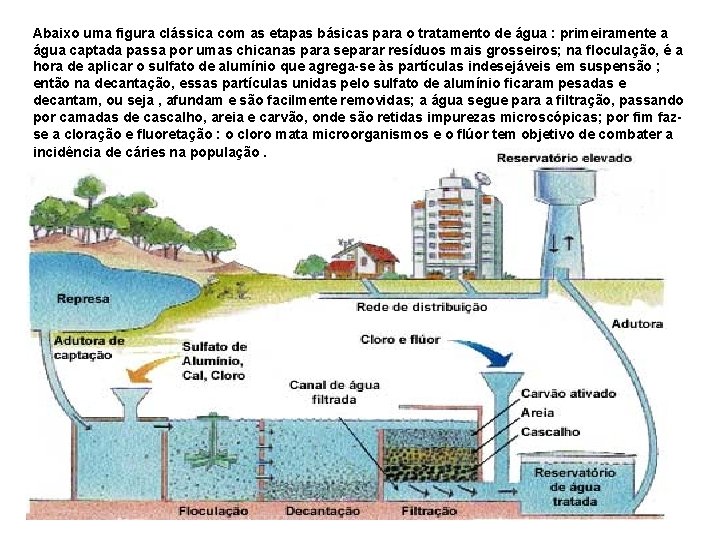
Abaixo uma figura clássica com as etapas básicas para o tratamento de água : primeiramente a água captada passa por umas chicanas para separar resíduos mais grosseiros; na floculação, é a hora de aplicar o sulfato de alumínio que agrega-se às partículas indesejáveis em suspensão ; então na decantação, essas partículas unidas pelo sulfato de alumínio ficaram pesadas e decantam, ou seja , afundam e são facilmente removidas; a água segue para a filtração, passando por camadas de cascalho, areia e carvão, onde são retidas impurezas microscópicas; por fim fazse a cloração e fluoretação : o cloro mata microorganismos e o flúor tem objetivo de combater a incidência de cáries na população.

Mistura lenta ou Floculação : O fundamento da mistura lenta, também chamada de floculação é a formação de flocos sedimentáveis de suspensões finas através do emprego de coagulantes. A floculaçâo tem por finalidade aumentar as oportunidades de contato entre as impurezas das águas e os flocos que se formam pela reação do coagulante, pois os flocos até então formados bem como as impurezas ainda dispersas não têm peso suficiente para se sedimentarem por peso próprio. Chicanas Usadas em estações de tratamento de água.

Questões de Vestibular (UFSC 2010) 1) A água potável proveniente de estações de tratamento resulta de um conjunto de procedimentos físicos e químicos que são aplicados na água para que esta fique em condições adequadas para o consumo. Esta separação é necessária uma vez que a água de rios ou lagoas apresenta muitos resíduos sólidos, por isso tem que passar por uma série de etapas para que esses resíduos sejam removidos. Neste processo de tratamento a água fica livre também de qualquer tipo de contaminação, evitando a transmissão de doenças. Em uma ETA (estação de tratamento de água) típica, a água passa pelas seguintes etapas: coagulação, floculação, decantação, filtração, desinfecção, fluoretação e correção de p. H. Assinale a(s) proposição(ões) correta(s). 1) Fluoretação: é quando se adiciona flúor na água, cuja finalidade é prevenir a formação de cárie dentária em crianças. 2) Floculação: ocorre em tanques de concreto, logo após a coagulação. Com a água em movimento, as partículas sólidas se aglutinam em flocos maiores. 4) Decantação: nesta etapa, que é posterior à coagulação e à floculação, por ação da gravidade, os flocos com as impurezas e partículas ficam depositados no fundo de outros tanques, separando-se da água. A etapa da decantação pode ser considerada um fenômeno físico. 8) Filtração: é a etapa em que a água passa por filtros formados por carvão, areia e pedras de diversos tamanhos. Nesta etapa, as impurezas de tamanho pequeno ficam retidas no filtro. A etapa da filtração pode ser considerada como um fenômeno químico. 16) Coagulação: é a etapa em que a água, na sua forma bruta, entra na ETA. Ela recebe, nos tanques, uma determinada quantidade de cloreto de sódio. Esta substância serve para aglomerar partículas sólidas que se encontram na água como, por exemplo, a argila. 32) Desinfecção: é a etapa em que cloro ou ozônio é aplicado na água para eliminar microorganismos causadores de doenças. 1) V ; 2) V; 4) V; 8) F; 16) F; 32) V

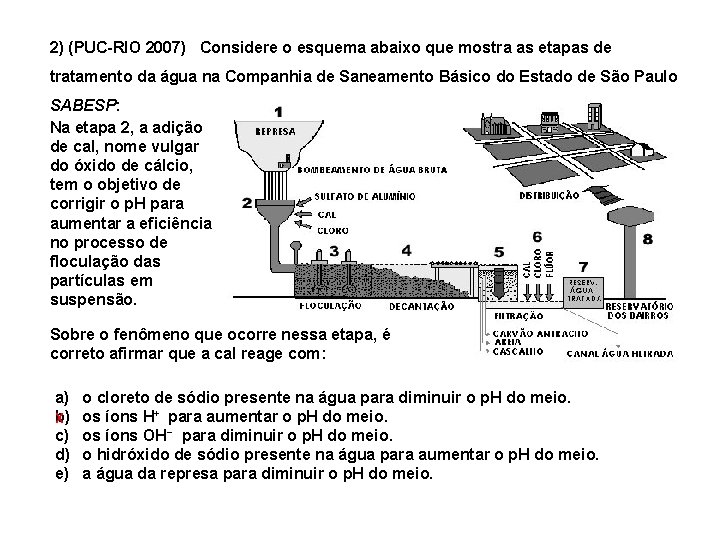
2) (PUC-RIO 2007) Considere o esquema abaixo que mostra as etapas de tratamento da água na Companhia de Saneamento Básico do Estado de São Paulo SABESP: Na etapa 2, a adição de cal, nome vulgar do óxido de cálcio, tem o objetivo de corrigir o p. H para aumentar a eficiência no processo de floculação das partículas em suspensão. Sobre o fenômeno que ocorre nessa etapa, é correto afirmar que a cal reage com: a) b) X c) d) e) o cloreto de sódio presente na água para diminuir o p. H do meio. os íons H+ para aumentar o p. H do meio. os íons OH− para diminuir o p. H do meio. o hidróxido de sódio presente na água para aumentar o p. H do meio. a água da represa para diminuir o p. H do meio.

3) Fuvest-2009 - A obtenção de água doce de boa qualidade está se tornando cada vez mais difícil devido ao adensamento populacional, às mudanças climáticas, à expansão da atividade industrial e à poluição. A água, uma vez captada, precisa ser purificada, o que é feito nas estações de tratamento. Um esquema do processo de purificação é: em que as etapas B, D e F são: B — adição de sulfato de alumínio e óxido de cálcio, D — filtração em areia, F — fluoretação. Assim sendo, as etapas A, C e E devem ser, respectivamente, a) filtração grosseira, decantação e cloração. X b) decantação, cloração e filtração grosseira. c) cloração, neutralização e filtração grosseira. d) filtração grosseira, neutralização e decantação. e) neutralização, cloração e decantação.

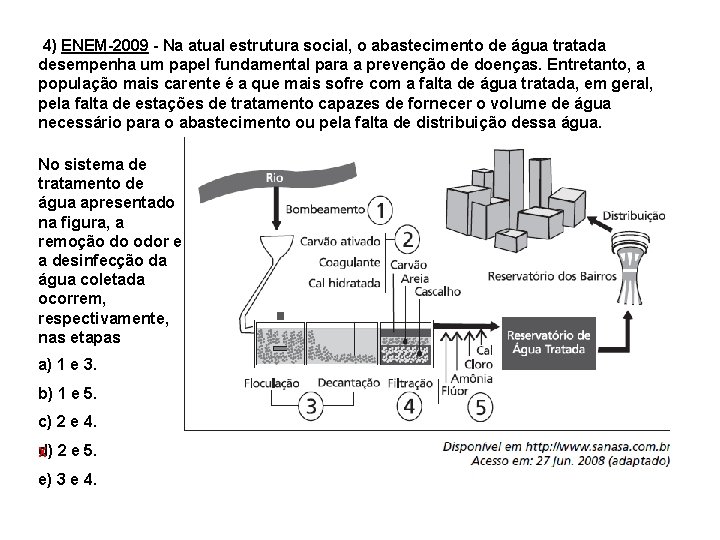
4) ENEM-2009 - Na atual estrutura social, o abastecimento de água tratada desempenha um papel fundamental para a prevenção de doenças. Entretanto, a população mais carente é a que mais sofre com a falta de água tratada, em geral, pela falta de estações de tratamento capazes de fornecer o volume de água necessário para o abastecimento ou pela falta de distribuição dessa água. No sistema de tratamento de água apresentado na figura, a remoção do odor e a desinfecção da água coletada ocorrem, respectivamente, nas etapas a) 1 e 3. b) 1 e 5. c) 2 e 4. d) 2 e 5. X e) 3 e 4.