ELEMENTI MINERALI Sono elementi inorganici presenti in natura






























- Slides: 41

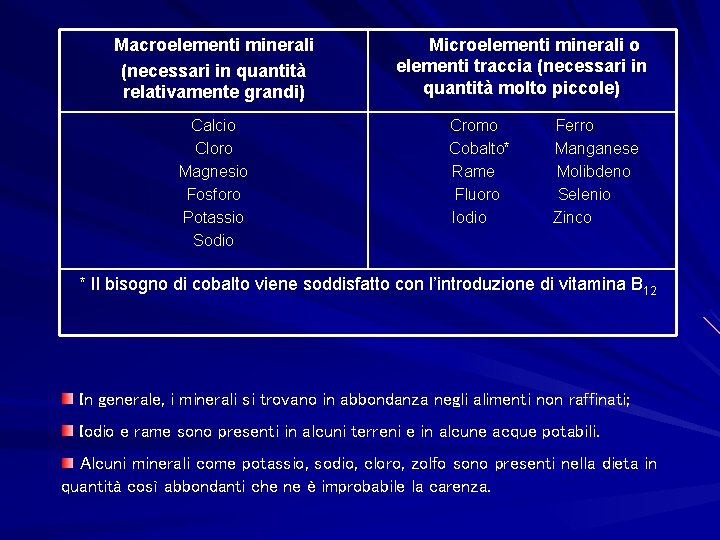
ELEMENTI MINERALI Sono elementi inorganici presenti in natura che non provengono né dalla vita animale né vegetale ma dalla crosta terrestre. Gli elementi minerali sono classificati in due gruppi in base alla quantità di ciascuno di essi nell’organismo. I minerali presenti in quantità relativamente grandi e di cui sono necessari almeno 100 mg/die sono detti macroelementi. I minerali presenti in bassa quantità e di cui sono necessari pochi mg al giorno sono detti microelementi o elementi traccia.

Macroelementi minerali (necessari in quantità relativamente grandi) Calcio Cloro Magnesio Fosforo Potassio Sodio Microelementi minerali o elementi traccia (necessari in quantità molto piccole) Cromo Cobalto* Rame Fluoro Iodio Ferro Manganese Molibdeno Selenio Zinco * Il bisogno di cobalto viene soddisfatto con l’introduzione di vitamina B 12 In generale, i minerali si trovano in abbondanza negli alimenti non raffinati; Iodio e rame sono presenti in alcuni terreni e in alcune acque potabili. Alcuni minerali come potassio, sodio, cloro, zolfo sono presenti nella dieta in quantità così abbondanti che ne è improbabile la carenza.

LE FUNZIONI DEI MINERALI possono essere così divise: Costruzione dei tessuti (ad es. calcio, fosforo, magnesio e fluoro entrano nella costituzione dei denti e delle ossa) Regolazione di processi vitali (ad es. trasmissione degli impulsi nervosi, contrazione muscolare, etc. )

1. Installare l’App «QR Code Reader» o similari 2. Aprire l’applicazione «QR Code Reader» 3. Inquadrare il codice a destra 4. Aprire il link 5. Inserire Nome Cognome e Matricola N. B. (in caso di errore di battitura il sistema è comunque in grado di identificare lo studente) 6. Selezionare «inviami conferma tramite posta elettronica» per avere una ricevuta della segnalazione della presenza 7. Selezionare Invia Corso di STDA Lezione del Giorno 04 Dicembre 2020

FERRO I depositi di ferro dell’organismo umano ammontano a circa 5 g ma, a dispetto delle piccole quantità, il ferro svolge importanti funzioni. Esso è ripartito: v 60% del ferro è presente nel gruppo eme dell’emoglobina v 25% è accumulato sotto forma di ferritina e emosiderina (fegato, milza e midollo) v 8% nella mioglobina (proteina del muscolo che lega l’ossigeno) v 5% negli enzimi v 1 -2% nel plasma legato alla transferrina

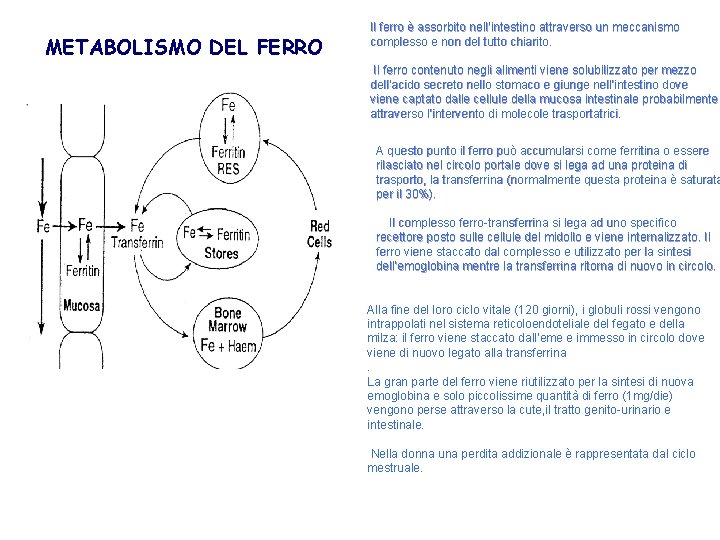
METABOLISMO DEL FERRO Il ferro è assorbito nell’intestino attraverso un meccanismo complesso e non del tutto chiarito. Il ferro contenuto negli alimenti viene solubilizzato per mezzo dell’acido secreto nello stomaco e giunge nell’intestino dove viene captato dalle cellule della mucosa intestinale probabilmente attraverso l’intervento di molecole trasportatrici. A questo punto il ferro può accumularsi come ferritina o essere rilasciato nel circolo portale dove si lega ad una proteina di trasporto, la transferrina (normalmente questa proteina è saturata per il 30%). Il complesso ferro-transferrina si lega ad uno specifico recettore posto sulle cellule del midollo e viene internalizzato. Il ferro viene staccato dal complesso e utilizzato per la sintesi dell’emoglobina mentre la transferrina ritorna di nuovo in circolo. Alla fine del loro ciclo vitale (120 giorni), i globuli rossi vengono intrappolati nel sistema reticoloendoteliale del fegato e della milza: il ferro viene staccato dall’eme e immesso in circolo dove viene di nuovo legato alla transferrina. La gran parte del ferro viene riutilizzato per la sintesi di nuova emoglobina e solo piccolissime quantità di ferro (1 mg/die) vengono perse attraverso la cute, il tratto genito-urinario e intestinale. Nella donna una perdita addizionale è rappresentata dal ciclo mestruale.

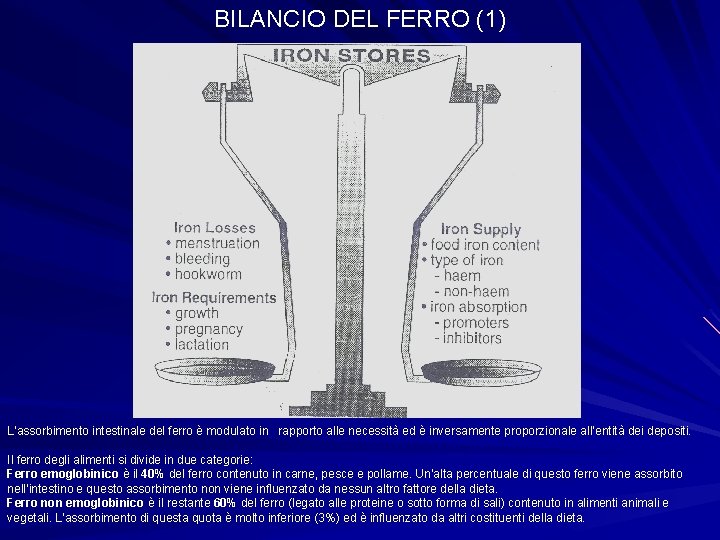
BILANCIO DEL FERRO (1) L’assorbimento intestinale del ferro è modulato in rapporto alle necessità ed è inversamente proporzionale all’entità dei depositi. Il ferro degli alimenti si divide in due categorie: Ferro emoglobinico è il 40% del ferro contenuto in carne, pesce e pollame. Un’alta percentuale di questo ferro viene assorbito nell’intestino e questo assorbimento non viene influenzato da nessun altro fattore della dieta. Ferro non emoglobinico è il restante 60% del ferro (legato alle proteine o sotto forma di sali) contenuto in alimenti animali e vegetali. L’assorbimento di questa quota è molto inferiore (3%) ed è influenzato da altri costituenti della dieta.

BILANCIO DEL FERRO (2) I fattori che favoriscono l’assorbimento del ferro non emoglobinico sono : • l’acido ascorbico (vit C) che converte il ferro da ferrico a ferroso (più solubile e assorbibile) • carne (probabilmente per la presenza di cisteina) I fattori che riducono l’assorbimento del ferro non emoglobinico sono: • polifenoli • fitati • calcio (se l’intake è > 300 mg/pasto) • alcuni elementi inorganici (Zn, Mn, Cu)

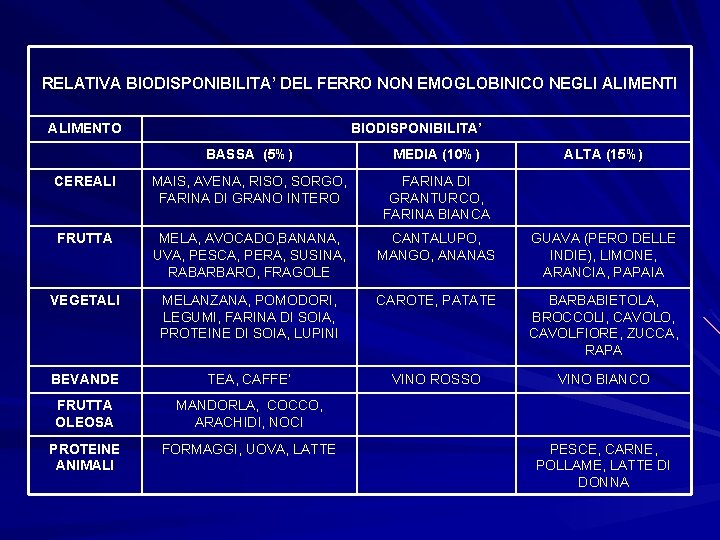
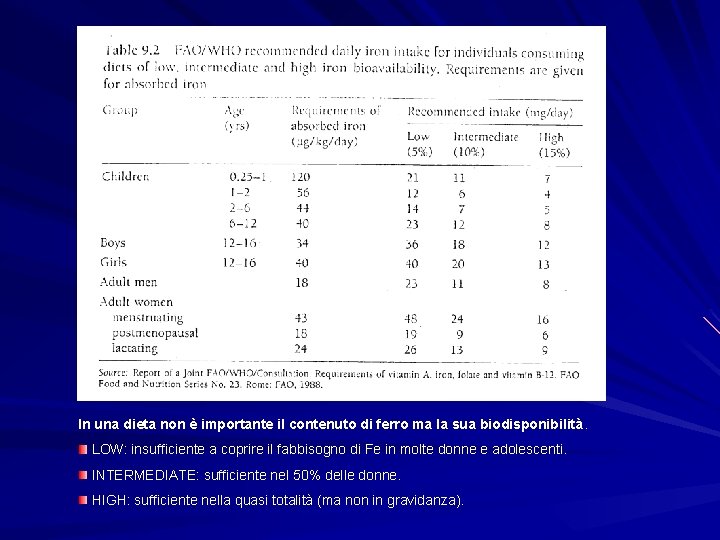
RELATIVA BIODISPONIBILITA’ DEL FERRO NON EMOGLOBINICO NEGLI ALIMENTO BIODISPONIBILITA’ BASSA (5%) MEDIA (10%) ALTA (15%) CEREALI MAIS, AVENA, RISO, SORGO, FARINA DI GRANO INTERO FARINA DI GRANTURCO, FARINA BIANCA FRUTTA MELA, AVOCADO, BANANA, UVA, PESCA, PERA, SUSINA, RABARBARO, FRAGOLE CANTALUPO, MANGO, ANANAS GUAVA (PERO DELLE INDIE), LIMONE, ARANCIA, PAPAIA VEGETALI MELANZANA, POMODORI, LEGUMI, FARINA DI SOIA, PROTEINE DI SOIA, LUPINI CAROTE, PATATE BARBABIETOLA, BROCCOLI, CAVOLO, CAVOLFIORE, ZUCCA, RAPA BEVANDE TEA, CAFFE’ VINO ROSSO VINO BIANCO FRUTTA OLEOSA MANDORLA, COCCO, ARACHIDI, NOCI PROTEINE ANIMALI FORMAGGI, UOVA, LATTE PESCE, CARNE, POLLAME, LATTE DI DONNA

In una dieta non è importante il contenuto di ferro ma la sua biodisponibilità. LOW: insufficiente a coprire il fabbisogno di Fe in molte donne e adolescenti. INTERMEDIATE: sufficiente nel 50% delle donne. HIGH: sufficiente nella quasi totalità (ma non in gravidanza).

DEFICIT DI FERRO N. B. La causa più frequente della deficienza di ferro non è dovuta ad aumentate perdite (per emorragie), ma ad un intake insufficiente, almeno nei paesi in via di sviluppo la cui alimentazione è scarsa e costituita da cereali non raffinati.

SOVRACCARICO DI FERRO L’ingestione acuta di grandi quantità di ferro (in genere accidentale) causa: dolori addominali vomito acidosi metabolica collasso cardiocircolatoria per dosi superiori a 600 mg può causare la morte. Il sovraccarico cronico si verifica nelle seguenti condizioni: emocromatosi: malattia genetica che causa un’aumentata disponibilità di ferro con accumulo nel fegato, cuore, pancreas e altri organi; uso prolungato di pentole o utensili in ferro frequenti trasfusioni (pz talassemici)

VALUTAZIONE DELLO STATO DEL FERRO Carenza di ferro: Ø Deplezione del ferro: - ferritina bassa Ø Ridotta eritropoiesi: ferritina bassa sideremia bassa saturazione della transferrina inferiore al 16% Ø Anemia con microcitosi e ipocromia Sovraccarico di ferro: Ø Ferritina aumentata Ø Saturazione della transferrina > 60%



Proteine Le proteine rappresentano la principale fonte di azoto. Le proteine sono costituite di amino acidi che possono legarsi in una varietà di modi pressocchè infinita per formare le migliaia di proteine necessarie all’organismo. Tutte le cellule e tessuti contengono proteine. Esse ammontano al 16% del peso corporeo, circa 11 Kg per un uomo di 70 kg. Di questi: muscolo 43% fegato 1. 8% cute 15% cervello 1. 5% sangue 16% Il 50% delle proteine totali è presente sotto forma di: collagene, emoglobina, miosina, actina

Funzioni delle proteine Strutturale scheletro, cute, tessuto connettivo, architettura cellulare Protettiva immunità umorale e cellulare Trasporto e comunicazione proteine plasmatiche (albumina, transferrina, apoproteine) ormoni (insulina, glucagone, GH) recettori, secondo messaggero Enzimatica enzimi extracellulari (digestivi, della coagulazione) enzimi intracellulari (vie metaboliche)

Digestione delle Proteine della dieta stomaco pepsina Polipeptidi pancreas tripsina, chimotripsina, carbossipeptidasi Polipeptidi, dipeptidi, amino acidi intestino aminopeptidasi dipeptidi, amino acidi intestino dipeptidasi amino acidi

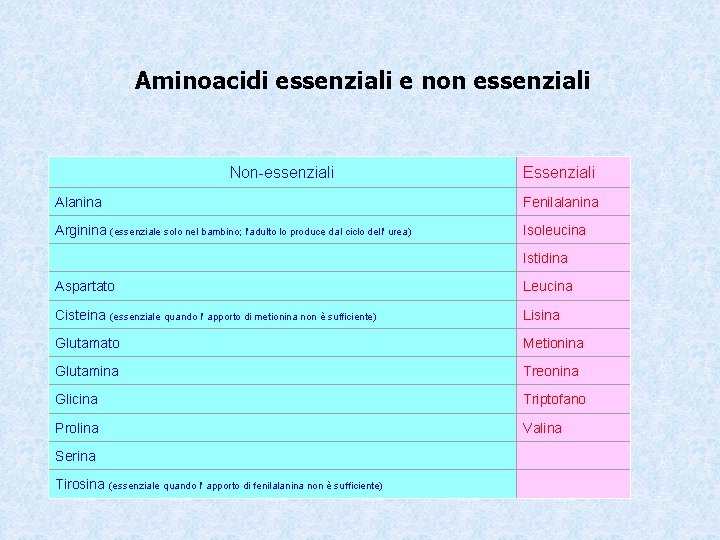
Aminoacidi essenziali e non essenziali Non-essenziali Essenziali Alanina Fenilalanina Arginina (essenziale solo nel bambino; l'adulto lo produce dal ciclo dell' urea) Isoleucina Istidina Aspartato Leucina Cisteina (essenziale quando l' apporto di metionina non è sufficiente) Lisina Glutamato Metionina Glutamina Treonina Glicina Triptofano Prolina Valina Serina Tirosina (essenziale quando l' apporto di fenilalanina non è sufficiente) . . . .

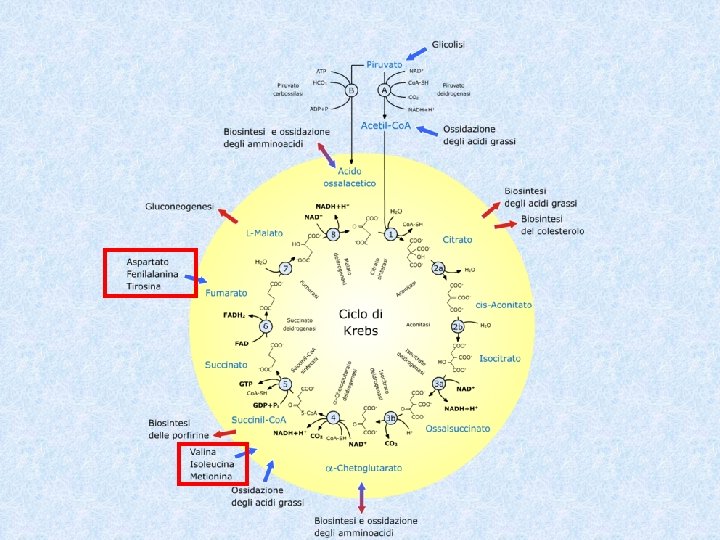
Fonti e destini degli amino acidi Gli aminoacidi originano da: - Proteine alimentari (esogene) - Sintesi de novo (ad es. alanina, ac glutammico ed aspartico originano dagli intermedi del ciclo dell’acido citrico: alfa chetoglutarato e ossalacetato) - Degradazione delle proteine endogene Gli amino acidi possono andare incontro a diversi destini: - Ossidazione a CO 2 e H 2 O - Conversione ad altri aminoacidi (transaminazione) - Conversione a glucosio, acidi nucleici, grassi - Sintesi delle proteine

Regolazione ormonale del metabolismo proteico - Ormoni che stimolano la sintesi proteica: Insulina Ormone della crescita Testosterone (stimola la sintesi proteica soltanto durante l’accrescimento) Tiroxina (l’eccesso stimola il catabolismo proteico) Ormoni che stimolano il catabolismo proteico: Glicocorticoidi

Metabolismo degli Aminoacidi La degradazione degli aminoacidi avviene in 2 tappe: 1 a tappa: Deaminazione o transaminazione cioè rimozione del gruppo aminico con formazione del chetoacido corrispondente 2 a tappa: Metabolismo del chetoacido corrispondente

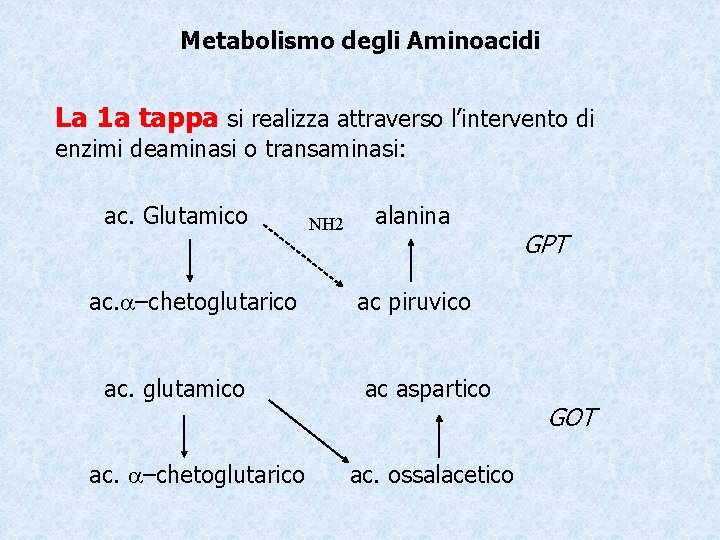
Metabolismo degli Aminoacidi La 1 a tappa si realizza attraverso l’intervento di enzimi deaminasi o transaminasi: ac. Glutamico ac. –chetoglutarico ac. glutamico ac. –chetoglutarico NH 2 alanina GPT ac piruvico ac aspartico ac. ossalacetico GOT

2 a Tappa: Metabolismo del chetoacido Lo scheletro carbonioso viene avviato verso l’ossidazione nel ciclo di Krebs oppure può essere utilizzato per la biosintesi dei CHO. Alanina, treonina, cisteina, serina, glicina danno origine all’ac. piruvico (AA gluconeogenetici) Metionina, valina, isoleucina sono trasformati in succinil. Co. A Leucina, lisina e triptofano sono trasformati in acetil. Co. A Prolina, arginina, glutamina e ac. glutamico sono trasformati in acido alfa -chetoglutarico


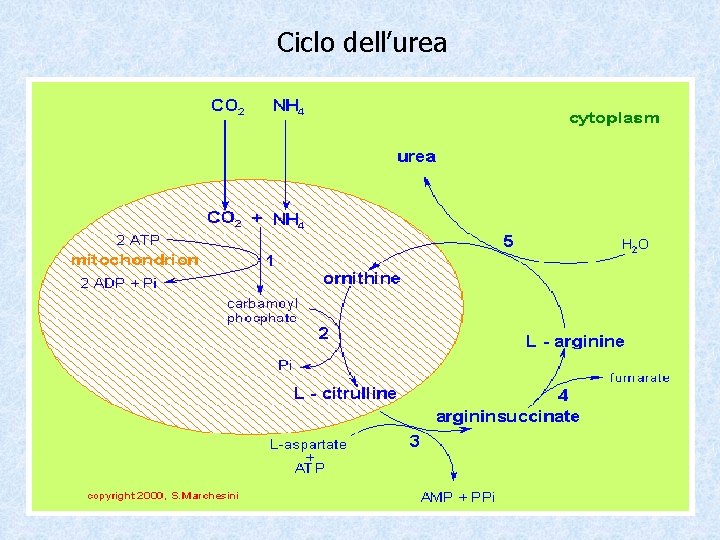
Destino dell’ammoniaca e dell’ammonio L’ammoniaca (NH 3) e gli ioni ammonio (nel sangue solo l’ 1% è presente come NH 3) al di sopra di una certa concentrazione sono tossici per l’organismo e, perciò, vengono eliminati sotto forma di urea, composto elettricamente neutro che non influenza il p. H. Il fegato è la sede in cui l’ammoniaca viene trasformata in urea. L’eliminazione dell’ammoniaca (tossica) attraverso un prodotto non tossico come l’urea è un esempio di azione detossicante del fegato. Quando il fegato, a causa di un grave processo patologico, non è in grado di eliminare l’ammoniaca attraverso la sintesi dell’urea, si verifica il coma epatico in quanto la NH 3 ha effetti tossici sul SNC.

Ciclo dell’urea

Regolazione del ciclo dell’urea Il bilancio d’azoto viene mantenuto costante nonostante le variazioni dell’intake proteico attraverso variazioni dell’escrezione urinaria di azoto. Questo meccanismo è in grado di compensare fino ad un introito di 35 -40 g/die dopo di che il bilancio azotato diventerà negativo.

Valore biologico delle proteine alimentari Il valore biologico di una proteina dipende dalla sua capacità di contribuire alla formazione dei tessuti. Esso esprime il percento dell’azoto assorbito che è reso disponibile per le esigenze dell’organismo. Maggiore è la quantità di azoto fornito da una certa proteina, maggiore è il suo valore biologico. Esso è determinato da due fattori: 1) Composizione 2) Grado di digestione e assorbimento

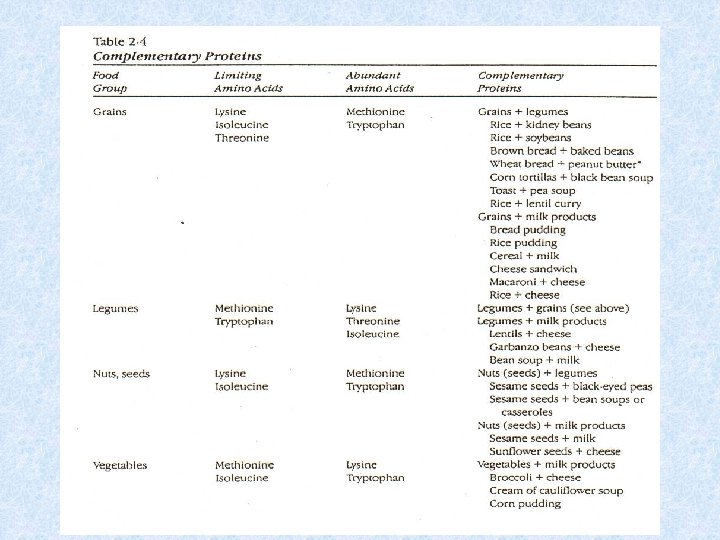
1) Composizione Sono dette proteine ad alto valore biologico o complete quelle contenenti gli AA essenziali. Quelle che forniscono solo alcuni AA in quantità limitate hanno un basso valore biologico e sono dette incomplete. La assenza di un AA essenziale arresta la sintesi della proteina e ciò si verifica a prescindere dalla disponibilità degli altri AA. Le proteine animali sono di qualità più elevata; la proteina dell’uovo ha la migliore composizione in AA fra tutti gli alimenti, subito dopo viene la proteina del latte. La gelatina è invece di scarsa qualità mancando di due AA essenziali. Le proteine vegetali sono di più basso valore biologico perchè contengono scarse quantità di AA essenziali. I cereali (grano e riso) hanno poca lisina; il mais scarseggia di lisina e triptofano; i legumi hanno quantità limitate di metionina.

2. Digeribilità Influenza il valore nutrizionale. Le proteine animali sono più digeribili di quelle vegetali poichè gli enzimi digestivi raggiungono più difficilmente le proteine vegetali che sono circondate da cellulosa e sostanze legnose. Non tutte le proteine vegetali mancano degli stessi AA. Durante un pasto, un cibo può fornire un AA che manca in un altro. L’alimento che fornisce l’AA è detto complementare a quello che ne difetta. Esempio: i legumi hanno molta lisina e poca metionina, i cereali esattamente il contrario. Mangiandole insieme si completano a vicenda. E’ importante che le proteine complementari siano ingerite nello stesso pasto.


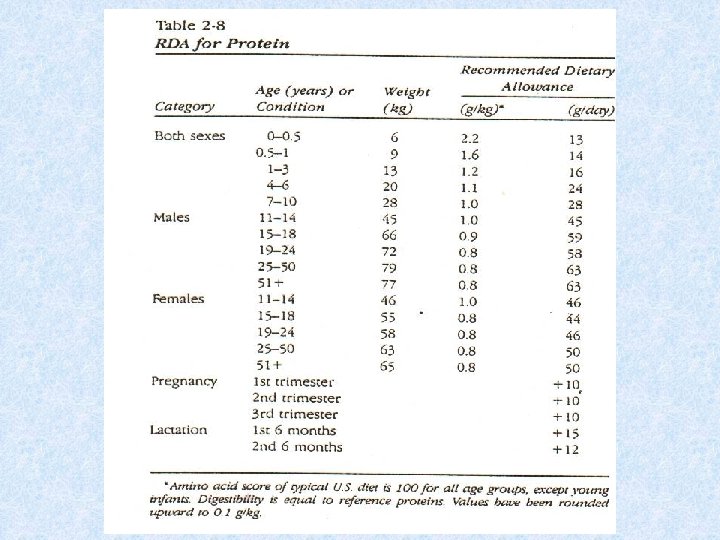
Fabbisogno proteico e Raccomandazioni La quantità minima di proteine necessaria a mantenere il bilancio d’azoto in equilibrio è 0. 6 g/Kg. La RDA cioè la dose raccomandata è 0. 8 g /Kg. La quota di energia derivante dalle proteine deve essere tra l’ 11 e il 15%. Nell’infanzia, gravidanza, allattamento, convalescenza il fabbisogno proteico aumenta (1. 5 g/Kg). E’ auspicabile che almeno un terzo delle proteine sia costituito di proteine animali e che siano incluse in ogni pasto delle proteine di alta qualità


Valutazione dello status proteico Valutazione della composizione corporea : stima la massa magra e la massa grassa basandosi sulla diversa densità. a) Metodo dell'acqua marcata con deuterio (il grasso non contiene acqua) b) Metodo del potassio che è essenzialmente intracellulare c) Impedenziometria Valutazione della massa muscolare attraverso: a) la escrezione urinaria di creatinina b) circonferenza coscia e braccio Concentrazione delle proteine e degli amino acidi nel plasma Valutazione del bilancio dell'azoto Turnover delle proteine mediante l'infusione di aminoacidi (leucina) marcati con traccianti

Bilancio dell’azoto (1) Il bilancio d’azoto esprime la differenza tra l’azoto introdotto con la dieta e l’azoto escreto (urina, feci, cute). Il 16% delle proteine è costituito da azoto, perciò dividendo per 6. 25 la quantità di proteine introdotte si conosce l’assunzione di azoto L’assunzione avviene prevalentemente con le proteine della dieta L'escrezione avviene attraverso le urine sotto forma di urea (85%), ammonio (5%), creatinina, acido urico. Il 5 -10% è eliminato con le feci e piccole quote attraverso la cute, i capelli etc. Bilancio azoto= Intake proteico (g) /6. 25 – (N urina 24 h+4)

Bilancio dell’azoto (2) Bilancio N positivo: intake>escrezione Questa condizione deve verificarsi quando si costruiscono nuovi tessuti come nell’infanzia, la gravidanza, l’allattamento. Bilancio N negativo: escrezione>intake Questa condizione si verifica in caso di interventi chirurgici, estese ustioni, febbre, stati patologici, digiuno protratto. In corso di digiuno la perdita proteica coinvolge tutti i tessuti mentre quella traumatica interessa soprattutto il distretto muscolare con risparmio della massa proteica viscerale. In corso di malattia aumenta la sintesi di proteine da parte del sistema immune e del fegato: fibrinogeno, prot. C reattiva, -1 glicoproteina, Immunoglobuline mentre è depressa la sintesi proteica nel muscolo.

Stati di malnutrizione proteico-energetica (PEM) La PEM può verificarsi in tre condizioni 1) nei bambini dei paesi sottosviluppati 2) negli adulti a seguito di gravi patologie 3) in tutte le età in tempi di carestia Le forme del bambino sono: Marasma (basso contenuto energetico e proteico) Kwashiorkor (grave malnutrizione proteica) Nei paesi africani, circa il 50 % dei bambini ha una PEM lieve-moderata (peso per età < 80% degli standard internazionali)

Diete vegetariane Latto-ovo vegetariani (esclude carne e pesce) Latto-vegetariani (esclude tutti i prodotti di derivazione animale eccetto il latte) Vegetariani puri o vegans (esclude tutti gli alimenti e derivati di origine animale)

Carenze delle diete vegane • Basso apporto di minerali: calcio, ferro zinco • Basso apporto di vitamine: riboflavina, vit. B 12 e vit. D (buone fonti di questi elementi sono riportate nella tabella) • Il fabbisogno proteico generalmente è sufficiente se si fa attenzione ad assumere “proteine complementari “

Fonti di nutrienti utili per limitare le carenze delle diete vegetariane